文章信息
- 徐苏微, 邢通, 李蛟龙, 张林, 高峰
- XU Suwei, XING Tong, LI Jiaolong, ZHANG Lin, GAO Feng
- 牛磺酸对肉鸡肉品质、糖酵解潜力及肌纤维特性的影响
- Effects of dietary taurine supplementation on meat quality, glycolytic potential and muscle fiber characteristics in broiler chickens
- 南京农业大学学报, 2020, 43(5): 935-941
- Journal of Nanjing Agricultural University, 2020, 43(5): 935-941.
- http://dx.doi.org/10.7685/jnau.201908030
-
文章历史
- 收稿日期: 2019-08-21
近年来, 禽肉因其相对低廉的价格以及丰富的营养价值深受消费者喜爱[1]。随着生活水平的提高, 消费者越来越重视禽肉品质。因此, 国内外禽肉生产者以及科研人员致力于寻找有效的方法来提高禽肉品质, 以满足消费者的需求。肌纤维是组成肌肉的基本单位, 不同类型的肌纤维具有不同的肌球蛋白ATPase活性、糖原含量以及糖酵解潜力(glycolytic potential, GP), 并对宰后肌肉的pH值、肉色、系水力、嫩度等肉品质指标有较大影响[2-3]。畜禽肌纤维数目通常在出生前已经确定, 但肌纤维类型会受生长环境、运动和营养等因素的影响而改变[4], 进而影响肉品质。钙调磷酸酶-活化T细胞核转录因子(calcineurin-nuclear factor of activated T cells, CaN-NFAT)是一条调控肌纤维类型转化的重要信号通路, 肌浆网中钙离子浓度持续升高, 可上调CaN mRNA的表达, 进而激活该通路, 促进Ⅱ型肌纤维向Ⅰ型肌纤维转化[4]。
牛磺酸是一种β-含硫氨基酸, 广泛分布于动物的组织和器官[5]。研究发现, 牛磺酸具有调节钙离子浓度、维持渗透压平衡、提高机体抗氧化能力等生物学功能[6]。因此, 牛磺酸已被广泛应用于临床、制药、食品、畜牧等领域。在畜牧生产上, 有研究表明牛磺酸可以作为饲料添加剂来改善肌肉品质, 但关于其改善的机制尚不清楚。因此, 本试验以爱拔益加(Arbor Acres, AA)肉鸡为试验对象, 研究在日粮中添加牛磺酸对其肉品质、宰后糖酵解潜力及肌纤维特性的影响, 并进一步探究牛磺酸影响鸡肉品质的潜在机制, 以期为牛磺酸在畜禽生产上的应用提供理论依据。
1 材料与方法 1.1 试验材料牛磺酸, 纯度>99.9%, 购于诺奥(美国)公司; AA肉鸡, 28日龄, 健康且体质量相近, 购于正大食品(宿迁)有限公司。
1.2 试验设计与饲养管理本试验采取单因素试验设计, 选取72只28日龄雄性AA肉鸡, 随机分为2组, 每组设6个重复, 每个重复6只鸡。对照组饲喂基础日粮, 处理组在基础日粮中添加质量分数为0.5%的牛磺酸, 试验期为14 d。基础日粮为玉米-豆粕型日粮, 日粮设计参照美国国家研究委员会(NRC)1994标准配制。日粮配方及营养水平见表 1。试验期内自由采食、饮水。
| 原料组成Ingredient component | 含量Content | 营养水平(计算值)Nutrient levels(calculated value) | 含量Content | |
| 玉米Corn | 62.27 | 代谢能2)Metabolizable energy | 13.13 | |
| 豆粕Soybean meal | 23.00 | 粗蛋白Crude protein | 19.57 | |
| 玉米蛋白粉Corn gluten meal | 6.00 | 钙Calcium | 0.95 | |
| 豆油Soybean oil | 4.00 | 有效磷Available phosphorus | 0.39 | |
| 石粉Limestone | 1.40 | 赖氨酸Lysine | 1.05 | |
| 磷酸氢钙Dicalcium phosphate | 1.60 | 蛋氨酸Methionine | 0.42 | |
| L-赖氨酸L-lysine | 0.35 | 蛋氨酸+半胱氨酸Methionine+cysteine | 0.76 | |
| DL-蛋氨酸DL-methionine | 0.08 | |||
| 食盐(饲料级)Salt | 0.30 | |||
| 复合预混料1) Premix | 1.00 | |||
| 注: 1)预混料为每千克日粮提供:维生素A(以视黄醇醋酸盐提供)12 000 IU, 维生素D3(以胆钙化醇提供)2 500 IU, 维生素E(以DL-α-生育酚醋酸盐提供)20 IU, 维生素K(以甲萘醌亚硫酸氢钠提供)1.3 mg, 维生素B1 2.2 mg, 核黄素8 mg, 烟酰胺40 mg, 氯化胆碱400 mg, 泛酸钙10 mg, 维生素B6 4 mg, 生物素0.04 mg, 叶酸1.0 mg, 维生素B12 0.013 mg, 铁(以硫酸亚铁提供)80 mg, 铜(以硫酸铜提供)8 mg, 锰(以硫酸锰提供)110 mg, 锌(以硫酸锌提供)60 mg, 碘(以碘酸钙提供)1.1 mg, 硒(以亚硒酸钠提供)0.3 mg; 2)代谢能单位为:MJ · kg-1。 Note: 1)Premix provided per kilogram of diet:retinyl acetate for vitamin A, 12 000 IU; cholecalciferol for vitamin D3, 2 500 IU; DL-α-tocopheryl acetate for vitamin E, 20 IU; menadione sodium bisulfate, 1.3 mg; thiamin, 2.2 mg; riboflavin, 8 mg; nicotinamide, 40 mg; choline chloride, 400 mg; calcium pantothenate, 10 mg; pyridoxine, 4 mg; biotin, 0.04 mg; folic acid, 1.0 mg; vitamin B12(cobalamin), 0.013 mg; Fe(from ferrous sulfate), 80 mg; Cu(from copper sulfate), 8 mg; Mn(from manganese sulfate), 110 mg; Zn(from zinc sulfate), 60 mg; Ⅰ(from calcium iodate), 1.1 mg; Se(from sodium selenite), 0.3 mg. 2)The unit of metabolizable energy is MJ · kg-1. | ||||
在试验期的第14天, 分别从每个重复中随机选取2只鸡进行空腹称体质量, 颈动脉放血宰杀, 待肉鸡死亡后立即解剖取样。剥离整个右侧腿肌, 称质量后置于4 ℃冷藏, 用于肉品质指标的测定。在肉鸡左腿束状胫骨前肌沿肌纤维走向取1.5 cm×1 cm×1 cm的样品, 放入体积分数为4%甲醛固定液中, 并置于4 ℃条件下保存以备肌纤维直径和密度的测定。采集肉鸡左侧腿肌样品于冻存管中, 加入液氮, 随后置-80 ℃保存待测。
1.4 测定指标及方法 1.4.1 糖酵解潜力参照南京建成生物科技研究所试剂盒说明书测定腿肌中糖原、乳酸含量(μmol · g-1), 再参考Wang等[7]的方法计算糖酵解潜力(GP, μmol · g-1):GP=2×糖原含量+乳酸含量。
1.4.2 肉品质pH值参考Brambila等[8]的方法, 在宰后45 min和24 h, 使用HI9125便携式pH计探头以45°斜插入腿肌中, 分别测定腿肌的pH45 min和pH24 h值。每个样品在不同位置测定3次, 取平均值。
肉色:参考Niu等[9]的方法, 在宰后24 h, 使用CR410色差仪测定腿肌亮度值(lightness, L*)、红度值(redness, a*)和黄度值(yellowness, b*)。每个样品在不同位置测定3次, 取平均值。
滴水损失:参考Li等[10]的方法, 在宰后24 h, 从右侧腿肌顺着肌纤维方向切取大小为4 cm×3 cm×2 cm的样品, 称质量并记录(始质量), 放入装满氮气的自封袋中, 在4 ℃冷库中悬挂24 h后取出, 用吸水纸吸干表面水分, 称质量并记录(末质量)。滴水损失=(始质量-末质量)/始质量×100%。
蒸煮损失:参考Li等[10]的方法, 在宰后48 h, 将测过滴水损失的肉样质量记为始质量, 放入自封袋中并置于75 ℃的水浴锅中蒸煮, 直至肉样中心温度达到70 ℃, 之后肉样用流水冷却至室温, 用吸水纸吸干表面水分, 称质量并记录(末质量)。蒸煮损失=(始质量-末质量)/始质量×100%。
剪切力:参考Gao等[11]的方法, 将测过蒸煮损失的肉样顺着肌纤维方向切成2个大小为3 cm×1 cm×1 cm的肉条, 用C-LM3B数显式肌肉嫩度仪沿肌纤维垂直方向测定剪切力(N)。每个肉条测定3次, 取平均值。
1.4.3 肌纤维特性肌纤维直径、密度:参考郭照宙等[12]的方法, 取出固定于多聚甲醛中的腿肌样品, 用石蜡包埋后, 用切片机切成厚度为6 μm的切片。贴片并用滤纸吸去多余水分, 干燥后置于4 ℃保存。将制备好的切片脱蜡, 再进行苏木素-伊红染色。使用BX50型光学显微镜在10×20倍视野下拍照, 每张切片随机选取5个视野, 并用Image-Pro Plus软件测定腿肌肌纤维直径(μm)和密度(N · mm-2)。
肌纤维类型:参考Liu等[13]的方法, 提取腿肌蛋白, 并将蛋白浓度调节至0.128 mg · mL-1。制备体积分数为4%的浓缩胶和6%的分离胶, 在每条电泳胶上加2 μg总蛋白, 4 ℃循环水浴, 125 V电泳66 h。电泳结束后, 使用考马斯亮蓝R-250对蛋白染色2 h, 脱色3次, 每次3 h, 至呈现干净的凝胶背景。用GT-800 F扫描仪对蛋白拍照, 并用Image J软件计算不同肌纤维类型所占比例。
1.4.4 CaN-NFAT信号通路关键基因采用Trizol试剂提取细胞中总RNA, 用超微量分光光度计检测RNA的浓度和纯度。RNA浓度以500 ng · μL-1为宜; 纯度采用A260/A280值来衡量, 比值在1.8~2.0为宜。
参考反转录试剂盒说明书, 将符合浓度和纯度条件的RNA反转录为cNDA。仪器参数设置为37 ℃、15 min, 85 ℃、5 s, 4 ℃至结束。
从GenBank中获取所有基因参考序列, 设计引物并由上海生工生物工程股份有限公司合成。引物序列表见表 2。
| 基因名称Gene | GenBank登录号GenBank ID | 引物对序列Prime pairs sequences(5′→3′) |
| CaM | NM_205005.1 | TGCATGTGGCTTACTCTGGA/ACTAGGGTCAGCATCTCGCT |
| CaN | XM_025149952.1 | TGTCCCATTTCCTCCAAGTC/GCTTTCTTCCAGTCTCCCTTC |
| NFATc1 | XM_025147636.1 | GGTCTTCCGAGTTCACATCC/TCTCCACCAGAGGCAGTTCT |
| PGC1α | XM_015285697.2 | CGTGGAGCAATAAAGCGAAG/TCTGAGGAGGGTCATCGTTC |
| MEF2C | XM_025144794.1 | CCATCAGCCATCTCAACAAC/CAGCCAGTCACAGAACCAAG |
| MyoD | NM_204214.2 | AACCTGAGTGACAGTGGAGC/TCTTGGAGCTTGGCTGAACG |
| Myf5 | NM_001030363.1 | GCAGCCACTATGAGGGAGAG/GATGTACCTGATGGCGTTCC |
| 18S | XR_003078044.1 | GCGATCCGGCGGCGTTATTC/GTGGTGCCCTTCCGTCAATTCC |
| 注: CaM:钙调蛋白; CaN:钙调磷酸酶; NFATc1 :活化T细胞核转录因子; PGC1α :过氧化物酶体增殖物激活受体C辅激活因子1α; MEF2C :肌细胞增强因子2C;MyoD:肌细胞生成素; Myf5 :生肌决定因子; 18S:18S rRNA复合物。 Note: CaM:Calmodulin; CaN:Calcineurin; NFATc1 :Nuclear factor of activated T cells c1;PGC1α :Peroxisome proliferator-activated receptor-γ coactivator-1α; MEF2C :Myocyte enhancer factor 2C;MyoD:Myogenic differentiation antigen; Myf5 :Myogenic regulatory factors 5; 18S:18S rRNA complex. | ||
参考SYBR Premix Ex Taq说明书加样, 反应体系为20 μL。反应条件:95 ℃、30 s; 95 ℃、5 s, 60 ℃、30 s, 40个循环; 95 ℃、15 s, 60 ℃、1 min, 95 ℃、15 s。每个基因样品3个重复, 计算3次CT值的平均值, 用2-ΔΔCT法[14]分析相关基因mRNA的表达水平。
1.5 数据处理与统计分析采用SPSS 20.0软件进行独立样本t检验分析, 数据以每笼2只鸡试验数据的平均值代表该重复的数据进行统计(n=6)。试验结果以平均值±标准差(x±SD)表示。
2 结果与分析 2.1 牛磺酸对肉鸡腿肌肉品质的影响由表 3可见:与对照组相比, 牛磺酸组肉鸡腿肌pH45 min值显著提高(P < 0.05), pH24 h值极显著提高(P < 0.01), 蒸煮损失显著降低(P < 0.05), 剪切力极显著降低(P < 0.01), 但L*、a*、b*值和滴水损失无显著变化(P>0.05)。
| 指标Items | 对照组Control group | 牛磺酸组Taurine group |
| pH45 min | 6.53±0.06 | 6.62±0.06* |
| pH24 h | 6.04±0.10 | 6.25±0.06** |
| 亮度(L*)Lightness | 49.93±1.34 | 48.65±0.71 |
| 红度(a*)Redness | 11.93±2.25 | 11.88±2.06 |
| 黄度(b*)Yellowness | 10.74±1.27 | 10.47±0.74 |
| 滴水损失/% Drip loss | 1.27±0.13 | 1.13±0.19 |
| 蒸煮损失/% Cooking loss | 16.33±2.52 | 12.95±1.72* |
| 剪切力/NShear force | 33.69±1.70 | 21.10±2.01** |
| 注:与对照组相比较, *和* *分别表示差异显著(P < 0.05)和差异极显著(P < 0.01), 下同。 Note: Compared with the control group, * and * *mean significant difference(P < 0.05)and extremely significant difference(P < 0.01), the same below. | ||
由表 4可见:日粮中添加牛磺酸显著降低腿肌中乳酸含量(P < 0.05), 极显著降低GP(P < 0.01), 但对糖原含量无显著影响(P>0.05)。
| 指标Items | 对照组Control group | 牛磺酸组Taurine group |
| 糖原含量/(μmol·g-1) Glycogen content | 2.70±0.24 | 2.75±0.21 |
| 乳酸含量/(μmol·g-1) Lactate content | 126.66±5.07 | 116.79±8.20* |
| GP/(μmol·g-1) Glycolytic potential | 132.73±5.35 | 121.01±7.89** |
由表 5和图 1可见:日粮中添加牛磺酸极显著降低腿肌肌纤维的直径(P < 0.01), 极显著提高肌纤维的密度(P < 0.01)。
| 指标Items | 对照组Control group | 牛磺酸组Taurine group |
| 肌纤维直径/μmFiber diameter | 29.89±0.88 | 27.40±0.75** |
| 肌纤维密度/(N·mm-2) Fiber density | 1265.20±41.73 | 1 430.04±83.75** |
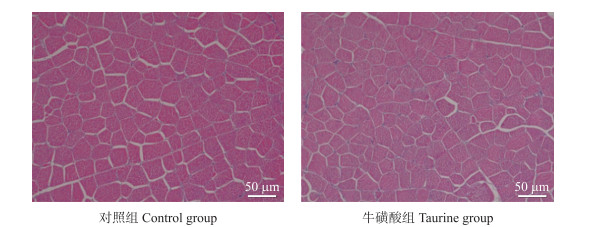
|
图 1 腿肌肌纤维切片 Fig. 1 Section of thigh muscle fiber |
由图 2可见:与对照组相比, 牛磺酸组肉鸡腿肌Ⅰ型肌纤维所占比例显著提高(P < 0.05), Ⅱb型肌纤维所占比例显著降低(P < 0.05), 而Ⅱa型肌纤维所占比例无显著变化(P>0.05)。
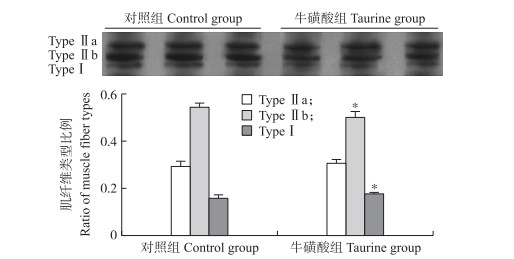
|
图 2 牛磺酸对肉鸡腿肌肌纤维类型比例组成的影响 Fig. 2 Effect of taurine supplementation on the muscle fiber ratio of thigh muscle in broilers |
TypeⅠ:Ⅰ型肌纤维(慢收缩氧化型)TypeⅠmuscle fiber(slow twitch, oxidative); Type Ⅱa:Ⅱa型肌纤维(快收缩氧化酵解型)Type Ⅱa muscle fiber(fast twitch, oxidative-glycolytic); Type Ⅱb:Ⅱb型肌纤维(快收缩酵解型)Type Ⅱb muscle fiber(fast twitch, glycolytic).
2.5 牛磺酸对CaN-NFAT信号通路相关基因表达的影响由图 3可见:日粮中添加牛磺酸显著提高了肉鸡腿肌中CaN、NFATc1、MEF2C和PGC1α mRNA的表达水平(P < 0.05), 但对CaM、MyoD和Myf5 mRNA的表达水平无显著影响(P>0.05)。
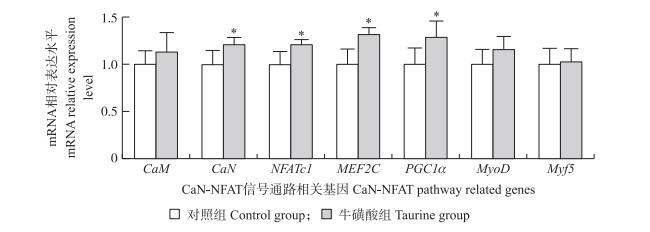
|
图 3 牛磺酸对肉鸡腿肌CaN-NFAT通路相关基因mRNA表达量的影响 Fig. 3 Effects of taurine supplementation on the related mRNA expression level of CaN-NFAT of thigh muscle in broilers |
pH值、肉色、系水力和嫩度等是评价肉品质的常用指标。pH值对肉色、嫩度、保水性和肉的贮藏期都有直接影响。Lu等[15]研究发现, 在日粮中添加0.5%牛磺酸可显著提高慢性热应激肉鸡胸肌的pH45 min值。在本试验中, 日粮中添加0.5%牛磺酸可显著提高肉鸡pH45 min和pH24 h值。宰后糖酵解代谢速率直接影响pH的下降程度和速率, 而糖酵解速率与肌纤维类型密切相关。Ⅱb型肌纤维中ATP酶活性、糖原含量以及糖酵解潜力均高于其他类型肌纤维[16]。在本试验中, 牛磺酸的添加显著减少了肉鸡腿肌中Ⅱb型肌纤维的比例, 并降低糖酵解潜力, 而对糖原含量无显著影响。这表明牛磺酸可能通过调控腿肌肌纤维的转化, 降低宰后糖酵解速率, 减少糖原的分解, 进而降低乳酸的产生。这也解释了本试验中牛磺酸组肉鸡腿肌pH值升高的原因。Jeong等[17]研究指出, Ⅰ型肌纤维属于慢速氧化型纤维, 血红蛋白含量较高, 肉色较红。然而在本试验中, 虽然牛磺酸的添加显著增加了Ⅰ型肌纤维的占比, 却对肉色没有显著影响。产生这种现象的确切原因还不清楚, 因为肌红蛋白化学状态、脂肪氧化状态和线粒体活性等因素都影响肉色[18]。在本试验中, 牛磺酸的添加显著降低了肉鸡腿肌的蒸煮损失, 这与曾得寿等[19]的研究结果一致, 其原因可能是牛磺酸的添加延缓了宰后pH值的下降, 蛋白质变性程度降低, 进而提高肉鸡腿肌的系水力。肌纤维的直径、类型、肌内脂肪含量等因素对肌肉的嫩度有重要的影响。Ⅰ型肌纤维直径较细, 密度较大, 嫩度较高, 而Ⅱb型肌纤维直径较粗, 密度较小, 嫩度较差[16]。臧素敏等[20]研究指出在日粮中添加0.1%~0.15%牛磺酸可显著降低肉鸭胸肌的剪切力和肌纤维直径, 增加肌纤维密度。在本试验中, 与对照组相比, 牛磺酸组肉鸡腿肌的剪切力显著降低, 这可能与牛磺酸的添加降低肉鸡腿肌肌纤维的直径, 同时增加肌纤维的密度有关。
CaN-NFAT信号通路在调节骨骼肌肌纤维类型的转化中发挥着重要的作用。CaN是一种依赖于Ca2+/CaM的丝氨酸/苏氨酸蛋白磷酸酶。NFAT是CaN的一个关键底物, 以磷酸化的形式存在于细胞液中。当细胞内Ca2+浓度增加时, Ca2+便与CaM结合并激活CaN, 从而使NFAT去磷酸化, 从胞质转移到细胞核内, 并与靶基因结合, 进而促进慢肌纤维基因的表达[4]。MEF2C是转录调节因子MADS-box家族中的成员, 在维持肌纤维比例和肌细胞成熟中发挥重要功能。PGC1α是核转录的一种辅助激活因子, 能协同NFAT和MEF2C调节Myf5、肌球蛋白重链、肌红蛋白等多种肌肉特异性基因的表达[21]。Dutka等[22]研究发现牛磺酸的添加可提高人肌肉肌浆网中Ca2+浓度。在本试验中, 牛磺酸组CaN、NFATc1、MEF2C和PGC1α mRNA的表达水平显著升高。这一结果的产生可能是因为牛磺酸对Ca2+的调节作用, 促进CaN mRNA的表达, 进而激活CaN-NFAT信号通路。Cong等[23]发现肉鸡腿肌中CaN mRNA表达水平的增加与Ⅰ型肌纤维比例提高以及Ⅱb型肌纤维比例降低显著相关。因此本试验牛磺酸组肉鸡腿肌Ⅰ型肌纤维占比的显著提高和Ⅱb型肌纤维占比的显著降低可能是因为牛磺酸的添加激活了CaN-NFAT信号通路。
综上所述, 日粮中添加牛磺酸可通过激活CaN-NFAT信号通路, 促进腿肌肌纤维由Ⅱb型向Ⅰ型转化, 降低糖酵解潜力(GP), 改善肉鸡腿肌肉品质。
| [1] |
Petracci M, Mudalal S, Soglia F, et al. Meat quality in fast-growing broiler chickens[J]. World's Poultry Science Journal, 2015, 71(2): 363-374. DOI:10.1017/S0043933915000367 |
| [2] |
Bowker B C, Grant A L, Swartz D R, et al. Myosin heavy chain isoforms influence myofibrillar ATPase activity under simulated postmortem pH, calcium, and temperature conditions[J]. Meat Science, 2004, 67(1): 139-147. DOI:10.1016/j.meatsci.2003.09.016 |
| [3] |
Listrat A, Lebret B, Louveau I, et al. How muscle structure and composition influence meat and flesh quality[J]. The Scientific World Journal, 2016, 2016: 1-14. |
| [4] |
郭秋平, 文超越, 王文龙, 等. 肌纤维类型转化的分子信号通路及其营养调控进展[J]. 动物营养学报, 2017, 29(6): 1836-1842. Guo Q P, Wen C Y, Wang W L, et al. Progress in molecular signaling pathway of skeletal muscle fiber type transformation and its nutritional regulation[J]. Chinese Journal of Animal Nutrition, 2017, 29(6): 1836-1842 (in Chinese with English abstract). |
| [5] |
Inam-Ullah, Piao F Y, Aadil R M, et al. Ameliorative effects of taurine against diabetes:a review[J]. Amino Acids, 2018, 50(5): 487-502. DOI:10.1007/s00726-018-2544-4 |
| [6] |
Schaffer S W, Ito T, Azuma J. Clinical significance of taurine[J]. Amino Acids, 2014, 46(1): 1-5. DOI:10.1007/s00726-013-1632-8 |
| [7] |
Wang X F, Li J L, Cong J H, et al. Preslaughter transport effect on broiler meat quality and post-mortem glycolysis metabolism of muscles with different fiber types[J]. Journal of Agricultural and Food Chemistry, 2017, 65(47): 10310-10316. DOI:10.1021/acs.jafc.7b04193 |
| [8] |
Brambila G S, Bowker B C, Chatterjee D, et al. Descriptive texture analyses of broiler breast fillets with the wooden breast condition stored at 4℃ and -20℃[J]. Poultry Science, 2018, 97(5): 1762-1767. DOI:10.3382/ps/pew327 |
| [9] |
Niu Y, Wan X L, Zhang X H, et al. Effect of supplemental fermented Ginkgo biloba leaves at different levels on growth performance, meat quality, and antioxidant status of breast and thigh muscles in broiler chickens[J]. Poultry Science, 2017, 96(4): 869-877. DOI:10.3382/ps/pew313 |
| [10] |
Li J L, Zhang L, Yang Z Y, et al. Effects of different selenium sources on growth performance, antioxidant capacity and meat quality of local Chinese Subei chickens[J]. Biological Trace Element Research, 2018, 181(2): 340-346. DOI:10.1007/s12011-017-1049-4 |
| [11] |
Gao T, Li J L, Zhang L, et al. Effect of different tumbling marination treatments on the quality characteristics of prepared pork chops[J]. Asian-Australasian Journal of Animal Sciences, 2015, 28(2): 260-267. |
| [12] |
郭照宙, 崔红霞, 武洪志, 等. 饲粮中添加超氧化物歧化酶模拟物对肉仔鸡肌纤维特性及肌肉超氧化物歧化酶活性的影响[J]. 动物营养学报, 2018, 30(1): 202-211. Guo Z Z, Cui H X, Wu H Z, et al. Effects of dietary superoxide dismutase simulant on myofiber characteristics and muscle superoxide dismutase activity of broilers[J]. Chinese Journal of Animal Nutrition, 2018, 30(1): 202-211 (in Chinese with English abstract). |
| [13] |
Liu R, Li Y P, Zhang W G, et al. Activity and expression of nitric oxide synthase in pork skeletal muscles[J]. Meat Science, 2015, 99: 25-31. DOI:10.1016/j.meatsci.2014.08.010 |
| [14] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [15] |
Lu Z, He X F, Ma B B, et al. Dietary taurine supplementation improves breast meat quality in chronic heat-stressed broilers via activating the Nrf2 pathway and protecting mitochondria from oxidative attack[J]. Journal of the Science of Food and Agriculture, 2019, 99(3): 1066-1072. DOI:10.1002/jsfa.9273 |
| [16] |
Ryu Y C, Kim B C. The relationship between muscle fiber characteristics, postmortem metabolic rate, and meat quality of pig longissimus dorsi muscle[J]. Meat Science, 2005, 71(2): 351-357. DOI:10.1016/j.meatsci.2005.04.015 |
| [17] |
Jeong J Y, Hur S J, Yang H S, et al. Discoloration characteristics of 3 major muscles from cattle during cold storage[J]. Journal of Food Science, 2009, 74(1): C1-C5. DOI:10.1111/j.1750-3841.2008.00983.x |
| [18] |
Suman S P, Joseph P. Myoglobin chemistry and meat color[J]. Annual Review of Food Science and Technology, 2013, 4(1): 79-99. DOI:10.1146/annurev-food-030212-182623 |
| [19] |
曾得寿, 高振华, 黄晓亮. 牛磺酸对肉仔鸡屠宰性能和肌肉品质的影响[J]. 中国饲料, 2011(17): 21-23, 28. Zeng D S, Gao Z H, Huang X L. Effects of taurine on slaughter performance and meat quality of broilers[J]. China Feed, 2011(17): 21-23, 28 (in Chinese with English abstract). |
| [20] |
臧素敏, 李同洲, 郭鹏飞. 添加牛磺酸对樱桃谷肉鸭生产性能和肌肉品质影响的研究[J]. 中国家禽, 2007, 29(24): 12-15. Zang S M, Li T Z, Guo P F. Effect of dietary taurine on the production performance and meat quality in Cherry Valley meat duck[J]. China Poultry, 2007, 29(24): 12-15 (in Chinese with English abstract). |
| [21] |
Lin J D, Wu H, Tarr P T, et al. Transcriptional co-activator PGC-1α drives the formation of slow-twitch muscle fibres[J]. Nature, 2002, 418(6899): 797-801. DOI:10.1038/nature00904 |
| [22] |
Dutka T L, Lamboley C R, Murphy R M, et al. Acute effects of taurine on sarcoplasmic Reticulum Ca2+ accumulation and contractility in human typeⅠand type Ⅱ skeletal muscle fibers[J]. Journal of Applied Physiology, 2014, 117(7): 797-805. DOI:10.1152/japplphysiol.00494.2014 |
| [23] |
Cong J H, Zhang L, Li J L, et al. Effects of dietary supplementation with carnosine on growth performance, meat quality, antioxidant capacity and muscle fiber characteristics in broiler chickens[J]. Journal of the Science of Food and Agriculture, 2017, 97(11): 3733-3741. DOI:10.1002/jsfa.8236 |




