文章信息
- 杨丹, 宋昕昊, 季春雷, 彭麟, 高修歌, 左儒楠, 季辉, 江善祥
- YANG Dan, SONG Xinhao, JI Chunlei, PENG Lin, GAO Xiuge, ZUO Runan, JI Hui, JIANG Shanxiang
- 马度米星铵对鲫鱼肝脏细胞色素P450酶系的影响
- Effects of maduramicin on hepatic cytochrome P450 enzymes of Carassius auratus
- 南京农业大学学报, 2020, 43(5): 927-934
- Journal of Nanjing Agricultural University, 2020, 43(5): 927-934.
- http://dx.doi.org/10.7685/jnau.201911012
-
文章历史
- 收稿日期: 2019-11-07
马度米星铵是一种聚醚类离子载体抗生素, 因其具备广谱抗球虫作用、效价高、低耐药性等特点被用于防治鸡球虫病[1-2]。马度米星铵在鸡体内代谢较快且不会被完全代谢, 部分以原形药物形式通过鸡粪进入土壤中, 进一步污染水体生态环境, 对人类和水生生物构成潜在威胁[3]。有文献报道[4], 在西班牙地表水中检测到马度米星铵的存在, 平均质量浓度为13.2 ng · L-1。已有研究表明, 2.5 mg · L-1的马度米星铵会损伤斑马鱼的鳃、肝脏和肠道等主要器官[5]。食用残留有马度米星铵的动物组织能引起人肌肉疼痛、心脏冠状动脉扩张、肝肾功能受损等症状, 对人类健康造成严重影响[6]。
细胞色素P450(cytochrome P450, CYP450)酶系是一类亚铁血红素蛋白的超家族酶系, 主要分布在肝脏, 参与多种内源物质(保幼激素及其类似物、蜕皮甾酮、脂肪酸和信息素等)和外源物质(药物、环境毒物等)在生物体内的代谢, 在解毒酶系中占有重要位置[7]。由于CYP450酶系同工酶对外源性物质的高敏感性, 已将其作为早期评估和检测水生生态环境系统污染的重要指标[8]。在CYP450酶系中, CYP1~4亚家族在代谢外源性物质的过程中发挥重要作用, 它的活性变化可能对动物食品的药物残留产生重要影响[9]。
鲫鱼是我国最常见的淡水鱼类之一[10]。鲫鱼在水生生态系统食物链中具有非常重要的位置, 因为其对水体环境的高度敏感性, 在毒理学和评价生态风险等方面发挥了重要作用[8, 11]。本文以鲫鱼为试验动物, 从基因、酶活性和体外肝微粒体孵育3个方向研究马度米星铵对鲫鱼肝脏CYP450酶系的影响, 筛选出敏感的生化指标作为马度米星铵污染水体的生物标志物, 为生态风险评估提供物质基础; 同时初步探讨其毒性机制, 为进一步研究马度米星铵在肝脏中的代谢提供依据。
1 材料与方法 1.1 试验药物及试验动物马度米星铵:含量91.9%, 生产批号1701004, 浙江汇能生物股份有限公司。
试验鲫鱼平均体质量为(289±25)g, 购于南京特给力种植专业合作社, 置于聚乙烯塑料箱(60 cm×40 cm×30 cm)内。水源为充分曝气脱氯的自来水, 试验期间不间断充氧, 水中溶氧量大于6 mg · L-1, pH值约为7, 水温(20±2)℃, 保持12 h : 12 h的光暗周期。每天更换一半养殖用水并将药物补充至初始浓度。按鲫鱼体质量的1%定时投喂不含抗生素的全价鱼饲料并清理箱底粪便及剩余饲料。试验前驯养1周, 自然死亡率低于1%。
1.2 主要试剂和仪器乙醇、氯化钾和三氯甲烷均购于国药集团化学试剂有限公司; RNAiso Plus、TB Green Premix Ex Taq Ⅱ和PrimeScript RT reagent Kit With gDNA Eraser均购于宝日医生物技术有限公司; 检测红霉素-N-脱甲基酶(ERND)、7-乙氧基异吩唑酮-脱乙基酶(EROD)、氨基比林-N-脱甲基酶(APND)、NADPH-细胞色素C还原酶(NCCR)、苯胺-4-羟化酶(AH)的活性和CYP450含量的试剂盒均购于上海江莱生物科技有限公司; 微量紫外分光光度计(NanoDrop 2000型)、高效液相色谱仪(UltiMate 3000), 美国Thermo Fisher; 荧光定量PCR仪(CFX96型)、微型电动匀浆器(1658050型), 美国BIO-RAD; 多功能酶标仪(Infinite 200 PRO), 瑞士Tecan。
1.3 试验方法 1.3.1 试验分组处理采用半静态染毒法, 试验时长28 d, 设定低剂量组(0.112 mg · L-1)、中剂量组(0.224 mg · L-1)、高剂量组(0.448 mg · L-1)及助溶剂(乙醇)对照组。鲫鱼处死前禁食1 d, 分别于染毒后7、14、21和28 d从各组随机取4条, 头部穿刺致死, 立即取出肝脏, 用冰冷的0.15 mol · L-1 KCl溶液反复漂洗除去红细胞, 滤纸吸干多余水分, 置于液氮冷冻后转入-80 ℃保存。
1.3.2 RT-qPCR检测CYP450酶系相关基因表达使用RNAiso Plus试剂提取肝脏总RNA并检测其完整性。采用微量分光光度计确定总RNA浓度和纯度(1.8 < D260/D280 < 2.0), 用1 g · L-1的焦炭酸二乙酯(DEPC)水将RNA浓度统一调至500 ng · μL-1。反转录(RT):使用20 μL的反应体系, 根据TaKaRa反转录试剂盒说明书的方法操作。反转录条件:37 ℃ 15 min, 85 ℃ 5 s。反转录产物cDNA在-20 ℃保存待用。qPCR反应基因引物序列由南京擎科公司合成(表 1)。25 μL反应体系:TB Green 12.5 μL, 上、下游引物各1 μL, 灭菌三蒸水8.5 μL, cDNA模板2 μL。qPCR反应程序:95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 30 s, 共40个循环; 95 ℃ 15 s, 65 ℃ 5 s, 95 ℃ 5 s。以ef1α 为内参基因[12], 根据各CT值, 按照2-ΔΔCT法计算各目的基因的mRNA相对表达量。
| 目的基因 Target gene |
引物对序列 Primer pairs sequences(5′→3′) |
产物大小/bp Product size |
GenBank登录号 GenBank accession No. |
| ef1α | F:ATGGGCTGGTTCAAGGGATG/R:GACGGCTGGGTGGCAAAATG | 100 | AB056104 |
| CYP1A | F:GACATCACCGACTCGCTCAT/R:GATAGACGACACCCCAAGAC | 160 | DQ517445 |
| CYP3A | F:GACCAATCCATCATCAAAACC/R:ATCTTCCACGACGGACACG | 114 | AEN69416 |
| CYP4T | F:TTTGAACATCCACCACCCAT/R:AAGTAAGCCATCGCCTAACC | 105 | JX412927 |
| 注: ef1α :延伸因子基因Elongation factor-1 alpha gene; CYP1A :细胞色素P450 1A基因Cytochrome P450 1A gene; CYP3A :细胞色素P450 3A基因Cytochrome P450 3A gene; CYP4T :细胞色素P450 4T基因Cytochrome P450 4T gene. | |||
取肝组织, 按1 : 9的质量体积比添加预冷的匀浆液(0.25 mol · L-1蔗糖、0.01 mol · L-1 Tris、1 mmol · L-1 EDTA, pH7.4), 用匀浆机冰水浴中匀浆, 4 ℃、13 000 g离心20 min, 取上清液立即检测。ERND、EROD和APND等指标测定均按试剂盒说明书的步骤进行。
1.3.4 对乙酰氨基酚浓度的HPLC检测[13]1) 色谱条件。色谱柱:Waters Sunfire C18柱(4.6 mm×150 mm, 5 μm), 流速0.5~0.8 mL · min-1, 检测波长254 nm, 柱温40 ℃, 进样量100 μL, 以甲醇(A)和水(B)为流动相, V(A) : V(B)依次为20 : 80、40 : 60、20 : 80, 采用梯度洗脱程序。洗脱条件见表 2。2)对乙酰氨基酚标准曲线。以对乙酰氨基酚和内标(安替比林)峰面积的比值为纵坐标(Y)对对乙酰氨基酚浓度(X)进行线性回归, 得出对乙酰氨基酚标准曲线方程。
| 时间/min | V(A)/% | V(B)/% | 流速/(mL·min-1) |
| 0~11 | 20 | 80 | 0.5 |
| 11~23 | 40 | 60 | 0.8 |
| 23~24 | 20 | 80 | 0.5 |
取空白鲫鱼肝组织, 按1 : 4的质量体积比添加预冷的匀浆液, 用匀浆机冰水浴中匀浆, 4 ℃、19 000 g离心20 min, 将1 mL上清液加入0.1 mL 88 mmol · L-1 CaCl2溶液, 冰浴放置10 min, 期间轻轻混匀数次, 再于4 ℃、27 000 g离心20 min, 向沉淀中加入4倍于肝质量的匀浆液, 于4 ℃、27 000 g离心20 min, 粉红色沉淀即为所需的肝微粒体。将沉淀重悬于含20%甘油的悬浮缓冲液(0.25 mol · L-1 KCl、0.01 mol · L-1 Tris、1 mmol · L-1 EDTA, pH7.4)中, 分装, 置-80 ℃保存备用。采用Bradford法测定肝微粒体中的蛋白浓度[15]。
1.3.6 体外肝微粒体孵育条件及样品处理孵育体系包括:1 mg · mL-1肝微粒体、133 μmol · L-1非那西丁、1 mmol · L-1 NADPH、50 mmol · L-1 Tris-HCl(pH7.4), 补足体系至600 μL。20 ℃预孵10 min, 加入NADPH启动反应后再孵育20 min。反应体系中有机溶剂少于1%。待反应结束后加入150 μL冰冷的甲醇(含内标安替比林)终止反应并沉淀蛋白。涡旋振荡, 13 000 g离心10 min, 吸100 μL上清液进行HPLC测定。
1.3.7 优化体外肝微粒体孵育条件根据肝微粒体孵育活性的影响因素, 对肝微粒体蛋白质量浓度(0.2、0.5、0.8、1.0、1.5、2.0和2.5 mg · mL-1)、孵育时间(10、20、30、60、90和120 min)及孵育温度(0、4、10、20、37和45 ℃)分别进行优化。分别以肝微粒体蛋白质量浓度、孵育时间及孵育温度为横坐标(X), 以对乙酰氨基酚生成率为纵坐标(Y), 选择线性范围内比值最高点作为最佳孵育条件。
1.3.8 马度米星铵对鲫鱼肝微粒体中CYP1A活性的影响向孵育体系中分别加入马度米星铵使其终浓度为1.25、2.50、5.00、10.00、20.00、40.00、80.00 μmol · L-1, 采用优化后指标进行试验, 其他条件不变。按如下公式计算马度米星铵对CYP1A活性的抑制率, 以马度米星铵浓度和抑制率为横、纵坐标, 绘制“马度米星铵浓度-抑制率”曲线图。
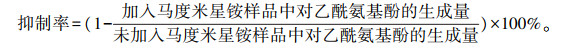
|
采用SPSS 25.0软件统计分析, 差异显著性检验采用单因素方差分析(One-way ANOVA, LSD法)。数据结果均以平均值±标准误(x±SE)表示, 并用GraphPad Prism 8软件绘图。
2 结果与分析 2.1 马度米星铵对鲫鱼肝CYP450酶系相关基因表达的影响染毒后7 d, 0.448 mg · L-1马度米星铵组CYP1A mRNA表达量显著高于对照组(P < 0.05);染毒后14和21 d, 0.112 mg · L-1马度米星铵组CYP1A mRNA表达量显著高于对照组(图 1-A)。染毒后7 d, 0.224 mg · L-1马度米星铵组CYP3A mRNA表达量显著高于对照组(P < 0.05);染毒后28 d, 0.448 mg · L-1组CYP3A mRNA表达量显著低于对照组(P < 0.05)(图 1-B)。染毒后21 d, 0.448 mg · L-1组CYP4T mRNA表达量显著高于对照组(P < 0.05)(图 1-C)。此结果提示, 染毒后的前21 d, 马度米星铵可诱导CYP1A、CYP3A和CYP4T mRNA的表达, 但这种诱导作用并无浓度-效应和时间-效应关系。

|
图 1 马度米星铵对鲫鱼肝脏中CYP1A、CYP3A和CYP4T mRNA表达的影响 Fig. 1 Effects of maduramicin on mRNA levels of CYP1A, CYP3A and CYP4T in liver of Carassius auratus 与对照组比, *表示差异显著(P < 0.05)。下同。 *mean significant difference at 0.05 level compared with control group. The same as follows. |
马度米星铵对各组EROD活性影响的结果显示(图 2-A):染毒后7 d, 0.112 mg · L-1和0.224 mg · L-1马度米星铵组EROD活性低于对照组, 0.448 mg · L-1马度米星铵组活性高于对照组, 但均无显著差异(P>0.05);染毒后14、21和28 d, 各染毒组活性均低于对照组, 其中14和21 d, 0.224和0.448 mg · L-1组EROD活性显著低于对照组(P < 0.05), 而其他染毒组与对照组相比无显著差异(P>0.05)。表明, 马度米星铵可抑制EROD的活性, 这种抑制作用在21 d后趋于平缓。

|
图 2 马度米星铵对鲫鱼肝脏中CYP450酶系活性的影响 Fig. 2 Effects of maduramicin on CYP450 enzymes activity in the liver of Carassius auratus |
图 2-B显示:试验期间, 马度米星铵处理组ERND活性均低于对照组; 除7 d 0.112 mg · L-1组、21 d 0.224和0.448 mg · L-1组的ERND活性与对照组相比无显著差异外(P>0.05), 其他染毒组均显著低于对照组(P < 0.05);ERND活性随染毒时间的延长呈下降趋势。表明, 马度米星铵对ERND活性的抑制作用有一定的时间-效应关系。
图 2-C显示:染毒后14 d, 0.224和0.448 mg · L-1组APND活性显著低于对照组(P < 0.05);后期APND活性逐渐上升并恢复至对照组水平。表明, 马度米星铵对APND的活性先抑制后诱导。
图 2-D显示:试验期间, 马度米星铵处理组的AH活性呈先升高后下降的趋势; 染毒后的前21 d, 各剂量马度米星铵组AH活性逐渐上升并于21 d达到最高, 其中0.112 mg · L-1组活性显著高于对照组(P < 0.05), 同时AH活性与药物浓度呈负相关; AH活性在28 d下降且均低于对照组, 其中0.112 mg · L-1组活性显著低于对照组(P < 0.05)。表明, 马度米星铵对AH的活性先诱导后抑制, 且AH活性和马度米星铵之间在前21 d存在浓度-效应和时间-效应关系。
图 2-E显示:马度米星铵组NCCR活性呈先降低后升高的趋势; 染毒后14 d, 各剂量马度米星铵组的NCCR活性达到最低且均低于对照组, 其中0.224和0.448 mg · L-1组活性均显著低于对照组(P < 0.05);后期各剂量组NCCR活性逐渐上升并高于对照组, 其中0.448 mg · L-1组活性在28 d显著高于对照组(P < 0.05)。表明, 马度米星铵对NCCR的活性先抑制后诱导。
图 2-F显示:染毒后14 d, 0.448 mg · L-1马度米星铵组CYP450含量显著低于对照组(P < 0.05);在其他时间点, 马度米星铵组的CYP450含量呈波动趋势, 与对照组相比差异均不显著(P>0.05)。表明, 高剂量的马度米星铵在一定时间内会干扰CYP450的合成。
2.3 对乙酰氨基酚的标准曲线的建立在空白肝微粒体温孵液中加入不同浓度的对乙酰氨基酚标准溶液, 使其终浓度分别为66.5、33.3、16.6、8.3、4.2、2.1、1.0和0.5 μmol · L-1, 按照1.3.6节处理后进样测定, 以对乙酰氨基酚和内标峰面积的比值对浓度绘图, 得到回归方程为Y=43.588X-0.093 3(R2=0.999 9)。表明, 对乙酰氨基酚在0.5~66.5 μmol · L-1范围内线性关系良好。
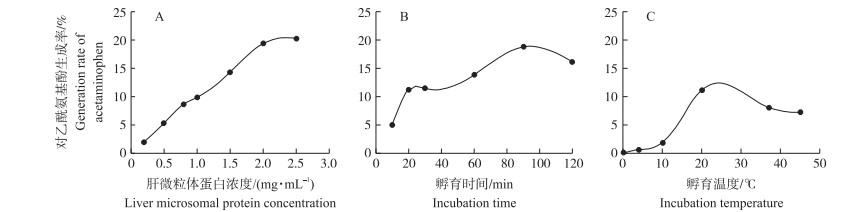
2.4 体外肝微粒体孵育条件的优化由图 3-A可知:肝微粒体蛋白质量浓度为0.2~2.0 mg · mL-1时, 对乙酰氨基酚生成率呈线性增长, 回归方程为Y=9.488X+0.535 6(R2=0.996 2), 线性范围内比值最高点为0.8 mg · mL-1; 由图 3-B可知:孵育时间为20~90 min时, 对乙酰氨基酚生成率呈线性增长, 回归方程为Y=0.108 3X+8.541 8(R2=0.945 4), 线性范围内比值最高点为20 min; 由图 3-C可知:孵育温度为4~20 ℃时, 对乙酰氨基酚的生成率呈线性增长, 回归方程为Y=0.683 8X-3.097 6(R2=0.924 6), 线性范围内比值最高点为20 ℃。因此, 最佳孵育条件为:肝微粒体蛋白质量浓度0.8 mg · mL-1、孵育时间20 min、孵育温度20 ℃。
|
图 3 肝微粒体蛋白浓度(A)、孵育时间(B)和孵育温度(C)对对乙酰氨基酚生成的影响 Fig. 3 Effect of liver microsomal protein concentration(A), incubation time(B)and incubation temperature(C) on the generation of acetaminophen |
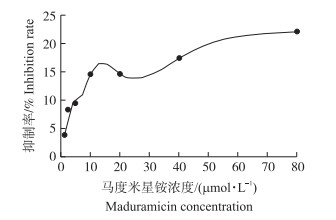
由图 4可知:马度米星铵对CYP1A活性的抑制率小于25%。表明, 马度米星铵对鲫鱼肝微粒体CYP1A活性无影响。
|
图 4 马度米星铵对CYP1A活性抑制率的影响 Fig. 4 Effect of maduramicin on inhibition rate of CYP1A activity |
在外来化合物的作用下, CYP450酶的活性可以被诱导, 也可以被抑制。诱导可能是由诱导剂引起相应基因的转录激活或增加。抑制作用可通过多种途径实现, 如抑制蛋白的合成、降低CYP450含量、影响药物氧化过程中电子传递及辅酶的合成等。此外, 与酶作用底物结构相似的化合物及抑制性抗体的竞争作用, 或缺氧也可抑制CYP450酶的活性[16]。
3.1 马度米星铵对鲫鱼肝CYP450酶系相关基因表达量的影响CYP1A是鱼类中研究最多的一个亚族, 在致癌效应的代谢和激活过程中起着重要作用。CYP1A可被百草枯、多氯联苯及多环芳烃(PAHs)等外源污染物诱导表达, 可作为持久性有机污染物的检测指标[17-19]。在鱼体内, CYP3A是大部分亲脂性或弱中性有机化合物的主要代谢酶[20]。Zhang等[21]试验表明, CYP3A可作为监测PAHs和重金属污染的候选生物标志物。CYP4T亚家族只在鱼类和两栖类表达, 该亚族在鱼体内代谢环境污染物的功能目前还不明确[22]。Liu等[23]研究表明, 稀有鮈鲫暴露于全氟辛酸后, 鳃中CYP4T11 表达量的增加可能是由过氧化物酶增殖物激活受体(PPAR)介导的。本试验结果显示, 马度米星铵可诱导CYP1A、CYP3A和CYP4T mRNA的表达, 但受时间和剂量的限制, 说明CYP1A、CYP3A和CYP4T不适合作为检测马度米星铵污染水体的指标。另外, 马度米星铵对CYP4T的诱导作用是否由PPAR途径介导有待进一步研究。
3.2 马度米星铵对鲫鱼肝CYP450酶系生化指标的影响EROD是CYP1A活性的标志酶。EROD是评估鱼类受PAHs影响的生物标志物[24]。Pannetier等[25]研究表明青鳉EROD活性的升高可作为苯并芘污染环境的生物指示物。He等[26]研究表明苯并三唑及其相关衍生物可抑制海洋扇贝的EROD活性。ERND是CYP3A活性的标志酶, 对药物进行氧化还原或者水解。Wang等[27]研究表明壬基酚可抑制中华圆田螺ERND的活性。朱雨田[28]研究表明辛硫磷对鲫鱼的ERND活性有抑制作用, 可用于监控有机磷农药的污染, 这与本文结果相似。ERND对马度米星铵较为敏感且有一定的时间-效应关系, 适合作为检测马度米星铵污染水体的生物标志物。EROD和ERND的活性在染毒14 d后均被抑制, 推测EROD和ERND在马度米星铵代谢过程中的解毒作用机制可能相似。马度米星铵对ERND的抑制作用强于EROD, 说明不同CYP450酶的底物与药物结合可能存在竞争机制, 也可能是由于酶的结构存在差异性[29]。此外, 马度米星铵诱导CYP3A 的表达, 却抑制其标志酶的活性, 这种抑制作用可能不通过转录水平调控, 为今后进一步研究马度米星铵的毒性机制提供了依据。
APND和AH分别是CYP2B和CYP2E1活性的标志酶。本试验结果表明, 马度米星铵处理后的前14 d APND的活性受抑制, 之后活性升高并恢复至对照组水平。这可能是机体受到外来物刺激后所表现出的一种自我保护, 以缓解抑制效应对生物体机能产生的影响[30]。CYP2E1占肝内CYP450总量的6.6%, 是鱼体内许多低分子有机化合物及药物的主要代谢酶, 经CYP2E1代谢的小分子化合物极易通过各种途径污染水域[31]。研究表明, 硬骨鱼类具有CYP2E1样的蛋白, 能被乙醇诱导且呈剂量依赖效应[32], 这与本试验结果一致。我们推测前期机体大量合成的AH会加速马度米星铵的代谢, 但合成能力有限(ATP供应不足、氨基酸数量不够等)[33], 导致酶活性先升高后降低。
NCCR并不直接参与鲫鱼对马度米星铵的代谢, 主要是给CYP450酶系提供电子。本试验结果表明, 马度米星铵对鲫鱼NCCR活性有先抑制后诱导的作用, 可能是前期马度米星铵对鲫鱼的毒性作用导致NCCR活性下降, 后期机体蓄积的马度米星铵中间代谢产物对NCCR活性有诱导作用。
CYP450含量作为常用的诊断指标之一, 是对P450蛋白总水平的量度。Fu等[34]研究表明, 鲤鱼CYP450含量可以被阿特拉津诱导, 但毒死蜱对CYP450含量没有影响。王国永[35]研究表明马度米星铵对鸡肝脏CYP450含量无显著影响。这些与本试验结果不同, 可能是由试验药物、试验物种、染毒方式及染毒时间不同引起的。
3.3 马度米星铵对鲫鱼肝微粒体CYP1A活性的影响体外肝微粒体孵育法是在模拟生理环境条件下进行生物代谢研究, 易于操作, 速度快, 重现性好, 是研究酶活性最简单有效的方法。本试验以CYP1A的特异性底物非那西丁作为探针, 通过测定其主要代谢产物对乙酰氨基酚的含量来评价马度米星铵对CYP1A活性的抑制程度。本试验结果表明, 马度米星铵对鲫鱼肝微粒体CYP1A活性无影响, 这与体内结果不同, 可能是体内外活性有差异或存在其他作用途径影响EROD活性。
综上所述, 马度米星铵对鲫鱼肝微粒体CYP1A活性无影响; 马度米星铵对ERND活性的抑制作用可能与CYP3A的转录水平无关; ERND对马度米星铵较为敏感, 适合作为马度米星铵污染水体的生物标志物, 为水环境的生态风险评估提供科学依据。
| [1] |
Liu C M, Hermann T E, Downey A, et al. Novel polyether antibiotics X-14868A, B, C, and D produced by a nocardia discovery, fermentation, biological as well as ionophore properties and taxonomy of the producing culture[J]. The Journal of Antibiotics, 1983, 36(4): 343-350. DOI:10.7164/antibiotics.36.343 |
| [2] |
Folz S D, Lee B L, Nowakowski L H, et al. Anticoccidial evaluation of halofuginone, lasalocid, maduramicin, monensin and salinomycin[J]. Veterinary Parasitology, 1988, 28(1): 1-9. |
| [3] |
Fourie N, Bastianello S S, Prozesky L, et al. Cardiomyopathy of ruminants induced by the litter of poultry fed on rations containing the ionophore antibiotic, maduramicin.Ⅰ. Epidemiology, clinical signs and clinical pathology[J]. The Onderstepoort Journal of Veterinary Research, 1991, 58(4): 291-296. |
| [4] |
Iglesias A, Nebot C, Vázquez B I, et al. Detection of veterinary drug residues in surface waters collected nearby farming areas in Galicia, north of Spain[J]. Environmental Science and Pollution Research, 2014, 21(3): 2367-2377. DOI:10.1007/s11356-013-2142-7 |
| [5] |
Ni H, Peng L, Gao X G, et al. Effects of maduramicin on adult zebrafish(Danio rerio):acute toxicity, tissue damage and oxidative stress[J]. Ecotoxicolgy and Environmental Safety, 2019, 168: 249-259. DOI:10.1016/j.ecoenv.2018.10.040 |
| [6] |
张小辉, 张改平, 职爱民, 等. 马杜霉素对人体健康危害及其检测方法研究进展[J]. 中国公共卫生, 2013, 29(1): 145-147. Zhang X H, Zhang G P, Zhi A M, et al. Advances in research on the harm of maduramycin to human health and its detection methods[J]. Chinese Journal of Public Health, 2013, 29(1): 145-147 (in Chinese). |
| [7] |
邱星辉, 冷欣夫. 细胞色素P450的多样性[J]. 生命的化学, 1997, 17(6): 13-16. Qiu X H, Leng X F. Diversity of cytochrome P450[J]. Chemistry of Life, 1997, 17(6): 13-16 (in Chinese). |
| [8] |
Široká Z, Drastichová J. Biochemical markers of aquatic environment contamination-cytochrome P450 in fish:a review[J]. Acta Veterinaria Brno, 2004, 73(1): 123-132. DOI:10.2754/avb200473010123 |
| [9] |
Goldstone J V, McArthur A G, Kubota A, et al. Identification and developmental expression of the full complement of cytochrome P450 genes in zebrafish[J]. BMC Genomics, 2010, 11: 643. DOI:10.1186/1471-2164-11-643 |
| [10] |
张江凡, 齐甜甜, 董传举, 等. 中国不同鲫鱼品系系统发育关系研究进展[J]. 河南水产, 2018, 30(3): 25-27. Zhang J F, Qi T T, Dong C J, et al. Development of phylogenetic relationship of different crucian carp(Carassius auratus)strains in China[J]. Henan Fisheries, 2018, 30(3): 25-27 (in Chinese with English abstract). |
| [11] |
Belton B, Thilsted S H. Fisheries in transition:food and nutrition security implications for the global South[J]. Global Food Security, 2014, 3(1): 59-66. |
| [12] |
莫非.鲫鱼肝胰脏细胞色素P450酶系的影响因素及作用机制研究[D].南京: 南京农业大学, 2011. Mo F. Research on the effect of drugs on expression and activities of cytochrome P450 and mechanism in Crucian[D]. Nanjing: Nanjing Agricultural University, 2011(in Chinese with English abstract). |
| [13] |
李宇琛, 陈鸿雨, 吴天兴, 等. 复方双氯芬酸钠注射液在猪体内药动学和生物利用度研究[J]. 南京农业大学学报, 2016, 39(3): 473-478. Li Y C, Chen H Y, Wu T X, et al. Pharmacokinetics and bioavailability of compound diclofenac soidium injection in pig[J]. Journal of Nanjing Agricultural University, 2016, 39(3): 473-478 (in Chinese with English abstract). DOI:10.7685/jnau.201509001 |
| [14] |
Cinti D L, Moldeus P, Schenkman J B. Kinetic parameters of drug-metabolizing enzymes in Ca2+-sedimented microsomes from rat liver[J]. Biochemical Pharmacology, 1972, 21(24): 3249-3256. DOI:10.1016/0006-2952(72)90089-5 |
| [15] |
Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254. DOI:10.1016/0003-2697(76)90527-3 |
| [16] |
翟倩倩, 李健. 恩诺沙星对脊尾白虾APND、ECOD和GST活性的影响[J]. 海洋科学, 2017, 41(2): 53-60. Zhai Q Q, Li J. Effects of enrofloxacin on APND, ECOD and GST activities in Exopalaemon carinciauda[J]. Marine Sciences, 2017, 41(2): 53-60 (in Chinese with English abstract). |
| [17] |
Ma J G, Li Y Y, Li W G, et al. Hepatotoxicity of paraquat on common carp(Cyprinus carpio L.)[J]. Science of the Total Environment, 2018, 616/617: 889-898. DOI:10.1016/j.scitotenv.2017.10.231 |
| [18] |
Roy M A, Sant K E, Venezia O L, et al. The emerging contaminant 3, 3'-dichlorobiphenyl(PCB-11)impedes Ahr activation and Cyp1a activity to modify embryotoxicity of Ahr ligands in the zebrafish embryo model(Danio rerio)[J]. Environmental Pollution, 2019, 254: 113027. DOI:10.1016/j.envpol.2019.113027 |
| [19] |
Pauletto M, Lopparelli R M, Pegolo S, et al. Significance of the goby Zosterisessor ophiocephalus as a sentinel species for Venice Lagoon contamination:combining biomarker responses and bioaccumulation[J]. Science of the Total Environment, 2019, 660: 959-973. DOI:10.1016/j.scitotenv.2019.01.033 |
| [20] |
Mcarthur A G, Hegelund T, Cox R L, et al. Phylogenetic analysis of the cytochrome P4503(CYP3)gene family[J]. Journal of Molecular Evolution, 2003, 57(2): 200-211. DOI:10.1007/s00239-003-2466-x |
| [21] |
Zhang J S, He Y H, Yan X J, et al. Two novel CYP3A isoforms in marine mussel Mytilus coruscus:identification and response to cadmium and benzo[J]. Aquatic Toxicology, 2019, 214: 105239. DOI:10.1016/j.aquatox.2019.105239 |
| [22] |
Fujita Y, Ohi H, Murayama N, et al. Identification of multiple cytochrome P450 genes belonging to the CYP4 family in Xenopus laevis:cDNA cloning of CYP4F42 and CYP4V4[J]. Comparative Biochemistry and Physiology Part B, 2004, 138(2): 129-136. |
| [23] |
Liu Y, Wang J S, Liu Y, et al. Expression of a novel cytochrome P4504T gene in rare minnow(Gobiocypris rarus)following perfluorooctanoic acid exposure[J]. Comparative Biochemistry and Physiology Part C, 2009, 150(1): 57-64. |
| [24] |
Santana M S, Sandrini-Neto L, Neto F F, et al. Biomarker responses in fish exposed to polycyclic aromatic hydrocarbons(PAHs):systematic review and meta-analysis[J]. Environmental Pollution, 2018, 242: 449-461. DOI:10.1016/j.envpol.2018.07.004 |
| [25] |
Pannetier P, Morin B, Clérandeau C, et al. Comparative biomarker responses in Japanese medaka(Oryzias latipes)exposed to benzo[J]. Science of the Total Environment, 2019, 652: 964-976. DOI:10.1016/j.scitotenv.2018.10.256 |
| [26] |
He T T, Zhang T, Liu S B, et al. Toxicological effects benzotriazole to the marine scallop Chlamys nobilis:a 2-month exposure study[J]. Environmental Science and Pollution Research, 2019, 26(10): 10306-10318. DOI:10.1007/s11356-019-04201-6 |
| [27] |
Wang H W, Zhao W B, Zhang J, et al. Effects of Nonylphenol on the enzyme activity of ERND in gastropods(Cipangopaludina chinensis)[J]. Advanced Materials Research, 2015, 1073: 253-255. |
| [28] |
朱雨田.辛硫磷对鲫鱼体内CYP450酶系的影响及其体内代谢研究[D].武汉: 华中农业大学, 2013. Zhu Y T. Effects on cytochrome P450s and study in vivo metabilism of phoxim Carassius auratus gibebio[D]. Wuhan: Huazhong Agricultural University, 2013(in Chinese with English abstract). |
| [29] |
Cui Y L, Xue Q, Zheng Q C, et al. Structural features and dynamic investigations of the membrane-bound cytochrome P45017A1[J]. Biochimica et Biophysica Acta, 2015, 1848(10): 2013-2021. DOI:10.1016/j.bbamem.2015.05.017 |
| [30] |
王莹, 李健, 葛倩倩, 等. 恩诺沙星对凡纳滨对虾(Litopenaeus vannamei)CYP2基因表达及氨基比林-N-脱甲基酶活性的影响[J]. 渔业科学进展, 2016, 37(2): 99-104. Wang Y, Li J, Ge Q Q, et al. Effects of enrofloxacin on the expression analysis of CYP2 and activity of APND in Litopenaeus vannamei[J]. Progress in Fishery Science, 2016, 37(2): 99-104 (in Chinese with English abstract). |
| [31] |
Crivello J F, Schultz R J. Genetic variation in the temperature dependence of liver microsomal CYP2E1 activity, within and between species of the viviparous fish Poeciliopsis[J]. Environmental Toxicology and Chemistry, 1995, 14(1): 1-8. |
| [32] |
Perkins E J, Schlenk D. Immunochemical characterization of hepatic cytochrome P450 isozymes in the channel catfish:assessment of sexual, developmental and treatment-related effects[J]. Comparative Biochemistry and Physiology Part C, 1998, 121(1): 305-310. |
| [33] |
王宏伟, 李林锋, 赵文博, 等. 罗红霉素对中国圆田螺ERND酶活性的影响[J]. 上海海洋大学学报, 2017, 26(3): 400-405. Wang H W, Li L F, Zhao W B, et al. The effect of Roxithromycin on the activity of ERND in Cipangopaludina chinensis[J]. Journal of Shanghai Ocean University, 2017, 26(3): 400-405 (in Chinese with English abstract). |
| [34] |
Fu Y, Li M, Liu C, et al. Effect of atrazine and chlorpyrifos exposure on cytochrome P450 contents and enzyme activities in common carp gills[J]. Ecotoxicology and Environmental Safety, 2013, 94: 28-36. DOI:10.1016/j.ecoenv.2013.04.018 |
| [35] |
王国永.氟苯尼考与聚醚类离子载体抗球虫药在肉鸡体内的相互作用初步研究[D].南京: 南京农业大学, 2012. Wang G Y. Priliminary interaction study of florfenicol with polyether ionophore coccidiostats in broiler chichens[D]. Nanjing: Nanjing Agricultural University, 2012(in Chinese with English abstract). |




