文章信息
- 李香秀, 王玥, 孙乃岩, 刘洋, 黄金虎, 樊萍, 王丽平
- LI Xiangxiu, WANG Yue, SUN Naiyan, LIU Yang, HUANG Jinhu, FAN Ping, WANG Liping
- 6种常用抗寄生虫药在鸡的生物药剂学分类研究
- Biopharmaceutical classification system research for six commonly used anti-parasitic drugs in chickens
- 南京农业大学学报, 2020, 43(5): 919-926
- Journal of Nanjing Agricultural University, 2020, 43(5): 919-926.
- http://dx.doi.org/10.7685/jnau.201912014
-
文章历史
- 收稿日期: 2019-12-09
2. 乾元浩南京生物药厂, 江苏 南京 210012
2. Nanjing Biopharmaceutical Factory, QYH Biotech Company Limited, Nanjing 210012, China
生物药剂学分类系统(Biopharmaceutics Classification System, BCS)是一个基于溶解度和渗透性对药物分类的科学框架, 该系统将口服药物分为4类, 即BCSⅠ类(高溶解性、高渗透性药物)、BCS Ⅱ类(低溶解性、高渗透性药物)、BCS Ⅲ类(高溶解性、低渗透性药物)和BCS Ⅳ类(低溶解性、低渗透性药物)[1]。美国食品药品监督管理局(FDA)在2000年首次发布了基于BCS分类体系免除新药注册申报时体内生物等效性研究的应用指南, 并于2015年进行了更新。截至2017年, FDA已基于BCS批准或暂时批准了50个新药和101个仿制药豁免体内生物等效性研究, 节约了药物研发成本的同时也加快了新药上市的速度[2]。目前, BCS已经被世界卫生组织(WHO)、美国药品食品管理局(FDA)及欧洲药品管理局(EMA)等权威机构认可并作为人用仿制药生物等效性研究豁免的依据, 成为新药和仿制药研发过程中的重要预测工具, 大大降低了仿制药上市的成本及新药研发的风险[3-6]。
基于此, 兽药研究者们也逐渐承认并积极推动BCS应用于兽药研发领域, 以期通过较为简单、快速和低成本的溶解度、渗透性试验尽早发现并解决兽用药物吸收的限速因素, 从而降低新药研发风险, 推动兽药行业发展[7-8]。Chiou等[9]和Papich等[10]通过搜集人常用口服药物的主要药动学参数, 并与犬体内试验所得数据进行线性回归分析, 发现相同药物在不同物种间(人和犬)的相关性较低(相关系数R2分别为0.51和0.15)。由此可见, 若将人用药物BCS的研究成果直接外推运用到兽药会有很大局限性, 这主要源于人和其他种属动物间固有的生理差异, 如胃肠容积、pH值和体温等生理环境以及临床上人和其他种属动物间药物使用剂量的差异[11]。因此, 为保证兽药BCS分类框架的准确性及良好的体内外相关性, 在进行兽药BCS研究时必须考虑不同物种间的生理差异, 并针对单一种属动物分别研究, 故较人用药物BCS研究更为复杂[12-13]。目前, 美国药典委员会(United States Pharmacopieial Convention, USP)已经特设专门机构讨论了将BCS应用于兽药时所需考虑的诸多条件, 并且确定首先选取犬开展相关研究[14-16]。本试验拟通过测定鸡的生理参数, 结合药物生理溶解度和渗透性测定方法, 建立与靶动物形成良好体内-体外相关性的鸡用药物专属BCS框架, 进而对6种常用抗寄生虫药物进行BCS分类, 以期指导候选药物筛选、剂型选择, 从生物药剂学角度制定处方研发策略, 为新药开发和老药制剂改进提供数据支持。
1 材料与方法 1.1 试验材料 1.1.1 试验动物健康1日龄AA肉鸡, 购于南京某养鸡场, 饲养期间饲喂不含任何药物的全价日粮, 试验前禁食24 h。
1.1.2 细胞株及其培养马丁达比犬肾上皮细胞(MDCK), 购于中国科学院上海生命科学研究院细胞资源中心; 过表达鸡源乳腺癌耐药基因(Abcg 2)和P-糖蛋白基因(Abcb 1)的MDCK-chAbcg2-Abcb1细胞以及过表达鸡源Abcg 2的MDCK-chAbcg2细胞均为本实验室构建并保存。
1.1.3 试剂和药物DMEM培养基、胎牛血清、双抗、体积分数为0.25%的胰酶、DMSO、D-Hank ’ s平衡液和PBS均为Solarbio产品; 甲醇、乙腈、三乙胺均为色谱纯级; 酒石酸美托洛尔(上海阿拉丁生化科技股份有限公司, 含量98%), 吡喹酮(南京巨优生物有限公司, 含量98%), 阿苯达唑(南京迈博生物科技有限公司, 含量98%), 盐酸氨丙啉(南京晶格化学科技有限公司, 含量98%), 盐酸左旋咪唑(南京泰坦医药管理有限公司, 含量98%), 地克珠利[凯默斯医药科技(上海)有限公司, 含量98%], 常山酮(南京天海医药科技有限公司, 含量98%)。
1.1.4 相关工作液配制不同pH值缓冲溶液的配制:pH1:0.2 mol · L-1 KCl溶液50 mL、0.2 mol · L-1 HCl溶液85 mL、蒸馏水65 mL; pH3:0.2 mol · L-1 C8H5KO4溶液50 mL、0.2 mol · L-1 HCl溶液22.3 mL、蒸馏水127.7 mL; pH5:0.2 mol · L-1 C8H5KO4溶液50 mL、0.2 mol · L-1 NaOH 22.6 mL、蒸馏水127.4 mL; pH7:0.2 mol · L-1 KH2PO4溶液50 mL、0.2 mol · L-1 NaOH 29.1 mL、蒸馏水120.9 mL; pH8:0.2 mol · L-1 K2B4O7 · 5H2O溶液50 mL、0.2 mol · L-1 NaOH 3.9 mL、蒸馏水146.1 mL。
K-R(小肠营养)液的配制:精准称取CaCl2 0.37 g、MgCl2 0.02 g、KCl 0.35 g、NaCl 7.8 g、NaH2PO4 0.32 g、葡萄糖1.4 g, 置于无菌烧杯中, 加入适量超纯水充分溶解后, 加入NaHCO31.37 g, 转置于1 000 mL容量瓶定容, 4 ℃保存备用。
1.2 试验方法 1.2.1 鸡相关生理参数的测定1日龄AA肉鸡90只饲养至8周龄, 分别于1、4和8周龄时测定鸡体温、胃肠容积以及胃肠段不同部位的pH值。其中, 相应周龄组各取10只鸡进行体温测量后对胃肠段不同部位的pH值进行测定, 然后另取20只鸡用于进食(n=10)和禁食(n=10)条件下胃肠容积的测定。
1.2.2 药物平衡溶解度的测定及剂量数(Do)计算在试剂瓶中加入pH值分别为1、3、5、7和8的缓冲溶液, 放置于41 ℃的恒温磁力搅拌水浴锅中, 将过量药物加入各个小瓶内, 以100 r · min-1持续溶解24 h, 静置4 h后从各试剂瓶中分别吸取适量6种药物的过饱和样品, 离心过滤, 适当稀释后, 采用高效液相色谱仪测定平衡溶解度。每个pH值设置3个平行, 根据以下公式计算各药物的剂量数(Do)。
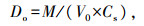
|
式中:M为药物单次给药的最高剂量(mg); V0为鸡的胃肠液体积(mL); Cs为药物pH-溶解度曲线最低点的平衡溶解度(mg · mL-1); Do>1为低溶解度药物, Do < 1为高溶解度药物。
1.2.3 鸡小肠原位单向灌流法测定药物渗透性选取体型匀称的4周龄AA肉鸡42只, 平均分为7组, 用于7种药物的渗透性测定。试验前动物禁食24 h, 自由饮水。按剂量0.5 mL · kg-1腹腔注射200 g · L-1乌拉坦, 维持麻醉并进行以下手术:沿下腹打开腹腔, 取出空肠, 保证肠段血流供应及肠系膜完整, 选取10 cm的空肠段, 两端剪开, 分别插入进液管和集液管。将预热的K-R液经恒流泵以0.2 mL · min-1的流速沿进液管灌流, 平衡肠段约30 min, 换含有药液的K-R液以10 mL · min-1高速平衡2 min, 而后以0.2 mL · min-1流速进行药物灌流100 min。每隔10 min更替新的供液管和集液管。试验结束后, 剪下灌流所用肠段, 测量内径和长度, 并称量试验供、集液管的质量。药物有效渗透系数(Peff)按如下公式计算:
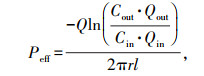
|
式中:Qin和Qout分别为供液和集液的体积(mL); Cin和Cout分别为鸡小肠原位灌流初始和结束时的药物浓度(μg · mL-1); Q为灌流速度(0.2 mL · min-1); 2πr为灌流肠段的周长(cm); l为灌流肠段的长度(cm); Peff取灌流最后5个时间点的平均值。
1.2.4 细胞培养及药物安全性试验取MDCK细胞于37 ℃灭菌温水箱迅速融化进行复苏, 加入体积分数为10%的胎牛血清培养基, 1 000 r · min-1离心1 min后进行培养。当培养皿内细胞的融合度超过90%时传代。MDCK-chAbcg2-Abcb1细胞培养方法类似, 但培养基需添加1 μg · mL-1嘌呤霉素及1 200 μg · mL-1 G418进行选择性培养。
MTT法检测各药物对MDCK、MDCK-chAbcg2以及MDCK-chAbcg2-Abcb1细胞的毒性作用, 通过酶标仪测定490 nm处吸光度(D490), 并与空白对照组比较计算细胞存活率。计算公式如下:

|
将生长状态良好的细胞制备成细胞悬液, 取0.5 mL悬液均匀加至小室的顶侧(AP), 使每孔细胞数为1×105, 基底侧(BL)则添加1.5 mL完全培养基, 隔天换液, 电阻仪测定细胞跨膜电阻值(transepithelial electrical resistance, TEER)。当电阻值升高至平台期, 在小室AP和BL侧分别加入0.5和1.5 mL 37 ℃预热的Hank ’ s液, 洗涤细胞。向AP侧添加0.5 mL药物转运工作液, BL侧添加1.5 mL空白Hank ’ s液, 考察药物在吸收方向的表观渗透系数; 向AP侧添加0.5 mL的Hank ’ s液药, BL侧添加1.5 mL药物转运工作液, 测定药物在外排方向的表观渗透系数。4 h后分别于BL和AP侧收取样品并进行浓度测定, 每组设置3个平行。根据以下公式计算表观渗透系数(Papp)、细胞外排率(ER)和细胞净外排率(NER)。
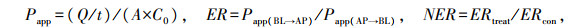
|
式中:Q/t为单位时间内药物的转运量; A为小室聚碳酯膜的面积; C0为药物的初始浓度; Papp(AP→BL)为吸收方向的表观渗透系数; Papp(BL→AP)为外排方向的表观渗透系数; ERcon为药物在MDCK细胞上的外排率; ERtreat为药物在MDCK-chAbcg2或MDCK-chAbcg2-Abcb1细胞上的外排率。
1.2.6 药物浓度的测定参考《中华人民共和国兽药典》(2015版)中收录的各药物高效液相色谱(HPLC)检测方法并适当优化, 得到6种药物的HPLC检测条件。
1.3 数据处理采用SPSS 25.0软件中的t测验法对试验数据进行统计分析。数据结果均以x±SD表示。
2 结果与分析 2.1 鸡的相关生理参数不同日龄鸡的体温平均为(41.30±0.20)℃; 胃肠道pH值范围为2.03~8.23, 其中作为药物吸收主要部位的胃和小肠前段(十二指肠、空肠)pH值均小于7.14;1 kg体质量的鸡在禁食和进食条件下的胃肠容积分别约为6.73和20.40 mL。综上, 我们将鸡常用药物溶解度的测定条件规定为41 ℃及pH1~8的水性缓冲溶液, 其中高溶解度的定义为药物单次给药的最高剂量能完全溶解于21 mL(进食)或7 mL(禁食)的水性缓冲溶液中。
2.2 各药物的标准曲线采用高效液相色谱仪测定药物峰面积, 并以标准溶液浓度为横坐标(X), 峰面积为纵坐标(Y), 绘制标准曲线。结果显示各药物浓度与峰面积线性关系良好。标准曲线如下:盐酸氨丙啉:Y=0.889 2X+0.212 1(R2=0.998 6);吡喹酮:Y=1.186 2X+0.269 2 (R2=1.000 0);阿苯达唑:Y=4.910 9X+0.139 9(R2=0.999 7);盐酸左旋咪唑:Y=1.419 9X+4.390 1(R2=0.999 0);常山酮:Y=0.124 8X+0.059 4(R2=0.999 0);地克珠利:Y=0.569 6X+0.223 3(R2=0.999 9);酒石酸美托洛尔:Y=0.472 3X+0.177 9(R2=1.000 0)。
2.3 药物的平衡溶解度及分类如表 1所示:盐酸左旋咪唑和常山酮的溶解度受pH值影响比较明显, 其他药物的溶解度则在不同pH值缓冲溶液中未表现出明显变化。另外, 地克珠利在不同pH值缓冲溶液中的溶解度均低于HPLC检测限, 故在溶解度分类中直接将其归为低溶解度药物。根据药物在不同pH值缓冲溶液中测得的最小生理平衡溶解度, 计算6种药物在禁食及进食条件下的剂量数(Do)。结果如表 2所示:盐酸氨丙啉、盐酸左旋咪唑和常山酮在禁食与进食条件下Do均小于1, 故为高溶解度药物, 其余则为低溶解度药物。本试验所选取的6种药物中, 有3种药物(吡喹酮、阿苯达唑和盐酸氨丙啉)的溶解度在人药BCS中分类明确, 且与我们的分类结果相同, 即吡喹酮和阿苯达唑为低溶解度药物, 盐酸左旋咪唑为高溶解度药物。
| 药物 Drugs |
不同pH值下的平衡溶解度/(mg·mL-1)Equilibrium solubility under different pH value | ||||
| pH1 | pH3 | pH5 | pH7 | pH8 | |
| 吡喹酮Praziquantel | 0.37±0.01 | 0.40±0.01 | 0.39±0.00 | 0.36±0.01 | 0.39±0.00 |
| 阿苯达唑Albendazole | 0.07±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 |
| 盐酸氨丙啉Aminoproline | 806.77±2.10 | 615.29±7.07 | 624.97±5.50 | 619.82±3.14 | 611.64±1.50 |
| 盐酸左旋咪唑Levamisole | 1 223.5±12.16 | 1 075.48±3.82 | 1 459.36±10.28 | 888.54±4.23 | 2 492.75±30.28 |
| 地克珠利Diclazuril | — | — | — | — | — |
| 常山酮Halofuginone | 1.63±0.02 | 11.92±0.27 | 7.41±0.11 | 5.94±0.12 | 1.39±0.01 |
| 注:—表示浓度过低, 未检测到。 Note:— indicates that the concentration is too low to be detected by HPLC. | |||||
| 药物 Drugs |
最小平衡溶解度/(mg·mL-1) Minimum equilibrium solubility |
进食Fed | 禁食Fasted | 参考BCS分类Reference BCS category | |||
| Do | 分类Class | Do | 分类Class | ||||
| 吡喹酮Praziquantel | 0.36±0.01 | 2.0 | L | 8.2 | L | L | |
| 阿苯达唑Albendazole | 0.00±0.00 | 30 000 | L | 920 000 | L | L | |
| 盐酸氨丙啉Aminoproline | 611.64±1.50 | 0.002 | H | 0.010 | H | * | |
| 盐酸左旋咪唑Levamisole | 888.54±4.23 | 0.001 | H | 0.010 | H | H | |
| 地克珠利Diclazuril | — | — | L | — | L | * | |
| 常山酮Halofuginone | 1.39±0.01 | 0.11 | H | 0.32 | H | * | |
| 注: *表示该药物在人药BCS研究中未有分类:—表示该药物溶解度过低, 无法检测, 直接归为低溶解度药物; H表示高溶解性; L表示低溶解性。下同。参考BCS类别来自https://www.drugbank.ca/。 Note: * indicates that the drug is not classified in the human drug BCS, — indicates that the drug is too low to detect and is directly classified as low solubility drug; H indicates high; L indicates low. The same below. The reference BCS category for human is from https://www.drugbank.ca/. | |||||||
MTT试验结果表明经药物处理后, MDCK、MDCK-chAbcg2及MDCK-chAbcg2-Abcb1细胞的存活率均在85%以上, 符合试验条件。此外, 随着细胞培养时间的延长, 跨膜电阻(TEER)值明显增加, MDCK、MDCK-chAbcg2和MDCK-chAbcg2-Abcb1细胞的TEER值在6~8 d时均达到平台期, 且TEER值均大于500 Ω · cm2, 表明3种细胞均已形成致密的细胞单层, 满足细胞单层转运试验的要求。
2.5 6种药物在不同细胞系的跨膜转运特性本试验通过对6种药物在MDCK、MDCK-chAbcg2及MDCK-chAbcg2-Abcb1细胞的膜渗透性以及跨膜转运过程中净外排率(NER)的计算来分析转运蛋白对药物渗透性的影响。如表 3所示:吡喹酮、阿苯达唑、盐酸左旋咪唑、盐酸氨丙啉、地克珠利在3种细胞中的NER值均小于2, 表明这5种药物不是鸡乳腺癌耐药蛋白(BCRP)和P-糖蛋白(P-gp)的底物, 故这2种外排转运蛋白不会对药物的转运过程产生影响。而常山酮在MDCK-chAbcg2和MDCK-chAbcg2-Abcb1细胞中测得的NER值分别为2.60和4.79, 均大于2。表明常山酮是鸡BCRP和P-gp的底物, 其跨膜转运过程会受到外排转运蛋白的影响, 并导致渗透性的显著改变。所以在采用细胞单层模型预测药物在肠道内的吸收情况时, 外排转运蛋白的作用不能忽略, 本试验选取MDCK-chAbcg2-Abcb1细胞作为体外模型测定药物的渗透性较为合理和准确。
| 药物 Drugs |
Papp/(10-6 cm·s-1) | NERa | NERb | |||||||
| MDCK | MDCK-chAbcg2 | MDCK-chAbcg2-Abcb1 | ||||||||
| AP→BL | BL→AP | AP→BL | BL→AP | AP→BL | BL→AP | |||||
| 吡喹酮Praziquantel | 11.62±0.53 | 11.83±0.18 | 10.40±1.15 | 12.41±0.81 | 12.92±0.04 | 14.10±0.38 | 1.17 | 1.07 | ||
| 阿苯达唑Albendazole | 14.69±0.19 | 5.01±0.01 | 14.99±0.01 | 5.05±0.03 | 15.12±0.02 | 4.93±0.07 | 1.00 | 0.97 | ||
| 盐酸氨丙啉Aminoproline | 0.55±0.04 | 0.50±0.04 | 0.54±0.08 | 0.46±0.06 | 0.66±0.01 | 0.80±0.01 | 0.76 | 1.10 | ||
| 盐酸左旋咪唑Levamisole | 14.37±1.01 | 13.44±1.42 | 14.99±0.22 | 15.58±1.10 | 14.64±0.85 | 14.50±0.60 | 1.11 | 1.05 | ||
| 地克珠利Diclazuril | 3.54±0.91 | 3.27±0.60 | 5.06±0.29 | 4.37±0.20 | 3.39±0.54 | 3.52±0.14 | 0.93 | 1.13 | ||
| 常山酮Halofuginone | 6.10±0.33 | 6.02±0.16 | 2.04±0.02 | 5.26±0.18 | 1.73±0.04 | 8.26±0.19 | 2.60 | 4.79 | ||
| 注: 1)NERa、NERb分别表示药物在MDCK-chAbcg2和MDCK-chAbcg2-Abcb1细胞中的净外排率值; 2)AP→BL表示药物由细胞单层顶侧至基底侧的转运, BL→AP表示药物由细胞单层基底侧至顶侧的转运。下同。 Note: 1)NERa and NERb represent the net efflux value of each drug in MDCK-chAbcg2 cells and MDCK-chAbcg2-Abcb1 cells respectly; 2)AP→BL indicating the drug transport from apical side to basolateral side, and BL→AP indicating the drug transport from basolateral side to apical side. The same as follows. | ||||||||||
如表 4所示:以相同试验条件下, 酒石酸美托洛尔的表观渗透系数作为药物高低渗透性分类的标准, 测得6种药物在3种细胞单层模型上的渗透性分类(n=3)均相同, 其中吡喹酮、阿苯达唑和盐酸左旋咪唑被归为高渗透性药物, 而盐酸氨丙啉、地克珠利和常山酮为低渗透性药物。同时, 以酒石酸美托洛尔的有效渗透系数为参考标准, 对鸡小肠原位灌流试验测得的药物渗透性(n=6)进行分析, 我们发现6种药物的渗透性分类结果与单层细胞模型测得的分类结果相一致。
| 药物 Drugs |
Papp/(10-6 cm·s-1) | 小肠原位灌流Peff/(10-4 cm·s-1) In-situ intestine perfusion model |
|||||||||
| MDCK | MDCK-chAbcg2 | MDCK-chAbcg2-Abcb1 | |||||||||
| AP→BL | 分类Class | AP→BL | 分类Class | AP→BL | 分类Class | 空肠Jejunum | 分类Class | ||||
| 酒石酸美托洛尔Metoprolol | 6.68±0.94 | — | 7.11±0.12 | — | 6.58±0.23 | — | 0.68±0.15 | — | |||
| 吡喹酮Praziquantel | 11.62±0.53 | H | 10.40±1.15 | H | 12.92±0.04 | H | 0.76±0.03 | H | |||
| 阿苯达唑Albendazole | 14.69±0.19 | H | 14.99±0.01 | H | 15.12±0.02 | H | 1.35±0.28 | H | |||
| 盐酸氨丙啉Aminoproline | 0.55±0.04 | L | 0.54±0.08 | L | 0.66±0.01 | L | 0.05±0.01 | L | |||
| 盐酸左旋咪唑Levamisole | 14.37±1.01 | H | 14.99±0.22 | H | 14.64±0.85 | H | 0.93±0.12 | H | |||
| 地克珠利Diclazuril | 3.54±0.91 | L | 5.06±0.29 | L | 3.39±0.54 | L | 0.66±0.06 | L | |||
| 常山酮Halofuginone | 6.00±0.33 | L | 2.04±0.02 | L | 1.73±0.04 | L | 0.31±0.05 | L | |||
| 注:Peff:有效渗透系数Effective permeability coefficient. | |||||||||||
依据药物的溶解度、渗透性测定结果以及人常用药物BCS分类的划分标准, 我们得到6种药物的BCS分类结果。如表 5所示:盐酸左旋咪唑为BCSⅠ类药物; 吡喹酮和阿苯达唑为BCSⅡ类药物; 盐酸氨丙啉和常山酮为BCS Ⅲ类药物; 地克珠利为BCS Ⅳ类药物。对比人药BCS分类的相关资料, 我们发现在已知分类的3种药物中, 只有1种药物(吡喹酮)在人和鸡的BCS分类相同, 而其余2种药物(阿苯达唑和盐酸左旋咪唑)溶解度分类相同, 但渗透性分类不同, 故最终的BCS分类不同, 进一步表明人用药物BCS的研究成果并不能直接种间外推到兽药BCS研究中。
| 药物 Drugs |
溶解度 Solubility |
渗透性 Permeability |
BCS分类 BCS classification |
参考BCS分类 Reference BCS classification |
| 吡喹酮Praziquantel | L | H | Ⅱ | Ⅱ |
| 阿苯达唑Albendazole | L | H | Ⅱ | Ⅱ/Ⅳ |
| 盐酸氨丙啉Aminoproline | H | L | Ⅲ | — |
| 盐酸左旋咪唑Levamisole | H | H | Ⅰ | Ⅰ/Ⅲ |
| 地克珠利Diclazuril | L | L | Ⅳ | — |
| 常山酮Halofuginone | H | L | Ⅲ | — |
| 注: —表示未查到相关资料, 参考BCS类别来自https://www.drugbank.ca/; BCS分类标准:Ⅰ为高溶解性、高渗透性药物, Ⅱ为低溶解性、高渗透性药物, Ⅲ为高溶解性、低渗透性药物, Ⅳ为低溶解性、低渗透性药物。 Note: — indicates that no relevant information was found, the reference BCS category is from https://www.drugbank.ca/; BCS classification criteria: ClassⅠis a high solubility and high permeability drug, Class Ⅱ is a low solubility and high permeability drug, Class Ⅲ is a high solubility and low permeability drug, Class Ⅳ is a low solubility and low permeability drug. | ||||
药物在胃肠道内溶解后, 才能以分子形式透过小肠上皮细胞吸收进入血液循环, 所以确定药物的生理溶解度是预测其吸收程度的前提。大量研究表明不同种属动物间胃肠解剖学和生理学等方面均存在明显差异[11]。所以为保证药物溶解度测定的准确性及良好的体内外相关性, 应基于靶动物的生理参数制定专属的溶解度测定方法。基于此, 本试验确定禽用药物溶解度的测定条件为41 ℃及pH1~8的水性缓冲溶液。在此条件下, 测得6种常用抗寄生虫药物的溶解度均大于兽药典所载录的溶解度数据。由于兽药典的试验条件为(25±2)℃(室温), 而本试验方法则是对鸡体内温度(41 ℃)的模拟, 因而药物的溶解性均有不同程度的改善。此外, 我们还发现对于本身溶解度较高的药物而言, 其溶解度受温度的影响相对较小。对于药物溶解度测定中pH值条件的选择, 我们设定的pH值涵盖了鸡进食和禁食状态下整个胃肠道的pH值范围, 排除了由于小肠液pH值比胃液高而药物在小肠内有沉淀析出的情况, 结果发现盐酸左旋咪唑、常山酮的溶解度受pH值影响较明显, 其他药物的溶解度则在不同pH值的缓冲溶液中未表现出明显变化。pH值仅对少部分药物的溶解度存在较大影响, 这可能是由于体内适宜的pH值范围较小, 因而pH值对溶解度的调节有一定局限, 也可能是温度的作用掩盖了pH值对药物溶解度的调节。值得注意的是, 药物单次给药的最高剂量很大程度会影响药物最终的溶解度分类结果, 例如, 兽药典规定吡喹酮的单次给药最高剂量为10~20 mg · kg-1, 本试验若选取10 mg · kg-1为其最高给药剂量, 计算得到Do小于1, 故吡喹酮为高溶解度药物, 而选取20 mg · kg-1时则得到Do大于1, 其为低溶解度药物的结果。当前各国药物监管机构对于同一口服药物针对不同适应症所使用治疗剂量的规定各异, 这进一步造成了对药物溶解度分类的分歧。另外, 虽然我们测得的溶解度结果与文献查阅的数值有一定差异, 但是我们模拟了靶动物体内的实际情况, 得到的是药物在体内的实际溶解度, 因而更符合FDA关于BCS溶解度分类的初衷。因本试验为体外和半在体试验, 故存在一定局限性, 如试验中我们未考虑胃排空时间和速率, 也未考虑肠道内存在的胆汁盐及磷脂等对亲脂性药物的增溶作用[17-18]。
药物肠渗透性的高低直接影响药物的吸收、代谢、生物利用度以及临床作用效果。在药物的BCS渗透性分类方法中, 单层细胞模型是FDA认可的测定药物渗透性方法之一, 其中Caco-2细胞和MDCK细胞是体外测定最常用的2种细胞模型[19-21]。Thiel-Demby等[22]采用过表达人源P-gp的MDCK细胞系测定了20种常用药物的渗透性, 且其测定结果与药物在人肠道的吸收情况相关性良好; 另外, Volpe[19]和Esaki等[23]也分别利用药物模型验证了Caco-2细胞模型的实用性。虽然上述2种细胞均不来源于小肠, 但拥有许多肠道上皮细胞的特征, 并能够形成致密的细胞单层, 因而可以较好地模拟肠道环境。本试验采用MDCK细胞以及过表达鸡源外排转运蛋白BCPR或P-gp的MDCK细胞系作为渗透性测定细胞, 试验结果表明作为鸡常用药物渗透性分类的工具而言, 3种细胞对同一药物的渗透性分类结果均相同。但是, 不同细胞系间表观渗透系数仍存在一定程度的差异, 表明细胞内表达的外排蛋白种类和数量对药物的渗透过程存在或大或小的影响。其中, 常山酮在MDCK细胞上的表观渗透系数(6.00)与酒石酸美托洛尔(6.68)非常接近, 而在MDCK-chAbcg2及MDCK-chAbcg2-Abcb1细胞系中, 却显著低于酒石酸美托洛尔; 通过对常山酮在2种细胞系中净外排率的测定, 我们推断其为鸡外排转运蛋白BCRP和P-gp的底物药物, 所以上述现象可能由于外排转运蛋白(BCRP和P-gp)将进入细胞内的常山酮外排所致。因此, 在预测药物在鸡肠道内的吸收情况时, 外排蛋白的作用不能忽略, 尤其是与鸡源外排蛋白具有强亲和力的底物、激活剂及抑制剂等药物[24]。相较于MDCK细胞, 过表达鸡源外排转运蛋白的细胞系更能与鸡体内吸收情况产生良好的相关性, MDCK-chAbcg2-Abcb1细胞同时表达鸡的2种重要外排转运蛋白, 故其作为体外模型测定药物的渗透性较为合理和准确。考虑到仅通过体外模型预测药物在肠道的渗透吸收还不够充分, 所以我们进一步结合鸡小肠原位灌流试验, 考察了药物在小肠的在体吸收过程。该法能模拟生理条件下药物的吸收, 而且与其他体内试验相比, 具有成本低、更易操作的特点[25]。试验结果表明该方法对6种药物的渗透性分类有效佐证了单层细胞模型对药物的渗透性测定结果, 这使我们对药物的肠渗透性分类更具说服力, 同时也为BCS渗透性分类方法在其他物种上的应用提供了参考。
药物肠渗透性分类的另一个问题是高低渗透性标准的制定。FDA推荐了以美托洛尔为代表的一系列药物作为高低渗透性分类的参考标准, 若待测药物的渗透性高于该参考标准则为高渗透性药物, 反之则为低渗透性药物[26]。WHO和EMA认为制剂口服后吸收程度达到90%(现修订为不小于85%)即为高渗透性药物[5-6]。参考Amidon等[1]和Takagi等[27]的观点, 当药物的Papp大于2×10-6 cm · s-1时, 其吸收程度就能达到85%以上, 故将Papp大于2×10-6 cm · s-1的药物定义为高渗透性药物。目前, 对药物高低渗透性分类标准的选择, 不同管理机构尚未形成统一意见。为确保药物渗透性分类的准确性, 对鸡常用口服药物生物利用度和体外及半在体测定的渗透系数进行体内-体外相关性分析, 建立相关数据库, 可为完善BCS科学框架提供参考。
由于药物吸收的最大速率为渗透系数与溶解度的乘积, 我们可以基于对药物渗透性与溶解度的测定来确定其在体内的吸收情况, 以达到体内外相关性预测进而用体外试验方法代替体内试验的目的。本试验在对人药生物药剂学分类系统充分理解的基础上, 参照其溶解度和渗透性分类标准、测定方法, 首次建立了鸡常用药物BCS并对6种常用抗寄生虫药物进行分类。其中盐酸左旋咪唑为BCSⅠ类药物, 目前, FDA已经批准了该类药物的速释口服制剂体内生物等效性豁免的申请[28]。但Ⅰ类药物数量较少, 故有学者提出, 将药物溶解度测定时的pH值上限标准依据胃肠道实际情况从7.5降至6.8, 并根据许多完全吸收药物的渗透性试验数据把高渗透性标准从90%降低到85%, 进而对Ⅱ类(吡喹酮和阿苯达唑)和Ⅲ类(盐酸氨丙啉和常山酮)药物豁免的可能性进行评估, 从而扩大豁免的范围[4, 29]。
综上所述, BCS对兽用药物的研发乃至行业发展均具有重要指导意义。由于物种间的生理学差异是建立不同种属动物BCS分类方法的基础, 准确获取靶动物的生理参数并结合相关生理数据制定不同动物专属的BCS分类方法是将BCS应用于兽药的前提。将BCS应用于兽药, 有利于解决兽药研发及应用上存在的问题, 推动兽药制剂行业的发展, 故具有重要的实用价值。
| [1] |
Amidon G L, Shah V P, Crison J R. A theoretical basis for a biopharmaceutic drug classification:the correlation of in vitro drug product dissolution and in vivo bioavailability[J]. Pharmaceutical Research, 1995, 12(3): 413-420. DOI:10.1023/A:1016212804288 |
| [2] |
Mehta M U, Uppoor R S, Conner D P, et al. Impact of the US FDA "biopharmaceutics classification system"(BCS)guidance on global drug development[J]. Molecular Pharmaceutics, 2017, 14(12): 4334-4338. DOI:10.1021/acs.molpharmaceut.7b00687 |
| [3] |
Polli J E. In vitro studies are sometimes better than conventional human pharmacokinetic in vivo studies in assessing bioequivalence of immediate-release solid oral dosage forms[J]. The AAPS Journal, 2008, 10(2): 289-299. DOI:10.1208/s12248-008-9027-6 |
| [4] |
FDA. Waiver of in vivo bioavailability and bioequivalence studies for immediate-release solid oral dosage forms based on a biopharmaceutics classification system[S]. 2015. https: //www.federalregister.gov/d/2015-10479.
|
| [5] |
高杨, 耿立冬. FDA, WHO和EMA关于基于生物药剂学分类系统的生物等效性豁免指导原则的比较[J]. 中国新药杂志, 2012, 21(24): 2861-2869. Gao Y, Geng L D. Comparison and discussion of FDA, WHO and EMA guidelines on BCS-based biowaiver[J]. Chinese Journal of New Drugs, 2012, 21(24): 2861-2869. |
| [6] |
Morais J A G, Lobato M D R. The new European medicines agency guideline on the investigation of bioequivalence[J]. Basic & Clinical Pharmacology & Toxicology, 2010, 106(3): 221-225. |
| [7] |
Marilyn N, Martinez M G P, Jim E R. Veterinary application of in vitro dissolution data and the biopharmaceutics classification system[J]. Pharmacopeial Forum, 2004, 30(6): 2295-2302. |
| [8] |
Martinez M N, Papich M G. Drug solubility classification in the dog[J]. Journal of Veterinary Pharmacology and Therapeutics, 2012, 35(1): 87-91. |
| [9] |
Chiou W L, Jeong H Y, Chung S M, et al. Evaluation of using dog as an animal model to study the fraction of oral dose absorbed of 43 drugs in humans[J]. Pharmaceutical Research, 2000, 17(2): 135-140. DOI:10.1023/A:1007552927404 |
| [10] |
Papich M G, Martinez M N. Applying biopharmaceutical classification system(BCS)criteria to predict oral absorption of drugs in dogs:challenges and pitfalls[J]. The AAPS Journal, 2015, 17(4): 948-964. DOI:10.1208/s12248-015-9743-7 |
| [11] |
Kararli T T. Comparison of the gastrointestinal anatomy, physiology, and biochemistry of humans and commonly used laboratory animals[J]. Biopharmaceutics & Drug Disposition, 1995, 16(5): 351-380. |
| [12] |
李振霞, 罗万和, 李超, 等. 兽用药物生物药剂学分类系统(BCS)的研究进展[J]. 中国兽药杂志, 2018, 52(6): 72-79. Li Z X, Luo W H, Li C, et al. Research progress on veterinary drug biopharmaceutics classification system(BCS)[J]. Chinese Journal of Veterinary Drug, 2018, 52(6): 72-79 (in Chinese). |
| [13] |
王丽平, 刘洋, 宋阳. 基于药物溶解性和渗透性测定的生物药剂分类系统在兽药制剂研发的应用前景[J]. 南京农业大学学报, 2018, 41(2): 223-230. Wang L P, Liu Y, Song Y. Application prospect of biopharmaceutical classification system based on drug solubility and permeability determination in veterinary drug development[J]. Journal of Nanjing Agricultural University, 2018, 41(2): 223-230. DOI:10.7685/jnau.201709009 |
| [14] |
Lui C Y, Amidon G L, Berardi R R, et al. Comparison of gastrointestinal pH in dogs and humans:implications on the use of the beagle dog as a model for oral absorption in humans[J]. Journal of Pharmaceutical Sciences, 1986, 75(3): 271-274. DOI:10.1002/jps.2600750313 |
| [15] |
Musther H, Olivares-Morales A, Hatley O J D, et al. Animal versus human oral drug bioavailability:do they correlate?[J]. European Journal of Pharmaceutical Sciences, 2014, 57(11): 280-291. |
| [16] |
Dressman J B. Comparison of canine and human gastrointestinal physiology[J]. Pharmaceutical Research, 1986, 3(3): 123-131. DOI:10.1023/A:1016353705970 |
| [17] |
Khadra I, Zhou Z, Dunn C, et al. Statistical investigation of simulated intestinal fluid composition on the equilibrium solubility of biopharmaceutics classification system class Ⅱ drugs[J]. European Journal of Pharmaceutical Sciences, 2015, 67(3): 65-75. |
| [18] |
Guo J, Elzinga P A, Hageman M J, et al. Rapid throughput solubility screening method for BCS class Ⅱ drugs in animal GI fluids and simulated human GI fluids using a 96-well format[J]. Journal of Pharmaceutical Sciences, 2008, 97(4): 1427-1442. DOI:10.1002/jps.21041 |
| [19] |
Volpe D A. Permeability classification of representative fluoroquinolones by a cell culture method[J]. AAPS Pharm Sci, 2004, 6(2): 1-6. DOI:10.1208/ps060213 |
| [20] |
Irvine J D, Takahashi L, Lockhart K, et al. MDCK(madin-darby canine kidney)cells:a tool for membrane permeability screening[J]. Journal of Pharmaceutical Sciences, 1999, 88(1): 28-33. |
| [21] |
Lentz K A, Hayashi J, Lucisano L J, et al. Development of a more rapid, reduced serum culture system for Caco-2 monolayers and application to the biopharmaceutics classification system[J]. International Journal of Pharmaceutics, 2000, 200(1): 41-51. DOI:10.1016/S0378-5173(00)00334-3 |
| [22] |
Thiel-Demby V E, Humphreys J E. Biopharmaceutics classification system:validation and learnings of an in vitro permeability assay[J]. Molecular Pharmaceutics, 2009, 6(1): 11-18. DOI:10.1021/mp800122b |
| [23] |
Esaki T, Ohashi R, Watanabe R, et al. Constructing an in silico three-class predictor of human intestinal absorption with Caco-2 permeability and dried-dmso solubility[J]. Journal of Pharmaceutical Sciences, 2019, 108(11): 3630-3639. DOI:10.1016/j.xphs.2019.07.014 |
| [24] |
刘洋, 郭荔, 何方, 等. 槲皮素对鸡P-糖蛋白转运功能的影响[J]. 畜牧与兽医, 2019, 51(2): 47-51. Liu Y, Guo L, He F, et al. Effect of quercetin on the transport function of chicken P-glycoprotein[J]. Animal Husbandry and Veterinary Medicine, 2019, 51(2): 47-51 (in Chinese). |
| [25] |
Lozoya-Agullo I, Zur M, Wolk O, et al. In-situ intestinal rat perfusions for human Fabs prediction and BCS permeability class determination:investigation of the single-pass vs. the doluisio experimental approaches[J]. International Journal of Pharmaceutics, 2015, 480(1/2): 1-7. |
| [26] |
Incecayir T, Tsume Y, Amidon G L. Comparison of the permeability of metoprolol and labetalol in rat, mouse, and Caco-2 cells:use as a reference standard for BCS classification[J]. Molecular Pharmaceutics, 2013, 10(4): 958-966. |
| [27] |
Takagi T, Ramachandran C, Bermejo M, et al. A provisional biopharmaceutical classification of the top 200 oral drug products in the United States, Great Britain, Spain, and Japan[J]. Molecular Pharmaceutics, 2006, 3(6): 631-643. DOI:10.1021/mp0600182 |
| [28] |
FDA. Guidence for industry, waiver of in vivo bioavailability and bioequivalence studies for immediate-release solid oral dosage forms based on a biopharmaceutics classification system[S]. 2000. http://www.fda.gov/cder/guidance/3618fnl.htm.
|
| [29] |
Yu L X, Amidon G L, Polli J E, et al. Biopharmaceutics classification system:the scientific basis for biowaiver extensions[J]. Pharmaceutical Research, 2002, 19(7): 921-925. DOI:10.1023/A:1016473601633 |




