文章信息
- 王换换, 刘颖, 李帅, 何晟, 朱斌, 张源淑
- WANG Huanhuan, LIU Ying, LI Shuai, HE Sheng, ZHU Bin, ZHANG Yuanshu
- 肾素-血管紧张素系统2条通路在油酸致大鼠BRL-3A细胞非酒精性脂肪肝中的作用
- Role of two pathways of renin-angiotensin system in oleic acid-induced non-alcoholic fatty liver disease in mouse BRL-3A cells
- 南京农业大学学报, 2020, 43(5): 910-918
- Journal of Nanjing Agricultural University, 2020, 43(5): 910-918.
- http://dx.doi.org/10.7685/jnau.201906050
-
文章历史
- 收稿日期: 2019-06-25
非酒精性脂肪肝病(nonalcoholic fatty liver disease, NAFLD)是一种除外酒精和其他已知病因引起的以肝细胞脂肪变性和脂质蓄积为主要病理特征的临床综合征, 在世界范围内广泛分布。由于存在诊断困难、发病机制复杂、没有许可的药物治疗方法等原因, NAFLD发病率在逐年上升, 成为影响人类公共健康最常见的慢性肝脏疾病之一[1-2]。
肾素-血管紧张素系统(renin angiotensin systems, RAS)是分布于机体内多个组织器官的重要内分泌调节系统[3]。RAS系统有2条通路, 分别是由血管紧张素转化酶(angiotensin converting enzyme, ACE)-血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)-血管紧张素Ⅱ受体1(angiotensinⅡ type1 receptor, AT1R)组成的经典的ACE/AngⅡ/AT1R通路和另一条新的由血管紧张素转化酶2(angiotensin converting enzyme2, ACE2)-血管紧张素1-7(angiotensin1-7, Ang1-7)-Mas受体组成的ACE2/Ang-1-7/Mas通路, 2条通路对立统一, 在维持动脉血压的稳态、体液和电解质平衡以及细胞增殖方面起着重要作用[4-6]。已有研究发现肝脏局部RAS以各种分泌方式发挥作用, 参与肝脏疾病的发生与发展, 在肝细胞脂肪沉积和调节肝脏功能中起着重要的作用[7]。RAS系统激活后, ACE促进AngⅡ合成, 介导肝脏损伤和组织纤维化, 进而促进非酒精性脂肪肝病的发展[8]。Cao等[9-10]在游离脂肪酸(FFA)诱导的HepG2细胞试验中发现, ACE2/Ang1-7/Mas通路通过ATP/P2受体/CaM信号通路, 可以减轻肝脏脂肪变性, 部分减少肝脏脂肪积累。许小妹等[11]发现添加ACE抑制剂贝那普利, 可通过ACE2/Mas受体mRNA的基因表达水平的升高抑制AngⅡ的增加, 从而发挥其抗肝损伤的作用。
ACE2是ACE的同源物, 是RAS系统的一个重要调控因子, 与ACE的功能相反[12]。ACE2参与RAS系统激活后, 主要抑制AngⅡ的合成并降低其生物利用度, 促进Ang(1-7)的生成而负向调节ACE, 抵抗AngⅡ在组织损伤和炎症反应等过程中的负性作用[13]。近年来的研究发现, ACE2除了在心血管疾病、糖尿病、肠道炎症、氨基酸转等病理生理过程中发挥重要的保护作用外, ACE2在肝脏疾病中也具有抗炎、抗纤维化和抗损伤作用, 可减轻肝脏疾病的发生发展[14-15]。刘波等[16]报道, 正常肝脏中ACE2-Ang-l-7-MasR、ACE-AngⅡ-AT1R系统均有表达, 且当肝脏损伤时两者表达水平均上调, ACE2也可以水解AngⅡ, 产生Ang1-7再通过其受体Mas发挥抗炎抗纤维化, 缓解非酒精性脂肪肝的炎症等作用。推测:外源性添加ACE2蛋白或可以成为治疗NAFLD疾病的新靶点。
油酸(oleic acid, OA)是一种单不饱和脂肪酸, 以甘油酯的形式存在于动植物油脂中[17]。有研究表明油酸是NAFLD发生时血清中含量最多的一种游离脂肪酸。在体外细胞培养中, 油酸可引起多种细胞发生氧化应激, 进一步诱导细胞脂肪变性[18]。目前多用油酸或油酸与亚油酸混合物建立非酒精性脂肪肝细胞模型, 其中油酸是引起肝细胞甘油三酯累积的最主要脂肪酸[19-20]。因此, 利用油酸建立非酒精性脂肪肝模型, 可能是研究非酒精性脂肪肝病的一种简便且实用的方法。
本研究通过油酸处理大鼠BRL-3A细胞, 建立非酒精性脂肪肝病细胞模型, 从细胞水平上探讨RAS 2条通路, 特别是ACE2与油酸诱导的NAFLD细胞损伤的相互关系, 为从肝脏局部RAS的角度研究NAFLD的发生与发展, 及ACE2的保护作用研究奠定基础。
1 材料与方法 1.1 试验材料大鼠肝脏间质细胞株(BRL-3A)购自中国科学院昆明细胞库。
1.2 试剂与仪器甘油三酯(triglyceride, TG)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)测试试剂盒、无毒快速油红O染液均购自南京建成生物工程研究所; 大鼠AngⅡ、Ang1-7 ELISA试剂盒均购自南京青奥生物技术有限公司; 溴化噻唑蓝四氮唑(MTT)、二甲基亚砜(DMSO)均购自索莱宝科技有限公司; 油酸(O1008)购自美国Sigma公司; DMEM培养液、胎牛血清购自美国Hyclone公司; ECL化学发光检测试剂盒购自上海Tanon科技有限公司。
用于Western blot的抗体, 辣根过氧化物酶(horse radish peroxidase, HRP)标记的山羊抗兔IgG, 兔抗大鼠GAPDH、ACE2、ACE、AT1R、MasR抗体均购自英国Abcam公司。
光学显微镜(美国Olympus公司); POWER-PAC300电泳仪、POWER-PAC HC转印仪(美国Bio-Rad公司); 5804R高速冷冻离心机(德国Eppendorff公司); Spark多功能酶标仪(奥地利Tecan公司); Tanon-3900全自动化学发光成像系统(上海Tanon科技有限公司)。
1.3 构建大鼠肝脏间质细胞(BRL-3A)的NAFLD细胞模型 1.3.1 BRL-3A细胞的培养与处理将BRL-3A细胞培养于DMEM高糖培养基中(含10%胎牛血清、100 U·mL-1青霉素和100 U·mL-1链霉素), 细胞在5% CO2、37 ℃恒温培养箱中贴壁培养。当细胞融合达到80%~90%时, 使用含0.02% EDTA的2.5 g·L-1胰酶进行消化。将1×105 mL-1细胞接种于放置有无菌盖玻片的12孔板, 将1.5×106 mL-1细胞接种于6孔板中。6孔板与12孔板每组设3个复孔, 在含5% CO2的培养箱中37 ℃孵育24 h。待细胞贴壁生长后, 设置对照组和模型组, 用DMEM培养液培养的细胞设为对照组; 模型组的培养液中分别加入终浓度为0.025、0.05、0.1、0.2 mmol·L-1的油酸。对12孔板的细胞进行脂滴染色检测, 对6孔板中的细胞进行TG含量和ALT、AST活性检测。
1.3.2 细胞活力检测将100 μL细胞悬液(约5×104 mL-1)接种于96孔板, 在含5% CO2的培养箱中37 ℃孵育24 h后进行处理。对照组用基础DMEM培养基, 模型组的培养液更换为不含血清的基础培养基配制的油酸(终浓度分别为0.025、0.05、0.1、0.2和0.4 mmol·L-1)培养液。最后每孔加入含0.5 mg·mL-1 MTT的无胎牛血清培养液20 μL, 继续培养4 h后, 弃上清液, 每孔加入150 μL DMSO充分溶解, 用酶标仪检测各孔的吸光值(A490)。
细胞存活率=A490样品/A490对照×100%。
1.3.3 油红O染色观察BRL-3A细胞胞内脂滴变化脂滴染色操作参照无毒快速油红O染液试剂盒说明书进行。于倒置显微镜下观察细胞内脂滴。每张玻片显微镜拍照10张, 利用Image Pro Plus软件分析总脂滴数和脂滴总面积。数据采用SPSS 19.0统计软件进行方差分析, 差异显著性检验采用Scheffe多重比较。使用GraphPad Prism 6绘图分析结果。
1.3.4 BRL-3A细胞中TG含量及ALT、AST活性的检测收集6孔板中油酸处理后的细胞, 超声破碎, 1 000 r·min-1离心10 min后取上清液。以组织细胞酶法试剂盒测定TG含量, 以BCA法测定蛋白浓度, 测吸光值(A500), 按如下公式计算细胞中TG含量(mmol·g-1):
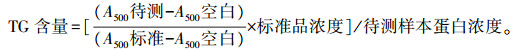
|
用改良赖氏法试剂盒测定细胞内ALT、AST活性, 以BCA法测定蛋白浓度, 测吸光值(A510), 按如下公式计算ALT和AST活性(U·g-1):

|
细胞培养方法同1.3.1节, 将80%~90%融合的BRL-3A细胞用胰酶消化, 以1.5×106 mL1细胞接种6孔板, 在含5% CO2的培养箱中37 ℃孵育24 h。待细胞贴壁生长后, 用DMEM培养液培养的细胞设为对照组, 根据构建NAFLD细胞模型的试验结果, 选取低(0.025 mmol·L-1)、中(0.1 mmol·L-1)和高(0.2 mmol·L-1)3个浓度油酸处理。油酸处理24 h后收集细胞, Western blot法检测RAS部分成员蛋白的表达, 收集细胞上清液用于ELISA法检测AngⅡ和Ang1-7水平。
1.4.2 BRL-3A细胞中ACE2、ACE、MasR、AT1R蛋白的Western blot检测收集6孔板细胞, RAPA裂解液裂解细胞得到总蛋白。BCA法测定蛋白浓度。Western blot法检测细胞中蛋白表达水平。先进行50 g·L-1浓缩胶和80 g·L-1分离胶的聚丙烯酰胺凝胶电泳。每孔上样10 μL, 电压先为80 V, 电泳至分离胶时, 改为100 V, 共电泳约1.5 h。用1 mA·cm-2的电流进行PVDF膜转印。将PVDF膜置于5%脱脂奶粉封闭1 h。ACE2、ACE、MasR、AT1R蛋白皆进行1:1 000稀释, 4 ℃孵育过夜, 洗膜后室温孵育二抗(HRP标记的羊抗兔IgG, 1:5 000稀释)。用凝胶成像系统分析并拍照, 用ImageJ软件进行条带灰度分析。
1.4.3 BRL-3A细胞上清液中AngⅡ、Ang1-7水平的ELISA检测采用双抗体夹心ELISA方法测定BRL-3A细胞上清液中AngⅡ、Ang1-7水平。操作按照试剂盒说明书进行。以空白孔调零, 测量各孔吸光值(A450), 根据标准曲线及回归方程, 计算出各个样品的AngⅡ、Ang1-7水平。
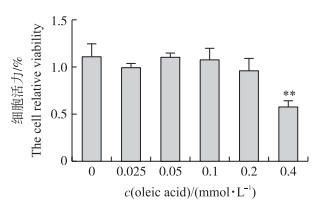
2 结果与分析 2.1 体外诱导非酒精脂肪肝细胞模型的建立 2.1.1 不同浓度油酸处理对BRL-3A细胞活力的影响由图 1可见:与对照相比, 0.025 mmol·L-1油酸对细胞生长无明显抑制作用; 油酸浓度达0.1 mmol·L-1时, 细胞活力有所下降, 但无统计学差异(P>0.05);油酸浓度达0.4 mmol·L-1时, 细胞活力显著下降(P < 0.05)。结果提示:0.025~0.2 mmol·L-1油酸处理24 h对BRL-3A细胞活力影响较小, 而0.4 mmol·L-1油酸处理24 h对BRL-3A细胞造成细胞毒性作用。结合细胞活力的变化, 在之后试验中剔除0.4 mmol·L-1油酸处理组。
|
图 1 不同浓度油酸对BRL-3A细胞活力的影响(n=5) Fig. 1 Effect of oleic acid concentration on the cell viability of BRL-3A cells 与对照组(0 mmol·L-1油酸)相比, * *表示差异极显著(P < 0.01)。下同。 * *indicates significant difference compared with control group(0 mmol·L-1 oleic acid)at 0.01 level. The same below. |
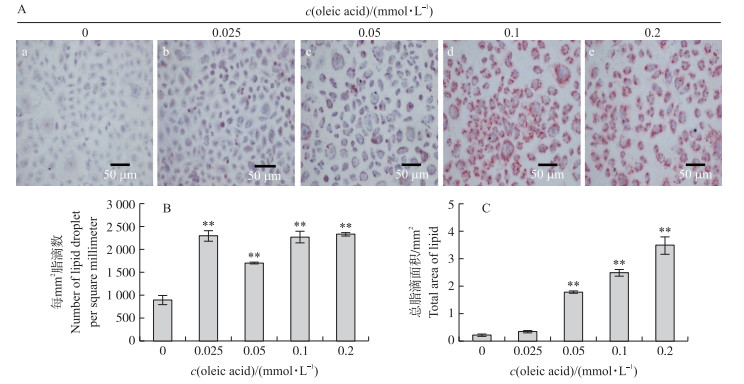
如图 2-A所示:应用油红O染色可见胞浆内的脂滴被染成红色, 细胞核染成深蓝色。油酸处理过的BRL-3A细胞胞浆内的脂滴增多。随油酸浓度增加, 细胞胞浆中脂肪着色增多, 颜色饱和度增大。表明:油酸诱导24 h后细胞脂质堆积主要为小泡性脂肪变性。
|
图 2 不同油酸浓度对BRL-3A细胞脂滴合成的影响 Fig. 2 Effect of oleic acid concentration on lipid droplet synthesis in BRL-3A cells A.油红O染色显微照片(×200)Oil red O staining micrograph; B.每mm2脂滴数Number of lipid droplet per square millimeter; C.总脂滴面积Total aera of lipid droplet. |
与对照组(0 mmol·L-1油酸)相比, 油酸浓度大于0.025 mmol·L-1时, 每mm2脂滴数极显著增加(P < 0.01)(图 2-B); 油酸浓度大于0.05 mmol·L-1时, 总脂滴面积极显著增加(P < 0.01)(图 2-C)。油酸可显著增加BRL-3A细胞中的脂质堆积。
2.1.3 不同浓度油酸对BRL-3A细胞TG含量及AST、ALT活性的影响如表 1所示:油酸可剂量依赖性增加肝细胞中TG含量。与对照组相比, 0.025 mmol·L-1油酸处理时可显著增加细胞中TG含量(P < 0.05);当油酸浓度大于0.05 mmol·L-1时, 极显著增加细胞中TG含量(P < 0.01)。
| 油酸浓度/(mmol·L-1)Oleic acid concentration | TG含量/(mmol·g-1)TG content | AST活性/(U·g-1)AST activity | ALT活性/(U·g-1)ALT activity |
| 0 | 0.05±0.05 | 11.65±1.25 | 10.43±2.50 |
| 0.025 | 0.12±0.11* | 12.13±1.04 | 9.04±1.79 |
| 0.05 | 0.25±0.25** | 10.80±0.90 | 9.55±1.43 |
| 0.1 | 0.33±0.13** | 13.05±1.65* | 14.60±1.44* |
| 0.2 | 0.54±0.00** | 18.05±1.88** | 18.06±1.15** |
| 注:与对照组(0 mmol·L-1油酸)相比, *表示差异显著(P < 0.05)。下同。 Note: *indicates significant difference compared with control group(0 mmol·L-1 oleic acid)at 0.05 level. The same below. |
|||
与对照组相比, 油酸浓度在0.1 mmol·L-1时, 细胞中的AST和ALT活性显著升高(P < 0.05), 当浓度达到0.2 mmol·L-1时, AST与ALT活性皆极显著升高(P < 0.01)。
综合以上油红染色及TG含量和ALT、AST活性测定结果, 本试验用不同浓度油酸诱导建立BRL-3A细胞体外NAFLD模型的条件是:0.1 mmol·L-1油酸, 培养时间为24 h。因此, 后续选取低(0.025 mmol·L-1)、中(0.1 mmol·L-1)和高(0.2 mmol·L-1)3种浓度油酸进行细胞处理试验。
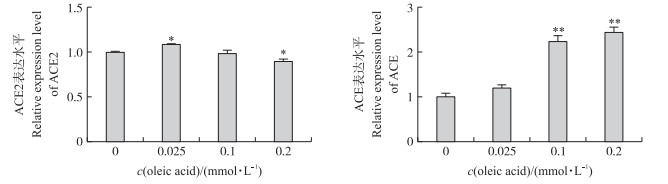
2.2 不同浓度油酸处理对BRL-3A细胞RAS 2条通路各成员表达的影响 2.2.1 不同浓度油酸处理对BRL-3A细胞ACE2、ACE蛋白表达的影响如图 3所示:在低浓度(0.025 mmol·L-1)时ACE2表达水平显著升高(P < 0.05), 中浓度(0.1 mmol·L-1)时ACE2表达水平与对照组差异不显著(P>0.05), 高浓度(0.2 mmol·L-1)时ACE2表达水平显著下降(P < 0.05)。提示:在油酸诱导的NAFLD细胞模型内, 油酸浓度较低时, 细胞损伤较轻, ACE2蛋白表达会代偿性升高, 而后细胞损伤加重; ACE2蛋白表达失代偿, 表达水平显著降低(P < 0.05)。
|
图 3 油酸处理后大鼠BRL-3A细胞ACE2和ACE蛋白的表达(n=3) Fig. 3 The expression of ACE2 and ACE protein in rat BRL-3A cells treated with different concentrations of oleic acid |
用不同浓度油酸对大鼠BRL-3A细胞进行诱导, 与对照组相比, 0.025 mmol·L-1油酸处理细胞时ACE表达无差异, 0.1和0.2 mmol·L-1油酸处理细胞时, ACE蛋白表达量均极显著升高(P < 0.01)。即油酸浓度较低, 细胞损伤较轻时, ACE表达较少; 油酸浓度升高, 细胞损伤加重, ACE蛋白表达增多。
2.2.2 不同浓度油酸处理BRL-3A细胞中ACE与ACE2的蛋白表达比值的变化如图 4所示:与对照组相比, 在0.025 mmol·L-1油酸处理细胞时, ACE/ACE2值有略微下降趋势(P>0.05), 0.1 mmol·L-1油酸处理细胞, ACE/ACE2值显著升高(P < 0.05), 0.2 mmol·L-1油酸处理细胞后ACE/ACE2值极显著升高(P < 0.01)。提示:低浓度油酸作用于BRL-3A细胞时, 细胞损伤程度较轻时, ACE2表达较多占优势; 而高浓度油酸作用于细胞时, 细胞损伤较重, ACE表达占优势。
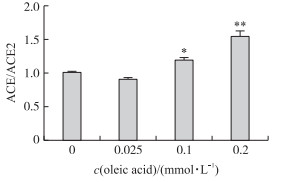
|
图 4 不同浓度油酸诱导BRL-3A细胞中ACE/ACE2的值(n=3) Fig. 4 Value of ACE/ACE2 in BRL-3A cells at different concentrations of oleic acid |
如图 5所示:与对照组相比, 0.025 mmol·L-1油酸处理细胞, MasR蛋白表达显著升高(P < 0.05), 0.1 mmol·L-1油酸处理上调ACE2通路中MasR蛋白表达水平(P>0.05), 0.2 mmol·L-1油酸处理的MasR蛋白表达水平稍有降低(P>0.05)。AT1R蛋白表达水平在0.025 mmol·L-1油酸处理中显著降低(P < 0.01), 0.1和0.2 mmol·L-1油酸处理中AT1R蛋白表达水平极显著(P < 0.01)和显著(P < 0.05)升高, 其表达趋势与ACE表达趋势基本一致。
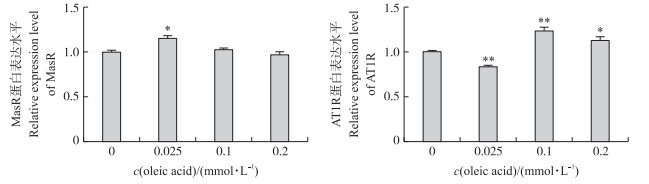
|
图 5 不同浓度油酸处理后大鼠BRL-3A细胞MasR和AT1R蛋白的表达水平(n=3) Fig. 5 The expression level of MasR and AT1R in rat BRL-3A cells treated with different concentrations of oleic acid |
由表 2可知, 与对照组相比, 0.025 mmol·L-1油酸处理细胞中, AngⅡ水平显著下降(P=0.03);0.1 mmol·L-1油酸处理细胞中AngⅡ水平略有升高(P>0.05), 0.2 mmol·L-1油酸处理细胞中AngⅡ水平极显著升高(P < 0.01)。相反, 油酸诱导BRL-3A细胞上清液中Ang1-7水平在0.025 mmol·L-1油酸处理细胞中极显著上升(P < 0.01), 而后逐渐下降; 0.2 mmol·L-1油酸处理时, 细胞上清液中Ang1-7水平的下降不具有统计学意义(P>0.05), 且与ACE2及MasR蛋白表达结果一致。提示:0.025 mmol·L-1油酸处理细胞时, 肝细胞损伤较轻, Ang1-7产生较多; 0.2 mmol·L-1油酸处理细胞时, 细胞损伤加重, AngⅡ水平增加, 进而加重细胞损伤。
| 油酸浓度/(mmol·L-1) Oleic acid concentrations |
AngⅡ水平/(ng·L-1) AngⅡ content |
Ang1-7水平/(ng·L-1) Ang1-7 content |
| 0 | 48.89±0.86 | 208.60±5.01 |
| 0.025 | 38.97±2.34* | 239.64±3.42** |
| 0.1 | 51.23±0.95 | 210.99±1.35 |
| 0.25 | 9.83±1.92** | 196.78±2.70 |
使用斯皮尔曼相关分析法对不同浓度油酸作用于BRL-3A细胞后所测得的TG含量及AST、ALT活性等生化指标与RAS系统的主要成员的表达水平进行相关分析。结果如图 6所示:油酸浓度、TG含量、AST和ALT活性及细胞中脂滴数、脂滴面积与ACE2表达水平和Ang1-7水平负相关(r=-0.628), 而与ACE表达水平、AngⅡ水平呈正相关关系(r=0.816)。提示:油酸的增加可激活整个RAS系统, 而油酸刺激ACE2通路表达减少, 同时ACE通路表达升高; 油酸浓度的增加使转氨酶含量升高、脂滴数以及脂滴面积增加, 加重脂肪沉积。
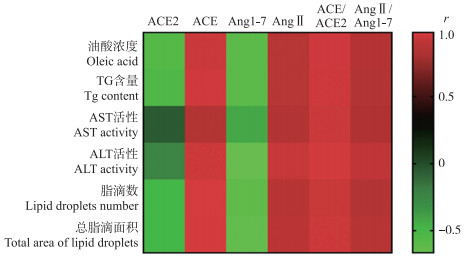
|
图 6 不同浓度油酸对BRL-3A细胞RAS系统表达的相关性分析 Fig. 6 Correlation analysis of RAS expression in BRL-3A cells with different concentrations of oleic acid |
NAFLD是一种以TG为主在肝脏中蓄积的慢性肝脏疾病。近年来, 为了探讨NAFLD发病机制以及寻求有效治疗方法, 有研究者运用特殊品系建立先天性或幼年性脂肪肝动物模型进行研究, 如Zucker肥胖大鼠、ADK-/-腺苷酸代谢障碍小鼠、日本FLS(Fatty Liver Shionogi)小鼠, 而养分失调性脂肪肝动物模型如高脂、高糖饮食、胆碱-蛋氨酸缺少饮食等是最为常用的构建动物模型的方式, 还有的研究使用如CCl4、四环素等毒物或药物构建脂肪肝模型[21-22]。最早构建的体外脂肪肝模型就是使用1 mmol·L-1油酸培养HepG2细胞[23]。刘江等[24]用游离脂肪酸混合物诱导HepG2细胞24 h, 陈益耀等[25]用1 μL·mL-1 20%脂肪乳培养人肝细胞系L02细胞24 h后传代再培养24 h, 赵莎莎等[26]用15 μg·mL-1软脂酸诱导正常肝细胞24 h, 王青等[27]用250 μmol·L-1棕榈酸孵育HepG2细胞12 h, 这些方法都能成功建立NAFLD体外细胞模型。本试验用含不同浓度油酸的培养液培养BRL-3A细胞, 当油酸浓度低于或等于0.2 mmol·L-1时, 对细胞活力以及细胞形态影响不大。油酸浓度为0.4 mmol·L-1时, 对细胞毒性较大, 显微镜下观察到细胞出现受损死亡等变化。肝脂肪变性的特征是至少5%肝细胞出现脂肪堆积, 油酸浓度为0.05 mmol·L-1时, 其甘油三酯含量、总脂滴面积和脂滴数是对照组的50%以上。当浓度在0.1和0.2 mmol·L-1时, AST与ALT活性皆升高, 肝细胞发生损伤, 所以油酸浓度高于(或等于)0.1 mmol·L-1, 低于0.4 mmol·L-1时, 成功建立了NAFLD体外细胞模型。
3.2 NAFLD与细胞局部RAS 2条通路的相互关系已有研究发现, RAS失衡与NAFLD的发生发展有着密切关系, AngⅡ在NAFLD发生发展中起着重要作用, 而RAS的激活在NAFLD脂质堆积后的进一步发展中起一定作用[28-30]。本试验证明BRL-3A大鼠肝脏细胞存在完整的RAS系统。不同浓度油酸对大鼠BRL-3A细胞进行诱导, ACE2蛋白在低浓度组中表达先升高, 后在中高浓度组中表达降低, 提示在低浓度油酸处理时, ACE2蛋白表达会代偿性升高, 出现抗损伤的作用, 而在中高浓度油酸处理时, ACE2蛋白表达会失代偿, 表达量降低。同时, ACE2酶解产生的Ang1-7及其受体MasR有一致的变化, 提示在低浓度油酸刺激BRL-3A细胞时, 细胞损伤较轻, ACE2通路激活, ACE2促进Ang1-7的生成增多, 并通过下游受体MasR改善损伤; 而在中高浓度油酸刺激时, 细胞损伤较重, ACE2表达减少, Ang1-7的生成量减少, 该通路受到抑制。
以往研究已证明, 随着NAFLD病情的加重, ACE/AngⅡ/AT1R通路表达升高[31-32]。本试验同样证明, 在油酸诱导脂肪变性的BRL-3A细胞中, ACE/AngⅡ/AT1R通路各组分在低浓度组中较少, 而后在中浓度及高浓度组中, 随着油酸浓度升高, 细胞损伤加重, 表达升高。Wu等[33]研究指出, AngⅡ可以促进细胞氧化应激, 肝脏脂肪沉积加重, 引起组织损伤, 使NAFLD病情进一步加重。本试验在低浓度组中AngⅡ表达降低, 提示ACE2通过降解AngⅡ的生成, 降低脂质堆积; 在中浓度组中ACE表达升高促进AngⅡ的表达升高, 并通过其受体AT1R作用加重细胞损伤; 高浓度组中ACE2表达减少不再抑制AngⅡ的增多, 同时ACE的增多进一步加剧AngⅡ的生成, 加重脂质沉积, 引起肝脏损伤加重。结果证明在油酸诱导的BRL-3A大鼠肝脏细胞中, ACE介导的AngⅡ/AT1R通路促进脂质沉积, 加重NAFLD的发展。
对ACE与ACE2、AngⅡ与Ang1-7表达优势进行对比, 结果显示在低浓度油酸作用下, ACE/ACE2、AngⅡ/Ang1-7比值降低, 提示低浓度油酸处理时, ACE2通路占主导, 即ACE2/Ang1-7/MasR通路处于优势地位, 产生抵抗细胞损伤的作用; 而在中高浓度油酸处理时, ACE/ACE2、AngⅡ/Ang1-7比值逐渐升高, 提示中高浓度油酸处理时, ACE通路占优势, 即ACE/AngⅡ/AT1R通路处于主导地位, 细胞损伤加重。因此, ACE与ACE2的平衡与否, 对于NAFLD的发展产生重要影响。
综上所述, 本试验用油酸诱导BRL-3A细胞建立了NAFLD细胞模型, 肝细胞受到一定程度的损伤, 细胞损伤较轻时, ACE2介导的Ang1-7/MasR通路占优势, 具有一定抵抗作用; 细胞损伤加重时, ACE介导的AngⅡ/AT1R通路占主导地位, 肝脏脂肪沉积加重。结果提示:正常状态时, 细胞中的ACE2与ACE共同维持RAS的动态平衡, 当有外源刺激物作用时, 内源ACE2被激活, 通过降解过量产生的AngⅡ, 生成Ang1-7, 介导Ang1-7/MasR通路抵抗对NAFLD细胞的损伤, 其机制有待进一步研究。
| [1] |
Stanković M N, Mladenović D R, Duričić I, et al. Time-dependent changes and association between liver free fatty acids, serum lipid profile and histological features in mice model of nonalcoholic fatty liver disease[J]. Archives of Medical Research, 2014, 45(2): 116-124. DOI:10.1016/j.arcmed.2013.12.010 |
| [2] |
Williamson R M, Price J F, Glancy S, et al. Prevalence of and risk factors for hepatic steatosis and nonalcoholic fatty liver disease in people with type 2 diabetes:the Edinburgh Type 2 Diabetes Study[J]. Diabetes Care, 2011, 34(5): 1139-1144. DOI:10.2337/dc10-2229 |
| [3] |
刘颖, 王换换, 闫书平, 等. 大鼠非酒精性单纯性脂肪肝中肾素血管紧张素系统两条通路的相互作用研究[J]. 畜牧兽医学报, 2019, 50(11): 2309-2317. Liu Y, Wang H H, Yan S P, et al. Study on the interaction of two pathways of renin angiotensin system in rat nonalcoholic simple fatty liver[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(11): 2309-2317 (in Chinese with English abstract). |
| [4] |
Wei Y Z, Clark S E, Morris E M, et al. Angiotensin Ⅱ-induced non-alcoholic fatty liver disease is mediated by oxidative stress in transgenic TG(mRen2)27(Ren2)rats[J]. Journal of Hepatology, 2008, 49(3): 417-428. DOI:10.1016/j.jhep.2008.03.018 |
| [5] |
Patel V B, Zhong J C, Grant M B, et al. Role of the ACE2/angiotensin 1-7 axis of the renin-angiotensin system in heart failure[J]. Circulation Research, 2016, 118(8): 1313-1326. DOI:10.1161/CIRCRESAHA.116.307708 |
| [6] |
刘颖, 王凯, 纪晓霞, 等. 肾素血管紧张素系统(RAS)两条轴相互负向调节与大鼠非酒精性脂肪肝病(NAFLD)肝损伤的关系研究[J]. 畜牧与兽医, 2019, 51(5): 48-54. Liu Y, Wang K, Ji X X, et al. Relationship between negative reversal of two axes of renin angiotensin(RAS)and liver injury induced by non-alcoholic fatty liver disease(NAFLD)in rats[J]. Animal Husbandry & Veterinary Medicine, 2019, 51(5): 48-54 (in Chinese with English abstract). |
| [7] |
Tiniakos D G, Vos M B, Brunt E M. Nonalcoholic fatty liver disease:pathology and pathogenesis[J]. Annual Review of Pathology:Mechanisms of Disease, 2010, 5(1): 145-171. DOI:10.1146/annurev-pathol-121808-102132 |
| [8] |
汪亮, 张霞. 肾素-血管紧张素系统在非酒精性脂肪肝发病中的作用[J]. 重庆医学, 2010, 39(22): 3139-3141, 3149. Wang L, Zhang X. The role of renin-angiotensin system in the pathogenesis of nonalcoholic fatty liver disease[J]. Chongqing Medicine, 2010, 39(22): 3139-3141, 3149 (in Chinese). |
| [9] |
Cao X, Yang F Y, Shi T T, et al. Angiotensin-converting enzyme 2/angiotensin-(1-7)/Mas axis activates Akt signaling to ameliorate hepatic steatosis[J]. Scientific Reports, 2016, 6(in Chinese with English abstract).
|
| [10] |
Cao X, Song L N, Zhang Y C, et al. Angiotensin-converting enzyme 2 inhibits endoplasmic reticulum stress-associated pathway to preserve nonalcoholic fatty liver disease[J]. Metab Res Rev, 2019, 35(4): e3123. |
| [11] |
许小妹, 申凤俊, 贾秀艳. AngⅡ对肝星状细胞中ACE2和Mas受体mRNA的影响[J]. 当代医学, 2014, 20(15): 25-26. Xu X M, Shen F J, Jia X Y. The effect of AngⅡon the mRNA expression of ACE2and Mas receptor in vitro cultured hepatic stellate cells[J]. Contemporary Medicine, 2014, 20(15): 25-26 (in Chinese with English abstract). |
| [12] |
Tipnis S R, Hooper N M, Hyde R, et al. A human homolog of angiotensin-converting enzyme. Cloning and functional expression as a captopril insensitive carboxypeptidase[J]. J Biol Chem, 2000, 275(43): 33238-33243. DOI:10.1074/jbc.M002615200 |
| [13] |
王凯, 王换换, 刘颖, 等. 利用CRISPR/Cas9系统靶向敲除猪肠上皮细胞(IPEC-J2)ace2基因及其功能分析[J]. 农业生物技术学报, 2019, 27(4): 656-665. Wang K, Wang H H, Liu Y, et al. Targeted knockout of ace2 in porcine intestinal epithelial cells(IPEC-J2)by CRISPR/Cas9 system and its functional analysis[J]. Journal of Agricultural Biotechnology, 2019, 27(4): 656-665 (in Chinese). |
| [14] |
Helmy A, Jalan R, Newby D E, et al. Role of angiotensin Ⅱ in regulation of basal and sympathetically stimulated vascular tone in early and advanced cirrhosis[J]. Gastroenterology, 2000, 118(3): 565-572. DOI:10.1016/S0016-5085(00)70263-0 |
| [15] |
Mak K Y, Chin R, Cunningham S C, et al. ACE2 therapy using adeno-associated viral vector inhibits liver fibrosis in mice[J]. Molecular Therapy, 2015, 23(9): 1434-1443. DOI:10.1038/mt.2015.92 |
| [16] |
刘波, 吴小翎, 张霞, 等. 福辛普利对非酒精性脂肪性肝炎大鼠肝纤维化的作用[J]. 第三军医大学学报, 2012, 34(16): 1646-1650. Liu B, Wu X L, Zhang X, et al. Effects and mechanism of fosinopril on hepatic fibrosis in rats with nonalcoholic steatohepatitis[J]. Acta Academiae Medicinae Militaris Tertiae, 2012, 34(16): 1646-1650 (in Chinese). |
| [17] |
徐凯.生物素在油酸致大鼠肝脏脂肪变性中的作用[D].扬州: 扬州大学, 2019. Xu K. The role of biotin in liver steatosis induced by oleic acid in rats[D]. Yangzhou: Yangzhou University, 2019(in Chinese with English abstract). |
| [18] |
Araya J, Rodrigo R, Videla L A, et al. Increase in long-chain polyunsaturated fatty acid n-6/n-3 ratio in relation to hepatic steatosis in patients with non-alcoholic fatty liver disease[J]. Clinical Science, 2004, 106(6): 635-643. |
| [19] |
刘文华, 齐越, 贾冬. 非酒精性脂肪肝实验模型研究概况[J]. 上海中医药杂志, 2015, 49(3): 95-97. Liu W H, Qi Y, Jia D. Research progress on experimental models of non-alcoholic fatty liver disease[J]. Shanghai Journal of Traditional Chinese Medicine, 2015, 49(3): 95-97 (in Chinese). |
| [20] |
潘雪丰.脂肪肝体内外模型的建立及药物筛选[D].福州: 福建医科大学, 2009. Pan X F. The establishment of fatty liver model in vitro and in vivo and drug screening[D]. Fuzhou: Fujian Medical University, 2009(in Chinese with English abstract). |
| [21] |
颜思宇.四环素诱导非酒精性脂肪肝的生化机制研究[D].长沙: 湖南师范大学, 2014. Yan S Y. The biochemical mechanism studied on tetracycline-induced nonalcoholic fatty liver disease[D]. Changsha: Hunan Normal University, 2014(in Chinese with English abstract). |
| [22] |
李晓冲, 张秀英, 徐尚, 等. C57BL/6J小鼠非酒精性脂肪肝模型的建立[J]. 中国兽医杂志, 2013, 49(1): 6-8. Li X C, Zhang X Y, Xu S, et al. Establishment of models of non-alcoholic fatty liver in C57BL/6J mouse[J]. Chinese Journal of Veterinary Medicine, 2013, 49(1): 6-8 (in Chinese with English abstract). |
| [23] |
Kurreck J. RNA interference:from basic research to therapeutic applications[J]. Angewandte Chemie International Edition, 2009, 48(8): 1378-1398. DOI:10.1002/anie.200802092 |
| [24] |
刘江, 厉有名, 陈韶华, 等. 一种实用的体外非酒精性脂肪肝细胞模型[J]. 浙江大学学报(医学版), 2009, 38(6): 626-629. Liu J, Li Y M, Chen S H, et al. An in vitro hepatic steatosis cell model for study of non-alcoholic fatty liver disease[J]. Journal of Zhejiang University(Medical Sciences), 2009, 38(6): 626-629 (in Chinese). |
| [25] |
陈益耀, 陈轶, 何周桃, 等. 原儿茶酸、白杨素对非酒精性脂肪肝细胞模型的抗氧化作用[J]. 中西医结合肝病杂志, 2018, 28(5): 294-296, 322. Chen Y Y, Chen Y, He Z T, et al. The anti-antioxidant role of protocatechuic acid and chrysin on non-alcoholic fatty liver cells[J]. Chinese Journal of Integrated Traditional and Western Medicine on Liver Disease, 2018, 28(5): 294-296, 322 (in Chinese with English abstract). |
| [26] |
赵莎莎, 赵玉勤, 张亚茹, 等. 文蛤多肽的制备及对非酒精性脂肪肝细胞模型的修复作用[J]. 中国食品学报, 2017, 17(6): 33-39. Zhao S S, Zhao Y Q, Zhang Y R, et al. Preparation of NAFLD cell model repair polypeptide from Meretrix[J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(6): 33-39 (in Chinese). |
| [27] |
王青, 贾丽, 李旺, 等. MST1过表达对棕榈酸诱导非酒精性脂肪肝细胞模型脂滴生成的影响[J]. 宁夏医科大学学报, 2016, 38(4): 381-385, 481. Wang Q, Jia L, Li W, et al. The effect of MST1 overexoression on palmitic acid-induced lipid droplets in the cell model of non-alcoholic fatty liver disease[J]. Journal of Ningxia Medical University, 2016, 38(4): 381-385, 481 (in Chinese with English abstract). |
| [28] |
Warner F J, Lew R A, Smith A I, et al. Angiotensin-converting enzyme 2(ACE2), but not ACE, is preferentially localized to the apical surface of polarized kidney cells[J]. Journal of Biological Chemistry, 2005, 280(47): 39353-39362. DOI:10.1074/jbc.M508914200 |
| [29] |
Day C P, James O F W. Steatohepatitis:a tale of two "hits"?[J]. Gastroenterology, 1998, 114(4): 842-845. DOI:10.1016/S0016-5085(98)70599-2 |
| [30] |
Fujimoto Y, Onoduka J, Homma K J, et al. Long-chain fatty acids induce lipid droplet formation in a cultured human hepatocyte in a manner dependent of acyl-CoA synthetase[J]. Biological & Pharmaceutical Bulletin, 2006, 29(11): 2174-2180. |
| [31] |
Suzuki Y, Ruiz-Ortega M, Lorenzo O, et al. Inflammation and angiotensin Ⅱ[J]. The International Journal of Biochemistry & Cell Biology, 2003, 35(6): 881-900. |
| [32] |
Kudo H, Yata Y, Takahara T, et al. Telmisartan attenuates progression of steatohepatitis in mice:role of hepatic macrophage infiltration and effects on adipose tissue[J]. Liver Int, 2009, 29(7): 988-996. DOI:10.1111/j.1478-3231.2009.02006.x |
| [33] |
武淑君, 霍丽娟, 张婕, 等. 大鼠肝纤维化进程中血管紧张素转化酶2-血管紧张素(1-7)-Mas受体的动态变化情况[J]. 中华肝脏病杂志, 2014, 22(2): 118-121. Wu S J, Huo L J, Zhang J, et al. Differential expression in ACE2, Ang(1-7)and Mas receptor during progression of liver fibrosis in a rat model[J]. Chinese Journal of Hepalogy, 2014, 22(2): 118-121 (in Chinese with English abstract). |




