文章信息
- 荆雅玮, 左佳坤, 王志豪, 胡剑刚, 黄燕, 米荣升, 苗晋锋, PHOUTHAPANE Vanhnaseng, 陈兆国, 韩先干
- JING Yawei, ZUO Jiakun, WANG Zhihao, HU Jiangang, HUANG Yan, MI Rongsheng, MIAO Jinfeng, PHOUTHAPANE Vanhnaseng, CHEN Zhaoguo, HAN Xiangan
- 氧化型辅酶NAD+及布氏杆菌SahH活性位点对SahH催化活性的影响
- Effects of oxidized coenzyme NAD+ and SahH active site on catalytic activity of Brucella SahH
- 南京农业大学学报, 2020, 43(5): 903-909
- Journal of Nanjing Agricultural University, 2020, 43(5): 903-909.
- http://dx.doi.org/10.7685/jnau.201910013
-
文章历史
- 收稿日期: 2019-10-14
2. 南京农业大学动物医学院, 江苏 南京 210095;
3. 老挝科技部生态与生物技术研究所, 万象 22797
2. College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China;
3. Animal Science Center at Biotechnology and Ecology Institute, Ministry of Science and Technology of Laos, Vientiane 22797, Laos
布氏杆菌病是一种重要的人畜共患传染病, 由布氏杆菌(Brucella)入侵机体引起, 世界动物卫生组织(World Organization for Animal Health, OIE)将该病列为必须通报的疫病, 我国将其列为二类动物疫病。人感染该病后主要表现为发热、关节痛、全身乏力和多汗等症状, 动物感染该病后主要表现为母畜流产、子宫炎、关节炎和睾丸炎等症状。全世界每年布氏杆菌发病人数超过50万例, 170多个国家有该病发生[1]。该病不但对养殖业造成重大经济损失, 同时也严重威胁食品安全和公共卫生, 开展布氏杆菌致病机制研究, 可为该病的有效防控提供理论支撑。
由sahH基因编码的S-腺苷同型半胱氨酸水解酶(S-adenosylhomocysteine hydrolase, SahH)广泛存在于细胞中, 并在新陈代谢过程中起重要作用[2-3]。对SahH在人及其他真核细胞中的研究表明, SahH可引起包括肿瘤、神经系统、心血管系统及肌肉病变等在内的多种疾病[4-6]。而SahH在细菌中的研究较少, SahH参与细菌的甲硫氨酸循环, 甲硫氨酸通过ATP活化和去甲基化后形成S-腺苷同型半胱氨酸(S-adenosylhomocysteine, SAH), SAH在SahH的催化作用下生成同型半胱氨酸(homocysteine, HCY), HCY再重新生成甲硫氨酸的过程, 称为甲硫氨酸循环[7-8]。甲硫氨酸循环在细菌的DNA合成、蛋白质翻译和甲基化等过程中发挥重要作用。
对埃氏慢生根瘤菌SahH的晶体结构研究表明, SahH由4个亚基组成, 每个亚基由底物结合位点、辅因子结合位点和羧基端二聚体组成, 并由于辅因子的结合, 通过形成开放和闭合两种构象, 影响其催化活性[9]。在影响SahH催化活性的众多因素中, NAD+作为辅因子, 参与调控包括结核杆菌、海洋热菌等在内的多种细菌的SahH催化活性[10]。研究表明, 维持细胞的SAH/SAM平衡, 对其发挥生理功能具有重要的调节作用, 而SahH的活性是维持SAH/SAM平衡的关键。因此, 通过调控布氏杆菌SahH的催化活性, 实现对其胞内SAM/SAH平衡的调控, 可为布氏杆菌病的防控提供新思路。
目前关于布氏杆菌SahH的研究较少, 仅有对其免疫原性和催化活性研究, 尚未见影响其催化活性的研究, 因此本试验在本课题组前期研究基础上, 进一步研究影响其催化活性的因素并鉴定可能的催化活性位点, 为后续开展SahH对布氏杆菌的调控作用提供参考。
1 材料与方法 1.1 菌株和质粒以及试剂大肠杆菌DH5α和BL21(DE3)感受态细胞、质粒小提试剂盒购自北京天根生化科技有限公司; 表达布氏杆菌SahH(Bru-SahH)的表达载体pET28a-Bru-sahH由本课题组前期构建[11]。限制性内切酶、DNA Marker以及高保真酶购自大连TaKaRa公司; BCA蛋白浓度测定试剂盒购自碧云天生物技术公司。
1.2 NAD+对SahH催化活性的影响将表达质粒pET28a-Bru-sahH转化大肠杆菌BL21, 用终浓度为1 mmol·L-1 IPTG诱导表达重组蛋白Bru-SahH, 纯化后备用[11-12]。
重组蛋白Bru-SahH体外催化活性分析方法参照文献[11-12], 采用BCA蛋白浓度测定试剂盒对纯化的各梯度蛋白进行浓度测定, 并取纯化后终浓度为1 mg·mL-1 Bru-SahH重组蛋白200 μL与终浓度为1 mmol·L-1底物SAH作用, 同时添加终浓度为100 μmol·L-1外源性NAD+, 37 ℃孵育1 h。反应结束后反应液用蛋白超滤管进行离心、超滤, 去除反应液中的蛋白后, 收集滤液, 检测催化产物HCY的生成量, 同时以PBS缓冲液作为阴性对照。重复3次。
催化产物HCY的浓度检测方法参照文献[13], DTNB[5, 5′-二硫代双(2-硝基苯甲酸)]是一种Ellman ’ s试剂, 可以通过与HCY中的巯基反应, 转化成为黄色的5-巯基-2-硝基苯甲酸, 测定412 nm处吸收峰值可确定底物反应液中的HCY含量。将200 μL重组蛋白滤液与100 μL 5 mmol·L-1 Ellman ’ s试剂充分混匀, 37 ℃培养箱静置避光孵育30 min, 检测反应液的吸光值(A412), 根据HCY标准曲线测定重组蛋白SahH的催化活性(HCY的产量)。
1.3 SahH理化特性分析、磷酸化及活性位点鉴定通过蛋白质理化特性预测网站(https://web.expasy.org/protparam/)分析SahH的理化特性。为了进行SahH的磷酸化位点检测, 将重组表达的Bru-SahH经SDS-PAGE凝胶电泳后, 切胶送至上海厚基生物科技有限公司进行磷酸化质谱分析。
分别选取流产布氏杆菌(Brucella abortus, EEP62727.1)、结核分枝杆菌(Mycobacterium tuberculosis, NC_000962.3)、铜绿假单胞菌(Pseudomonas aeruginosa, JQ894861.1)、类鼻疽伯克氏菌(Burkholderia pseudomallei, CAH37303.1)、大豆根瘤菌(Bradyrhizobium japonicum, BAL09033.1)、黄杆菌(Flavobacteria bacterium, EAZ95386.1)和哈维弧菌(Vibrio harveyi CAIM, EMR35983.1)的SahH氨基酸序列, 运用DNAStar等软件, 对SahH可能的活性位点进行预测。
1.4 sahH突变表达质粒的构建、表达通过点突变引物(表 1), 利用重叠引物延伸PCR(overlap PCR)对表达载体pET28a-sahH的第337位(His)、338位(Phe)和第444位(Ser)氨基酸分别进行单点突变, 对337和338位氨基酸进行双突变, 构建sahH点突变质粒(表 2)。将突变后的重组表达质粒转化BL21(DE3)菌株, IPTG诱导表达突变的SahH, 纯化后备用。
| 引物Primers | 序列Sequence(5′→3′) | 突变位点Mutant site | 产物大小/bpProduct size |
| Fa337 | CGCGGATCCATGACCGCAAGCCAAGa | 337 | 1 010 |
| Ra337 | TTGTCGAAGGGGCCGATATTGCCGAC | ||
| Fb337 | ATATCGGCCCCTTCGACAATGAAAT | 388 | |
| Rb337 | CCGGTCGACATACCTGTAGTGTTCCb | ||
| Fa338 | CGCGGATCCATGACCGCAAGCCAAGa | 338 | 1 013 |
| Ra338 | TTCATTGTCGTAGTGGCCGATATTGC | ||
| Fb338 | TCGGCCACTACGACAATGAAATTCAG | 385 | |
| Rb338 | CCGGTCGACATACCTGTAGTGTTCCb | ||
| Fa337-338 | CGCGGATCCATGACCGCAAGCCAAGa | 337-338 | 1 013 |
| Ra337-338 | TTCATTGTCGTAGGGGCCGATATTGCCGAC | ||
| Fb337-338 | TCGGCCCCTACGACAATGAAATTCAG | 385 | |
| Rb337-338 | CCGGTCGACATACCTGTAGTGTTCCb | ||
| Fa444 | CGCGGATCCATGACCGCAAGCCAAGa | 444 | 1 340 |
| Ra444 | TGTTCCTCGCAAAGTACCGTC | ||
| Fb444 | GACGGTACTTTGCGAGGAACA | 58 | |
| Rb444 | CCGGTCGACATACCTGTAGTGTTCCb | ||
| 注:下划线表示内切酶位点(a:BamHⅠ; b:SalⅠ)。The restriction sites were underlined(a:BamHⅠ; b:SalⅠ). | |||
| 突变位点Mutation site | 原始氨基酸Original amino acid | 突变后氨基酸Post-mutation amino acid | 突变质粒Mutant plasmid |
| 337 | His(CAC) | Pro(CCC) | pET28a-sahH-M337 |
| 338 | Phe(TTC) | Tyr(TAC) | pET28a-sahH-M338 |
| 337-338 | His Phe(CACTTC) | Pro Tyr(CCCTAC) | pET28a-sahH-M337-338 |
| 444 | Ser(TCC) | Cys(TGC) | pET28a-sahH-M444 |
| 注:His:组氨酸Histidine; Pro:脯氨酸Proline; Phe:苯丙氨酸Phenylalanine; Tyr:苏氨酸Threonine; Ser:丝氨酸Serine; Cys:半胱氨酸Cysteine. | |||
纯化表达的4种SahH突变重组蛋白, 采用BCA法测定其浓度。将终质量浓度为4 mg·mL-1的4种SahH突变重组蛋白分别与终浓度为1 mmol·L-1 SAH混匀, 置于37 ℃培养箱静置孵育1 h, 以未突变的SahH作为催化反应的阳性对照, 以PBS缓冲液作为阴性对照, 评价SahH突变重组蛋白的体外催化活性。
2 结果与分析 2.1 NAD+抑制SahH的体外催化活性对SahH的催化活性检测结果表明, 添加终浓度为100 μmol·L-1的NAD+后, SahH对底物的催化活性降低85.6%, 表明NAD+对SahH的催化活性具有抑制作用(表 3)。
| 底物 Substrate |
酶 Enzyme |
催化生成HCY的浓度/(μmol·L-1) Concentration of homocysteine |
活性降低/% Activity decreased |
| SAH | SahH | 100.2 | 0 |
| SAH | SahH+NAD+ | 14.4 | 85.6 |
| SAH | PBS(-) | 0 |
对Bru-SahH的理化特性分析表明, 该蛋白含有466个氨基酸(相对分子质量50.79×103), 理论等电点5.30, 带负电荷残基数(天冬氨酸+谷氨酸)为61, 带正电荷残基数(精氨酸+赖氨酸)为49, 不稳定指数(instability index)为32.40, 表明该蛋白属于稳定蛋白。脂溶指数(aliphatic index)为88.13, 总平均亲水性(grand average of hydropathicity, GRAVY)为-0.148。
质谱分析结果表明, Bru-SahH的第444位丝氨酸为预测的磷酸化修饰位点(图 1)。
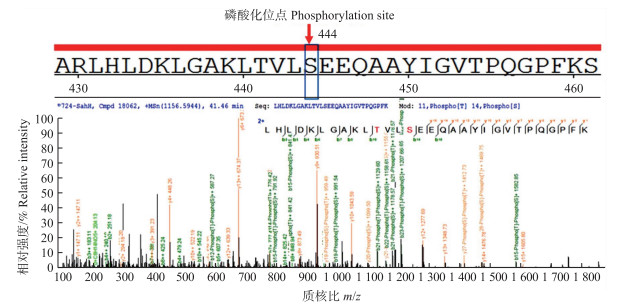
|
图 1 Bru-SahH的第444位丝氨酸为预测的磷酸化修饰位点 Fig. 1 The prediction phosphorylation site of Bru-SahH by Mass spectrum |
对流产布氏杆菌、结核分枝杆菌、类鼻疽伯克氏菌、铜绿假单胞菌、黄杆菌、哈维弧菌和大豆根瘤菌的SahH氨基酸活性位点分析表明, 布氏杆菌SahH的第337和338位存在组氨酸(H)和苯丙氨酸(F)活性位点(图 2)。

|
图 2 Bru-SahH活性位点分析 Fig. 2 Analysis of Bru-SahH active sites Ba:流产布氏杆菌Brucella abortus; Mt:结核分枝杆菌Mycobacterium tuberculosis; Bp:类鼻疽伯克氏菌Burkholderia pseudomallei; Pa:铜绿假单胞菌Pseudomonas aeruginosa; Fb:黄杆菌Flavobacteria bacterium; Vh:哈维弧菌Vibrio harveyi; Bj:大豆根瘤菌Bradyrhizobium japonicum. |
测序结果表明, 成功构建布氏杆菌sahH的第337、338、444位单突变和337-338位点双突变的4种表达质粒, 分别为pET28a-sahH-M337、pET28a-sahH-M338、pET28a-sahH-M444和pET28a-sahH-M337-338(表 2, 图 3)。
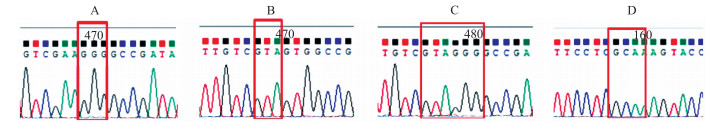
|
图 3 sahH突变位点的反向互补序列测序结果 Fig. 3 The reverse complementary sequences of the 337th, 338th, 337-338th and 444th amino acids of the mutant strains A-D分别显示第337、338、337-338和444位氨基酸突变为GGG、GTA、GTAGGG和GCA。 A-D:The base of 337th, 338th, 337-338th and 444th amino acids had been mutated to GGG, GTA, GTAGGG and GCA by sequencing, respectively. |
将构建的4种sahH突变表达质粒分别转化BL21(DE3), 用T7通用引物对重组菌进行PCR鉴定, 结果表明成功获得含sahH突变质粒的BL21重组菌(图 4)。

|
图 4 T7引物鉴定含有sahH点突变质粒的重组菌 Fig. 4 Identification of recombinant strains contained different mutation plasmid of sahH by T7 primer M. DNA标准品DNA maker DL2000;1. BL21(pET28a-sahH-M337);2. BL21(pET28a-sahH-M338);3. BL21(pET28a-sahH-M337-338);4. BL21(pET28a-sahH-M444);5.阴性对照Negative control. |
含有不同sahH突变质粒的BL21重组菌, 均可表达相对分子质量为55×103的Bru-SahH突变蛋白, 与预期结果相符。对突变的Bru-SahH蛋白进行纯化, 结果表明当咪唑浓度为100和150 mmol·L-1时, Bru-SahH蛋白的洗脱效率较高(图 5)。

|
图 5 点突变Bru-SahH蛋白表达与纯化的SDS-PAGE分析 Fig. 5 Expression and purification of site mutation Bru-SahH by SDS-PAGE A-D.分别显示第337、338、337-338和444位突变的Bru-SahH蛋白; M.蛋白标准品; 1.全菌蛋白; 2~3.分析分别用10和20 mmol·L-1咪唑纯化的Bru-SahH突变蛋白; 4~6.分别用100、150和200 mmol·L-1咪唑纯化的Bru-SahH突变蛋白; 7.空白对照。 A-D. Purification of mutantion Bru-SahH with site 337th, 338th, 337-338th and 444th mutation, respectively. M. Protein marker; 1. Whole bacterial protein; 2-3. Site mutation Bru-SahH purification with 10 and 20 mmol·L-1 imidazole, respectively; 4-6. Site mutation Bru-SahH purification with 100, 150 and 200 mmol·L-1 imidazole, respectively; 7. Blank control. |
对突变的Bru-SahH催化活性检测结果(表 4)表明, Bru-SahH的第337位和338位氨基酸突变后, 其催化活性降低90.8%以上; Bru-SahH的第444位丝氨酸为磷酸化位点, 对该位点突变后, 其催化活性降低85.5%。
| 底物 Substrate |
酶 Enzyme |
催化生成HCY浓度/(μmol·L-1) Concentration of homocysteine |
活性下降/% Activity decreased |
| SAH | SahH(+) | 150.3 | 0 |
| SAH | SahH-M337 | 1.6 | 98.9 |
| SAH | SahH-M338 | 13.8 | 90.8 |
| SAH | SahH-M337-338 | 4.5 | 97.0 |
| SAH | SahH-M444 | 21.8 | 85.5 |
| SAH | PBS(-) | 0 |
甲硫氨酸代谢对细菌具有重要的调控作用, 参与包括DNA复制与修复[14]、磷脂合成和群体感应等过程。SahH是甲硫氨酸循环过程中的关键酶[15-16], 在多种疾病(包括癌症、高胆固醇血症、寄生虫及病毒性传染病)中被作为潜在的药物靶标。如在结核病防治中, SahH被提出可作为一种具有前景的药物靶标[17-19]。在人体细胞中SahH功能障碍可引起包括肿瘤、神经系统、心血管系统及肌肉病变在内的多种疾病。在布氏杆菌中, SahH参与甲硫氨酸循环, 但对其催化活性的分子机制尚不清楚。
为了探讨影响布氏杆菌SahH催化活性的因素, 本研究开展了NAD+对SahH催化活性的影响, 结果表明NAD+对SahH的催化活性具有抑制作用。这可能是由于辅因子NAD+可通过氢键和疏水作用与SahH上特定的氨基酸残基相互作用所致。例如在人的SahH中, 由于NAD+与SahH的氨基酸残基Asn191、Val224、Ile244和Thr276形成疏水作用和相互作用, 从而影响其催化活性[20]。而与NAD+具有相互作用的氨基酸残基可用于作为抑制剂设计的靶位点, 同时NAD+的类似物也可作为SahH的抑制剂。
为了进一步分析影响SahH活性的位点, 对埃氏慢生根瘤菌的SahH晶体结构研究表明, SahH由4个亚基组成, 每个亚基由底物结合位点(substrate-binding domain)、辅因子结合位点(cofactor-binding domain)和羧基端二聚体(C-terminal dimerization domain)组成, 并具有开放和闭合2种构象, 而调节这种构象的关键是2个相连的氨基酸-组氨酸和苯丙氨酸(HF)[9]。本试验通过对布氏杆菌和其他细菌的SahH进行序列比对, 结果发现布氏杆菌SahH也存在第337位组氨酸和第338位苯丙氨酸, 通过对SahH上述2个位点的突变, 证明第337位组氨酸和第338位苯丙氨酸参与调控SahH的催化活性。突变337位和/或338位氨基酸后, 可能破坏了控制布氏杆菌SahH的开放与闭合构象的分子闸门, 无法暴露出底物结合位点与辅因子结合位点, 进而使布氏杆菌SahH无法结合底物SAH, 而使其催化活性大大降低, 具体机制仍有待进一步研究。
磷酸化是影响蛋白质活性的重要方式, 为了分析SahH可能的磷酸化位点, 本试验通过质谱分析, 预测布氏杆菌SahH的第444位丝氨酸是潜在的磷酸化修饰位点, 突变后其催化活性显著降低, 表明该位点在SahH催化活性中具有重要作用。有研究表明, 在结核分枝杆菌中, SahH通过被细菌的丝氨酸/苏氨酸蛋白激酶磷酸化, 实现其对酶活的调控[21]。因此, 在本试验中, 推测当布氏杆菌SahH的第444位丝氨酸突变为半胱氨酸后, 布氏杆菌SahH无法被磷酸激酶磷酸化, 进而使酶催化活性显著下降。
本试验采用测定SahH催化产物HCY的浓度评价SahH活性位点和氧化型辅酶NAD+对其催化活性的影响, 在后续的研究中, 将通过开展对布氏杆菌SahH酶活单位、催化反应速度和米氏常数等参数的研究, 进一步研究SahH催化活性及其影响因素, 为开展布氏杆菌SahH功能研究和基于SahH开展布氏杆菌防控提供新思路。
| [1] |
Atluri V L, Xavier M N, de Jong M F, et al. Interactions of the human pathogenic Brucella species with their hosts[J]. Annual Review of Microbiology, 2011, 65: 523-541. DOI:10.1146/annurev-micro-090110-102905 |
| [2] |
Shao H, Lamont R J, Demuth D R. Autoinducer 2 is required for biofilm growth of Aggregatibacter(Actinobacillus)actinomycetemcomitans[J]. Infection and Immunity, 2007, 75(9): 4211-4218. DOI:10.1128/IAI.00402-07 |
| [3] |
Walters M, Sircili M P, Sperandio V. AI-3 synthesis is not dependent on luxS in Escherichia coli[J]. Journal of Bacteriology, 2006, 188(16): 5668-5681. DOI:10.1128/JB.00648-06 |
| [4] |
Leal J F, Ferrer I, Blanco-Aparicio C, et al. S-adenosylhomocysteine hydrolase downregulation contributes to tumorigenesis[J]. Carcinogenesis, 2008, 29(11): 2089-2095. DOI:10.1093/carcin/bgn198 |
| [5] |
Baric I. Inherited disorders in the conversion of methionine to homocysteine[J]. Journal of Inherited Metabolic Disease, 2009, 32(4): 459-471. DOI:10.1007/s10545-009-1146-4 |
| [6] |
de Clercq E. John Montgomery's legacy:carbocyclic adenosine analogues as SAH hydrolase inhibitors with broad-spectrum antiviral activity[J]. Nucleosides, Nucleotides & Nucleic Acids, 2005, 24(10/11/12): 1395-1415. |
| [7] |
Redanz S, Standar K, Podbielski A, et al. Heterologous expression of sahH reveals that biofilm formation is autoinducer-2-independent in Streptococcus sanguinis but is associated with an intact activated methionine cycle[J]. The Journal of Biological Chemistry, 2012, 287(43): 36111-36122. DOI:10.1074/jbc.M112.379230 |
| [8] |
Han T, Li Y, Shan Q, et al. Characterization of S-adenosylhomocysteine/methylthioadenosine nucleosidase on secretion of AI-2 and biofilm formation of Escherichia coli[J]. Microbial Pathogenesis, 2017, 108: 78-84. DOI:10.1016/j.micpath.2017.05.015 |
| [9] |
Manszewski T, Singh K, Imiolczyk B, et al. An enzyme captured in two conformational states:crystal structure of S-adenosyl-L-homocysteine hydrolase from Bradyrhizobium elkanii[J]. Acta crystallographica section D:Biological Crystallography, 2015, 71: 2422-2432. DOI:10.1107/S1399004715018659 |
| [10] |
Brzezinski K, Czyrko J, Sliwiak J, et al. S-adenosyl-L-homocysteine hydrolase from a hyperthermophile(Thermotoga maritima)is expressed in Escherichia coli in inactive form:Biochemical and structural studies[J]. International Journal of Biological Macromolecules, 2017, 104: 584-596. DOI:10.1016/j.ijbiomac.2017.06.065 |
| [11] |
徐达, 吴小卡, 荆雅玮, 等. 布氏杆菌半胱氨酸水解酶在甲硫氨酸循环中的催化活性研究[J]. 南京农业大学学报, 2017, 40(4): 697-702. Xu D, Wu X K, Jing Y W, et al. Catalytic activity of Brucella abortus SahH in activated methionine cycle[J]. Journal of Nanjing Agricultural University, 2017, 40(4): 697-702 (in Chinese with English abstract). DOI:10.7685/jnau.201608021 |
| [12] |
Xu D, Zuo J, Chen Z, et al. Different activated methyl cycle pathways affect the pathogenicity of avian pathogenic Escherichia coli[J]. Veterinary Microbiology, 2017, 211: 160-168. DOI:10.1016/j.vetmic.2017.10.017 |
| [13] |
Han X, Lu C. Biological activity and identification of a peptide inhibitor of LuxS from Streptococcus suis serotype 2[J]. FEMS Microbiol Lett, 2009, 294: 16-23. DOI:10.1111/j.1574-6968.2009.01534.x |
| [14] |
Chiang P K, Gordon R K, Tal J, et al. S-adenosylmethionine and methylation[J]. FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology, 1996, 10(4): 471-480. DOI:10.1096/fasebj.10.4.8647346 |
| [15] |
Kitade Y, Kozaki A, Gotoh T, et al. Synthesis of S-adenosyl-L-homocysteine hydrolase inhibitors and their biological activities[J]. Nucleic Acids Symposium Series, 1999, 42: 25-26. DOI:10.1093/nass/42.1.25 |
| [16] |
Vandenplas C, Guillerm D, Guillerm G. A new series of mechanism-based inhibitors of S-adenosyl-L-homocysteine hydrolase from beef liver[J]. Nucleosides & Nucleotides, 1999, 18(4/5): 569-570. |
| [17] |
Yamada T, Komoto J, Lou K, et al. Structure and function of eritadenine and its 3-deaza analogues:potent inhibitors of S-adenosylhomocysteine hydrolase and hypocholesterolemic agents[J]. Biochemical Pharmacology, 2007, 73(7): 981-989. DOI:10.1016/j.bcp.2006.12.014 |
| [18] |
Bujnicki J M, Prigge S T, Caridha D, et al. Structure, evolution, and inhibitor interaction of S-adenosyl-L-homocysteine hydrolase from plasmodium falciparum[J]. Proteins, 2003, 52(4): 624-632. DOI:10.1002/prot.10446 |
| [19] |
Cai S, Li Q S, Fang J, et al. The rationale for targeting the NAD/NADH cofactor binding site of parasitic S-adenosyl-L-homocysteine hydrolase for the design of anti-parasitic drugs[J]. Nucleosides, Nucleotides & Nucleic Acids, 2009, 28(5): 485-503. |
| [20] |
Singh D B, Dwivedi S. Structural insight into binding mode of inhibitor with SAHH of Plasmodium and human:interaction of curcumin with anti-malarial drug targets[J]. Journal of Chemical Biology, 2016, 9(4): 107-120. DOI:10.1007/s12154-016-0155-7 |
| [21] |
Corrales R M, Leiba J, Cohen-Gonsaud M, et al. Mycobacterium tuberculosis S-adenosyl-L-homocysteine hydrolase is negatively regulated by Ser/Thr phosphorylation[J]. Biochemical and Biophysical Research Communications, 2013, 430(2): 858-864. DOI:10.1016/j.bbrc.2012.11.038 |




