文章信息
- 马水燕, 王楠楠, 董雨豪, 刘锦, 陆承平, 刘永杰
- MA Shuiyan, WANG Nannan, DONG Yuhao, LIU Jin, LU Chengping, LIU Yongjie
- 嗜水气单胞菌Ⅵ型分泌系统假定效应蛋白基因tle1AH的生物学功能
- Biological functions of the type Ⅵ secretion system putative effector gene tle1AH in Aeromonas hydrophila
- 南京农业大学学报, 2020, 43(5): 896-902
- Journal of Nanjing Agricultural University, 2020, 43(5): 896-902.
- http://dx.doi.org/10.7685/jnau.201910004
-
文章历史
- 收稿日期: 2019-10-09
嗜水气单胞菌(Aeromonas hydrophila)是广泛存在于水体环境中的革兰阴性菌, 可引起淡水鱼的出血性败血症, 也可感染人引发胃肠炎和败血症[1]。该菌的致病性与其产生的多种毒力因子如胞外蛋白酶、溶血素及外膜蛋白等密切相关[2]。此外, Ⅵ型分泌系统(type Ⅵ secretion system, T6SS)也是嗜水气单胞菌重要的毒力因子[3]。
T6SS广泛存在于革兰阴性菌中, 对细菌的致病性和环境适应性有重要作用。功能性的T6SS一般是由13个保守的“核心”基因编码的蛋白组装成类似于倒置T4噬菌体的复杂结构, 可以锚定在细胞膜上, 通过分泌效应蛋白到原核细胞或真核细胞发挥毒力作用[4]。效应蛋白的种类和功能复杂, 通常使用质谱分析、蛋白组学和突变体库等方法鉴定。目前研究最多的是溶血素共调节蛋白(Hcp)和缬氨酸谷氨酸重复蛋白(VgrG)[5], 它们也是重要的结构蛋白。近年来随着生物信息学技术的不断发展, 利用一些特征基因簇或保守结构域如脯氨酸-丙氨酸-丙氨酸-精氨酸(PAAR)重复蛋白[6]、未知功能结构域4123(DUF4123)[7]等, 已成功鉴定到多种效应蛋白。Russell等[8]通过保守催化基序GxSxG鉴定出具有脂酶活性的效应蛋白, 命名为Ⅵ型脂酶效应蛋白(Tle), 并将其划分为4个家族, 即Tle1—Tle4。
嗜水气单胞菌NJ-35株于2010年分离自江苏省南京市浦口区某渔场的发病鲫鱼, 基因序列比对发现其基因组内有完整的T6SS基因簇。本课题组前期工作主要集中于Hcp蛋白的功能研究[9], 未对其他潜在的效应蛋白进行鉴定。本研究利用生物信息学方法, 在NJ-35基因组中寻找保守结构域, 通过保守结构域预测到假定的T6SS效应蛋白Tle1AH, 进一步构建基因缺失株及互补株, 并测定其竞争能力、生长特性及毒力, 研究结果为深入探讨嗜水气单胞菌T6SS致病机制奠定理论基础。
1 材料与方法 1.1 菌株、质粒与试剂嗜水气单胞菌NJ-35、大肠杆菌SM10由本课题组分离保存; 自杀性质粒pYAK1、pMMB207由浙江大学方维焕教授馈赠。Prime STAR DNA聚合酶、限制性内切酶、DNA fragment Purification Kit均购自大连TaKaRa公司; 细菌质粒提取试剂、E.Z.N.A.TM细菌RNA提取试剂盒购自OMEGA公司; DNA Marker、DNA Gel Purification Kit、2×PCR Pre Mix购自南京诺唯赞生物科技有限公司; 氨苄青霉素(Amp)、氯霉素(Cm)、卡那霉素(Kan)均为Invitrogen产品。试验相关引物(表 1)由苏州金唯智科技有限公司合成。
| 目的基因 Target genes |
片段长度/bp Product length | 引物名称 Primers |
引物序列 Primer sequence(5′→3′) |
| tle1AH上游片段 tle1AH-upstream |
677 | P1 P2 |
CAGGTCGACTCTAGAGGATCCTCGGTGACGGGTTGGGTA AGTATCCTGAATGAAACAATGTATTGCGGTAGTG |
| tle1AH下游片段 tle1AH-downstream |
724 | P3 P4 |
ATTGTTTCATTCAGGATACTCCTGTCAATTCG GAGCTCGGTACCCGGGGATCCAGCCGTGGCGGATTTCTA |
| tle1AH基因 tle1AH gene |
1 998 | P5 P6 |
TTCACACAGGAAACAGAATTCATGGCGGCAGATCCCC CCGGGTACCGAGCTCGAATTCTCATGCCTCCTGATTACCGAT |
| aetY | 101 | aetY-RT-S aetY-RT-A |
ATCAGCAAGGAGCAACAC AGACGGCATCATAACCCT |
| tle1AH-RT | 185 | tle1AH-RT-S tle1AH-RT-A |
GGGCTTAGAAACATCAGCGTAGA AAGTTCACAGTGGGATACGAGAGC |
参考已报道的保守结构域DUF4123, 对NJ-35株的全基因组序列进行潜在的T6SS效应蛋白搜索。使用Conserved Domains(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)在线软件预测特殊的结构域, 利用Geneious软件人工比对催化基序生成序列标识。
1.3 基因缺失株的构建利用同源重组技术构建基因缺失株[10]。以NJ-35株基因组为模版, 用上游片段引物(P1/P2)和下游片段引物(P3/P4)分别扩增目的基因的上、下游同源臂。以上、下游产物为模版, 使用P1/P4引物融合上、下游同源臂, 再利用常规的酶切、连接, 将融合片段连接到pYAK1载体并转化宿主菌SM10。测序鉴定后进行下一步试验。
以含有自杀重组质粒的大肠杆菌SM10为供体菌, 嗜水气单胞菌NJ-35为受体菌, 通过菌毛接合的方式将重组质粒从SM10转移至NJ-35中。具体方法:2种菌均培养至对数生长期, 5 000 g离心5 min后弃上清液; 用新鲜LB液体培养基洗2次, 将2种菌浓度均调至1.0×108 CFU·mL-1(A600=0.2), 按照2 : 1(体积比)的比例将SM10与NJ-35充分混匀。各取200 μL混合菌液滴加在铺有0.45 μm孔径无菌滤膜的LB固体培养基上, 平板正放于28 ℃培养箱中培养24 h。
无菌镊子取出带菌滤膜, 吹打至1 mL新鲜LB液体培养基, 5 000 g离心5 min, 弃800 μL上清液, 其余菌液涂布于含氨苄青霉素(Amp, 100 μg·mL-1)和氯霉素(Cm, 34 μg·mL-1)双抗的LB平板上, 28 ℃培养箱中倒置培养24~36 h。挑取单菌落于含有上述2种抗生素的LB液体培养基培养过夜, 提取基因组后用P1/P4引物进行PCR鉴定, 筛选第1次同源重组的菌株(单交换株)。
单交换株转接至不含NaCl的LB培养基中, 传代3次后转接至含200 g·L-1蔗糖的LB培养基中培养36 h, 菌液涂布含200 g·L-1蔗糖的LB固体培养基。培养24 h后挑取单菌落于普通LB培养基振荡培养6~ 8 h, 提取基因组并进行PCR验证, 筛选第2次同源重组后丢失目的基因的菌株, 即基因缺失株Δtle 1AH。
1.4 基因互补株的构建以NJ-35株基因组为模版, 用互补片段引物(P5/P6)进行PCR扩增, 获得含有目的基因的片段, 通过常规单酶切、连接、转化, 将片段产物连接到质粒pMMB207(宿主菌为大肠杆菌SM10)。以含有互补质粒的大肠杆菌SM10为供体菌, NJ-35株基因缺失株为受体菌, 通过细菌接合将互补质粒转移至缺失株。接合完成后, 用无菌镊子取出带菌滤膜, 用1 mL新鲜的LB将滤膜上的菌体吹打至离心管中, 5 000 g离心5 min, 弃800 μL上清液, 菌体重悬后涂布于含有双抗(100 μg·mL-1 Amp, 34 μg·mL-1 Cm)的LB平板上, 倒置于28 ℃培养36~48 h。挑取单菌落于含有双抗的LB液体培养基中培养过夜, 提取基因组进行PCR验证, 筛选含有互补质粒的菌株, 即基因互补株CΔtle 1AH。
1.5 RT-qPCR检测取对数生长期的野生株、缺失株及互补株的菌液, 提取细菌RNA, 用反转录试剂盒反转录(RT)为cDNA, 采用SYBR Premix Ex TaqTM Kit进行qPCR, 用tle 1AH-RT-S/A引物检测各菌株基因转录水平, 并以aetY-RT-S/A作为内参引物, 采用2-ΔΔCT法计算各基因相对转录水平[11]。试验重复3次。
1.6 生长曲线的测定分别挑取野生株、缺失株和互补株的单菌落于LB液体培养基, 28 ℃、180 r·min-1振荡培养过夜。各菌株A600值调至0.5, 以1 : 100的比例转接至20 mL LB液体培养基中, 28 ℃、180 r·min-1振荡培养。每隔2 h取3个平行样本, 测定A600值, 绘制生长曲线。
1.7 生物被膜形成能力和运动性测定参考已报道的方法[12], 挑取各菌株单菌落接种LB液体培养基, 28 ℃、180 r·min-1培养过夜。取菌液按1 : 100转接至新鲜LB培养基, 振荡培养至对数生长期, 用LB培养基将A600值调至0.1后再稀释100倍。制备好的菌液按每孔200 μL加入无菌的96孔平底细胞板中, 每株菌重复8孔。同时加8孔新鲜LB液体培养基作为阴性对照。细胞板在28 ℃静置培养24 h后, 弃培养上清液, 用无菌PBS清洗3次除去浮游菌体。然后, 每孔加入200 μL甲醇固定菌体, 15 min后弃去, 室温下干燥。向每孔加200 μL 0.1%结晶紫染色, 10 min后弃去并用ddH2O清洗5次。待完全干燥后向各孔加无水乙醇200 μL, 溶解10 min, 最后用酶标仪测定A595值。试验重复3次。
将上述A600=0.1的菌液各取1 μL轻轻垂直点于琼脂含量3 000 mg·L-1的LB培养基表面, 在28 ℃静置培养24 h后测量细菌圆形运动轨迹的直径。试验重复3次。
1.8 细菌竞争试验嗜水气单胞菌与大肠杆菌的竞争试验参照Macintyre等[13]的方法进行。嗜水气单胞菌NJ-35株有Amp抗性, 大肠杆菌BL21含有pET-28a(+)载体, 带有卡那霉素抗性(Kanr)。2种菌分别培养至对数生长期后将A600值调为1.0, 再浓缩至原来体积的1/10, 将嗜水气单胞菌各菌株菌液(5×109 CFU·mL-1)与大肠杆菌菌液(5×109 CFU·mL-1)按1 : 1充分混匀, 各取25 μL滴加于LB平板上的0.22 μm滤膜; 同时LB液体培养基和等量大肠杆菌混匀作为对照。平板置于28 ℃温箱培养3 h。取出带菌滤膜, 用1 mL LB液体培养基冲洗收集的菌体并倍比稀释。取100 μL合适稀释度菌液涂布于含有Kan抗性的LB平板培养并计数。试验重复3次。
1.9 小鼠巨噬细胞吞噬试验参照Dong等[14]的方法, 将小鼠巨噬细胞RAW264.7按每孔4×105的细胞量接种于24孔细胞培养板中, 置于37 ℃、5% CO2的细胞培养箱中静置培养。待细胞长成单层后以PBS洗涤细胞3次后, 加入400 μL DMEM待用, 同时计数每孔中的细胞数量。取处于对数生长期各菌株菌液, 4 000 g离心5 min, 取沉淀用无菌PBS洗3次。向每孔细胞中加入100 μL细菌(4×106 CFU·mL-1), 使细菌与细胞的感染比例为1 : 1, 加入细菌后, 800 g离心细胞板10 min, 使细菌集中到细胞表面。同时把菌悬液10倍比梯度稀释后进行平板计数, 以确定实际加入每孔的细菌量。将细胞板置于28 ℃、5% CO2细胞培养箱中培养1 h, 无菌PBS洗涤5次, 加入含有100 μg·mL-1庆大霉素的DMEM, 置于28 ℃、5% CO2细胞培养箱中培养1 h, 无菌PBS洗涤5次, 然后加入1 mL细胞裂解液室温裂解细胞10 min, 吹打混匀, 10倍比梯度稀释后涂LB固体平板, 取菌落数在30~300的平板进行计数。试验重复3次。
1.10 对斑马鱼半数致死量(LD50)的测定LD50的测定参照Pang等[15]的方法。斑马鱼在室内喂养1周并观察状态, 确认良好后进行试验。水温保持在25~28 ℃。挑取各菌株单菌落于LB培养基中28 ℃过夜培养, 再1 : 100转接至新鲜培养基培养至对数期, 5 000 g离心后弃上清液, 菌体用无菌PBS洗3次, 将菌液浓度分别调整为5×106、5×105、5×104、5×103、5×102 CFU·mL-1。每个浓度注射10尾斑马鱼, 每尾0.02 mL, 同时注射等量PBS设为空白对照。观察记录1周, 按照Bliss算法[16]计算LD50。
1.11 数据的统计与分析统计分析采用Microsoft Excel 2013和Graphpad prism 5软件进行数据处理。用t测验法进行组间差异显著性比较。
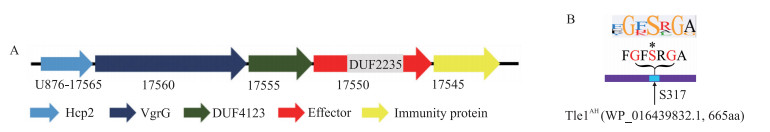
2 结果与分析 2.1 利用DUF4123结构域预测潜在效应蛋白以DUF4123保守结构域作为靶点, 在嗜水气单胞菌NJ-35株中预测到潜在的效应蛋白基因(图 1-A), 发现该基因编码具有水解酶活性的DUF2235结构域, 蛋白氨基酸序列含有典型的磷酸酶GxSxG催化位点(图 1-B), 符合已鉴定效应蛋白Tle磷脂酶家族的特点, 命名为Tle1AH。
|
图 1 假定效应蛋白的基因及氨基酸序列分析 Fig. 1 Gene and amino acid sequence analysis of a puatative effector protein A. NJ-35基因组中含DUF4123结构域的T6SS相关基因(上)及其编码蛋白(下)。数字表示不同基因的GenBank序列号(U876-XXXXX); B. Tle1AH蛋白大小及催化位点GxSxG的位置。*表示催化残基。 A. The T6SS-related genes(upper)and their encoding proteins(lower)containing the DUF4123 domain in Aeromonas hydrophila NJ-35. The numbers below refer to the gene locus tag(U876-XXXXX); B. The size of Tle1AH and location of catalytic site GxSxG. * represents the catalytic residues. |
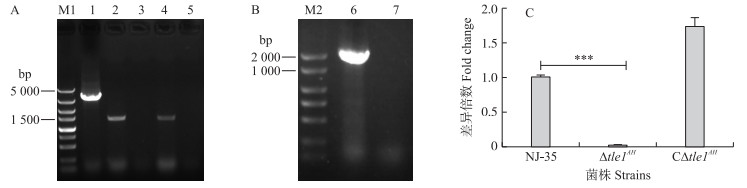
重组缺失质粒和互补质粒序列经NCBI BLAST在线比对, 确认没有碱基突变。用引物P1/P4对野生株和缺失株进行PCR验证, 野生株检测到3 399 bp大小的产物, 缺失株产物大小为1 401 bp, 即成功缺失了1 998 bp目的片段。用目的基因内部引物P5/P6进一步验证, 缺失株中不能检测到条带, 而野生株有扩增产物, 说明成功构建了tle 1AH单基因缺失株(图 2-A)。用互补引物进行PCR验证, 结果表明在互补株中可以检测到目的基因, 说明tle 1AH基因回补成功(图 2-B)。连续传10代后再次经PCR检测, 未发生回复突变。
|
图 2 基因缺失株Δtle 1AH(A)和互补株CΔtleAH(B)的鉴定及tle 1AH基因转录水平分析(C) Fig. 2 Identification of the Δtle 1AH(A)and CΔtleAH(B)strains, and analysis of the tle 1AH transcription level(C) M1. DNA标准品DL-5000;1~3. P1/P4引物依次检测野生株NJ-35、缺失株Δtle 1AH和阴性对照; 4~5. P5/P6引物分别检测野生株和缺失株; M2. DNA标准品DL-2000;6. P5/P6引物检测互补株CΔtleAH; 7.阴性对照。* * *P < 0.001。下同。 M1. DNA marker DL-5000;1-3. Primers P1/P4 were used to detect the wild strain NJ-35, tle 1AH-deleted strain and negative control; 4-5. Primers P5/P6 were used to detect the wild strain NJ-35 and tle 1AH-deleted strain; M2. DNA marker DL-2000;6. Primers P5/P6 were used to detect tle 1AH -complemented strain; 7. Negative control. * * *P < 0.001. The same as follows. |
采用qPCR对野生株、缺失株Δtle 1AH和互补株CΔtle 1AH进行目的基因转录分析。结果显示, Δtle 1AH株无目的基因转录, 而野生株和互补株中均有一定水平的转录(图 2-C)。
2.3 菌株的生长曲线和运动性测定NJ-35、Δtle 1AH、CΔtle 1AH在28 ℃条件下生长速率(图 3-A)和运动性(图 3-B)没有明显差异, 说明敲除tle 1AH基因并不影响嗜水气单胞菌在LB培养基中的生长能力和运动性。

|
图 3 野生株、Δtle 1AH及CΔtle 1AH的生长曲线(A)和运动能力(B) Fig. 3 Growth curve(A)and motility ability(B)of the wild-type, Δtle 1AH and CΔtle 1AH strains |
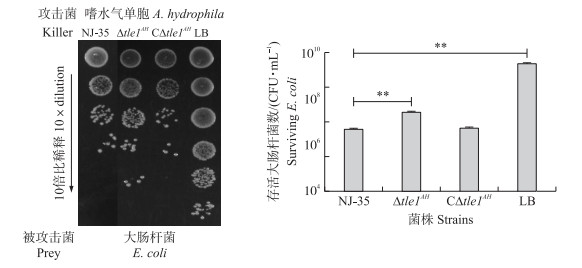
用大肠杆菌与嗜水气单胞菌各菌株分别共培养, 检测大肠杆菌存活数。结果显示:与NJ-35株共培养时, 存活的大肠杆菌数量显著降低; 同时tle 1AH基因的缺失显著降低了NJ-35对大肠杆菌生长的抑制能力(P < 0.01), 而互补株CΔtle 1AH又能恢复到野生株的抑制水平(图 4)。表明Tle1AH在嗜水气单胞菌抑制其他细菌生长过程中起重要作用。
|
图 4 野生株、Δtle 1AH及CΔtle 1AH抑制大肠杆菌生长能力 Fig. 4 The antibacterial ability of the wild-type, Δtle 1AH and CΔtle 1AH strains towards Echerichia coli * *P < 0.01.下同。The same as follows. |
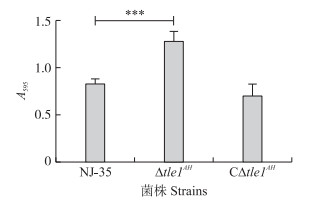
与野生株比较, 缺失株的生物被膜形成能力显著上升(P < 0.05)(图 5), 提示该基因除了参与细菌竞争活动外, 也参与调控生物被膜形成。
|
图 5 野生株、Δtle 1AH及CΔtle 1AH生物被膜的形成能力 Fig. 5 Biofilm formation abilities of the wild-type, Δtle 1AH and CΔtle 1AH strains |
巨噬细胞RAW264.7吞噬试验结果(图 6)表明:RAW264.7细胞对野生株和互补株的吞噬率分别为9%和8%, 显著低于对缺失株的吞噬率(38.7%)(P < 0.05), 说明tle 1AH缺失可导致嗜水气单胞菌抗吞噬能力明显降低。
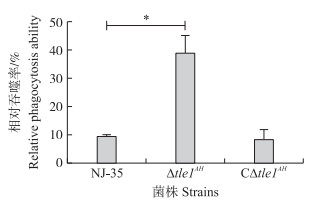
|
图 6 野生株、Δtle 1AH及CΔtle 1AH的抗吞噬能力 Fig. 6 Antiphagocytosis abilities of the wild-type, Δtle 1AH and CΔtle 1AH strains *P < 0.05. |
试验组感染细菌24 h后开始出现死亡, 对照组斑马鱼在试验过程中均活动正常, 未出现临床症状和死亡情况。发病的鱼出现典型的临床症状, 身体侧翻, 腹部及鳍条明显充血、出血, 继而死亡。对病死鱼进行细菌分离鉴定, 确定为嗜水气单胞菌感染。统计各试验组斑马鱼在1周内的死亡数量, 按照Bliss法计算出野生株NJ-35的LD50值约为4.40×103 CFU, 缺失株Δtle 1AH的LD50约为7.41×104 CFU, 互补株CΔtle 1AH的LD50约为7.48×103 CFU(图 7)。表明tle 1AH基因在嗜水气单胞菌NJ-35株毒力上发挥重要作用。
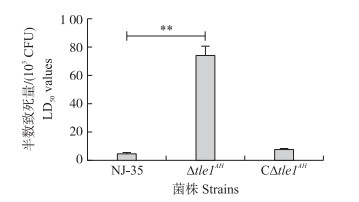
|
图 7 菌株对斑马鱼的LD50测定 Fig. 7 The LD50 assay of bacterial strains in zebrafish |
细菌为了克服从胞质向胞外转运蛋白的困难, 进化出多种不同类型的蛋白分泌系统。革兰阴性菌中至少存在6种蛋白分泌系统(T1SS—T6SS), 其中分布广泛的T6SS在细菌的致病和环境适应过程中发挥重要作用[17]。目前已经鉴定的效应蛋白种类和功能复杂, 基于作用靶标分为3类, 分别靶向细胞壁、细胞膜和核酸[18]。Tle1—Tle4家族除了保守的催化基序外, 与其他已知的脂肪酶无明显的序列同源性。本研究分析AH17550的氨基酸序列, 结果发现有GxSxG催化基序, 且在其C端存在T6SS效应蛋白常见的DUF2235结构域[19], 该基因上游还存在目前公认的效应蛋白基因hcp和VgrG, 因此推测AH17550很可能是一种潜在的脂质水解酶型T6SS效应分子, 将其命名为Tle 1AH。
为进一步分析tle 1AH基因的功能, 本试验成功构建tle 1AH缺失株及相应互补株, 并对其生物学特性进行分析。tle 1AH缺失后, 嗜水气单胞菌对大肠杆菌生长的抑制能力显著降低, 提示该基因参与细菌种间竞争, 从而有助于增强细菌自身的环境适应性。此外, tle 1AH缺失可导致嗜水气单胞菌抗巨噬细胞的吞噬能力及对斑马鱼的毒力作用均明显降低, 表明tle 1AH在该菌致病过程中发挥重要作用。有研究报道, Hcp和VgrG作为嗜水气单胞菌SSU(现已更名为达卡气单胞菌SSU)的重要T6SS效应蛋白, 除参与环境竞争外, 还参与调控细菌的运动性、生物被膜形成及毒力特性[20]。Gallique等[21]研究表明, T6SS效应蛋白的缺失可导致铜绿假单胞菌(Pseudomonas fluorescens)生物被膜形成能力下降。本试验中tle 1AH缺失则引起嗜水气单胞菌NJ-35的生物被膜形成能力明显增强, 但不影响细菌的运动性。这些研究结果的差异可能与菌株的不同或效应蛋白种类不同有关。本课题组前期研究发现, NJ-35的T6SS效应蛋白Hcp有3个基因拷贝, 在生物被膜形成能力上发挥不同的作用:hcp 1和hcp2基因缺失会导致生物被膜形成能力降低, 而hcp 3缺失则导致生物被膜形成能力增强[22]。因此, 推测T6SS多种效应蛋白在调控嗜水气单胞菌生物被膜形成上可能存在相互协调作用。
效应蛋白有一定的毒性作用, 细菌为了避免对自身细胞的伤害, 通常会在其下游编码特异性同源免疫蛋白, 从而中和毒素效应[23]。本研究同样在tle 1AH基因下游预测到编码假定免疫蛋白的基因。后续将着重研究tle 1AH及相应免疫蛋白的关系, 并从蛋白层面上对Tle1AH功能开展深入研究, 以期更进一步阐明Tle1AH在嗜水气单胞菌生存及致病过程中的作用。
| [1] |
Chopra A K, Houston C W. Enterotoxins in Aeromonas-associated gastroenteritis[J]. Microbes and Infection, 1999, 1(13): 1129-1137. DOI:10.1016/S1286-4579(99)00202-6 |
| [2] |
Citterio B, Biavasco F. Aeromonas hydrophila virulence[J]. Virulence, 2015, 6(5): 417-418. DOI:10.1080/21505594.2015.1058479 |
| [3] |
Suarez G, Sierra J C, Kirtley M L, et al. Role of Hcp, a type 6 secretion system effector, of Aeromonas hydrophila in modulating activation of host immune cells[J]. Microbiology, 2010, 156(12): 3678-3688. DOI:10.1099/mic.0.041277-0 |
| [4] |
Ho B T, Dong T G, Mekalanos J J. A view to a kill:the bacterial type Ⅵ secretion system[J]. Cell Host & Microbe, 2014, 15(1): 9-21. |
| [5] |
Renault M G, Zamarreno B J, Douzi B, et al. The gp27-like hub of VgrG serves as adaptor to promote hcp tube assembly[J]. Journal of Molecular Biology, 2018, 430(18): 3143-3156. DOI:10.1016/j.jmb.2018.07.018 |
| [6] |
Shneider M M, Buth S A, Ho B T, et al. PAAR-repeat proteins sharpen and diversify the type Ⅵ secretion system spike[J]. Nature, 2013, 500(7462): 350-353. DOI:10.1038/nature12453 |
| [7] |
Liang X Y, Moore R, Wilton M, et al. Identification of divergent type Ⅵ secretion effectors using a conserved chaperone domain[J]. Proc Natl Acad Sci USA, 2015, 112(29): 9106-9111. DOI:10.1073/pnas.1505317112 |
| [8] |
Russell A B, LeRoux M, Hathazi K, et al. Diverse type Ⅵ secretion phospholipases are functionally plastic antibacterial effectors[J]. Nature, 2013, 496(7446): 508-512. DOI:10.1038/nature12074 |
| [9] |
Wang N N, Wu Y F, Pang M D, et al. Protective efficacy of recombinant hemolysin co-regulated protein(Hcp)of Aeromonas hydrophila in common carp(Cyprinus carpio)[J]. Fish & Shellfish Immunology, 2015, 46(2): 297-304. |
| [10] |
Abolghait S K. Suicide plasmid-dependent IS1-element untargeted integration into Aeromonas veronii bv.sobria generates brown pigment-producing and spontaneous pelleting mutant[J]. Current Microbiology, 2013, 67(1): 91-99. DOI:10.1007/s00284-013-0335-4 |
| [11] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [12] |
O'Toole G A, Pratt L A, Watnick P I, et al. Genetic approaches to study of biofilms[J]. Methods in Enzymology, 1999, 310(1): 91-109. |
| [13] |
Macintyre D L, Miyata S T, Kitaoka M, et al. The Vibrio cholerae type Ⅵ secretion system displays antimicrobial properties[J]. Proc Natl Acad Sci USA, 2010, 107(45): 19520-19524. DOI:10.1073/pnas.1012931107 |
| [14] |
Dong Y H, Geng J Z, Liu J, et al. Roles of three TonB systems in the iron utilization and virulence of the Aeromonas hydrophila Chinese epidemic strain NJ-35[J]. Applied Microbiology and Biotechnology, 2019, 103(10): 4203-4215. DOI:10.1007/s00253-019-09757-4 |
| [15] |
Pang M D, Lin X Q, Hu M, et al. Tetrahymena:an alternative model host for evaluating virulence of Aeromonas strains[J]. PLoS One, 2012, 7(11): e48922. DOI:10.1371/journal.pone.0048922 |
| [16] |
Dong Y H, Wang Y, Liu J, et al. Discovery of lahS as a global regulator of environmental adaptation and virulence in Aeromonas hydrophila[J]. International Journal of Molecular Sciences, 2018, 19(9): 2709. DOI:10.3390/ijms19092709 |
| [17] |
Costa T R D, Felisberto-Rodrigues C, Meir A, et al. Secretion systems in Gram-negative bacteria:structural and mechanistic insights[J]. Nature Reviews Microbiology, 2015, 13(6): 343-359. DOI:10.1038/nrmicro3456 |
| [18] |
Russell A B, Peterson S B, Mougous J D. Type Ⅵ secretion system effectors:poisons with a purpose[J]. Nature Reviews Microbiology, 2014, 12(2): 137-148. DOI:10.1038/nrmicro3185 |
| [19] |
Ma J L, Pan Z H, Huang J H, et al. The Hcp proteins fused with diverse extended-toxin domains represent a novel pattern of antibacterial effectors in type Ⅵ secretion systems[J]. Virulence, 2017, 8(7): 1189-1202. DOI:10.1080/21505594.2017.1279374 |
| [20] |
Sha J, Rosenzweig J A, Kozlova E V, et al. Evaluation of the roles played by Hcp and VgrG type 6 secretion system effectors in Aeromonas hydrophila SSU pathogenesis[J]. Microbiology, 2013, 159(6): 1120-1135. |
| [21] |
Gallique M, Decoin V, Barbey C, et al. Contribution of the Pseudomonas fluorescens MFE01 type Ⅵ secretion system to biofilm formation[J]. PLoS One, 2017, 12(1): e0170770. DOI:10.1371/journal.pone.0170770 |
| [22] |
Wang N N, Liu J, Pang M D, et al. Diverse roles of Hcp family proteins in the environmental fitness and pathogenicity of Aeromonas hydrophila Chinese epidemic strain NJ-35[J]. Applied Microbiology and Biotechnology, 2018, 102(16): 7083-7095. DOI:10.1007/s00253-018-9116-0 |
| [23] |
Kirchberger P C, Unterweger D, Provenzano D, et al. Sequential displacement of type Ⅵ secretion system effector genes leads to evolution of diverse immunity gene arrays in Vibrio cholerae[J]. Scientific Reports, 2017, 7: 45133. DOI:10.1038/srep45133 |




