文章信息
- 马宁, 刘艳霞, 李想, 陈雪, 杨兴明
- MA Ning, LIU Yanxia, LI Xiang, CHEN Xue, YANG Xingming
- 基于熵权法综合评价植物根际促生菌对烟草的促生作用
- Comprehensive evaluation of growth promotion effect of PGPR strains on tobacco based on entropy weight method
- 南京农业大学学报, 2020, 43(5): 887-895
- Journal of Nanjing Agricultural University, 2020, 43(5): 887-895.
- http://dx.doi.org/10.7685/jnau.201910046
-
文章历史
- 收稿日期: 2019-10-28
2. 贵州省烟草科学研究院, 贵州 贵阳 550000;
3. 贵州省烟草公司毕节分公司, 贵州 毕节 551700
2. Guizhou Tobacco Research Institute, Guiyang 550000, China;
3. Bijie Company of Guizhou Tobacco Corporation, Bijie 551700, China
植物根际促生菌(plant growth-promoting rhizobacteria, PGPR)是指一类定殖在植物根际土壤, 可促进植物生长的有益微生物[1]。大量研究表明, 某些PGPR不仅能够产生多种抗生素, 如分泌氰化氢(HCN)[2], 同时具有生物固氮[3]、溶磷[4]、解钾[5]、分泌吲哚乙酸[6]等功能特性, 可以促进植物生长和改善土壤的微生态环境[7-8]。因此, 植物根际促生菌的研究越来越受到广泛关注[9]。
目前, 促生菌效果的评定一般凭研究者的经验判断, 由于评判的指标较多, 容易产生偏差。因此, 指标权重的确定是一项重要工作。权重确定方法有很多, 大致可分为主观赋权法、客观赋权法和组合赋权法。近年来, 赋权法更是被广泛应用于农作物品质分析中[10-13], 可借鉴于筛选烟草促生菌。其中, 熵权法是目前常用的一种客观赋权法, 其根据样本数据信息确定指标权重, 避免主观性倾向的影响。熵权法以信息熵评价某项指标在不同评价对象中的差异程度, 若某项指标的数据变幅很大, 说明该指标提供的信息量大, 相应的信息熵小, 赋予的权重大; 反之亦然。若某项指标的数据全部相等, 说明该指标对评价对象无法提供区别信息, 相应的信息熵最大, 权重为零。该方法对评估指标数量没有太大限制, 适宜于烟草促生菌效果评价。本研究以烟草为供试材料, 用实验室前期分离筛选得到的25株菌株菌液灌根处理, 分析接种促生菌对烟草生长的影响, 并使用熵权法处理促生菌处理后烟草的生理指标, 筛选高效的烟草根际促生菌, 为烟草微生物肥料开发提供可靠材料。
1 材料与方法 1.1 供试材料与培养基供试菌株为贵州省烟草科学研究院微生物实验室前期从贵州烟区烟草根际分离筛选得的优良菌株, 共25株, 保存于本实验室, 菌株分别为:PS-S、W1、VC48、L9、34、F2、L25、LX5、L4、VC108、F1、TD1、LX7、L16、LX4、VC110、BA-S、N1、L14、VC21、TLZZ、VC29、L2、114和VC109。烟草品种为‘K326’。
细菌活化和保存培养基:LB、NB培养基; 放线菌活化和保存培养基:高氏1号合成培养基; 检测菌株固氮能力培养基:NFM培养基[14]; 检测菌株溶磷能力培养基:PVK培养基[15]; 检测菌株解钾能力培养基:解钾菌选择培养基[16]。
1.2 试验方法 1.2.1 菌株促生及产生植物激素能力的测定菌株的生物固氮[14]、产HCN[17]、溶磷[15]以及解钾[16]能力采用相关文献方法。采用ELISA定量检测试剂盒(GENMED SCIENTIFICS INC. U.S.A)测定菌株的生长素含量[18]。
1.2.2 接种菌液的制备将甘油保存的供试菌株接入LB固体培养基, 在28 ℃培养箱中放置24 h, 然后用无菌水清洗菌体制成种子菌悬液。在250 mL三角瓶中装入100 mL液体培养基, 灭菌后接入2 mL种子菌悬液, 28 ℃、170 r · min-1振荡培养24 h, 调整发酵液菌体含量为108 CFU · g-1, 即得菌种培养液, 备用。
1.2.3 菌株对烟草的促生作用漂浮育苗:调节基质持水量后, 加入已用福尔马林溶液消毒的育苗盘, 每穴2粒种子, 苗池注水, 待烟苗长至4~5叶期时移栽。移栽前要将所用基质湿热灭菌, 分装到一次性杯子(底部扎孔)中, 每盆装0.1 kg基质, 备用。移栽烟苗7 d后, 分别用配制好的菌种培养液处理, 每株烟苗接种量为10 mL, 灌根处理, 每个处理2株, 对照处理使用等量无菌水。
每天观察烟草的生长情况, 每隔8 d拍照。培养25 d后, 将烟苗整株挖出, 洗去根部泥土, 测定烟株农艺性状, 主要测定最大叶长、最大叶宽、株高、茎围、总根长、根投影面积、根系活力[19]、地上部鲜质量等指标, 具体参照《烟草农艺性状调查方法:YC/T142—1998》。使用根系扫描仪(EPSON1680)及其配套的WinRhizo Pro 5.0根系分析软件测定根系指标[20]。
1.2.4 熵权法综合评价烟品质通过隶属函数与因子分析对不同菌株处理下的烟草生长性状进行综合评价, 熵权法确定权重, 计算不同促生菌处理下烟草的得分。
隶属函数值(Yij):
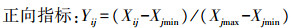
|
(1) |
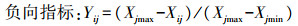
|
(2) |
式中:i(i=1, 2, …, n)为不同促生菌接菌处理; j(j=1, 2, …, m)为烟草生长指标; Xij为第i菌株处理下烟草生长指标的数值; Yij为第i菌株处理下隶属函数值。
第i菌株接菌处理第j项指标的比重(Pij):

|
(3) |
信息熵(Ej)及其冗余度(Gj):
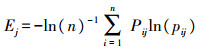
|
(4) |
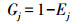
|
(5) |
指标权重(Wj):
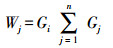
|
(6) |
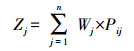
|
(7) |
采用Excel 2007软件对数据初步计算, 采用SPSS 22.0软件进行数据显著性差异分析。
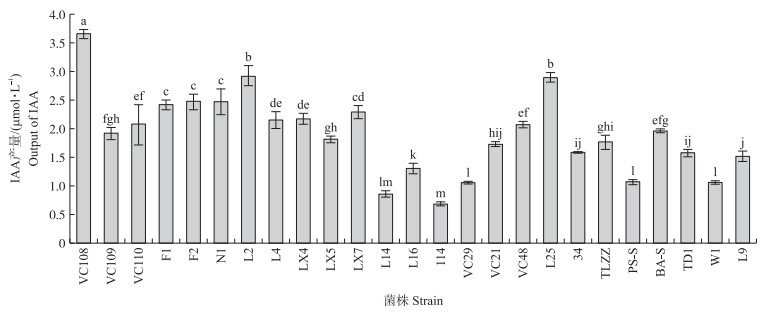
2 结果与分析 2.1 菌株促生及产植物激素能力测定分别测定25株菌的5项促生指标(固氮能力、产HCN、溶磷能力、解钾能力、分泌吲哚乙酸能力), 结果见表 1和图 1。由表 1可见:菌株TD1、PS-S、L25、N1、VC109、BA-S和VC29不具备固氮能力, 占供试菌株的32%;菌株L4、VC110、L2、114、VC109、VC29和L16不具备产HCN的能力, 占供试菌株的28%;在溶磷能力上菌株LX7、L2、F1、BA-S、LX4、VC29、L9和VC108表现优于其他菌株; 在解钾能力方面, 菌株W1、PS-S、F2、34和VC108表现优于其他菌株; 供试菌株均能分泌吲哚乙酸, 其中菌株VC108产吲哚乙酸的能力最强, 其次为菌株L2和L25。
| 菌株 Strain |
固氮能力① Nitrogen fixation |
产HCN② Produce HCN |
溶磷能力③ Phosphate solubilization |
解钾能力③ Dissolving potassium |
| TD1 | - | + | + | + |
| W1 | ++ | + | + | ++ |
| LX7 | + | +++ | ++ | - |
| L4 | + | - | + | - |
| PS-S | - | ++ | + | ++ |
| VC110 | + | - | + | - |
| L25 | - | +++ | + | - |
| N1 | - | + | + | + |
| L2 | ++ | - | ++ | - |
| F1 | - | + | ++ | + |
| L14 | + | + | + | + |
| 114 | + | - | + | - |
| F2 | + | ++ | + | ++ |
| TLZZ | + | ++ | + | - |
| LX5 | + | ++ | + | + |
| VC109 | - | - | + | + |
| BA-S | - | +++ | ++ | + |
| 34 | ++ | ++ | + | ++ |
| LX4 | ++ | ++ | ++ | + |
| VC29 | - | - | ++ | + |
| VC48 | + | ++ | - | + |
| VC21 | ++ | + | + | + |
| L9 | ++ | + | ++ | + |
| VC108 | + | + | ++ | ++ |
| L16 | ++ | - | - | + |
| 注: ①“++”表示在NFM培养基中生长较快、菌落形态较大, “+”表示在NFM培养基中能够生长的菌落, “-”表示在NFM培养基中不能够生长的菌落; ②“+++”表示滤纸呈深棕, “++”表示滤纸呈橘棕, “+”表示滤纸呈橘色, “-”表示滤纸颜色无变化; ③“++”表示菌落周围产生较大晕圈, “+”表示菌落周围产生较小晕圈, “-”表示菌落周围不产生晕圈。 Note: ①“++”indicates the colony with fast growth and large colony morphology in NFM medium, “+”indicates a colony that can grow in NFM medium, “-”indicates a colony that cannot grow in NFM medium; ②“+++”indicates that the filter paper is present as a deep brown, “++”indicates that the filter paper is presented as a orange-brown, “+”indicates that the filter paper is presented as a orange, “-”indicates that there is no change in the color of the filter paper; ③“++”indicates that a large halo circle occurs around the colony, “+”indicates that a small halo circle occurs around the colony, “-”indicates that there is no halo around the colony. |
||||
|
图 1 各菌株的IAA产量 Fig. 1 Output of IAA in bacteria strain 不同小写字母表示处理间在0.05水平差异显著。下同。 Different lowercases mean significantly different at 0.05 level. The same as follows. |
将菌液对烟草植株进行灌根处理, 25 d后对植株的农艺性状进行拍照和测定(图 2和表 2), 除菌株L2以外, 其他供试菌株处理烟草各项指标的综合评价均高于对照, 其中菌株PS-S和F2促生效果较好, 菌株L25和菌株VC48次之。经菌株PS-S菌液处理, 烟苗最大叶长和株高显著提高; 经F2菌液处理, 烟苗最大叶长和茎直径显著提高; L25菌液显著增加烟苗茎直径和地上部鲜质量; VC48菌液显著增加烟株的最大叶宽、最大叶长和茎直径; W1菌液增加了烟苗最大叶长。

|
图 2 不同菌株处理对烟草生长的影响 Fig. 2 The effect of different strains on the growth of tobacco |
| 菌株 Strain |
最大叶长/cm Maximum leaf length |
最大叶宽/cm Maximum leaf width |
茎直径/mm Stem diameter |
地上部鲜质量/g Fresh weight of shoot |
株高/cm Plant height |
总分 Total points |
综合名次 Comprehensive ranking |
| CK | 13.39b | 6.90c | 3.05d | 3.75f | 3.03bcdef | 20 | 25 |
| TD1 | 12.31b | 7.60abc | 3.96cd | 5.90def | 3.10bcdef | 28 | 22 |
| N1 | 13.13b | 7.46abc | 4.48abc | 8.98abcd | 2.50cdef | 55 | 17 |
| L25 | 14.20ab | 7.91abc | 5.26a | 10.96a | 3.23bcde | 98 | 3 |
| PS-S | 14.94ab | 8.47abc | 4.37abc | 9.16abcd | 3.93ab | 105 | 1 |
| L2 | 11.95b | 7.09bc | 4.05bcd | 6.07cdef | 1.85f | 11 | 26 |
| F1 | 14.32ab | 7.51abc | 4.32abc | 8.51abcde | 3.45bc | 72 | 13 |
| L4 | 13.44ab | 7.87abc | 4.22abc | 8.77abcd | 2.98bcdef | 59 | 15 |
| VC48 | 14.88ab | 9.05a | 4.21abc | 10.06ab | 3.24bcde | 98 | 3 |
| TLZZ | 16.81a | 8.51abc | 4.23abc | 5.05ef | 4.85a | 85 | 7 |
| 34 | 13.71ab | 7.93abc | 4.62abc | 8.70abcd | 2.95bcdef | 74 | 12 |
| VC29 | 13.73b | 7.21bc | 3.72cd | 6.70bcdef | 1.9ef | 21 | 24 |
| LX4 | 13.43b | 7.38bc | 5.06ab | 9.55abcd | 3.30bcd | 79 | 9 |
| F2 | 14.89ab | 8.54abc | 4.51ab | 9.59abc | 3.15bcdef | 105 | 1 |
| L14 | 13.25ab | 7.70abc | 4.42abc | 9.45abcd | 3.45bc | 79 | 9 |
| L9 | 12.65b | 7.78abc | 4.22abc | 7.43abcde | 2.35cdef | 36 | 20 |
| LX7 | 14.22ab | 7.91abc | 4.37abc | 9.23abcd | 3.17bcdef | 84 | 8 |
| VC21 | 11.77b | 7.17bc | 3.8cd | 8.24abcde | 2.84bcdef | 23 | 23 |
| W1 | 14.48ab | 8.44abc | 4.38abc | 8.91abcd | 3.30bcd | 93 | 5 |
| L16 | 14.68ab | 8.58ab | 4.02bcd | 8.81abcd | 3.45bc | 86 | 6 |
| 114 | 11.98b | 7.73abc | 4.32bc | 7.19bcde | 2.25cdef | 35 | 21 |
| BA-S | 12.95b | 7.88abc | 4.12bc | 8.19abcde | 2.13cdef | 38 | 19 |
| VC108 | 13.94ab | 7.86abc | 4.4bc | 8.32abcde | 2.80bcdef | 63 | 14 |
| VC109 | 13.94ab | 7.77abc | 4.31bc | 7.66abcde | 1.95def | 47 | 18 |
| VC110 | 13.95ab | 8.30abc | 4.21abc | 9.02abcd | 3.20bcdef | 75 | 11 |
| LX5 | 14.28ab | 8.33abc | 4.03bcd | 7.49abcd | 2.58bcdef | 56 | 16 |
| 注:得分按名次计算, 在各项指标排名第1名得25分, 排2名得24分, 以此类推。Note:The score was calculated by rank, ranking 1 with 25 points, ranking 2 with 24 points, and so on. | |||||||
进一步分析供试菌株对烟草根系生长发育的影响, 测定烟草总根长和根投影面积(表 3)及根系活力(图 3)。除L2菌液处理外, 其他菌液处理烟草总根长均与无菌水对照处理差异显著(P < 0.05);各菌液处理烟草根投影面积均与对照处理差异显著。除菌株LX7和VC29处理植物根系活力低于对照处理外, 其他处理植物根系活力均高于对照处理, 尤其是菌株W1和LX5处理显著提高植物根系活力, 说明供试菌株处理对提高烟株根系活力具有促进作用(图 4)。
| 菌株 Strain |
总根长/cm Total root length | 根投影面积/cm2 Total root surface area |
| CK | 136.21±7.00n | 11.21±1.46k |
| BA-S | 407.05±21.82c | 32.27±0.56bc |
| 34 | 341.36±18.92de | 26.70±0.83ef |
| LX5 | 286.23±22.08h | 18.13±1.34ij |
| L14 | 302.72±12.13gh | 25.29±0.59fg |
| PS-S | 467.40±27.62ab | 37.50±0.65a |
| N1 | 255.00±9.17i | 24.36±1.39fg |
| LX4 | 367.00±19.90d | 33.73±1.71abc |
| VC109 | 193.35±9.22lm | 25.45±1.93fg |
| L2 | 150.73±11.59n | 17.00±0.840j |
| F1 | 226.47±10.72jk | 22.49±0.13gh |
| VC108 | 316.98±15.85efg | 30.92±1.62bcd |
| F2 | 444.79±23.25b | 34.70±0.41ab |
| VC48 | 490.89±40.00a | 30.57±1.68cde |
| W1 | 334.77±13.91ef | 26.92±0.21def |
| L4 | 330.00±26.71ef | 32.06±2.25bc |
| L25 | 193.92±2.50lm | 22.31±0.14gh |
| 114 | 204.26±2.11klm | 25.37±1.51fg |
| TLZZ | 206.60±10.57jklm | 16.12±0.55j |
| VC29 | 337.49±20.24ef | 23.78±0.57fgh |
| L9 | 290.77±16.66gh | 33.08±7.36abc |
| L16 | 312.91±18.79fgh | 23.45±1.73fgh |
| LX7 | 216.84±16.32jkl | 23.27±1.07fgh |
| VC21 | 200.98±6.42klm | 20.01±1.35hij |
| TD1 | 182.85±11.80m | 17.67±0.61j |
| VC110 | 231.99±10.78ij | 22.11±1.86ghi |

|
图 3 不同菌液处理对烟株根系活力的影响 Fig. 3 Effects of different inoculation treatments on root activity of tobacco plants |
依据熵权法计算, 将前期测得数据整理即得表 4, 其中X1—X8分别代表烟草最大叶长、最大叶宽、茎直径、地上部鲜质量、株高、总根长、根投影面积和根系活力。对数据进行标准化处理即隶属函数值计算, 因上述指标均为正向指标, 指标数值越大, 代表烟草品质越好, 故使用正向指标公式得出表 5。根据公式, 烟草各指标信息熵分别为0.944、0.951、0.978、0.973、0.937、0.933、0.963和0.919。根据烟草各指标信息熵算出烟草各指标的权重分别为0.023、0.021、0.009、0.011、0.026、0.028、0.016和0.034。因此, 根系活力的权重为0.034, 较其他性状大, 说明在给定样本数据中, 烟草根系活力的数据差异性较大, 相对于其他性状, 对评价结果有更大的影响。各促生菌的最终促生效应排名(表 6)显示:排名靠前的菌株有W1、F2、VC48和LX5, 说明这4株菌对烟草促生效果显著。
| 菌株Strain | X1 | X2 | X3 | X4 | X5 | X6 | X7 | X8 |
| CK | 13.39 | 6.90 | 3.05 | 3.75 | 3.03 | 136.21 | 11.21 | 163 |
| BA-S | 12.95 | 7.88 | 4.12 | 8.19 | 2.13 | 407.05 | 32.27 | 170 |
| 34 | 13.71 | 7.93 | 4.62 | 8.70 | 2.95 | 341.36 | 26.70 | 236 |
| LX5 | 14.28 | 8.33 | 4.03 | 7.49 | 2.58 | 286.23 | 18.13 | 492 |
| L14 | 13.25 | 7.70 | 4.42 | 9.45 | 3.45 | 302.72 | 25.29 | 290 |
| PS-S | 14.94 | 8.47 | 4.37 | 9.16 | 3.93 | 467.40 | 37.50 | 216 |
| N1 | 13.13 | 7.46 | 4.48 | 8.98 | 2.50 | 255.00 | 24.36 | 290 |
| LX4 | 13.43 | 7.38 | 5.06 | 9.55 | 3.30 | 367.00 | 33.73 | 150 |
| VC109 | 13.94 | 7.77 | 4.31 | 7.66 | 1.95 | 193.35 | 25.45 | 201 |
| L2 | 11.95 | 7.09 | 4.05 | 6.07 | 1.85 | 150.73 | 17.00 | 186 |
| F1 | 14.32 | 7.51 | 4.32 | 8.51 | 3.45 | 226.47 | 22.49 | 270 |
| VC108 | 13.94 | 7.86 | 4.40 | 8.32 | 2.80 | 316.98 | 30.92 | 230 |
| F2 | 14.89 | 8.54 | 4.51 | 9.59 | 3.15 | 444.79 | 34.70 | 386 |
| VC48 | 14.88 | 9.05 | 4.21 | 10.06 | 3.24 | 490.89 | 30.57 | 333 |
| W1 | 14.48 | 8.44 | 4.38 | 8.91 | 3.30 | 334.77 | 26.92 | 576 |
| L4 | 13.44 | 7.87 | 4.22 | 8.77 | 2.98 | 330.00 | 32.06 | 320 |
| L25 | 14.20 | 7.91 | 5.26 | 10.96 | 3.23 | 193.92 | 22.31 | 173 |
| 114 | 11.98 | 7.73 | 4.32 | 7.19 | 2.25 | 204.26 | 25.37 | 326 |
| TLZZ | 16.81 | 8.51 | 4.23 | 5.05 | 4.85 | 206.60 | 16.12 | 393 |
| VC29 | 13.73 | 7.21 | 3.72 | 6.70 | 1.90 | 337.49 | 23.78 | 126 |
| L9 | 12.65 | 7.78 | 4.22 | 7.43 | 2.35 | 290.77 | 33.08 | 220 |
| L16 | 14.68 | 8.58 | 4.02 | 8.81 | 3.45 | 312.91 | 23.45 | 293 |
| LX7 | 14.22 | 7.91 | 4.37 | 9.23 | 3.17 | 216.84 | 23.27 | 113 |
| VC21 | 11.77 | 7.17 | 3.80 | 8.24 | 2.84 | 200.98 | 20.01 | 141 |
| TD1 | 12.31 | 7.60 | 3.96 | 5.90 | 3.10 | 182.85 | 17.67 | 326 |
| VC11 | 13.95 | 8.30 | 4.21 | 9.02 | 3.20 | 231.99 | 22.11 | 320 |
| 注: X1—X8分别为代表烟草最大叶长、最大叶宽、茎直径、地上部鲜质量、株高、总根长、根投影面积和根系活力。下同。 Note: X1-X8 indicate marimum leaf length, maximum leaf width, stem diameter, fresh weight of shoot, plant height, total root length, total root surface area and root activity, respectively. The same as follows. |
||||||||
| 菌株Strain | X1 | X2 | X3 | X4 | X5 | X6 | X7 | X8 |
| CK | 0.321 | 0.000 | 0.000 | 0.000 | 0.393 | 0.000 | 0.000 | 0.108 |
| BA-S | 0.234 | 0.456 | 0.484 | 0.616 | 0.093 | 0.764 | 0.801 | 0.123 |
| 34 | 0.385 | 0.479 | 0.710 | 0.687 | 0.367 | 0.578 | 0.589 | 0.266 |
| LX5 | 0.498 | 0.665 | 0.443 | 0.519 | 0.243 | 0.423 | 0.263 | 0.819 |
| L14 | 0.294 | 0.372 | 0.620 | 0.791 | 0.533 | 0.469 | 0.536 | 0.382 |
| PS-S | 0.629 | 0.730 | 0.597 | 0.750 | 0.693 | 0.934 | 1.000 | 0.222 |
| N1 | 0.270 | 0.260 | 0.647 | 0.725 | 0.217 | 0.335 | 0.500 | 0.382 |
| LX4 | 0.329 | 0.223 | 0.910 | 0.804 | 0.483 | 0.651 | 0.857 | 0.080 |
| VC109 | 0.431 | 0.405 | 0.570 | 0.542 | 0.033 | 0.161 | 0.542 | 0.190 |
| L2 | 0.036 | 0.088 | 0.452 | 0.322 | 0.000 | 0.041 | 0.220 | 0.158 |
| F1 | 0.506 | 0.284 | 0.575 | 0.660 | 0.533 | 0.254 | 0.429 | 0.339 |
| VC108 | 0.431 | 0.447 | 0.611 | 0.634 | 0.317 | 0.510 | 0.750 | 0.253 |
| F2 | 0.619 | 0.763 | 0.661 | 0.810 | 0.433 | 0.870 | 0.893 | 0.590 |
| VC48 | 0.617 | 1.000 | 0.525 | 0.875 | 0.463 | 1.000 | 0.736 | 0.475 |
| W1 | 0.538 | 0.716 | 0.602 | 0.716 | 0.483 | 0.560 | 0.598 | 1.000 |
| L4 | 0.331 | 0.451 | 0.529 | 0.696 | 0.377 | 0.546 | 0.793 | 0.447 |
| L25 | 0.482 | 0.470 | 1.000 | 1.000 | 0.460 | 0.163 | 0.422 | 0.130 |
| 114 | 0.042 | 0.386 | 0.575 | 0.477 | 0.133 | 0.192 | 0.539 | 0.460 |
| TLZZ | 1.000 | 0.749 | 0.534 | 0.180 | 1.000 | 0.198 | 0.187 | 0.605 |
| VC29 | 0.389 | 0.144 | 0.303 | 0.409 | 0.017 | 0.567 | 0.478 | 0.028 |
| L9 | 0.175 | 0.409 | 0.529 | 0.510 | 0.167 | 0.436 | 0.832 | 0.231 |
| L16 | 0.577 | 0.781 | 0.439 | 0.702 | 0.533 | 0.498 | 0.466 | 0.389 |
| LX7 | 0.486 | 0.470 | 0.597 | 0.760 | 0.440 | 0.227 | 0.459 | 0.000 |
| VC21 | 0.000 | 0.126 | 0.339 | 0.623 | 0.330 | 0.183 | 0.335 | 0.060 |
| TD1 | 0.107 | 0.326 | 0.412 | 0.298 | 0.417 | 0.131 | 0.246 | 0.460 |
| VC110 | 0.433 | 0.651 | 0.525 | 0.731 | 0.450 | 0.270 | 0.415 | 0.447 |
| 菌株 Strain |
得分 Score |
排名 Ranking |
| W1 | 29.803 | 1 |
| F2 | 26.637 | 2 |
| VC48 | 26.096 | 3 |
| LX5 | 25.452 | 4 |
| PS-S | 21.624 | 5 |
| L4 | 21.119 | 6 |
| TLZZ | 19.977 | 7 |
| L16 | 19.657 | 8 |
| L14 | 19.261 | 9 |
| 34 | 18.545 | 10 |
| VC110 | 18.260 | 11 |
| BA-S | 18.199 | 12 |
| N1 | 17.878 | 13 |
| VC108 | 17.723 | 14 |
| 114 | 17.637 | 15 |
| TD1 | 16.930 | 16 |
| L9 | 16.636 | 17 |
| LX4 | 16.490 | 18 |
| F1 | 16.430 | 19 |
| VC29 | 14.631 | 20 |
| VC109 | 13.187 | 21 |
| L25 | 12.303 | 22 |
| L2 | 11.281 | 23 |
| VC21 | 11.265 | 24 |
| LX7 | 10.916 | 25 |
| CK | 10.040 | 26 |
在农业中广泛应用的PGPR一般都兼具多种促生机制, 如能够产生HCN的PGPR, 可有效抑制土传病害[21]; 具有固氮、溶磷能力的PGPR, 在一定程度上可为自身和植物提供可利用氮和磷, 促进植物生长[22-23]。Burkholderia sp.7016能促进番茄生长, 具有固氮、溶磷、产ACC脱氨酶活性和拮抗土传病害等功能[22]。Pseudomonas aeruginosa PM389能促进狗尾草藜生长, 具有拮抗土传病害、产铁载体、固氮、溶磷等功能特性[24]。Lin等[25]筛选到21株拮抗真菌病害的芽胞杆菌, 同时具有固氮能力和产IAA能力, 对黄瓜根腐病具有明显抑制作用, 并能促进黄瓜生长。本研究测定25株菌的5项促生指标(固氮能力、产HCN、溶磷能力、解钾能力、分泌IAA能力), 每株PGPR均具有多项促生指标, 使用熵权法赋重得到对烟草生物学性状有显著提升作用的菌株, 如菌株W1、F2、LX5和VC48均具有3项以上促生指标, 尤其是菌株W1在固氮能力和解钾能力表现突出, 菌株F2则是在产HCN和解钾能力表现优异。过量的激素可能会抑制植物生长[26]。本研究中, 菌株VC108、L2和L25虽然产生生长素相对较多, 但是对烟草的促生作用却不显著。因此, 影响促生菌促进烟草生长的因素是比较复杂的, 既有溶磷、解钾、分泌IAA能力的影响, 也有固氮、吸收营养物质、分泌HCN等因素的影响, 以及各个因素间的相互作用[27]。这表明通过接种促生菌株来提高植物的生物量是一个非常有效的途径, 对农业生产有积极的作用。
烟草生物学性状是由多个综合而复杂的因素组成的。单以某一或几个指标评价某烟草可能优于或劣于对照烟草, 其片面性难以真实反映烟草性状特征。同时, 各指标既有各自的单方面作用, 还有多指标间的相互作用, 只有对这些指标的交互作用进行深入研究, 才更具客观与合理性。因此, 前人利用不同数据分析或统计方法对多个作物生物学性状进行综合评价[10-13]。有关于烟草生物学性状的分析多集中于其化学成分特性[28], 鲜有对烟草生物学特性的综合评价。本研究利用隶属函数对计量单位或衡量量化上不同原始数据进行转化, 使各指标都具有一定的统计学意义与生物学意义, 结果表明影响烟草生物学性状综合评价的关键因子从大到小依次为:根系活力、总根长、株高、烟草最大叶长、最大叶宽、根投影面积和、地上部分鲜质量、茎直径, 即根系活力对综合评价烟草生物学性状影响大。相对而言, 茎直径等指标贡献性较小, 这为烟草生物学性状综合评价提供新的方法。
本研究采用熵权法对烟草促生效果进行综合评价, 与其他评价方法相比, 该方法可以避免根据传统经验评价的主观性、标准的单一性, 能够给出有较大区分度的、直观的评价结果。本研究筛选的PGPR是在室内纯培养的条件下进行, 促生试验是在培养箱可控条件下开展的, 而在自然条件下影响菌株的促生效果的因素有很多, 例如:土壤、原著微生物、气候和植物自身因素等[29]。因此, 筛选菌株是否能用于微生物肥料生产, 还需要进一步的田间验证。
研究结果表明, W1具有较强的固氮和解钾能力, F2具有较强的产HCN、解钾和产生长素的能力, VC48和LX5具有较强的产HCN和生长素的能力, 4株菌均具有2种及2种以上促生特性。根据盆栽试验, 这4株菌也能较好促进烟草生长的提升, 说明这4个菌株具有较强的植物促生能力, 可以作为研发烟草专用生物有机肥菌种, 但不同PGPR菌株促生效果存在差异, 田块差异、土壤差异可能是产生影响的因素之一, 需进一步观察这些菌株在田间栽培效果。综上所述, 菌株W1、F2、VC48和LX5可以作为烟草促生有机肥的功能菌株, 具有较好的应用潜力。
| [1] |
Nadeem S M, Ahmad M, Zahir Z A, et al. The role of mycorrhizae and plant growth promoting rhizobacteria(PGPR)in improving crop productivity under stressful environments[J]. Biotechnology Advances, 2014, 32(2): 429-448. DOI:10.1016/j.biotechadv.2013.12.005 |
| [2] |
Zaidi A, Ahmad E, Khan M S, et al. Role of plant growth promoting rhizobacteria in sustainable production of vegetables:current perspective[J]. Scientia Horticulturae, 2015, 193: 231-239. DOI:10.1016/j.scienta.2015.07.020 |
| [3] |
Taulé C, Mareque C, Barlocco C, et al. The contribution of nitrogen fixation to sugarcane(Saccharum officinarum L.), and the identification and characterization of part of the associated diazotrophic bacterial community[J]. Plant and Soil, 2012, 356(1/2): 35-49. |
| [4] |
Wu F Y, Wan J, Wu S C, et al. Effects of earthworms and plant growth-promoting rhizobacteria(PGPR)on availability of nitrogen, phosphorus, and potassium in soil[J]. Journal of Plant Nutrition and Soil Science, 2012, 175(3): 423-433. DOI:10.1002/jpln.201100022 |
| [5] |
宫安东, 孔宪巍, 翟新可, 等. 枯草芽胞杆菌WY8-7的溶磷、抑菌及促生长作用[J]. 南京农业大学学报, 2019, 42(4): 697-705. Gong A D, Kong X W, Zhai X K, et al. Phosphate solubilizing, antagonistic and plant growth promoting activity of Bacillus subtilis WY8-7[J]. Journal of Nanjing Agricultural University, 2019, 42(4): 697-705 (in Chinese with English abstract). DOI:10.7685/jnau.201811031 |
| [6] |
Piromyou P, Buranabanyat B, Tantasawat P, et al. Effect of plant growth promoting rhizobacteria(PGPR)inoculation on microbial community structure in rhizosphere of forage corn cultivated in Thailand[J]. European Journal of Soil Biology, 2011, 47(1): 44-54. DOI:10.1016/j.ejsobi.2010.11.004 |
| [7] |
Velusamy P, Immanuel J E, Gnanamanickam S S. Rhizosphere bacteria for biocontrol of bacterial blight and growth promotion of rice[J]. Rice Science, 2013, 20(5): 356-362. DOI:10.1016/S1672-6308(13)60143-2 |
| [8] |
刘艳霞, 李雨, 李想, 等. 烤烟根际土壤微生物对根系酚酸类物质的响应[J]. 植物营养与肥料学报, 2019, 25(8): 1373-1382. Liu Y X, Li Y, Li X, et al. Responses of soil microbiome to phenolic acid secreted from tobacco rhizosphere[J]. Journal of Plant Nutrition and Fertilizers, 2019, 25(8): 1373-1382 (in Chinese with English abstract). |
| [9] |
Bhattacharyya P N, Jha D K. Plant growth-promoting rhizobacteria(PGPR):emergence in agriculture[J]. World Journal of Microbiology and Biotechnology, 2012, 28(4): 1327-1350. DOI:10.1007/s11274-011-0979-9 |
| [10] |
靳玉龙, 白婷, 朱明霞, 等. 利用因子分析综合评价9个西藏农家青稞品种的品质[J]. 作物杂志, 2019(4): 55-60. Jin Y L, Bai T, Zhu M X, et al. Comprehensive evaluation of quality of nine Tibetan barley landlaces by factor analysis[J]. Crops, 2019(4): 55-60 (in Chinese with English abstract). |
| [11] |
唐忠厚, 魏猛, 陈晓光, 等. 不同肉色甘薯块根主要营养品质特征与综合评价[J]. 中国农业科学, 2014, 47(9): 1705-1714. Tang Z H, Wei M, Chen X G, et al. Characters and comprehensive evaluation of nutrient quality of sweetpotato storage root with different flesh colors[J]. Scientia Agricultura Sinica, 2014, 47(9): 1705-1714 (in Chinese with English abstract). |
| [12] |
罗尧幸, 郭荣荣, 李雪雪, 等. 基于隶属函数法评价7个鲜食葡萄品种的抗寒性[J]. 贵州农业科学, 2018, 46(6): 38-44. Luo Y X, Guo R R, Li X X, et al. Cold resistance of seven table grape varieties evaluated by subordinate function method[J]. Guizhou Agricultural Sciences, 2018, 46(6): 38-44 (in Chinese with English abstract). |
| [13] |
杨禹伟, 陈华, 姜波, 等. 一种加工番茄品质的多性状评价方法[J]. 中国农业大学学报, 2017, 22(3): 131-137. Yang Y W, Chen H, Jiang B, et al. An evaluation method for processing tomato quality on multiple traits[J]. Journal of China Agricultural University, 2017, 22(3): 131-137 (in Chinese with English abstract). |
| [14] |
康贻军, 程洁, 梅丽娟, 等. 植物根际促生菌的筛选及鉴定[J]. 微生物学报, 2010, 50(7): 853-861. Kang Y J, Cheng J, Mei L J, et al. Screening and identification of plant growth-promoting rhizobacteria[J]. Acta Microbiologica Sinica, 2010, 50(7): 853-861 (in Chinese with English abstract). |
| [15] |
Subramanian J, Satyan K. Isolation and selection of fluorescent pseudomonads based on multiple plant growth promotion traits and siderotyping[J]. Chilean Journal of Agricultural Research, 2014, 74(3): 319-325. DOI:10.4067/S0718-58392014000300010 |
| [16] |
Wu F Y, Wan J, Wu S C, et al. Effects of earthworms and plant growth-promoting rhizobacteria(PGPR)on availability of nitrogen, phosphorus, and potassium in soil[J]. Journal of Plant Nutrition and Soil Science, 2012, 175(3): 423-433. DOI:10.1002/jpln.201100022 |
| [17] |
冯哲叶, 陈莎莎, 王文超, 等. 几株溶磷细菌的筛选和鉴定及其溶磷效果[J]. 南京农业大学学报, 2017, 40(5): 842-849. Feng Z Y, Chen S S, Wang W C, et al. Screening and identification of several phosphate-solubilizing bacteria and effect of their P-solubility[J]. Journal of Nanjing Agricultural University, 2017, 40(5): 842-849 (in Chinese with English abstract). DOI:10.7685/jnau.201612008 |
| [18] |
Lequin R M. Enzyme immunoassay(EIA)/enzyme-linked immunosorbent assay(ELISA)[J]. Clinical Chemistry, 2005, 51(12): 2415-2418. DOI:10.1373/clinchem.2005.051532 |
| [19] |
高飞燕, 曹越, 艾昊, 等. 水稻铁氧化酶基因OsLPR5对拟南芥根系发育和养分利用的影响[J]. 南京农业大学学报, 2018, 41(6): 1054-1060. Gao F Y, Cao Y, Ai H, et al. Effects of rice ferroxidase gene OsLPR5 on root growth and nutrient utilization in Arabidopsis plants[J]. Journal of Nanjing Agricultural University, 2018, 41(6): 1054-1060 (in Chinese with English abstract). DOI:10.7685/jnau.201803030 |
| [20] |
王亚男, 程立娟, 周启星. 鸢尾对石油烃污染土壤的修复以及根系代谢分析[J]. 环境科学, 2016, 37(4): 1531-1538. Wang Y N, Cheng L J, Zhou Q X. Phytoremediation of petroleum contaminated soils with Iris pseudacorus L. and the metabolic analysis in roots[J]. Environmental Science, 2016, 37(4): 1531-1538 (in Chinese with English abstract). |
| [21] |
González-Sánchez M Á, de Vicente A, Pérez-García A, et al. Evaluation of the effectiveness of biocontrol bacteria against avocado white root rot occurring under commercial greenhouse plant production conditions[J]. Biological Control, 2013, 67(2): 94-100. DOI:10.1016/j.biocontrol.2013.08.009 |
| [22] |
Gao M, Zhou J J, Wang E T, et al. Multiphasic characterization of a plant growth promoting bacterial strain, Burkholderia sp. 7016 and its effect on tomato growth in the field[J]. Journal of Integrative Agriculture, 2015, 14(9): 1855-1863. DOI:10.1016/S2095-3119(14)60932-1 |
| [23] |
李想, 刘艳霞, 夏范讲, 等. 烟草根际促生菌(PGPR)的筛选、鉴定及促生机理研究[J]. 中国烟草学报, 2017, 23(3): 111-118. Li X, Liu Y X, Xia F J, et al. Screening, identification and plant growth-promotion mechanism of tobacco plants rhizobacteria[J]. Acta Tabacaria Sinica, 2017, 23(3): 111-118 (in Chinese with English abstract). |
| [24] |
Gupta G, Panwar J, Jha P N. Natural occurrence of Pseudomonas aeruginosa, a dominant cultivable diazotrophic endophytic bacterium colonizing Pennisetum glaucum(L.)R. Br[J]. Applied Soil Ecology, 2013, 64: 252-261. DOI:10.1016/j.apsoil.2012.12.016 |
| [25] |
Lin Y, Du D L, Si C C, et al. Potential biocontrol Bacillus sp. strains isolated by an improved method from vinegar waste compost exhibit antibiosis against fungal pathogens and promote growth of cucumbers[J]. Biological Control, 2014, 71: 7-15. DOI:10.1016/j.biocontrol.2013.12.010 |
| [26] |
Persello-Cartieaux F, Nussaume L, Robaglia C. Tales from the underground:molecular plant-rhizobacteria interactions[J]. Plant, Cell & Environment, 2003, 26(2): 189-199. |
| [27] |
庞发虎, 杜瑞卿, 王坦, 等. 小麦内生细菌促生菌株的筛选及其影响小麦生长的因子的相关性分析[J]. 中国农业大学学报, 2016, 21(1): 8-21. Pang F H, Du R Q, Wang T, et al. Screening of wheat growth-promoting entophytic bacteria strains and correlation analysis of factors influencing wheat growth[J]. Journal of China Agricultural University, 2016, 21(1): 8-21 (in Chinese with English abstract). |
| [28] |
肖雅, 马继良, 曹凡宝, 等. 云南烤烟品种K326化学成分分析及聚类评价[J]. 西南农业学报, 2012, 25(1): 44-47. Xiao Y, Ma J L, Cao F B, et al. Cluster evaluation and analysis on chemical com-ponents of flue-cured tobacco K326 in Yunnan[J]. Southwest China Journal of Agricultural Sciences, 2012, 25(1): 44-47 (in Chinese with English abstract). |
| [29] |
Vimal S R, Singh J S, Arora N K, et al. Soil-plant-microbe interactions in stressed agriculture management:a review[J]. Pedosphere, 2017, 27(2): 177-192. DOI:10.1016/S1002-0160(17)60309-6 |




