文章信息
- 王园园, 刘琳莉, 李雷, 戴伟民, 强胜, 宋小玲
- WANG Yuanyuan, LIU Linli, LI Lei, DAI Weimin, QIANG Sheng, SONG Xiaoling
- 复合性状转cry2A*/bar基因水稻T2A-1的生存竞争能力
- Survival competitive ability of stacked transgenic rice T2A-1 with cry2A*/bar
- 南京农业大学学报, 2020, 43(5): 862-868
- Journal of Nanjing Agricultural University, 2020, 43(5): 862-868.
- http://dx.doi.org/10.7685/jnau.201910041
-
文章历史
- 收稿日期: 2019-10-26
转基因水稻的环境释放给人们带来利益的同时, 其潜在的生态风险也引起广泛关注, 其中最值得关注的风险之一是转基因水稻的杂草化。包括转基因水稻的抗性基因通过花粉漂移到杂草稻中, 产生携带抗性基因的杂交后代可能引起的潜在生态风险, 以及转基因水稻的自身杂草化[1-2]。
作物是经人类对野生植物的长期驯化和培育获得的, 因此许多作物本身都存在作物-杂草-野生种的复合状态[3]。原本自然分布或人工栽培的植物, 在新的人工种植条件下能自然繁殖, 其种群变为杂草的演化过程就是植物的杂草化[4]。水稻(Oryza sativa L.)具有伴生的同属同种的近源杂草——杂草稻(Oryza sativa f. spontanea), 因此在转基因水稻商业化释放前对其杂草化的风险评估非常必要。
花粉介导的基因漂移是转基因水稻向伴生同属同种杂草稻逃逸的主要途径[5]。转基因水稻的抗性基因通过花粉漂移到杂草稻中能产生适合度较高的抗性杂草稻, 因此导致杂草稻防治困难[6]。由于不同转基因水稻导入基因的种类和插入位点等不同, 其自身杂草化的风险也存在差异[7-8]。余柳青等[9]发现抗草铵膦的转基因水稻99-1比常规粳稻‘秀水11’具有更强的竞争力。Jung等[10]发现抗原卟啉原氧化酶抑制剂类除草剂转基因水稻T4和T5的产量与受体水稻相比略低。崔荣荣等[8]在农田生态环境有杂草竞争条件下比较抗草铵膦转基因水稻‘明恢86B’与受体‘明恢86’以及杂交稻‘汕优63’在不同播期及播种密度下的竞争能力、繁育能力、落粒性及种子生存能力后发现, ‘明恢86B’演化为杂草的可能性较低。Chun等[11]发现抗原卟啉原氧化酶抑制剂转基因水稻的竞争能力弱于受体水稻。
对抗虫转基因水稻, 其适合度表现与虫压有密切关系。Tu等[12]发现抗虫转基因杂交稻‘Bt-籼优63’在田间自然靶标虫压(50%~60%)下与亲本‘明恢63’相比具有更高的生存竞争能力。Chen等[13]发现转Bt基因、转CpTI基因和转Bt/CpTI双价基因水稻在低虫压下与受体‘明恢86’混种时表现出一定的适合度代价, 在中虫压下与受体‘明恢86’混种时均没有表现出适合度代价。张富丽等[14]发现转Bt抗虫水稻Bt63、R1、R2在低虫压(< 18%)条件下的分蘖数、生物量鲜质量与非转基因普通栽培水稻‘Ⅱ优838’相比无显著差异, 但株高、穗长和穗质量显著低于‘Ⅱ优838’; 但在高虫害胁迫条件(35%)下, 3种转Bt基因水稻的这些指标均明显高于‘Ⅱ优838’。
目前, 对复合性状转基因水稻的生存竞争能力的报道较少。Huang等[2]研究抗虫抗草铵膦转cry 1C*/bar基因水稻T1c-19的竞争能力、繁育能力、落粒性、种子萌发能力和活力保存能力, 发现T1c-19的自身杂草化可能性较小。
本研究以复合性状转cry 2A*/bar基因水稻T2A-1为供试材料, 研究其竞争能力及种子生存能力, 评价T2A-1的自身杂草化风险, 为T2A-1申请安全证书提供安全性评估资料, 同时也为制定复合性状转基因水稻风险评价标准提供试验依据。
1 材料与方法 1.1 试验材料复合性状转cry 2A*/bar基因水稻T2A-1由华中农业大学作物遗传改良国家重点实验室培育, 是采用农杆菌介导的遗传转化方法将人工改造合成并获得自主知识产权的抗虫基因cry 2A*导入到优良的恢复系籼型水稻‘明恢63’(MH63)获得的[15]。T2A-1在筛选过程中使用了抗草铵膦bar基因作为选择标记, 因此T2A-1具有很好的抗草铵膦特性。田间试验结果表明, T2A-1遗传稳定, 对二化螟、三化螟和稻纵卷叶螟表现出高度的抗性, 同时具有很好的抗草铵膦特性, 农艺性状与受体‘明恢63’基本一致, 具有巨大的产业化前景[15-16]。南京本地常规籼型水稻‘中莲恢510’(LC)和江苏泰州杂草稻(WRTZ)由笔者所在的杂草研究室提供。
1.2 试验设计试验于农业农村部批准的转基因作物安全性评估试验基地(32.011569N, 118.624535E)进行。按照常规稻田的标准对整个生长期水稻进行水肥和病虫害管理。试验完成后所有剩余材料全部烧毁。在试验田的周围没有种植水稻, 并且在试验田四周种植玉米, 符合国家相关规定。
1.2.1 种植方式试验于2017年5月25日—10月10日进行。以T2A-1、MH63、LC和WRTZ为供试材料。单种条件下, 每种供试材料饱满种子浸种24 h后, 点播于2 m×2 m的小区内, 每点播种1粒种子, 2点距离20 cm, 每个小区播种11行11列, 每行、每列均11粒种子, 共121粒种子。每处理4次重复, 小区随机区组分布。
在混种条件下, T2A-1分别与MH63、LC和WRTZ相邻混种, 选取T2A-1饱满种子60粒, MH63、LC或WRTZ的饱满种子61粒, 浸种24 h后, 相邻点播于2 m×2 m的小区内, 每点播种1粒种子, 2点距离20 cm。每种混种组合4次重复, 各混种小区随机区组分布, 共12个区, 各小区间隔0.5 m。
试验期间人工拔出单种和混种小区内的杂草, 保持无杂草状态, 田间保持1~3 cm水层, 并在分蘖期和灌浆期分别施用1次高光效复合肥(450 kg · hm-2, 江苏中东化肥股份有限公司)。试验期间, 不使用杀虫剂, 试验期间的靶标害虫为自然虫压。
1.2.2 出苗率和抽穗期调查调查单种和混种小区中T2A-1、MH63、LC和WRTZ分别在直播15 d后的出苗数量, 统计出苗率。出苗率=出苗数/播种种子数×100%。以单种小区中T2A-1、MH63、LC和WRTZ为调查对象, 记录每种材料初始抽穗的日期。
1.2.3 营养及生殖生长指标的测定每个小区内各种供试材料随机选取20株进行测定。在水稻黄熟期, 测定株高、分蘖数和剑叶面积; 收获后测定穗长、单穗饱满粒数、结实率、百粒质量、单株产量和单株干生物量[17]。
1.2.4 落粒率的统计供试材料成熟后立即统计落粒率。以单种小区中T2A-1、MH63、LC和WRTZ为材料, 每个小区随机选取5株, 每株供试材料的主茎稻穗剪下后从1.5 m处自由坠地, 连续重复3次, 统计脱落与未脱落的水稻饱满粒数, 计算落粒率。落粒率=脱落饱满粒数/单穗总饱满粒数×100%。
1.2.5 种子生存能力种子生存能力的测定方法:将收获的种子放置在室温通风环境中30 d后进行萌发试验。分别选取T2A-1、MH63、LC和WRTZ各50粒种子, 每种供试材料设置4次重复。用乙醇溶液对种子消毒30 s后, 用无菌水反复冲洗3次。将种子放入装有2层滤纸的盘子中, 加入约20 mL蒸馏水。置于光/暗培养时间为16 h/8 h及光/暗温度为(30±1)℃/(25±1)℃的条件下培养10 d, 统计萌发与未萌发种子数, 计算萌发率。萌发率=萌发种子数/总种子数×100%。
种子活力保持能力的测定方法:试验设置浅埋(3 cm)和深埋(20 cm)。分别选取T2A-1、MH63、LC和WRTZ种子各50粒, 分装于孔径为75 μm的尼龙网袋中, 每种供试材料4次重复。埋藏试验地点为水稻生存竞争力的试验田。分别在埋藏2、4和6个月后取出种子, 统计腐烂种子, 对完好种子进行室内萌发试验。种子萌发测定的方法同种子生存能力试验。培养10 d后, 分别统计萌发与未萌发种子的种子数。采用TTC染色法对未萌发种子进行活力测定, 计算种子失活率。种子失活率=(腐烂种子数+未萌发但失活种子数)/总种子数×100%。
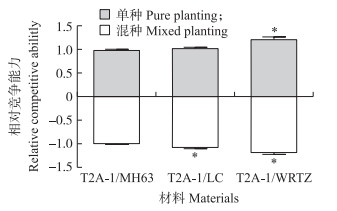
1.3 数据统计与分析采用SPSS 20.0软件的Duncan ’ s新复极差测验, 比较T2A-1与MH63、LC和WRTZ在单种条件下的营养生长指标、生殖生长指标、出苗率、萌发率和种子活力保持能力的差异性。采用独立样本t测验比较T2A-1与MH63、LC和WRTZ在混种条件下的营养生长指标、生殖生长指标和出苗率的差异性。在单种和混种条件下, 以MH63、LC和WRTZ的各项营养和生殖指标为1, T2A-1与它们的各项营养和生殖指标比值的平均值为T2A-1的相对竞争能力。
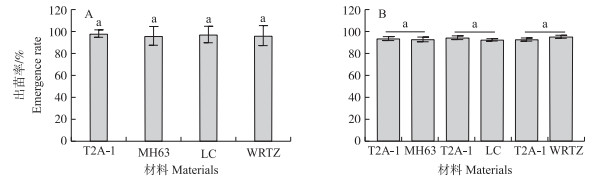
2 结果与分析 2.1 出苗率和抽穗期的观察从图 1可知:在单种和混种15 d后, T2A-1的出苗率与MH63、LC和WRTZ相比均无显著差异, 它们的出苗率为92.62%~98.35%。在单种小区观察T2A-1、MH63、LC和WRTZ的抽穗期发现, T2A-1与受体MH63的抽穗期相同, 为9月12日, 但晚于LC 2 d, 晚于杂草稻5 d。
|
图 1 单种(A)及混种(B)条件下T2A-1、MH63、LC和WRTZ直播15 d后的出苗率
Fig. 1 The emergence rate of T2A-1, MH63, LC and WRTZ at 15 days after direct sowing in pure(A)and mixed(B)planting
1)T2A-1、MH63、LC、WRTZ分别为复合性状转cry 2A*/bar基因水稻、受体水稻‘明恢63’、南京本地常规籼型水稻‘中莲恢510’、江苏泰州杂草稻。T2A-1, MH63, LC and WRTZ were stacked transgenic rice with cry 2A*/bar, recipient rice ‘Minghui 63’, Nanjing local conventional indica rice ‘Zhonglianhui 510’and Jiangsu Taizhou weedy rice. 2)不同小写字母表示在0.05水平差异显著。下同。The lowercase indicates significant differences at 0.05 level. The same as follows. |
在单种条件下, T2A-1与受体水稻MH63的营养生长指标和生殖生长指标以及相对竞争能力均无显著差异(图 2, 表 1)。这说明在单种条件下, 转基因没有改变受体水稻的竞争能力。T2A-1的百粒质量比LC显著提高34.6%, 株高显著降低4.07%, 但两者的相对竞争能力无显著差异。T2A-1的相对竞争能力显著高于WRTZ(图 2), 主要表现在株高、剑叶面积、单株干生物量、百粒质量和单株产量分别显著提高17.3%、59.61%、41.23%、35.12%和23.95%(表 1)。这说明在单种条件下T2A-1与WRTZ相比表现出竞争优势。
|
图 2 单种及混种条件下T2A-1相对于MH63、LC和WRTZ的相对竞争能力 Fig. 2 The relative competitive ability of T2A-1 to MH63, LC and WRTZ in pure and mixed planting *P < 0.05. |
| 种植条件 Planting method |
材料 Materials |
株高/cm Plant height |
有效分蘖数 Effective tiller per plant |
剑叶面积/cm2 Flag leaf area |
单株干生物量/g Dry biomass per plant |
穗长/cm Panicle length |
单穗饱满粒数 Full grain number per panicle |
百粒质量/g 100-grain weight |
结实率/% Seed set |
单株产量/g Yield per plant |
| 单种 | T2A-1 | 135.17±0.60b | 10.20±0.36a | 60.54±3.37a | 92.01±7.80a | 23.09±0.12ab | 102.05±3.89a | 3.27±0.10a | 77.27±2.94a | 35.71±2.87a |
| Pure | MH63 | 133.00±0.34b | 10.58±0.11a | 60.56±2.22a | 89.27±6.50a | 24.80±0.92a | 105.15±3.59a | 3.15±0.04a | 80.28±1.00a | 35.05±3.42a |
| planting | LC | 140.90±0.98a | 11.55±0.73a | 56.00±1.52a | 85.83±7.54a | 22.05±0.32b | 111.10±2.64a | 2.43±0.04b | 83.77±2.38a | 35.19±3.21a |
| WRTZ | 115.27±1.41c | 10.88±0.36a | 37.93±2.43b | 65.15±1.54b | 21.14±1.10b | 94.40±8.76a | 2.42±0.05b | 77.37±4.71a | 28.81±1.65b | |
| 混种 | T2A-1 | 136.05±1.03a | 17.20±0.39a | 72.61±2.06a | 123.07±3.63a | 22.65±0.89a | 102.60±9.61a | 3.32±0.06a | 79.03±1.62a | 45.17±1.79a |
| Mixed | MH63 | 129.10±1.11b | 17.28±0.69a | 70.18±2.05a | 117.35±3.32a | 24.20±0.88a | 108.95±7.29a | 3.33±0.08a | 78.38±2.16a | 43.30±1.40a |
| planting | T2A-1 | 160.36±2.12a | 12.45±0.12a | 86.49±4.42a | 137.34±8.70a | 23.29±0.74a | 108.05±4.03a | 3.41±0.02a | 80.02±2.67a | 44.87±1.38a |
| LC | 156.22±0.33a | 13.13±0.31a | 72.35±1.67b | 119.86±8.15b | 23.26±0.52a | 94.15±5.95a | 2.65±0.19b | 76.47±3.54a | 42.55±0.87a | |
| T2A-1 | 126.36±3.11a | 19.20±0.99a | 71.68±1.44a | 115.20±8.77a | 22.47±0.27a | 96.45±5.94a | 3.42±0.04a | 75.37±1.49a | 41.15±1.37a | |
| WRTZ | 127.45±0.96a | 22.30±1.01a | 49.15±1.26b | 76.60±5.69b | 20.27±0.98a | 90.00±8.48a | 2.25±0.04b | 77.14±3.52a | 34.23±0.48b | |
| 注:相同种植条件同列数据后不同字母表示在0.05水平差异显著。 Note:The different letters in the same column at the same planting condition indicate significant differences at 0.05 level. |
||||||||||
在混种条件下, 尽管T2A-1的株高比MH63显著提高了5.38%, 但相对竞争能力与MH63相比没有显著差异(图 2)。这说明在混种存在竞争条件下, 转基因没有明显改变受体水稻的竞争能力。T2A-1的相对竞争能力显著大于LC和WRTZ(图 2), 主要表现在T2A-1比LC的剑叶面积、单株干生物量和百粒质量显著提高19.54%、14.58%和28.68%;T2A-1比WRTZ的剑叶面积、单株干生物量、百粒质量和单株产量分别显著提高45.84%、50.40%、52.00%和20.22%(表 1)。这说明在混种存在竞争条件下, T2A-1与LC和WRTZ相比均表现出显著的竞争优势。
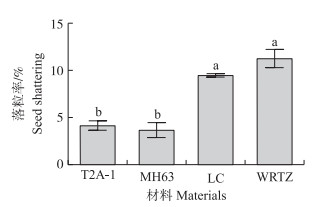
2.3 单种条件下T2A-1、MH63、LC和WRTZ的落粒率T2A-1的落粒率与MH63相比无显著差异, 均显著低于LC和WRTZ(图 3)。这说明抗性基因的导入没有影响MH63的落粒性。
|
图 3 T2A-1、MH63、LC和WRTZ的落粒率 Fig. 3 Seed shattering of T2A-1, MH63, LC and WRTZ |
T2A-1、MH63、LC和WRTZ的种子收获30 d后室内萌发试验结果表明, 培养10 d后的萌发率分别为93.5%、91.0%、90.0%和92.5%, T2A-1、MH63、LC和WRTZ种子的萌发率均没有差异。
2.4.2 活力保存能力经过埋藏后, 在浅埋和深埋条件下, 4种材料种子活力均明显下降。在浅埋2个月后, T2A-1、MH63、LC和WRTZ的种子失活率分别为64.0%、62.0%、72.5%和55.5%。其中T2A-1的种子失活率与MH63相似, 显著高于WRTZ, 但显著低于LC。在浅埋4个月和6个月后, T2A-1、MH63、LC和WRTZ的种子失活率均达到97.0%以上(图 4)。
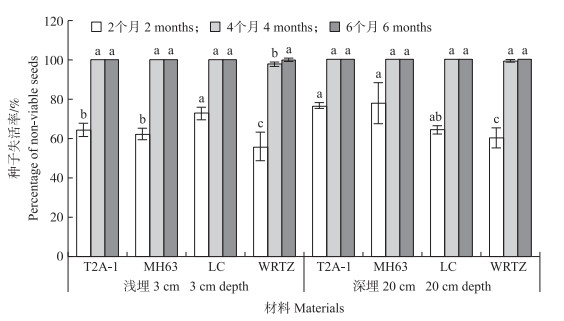
|
图 4 T2A-1、MH63、LC和WRTZ种子在埋藏不同时间和不同深度的失活率 Fig. 4 Percentage of non-viable seeds of T2A-1, MH63, LC and WRTZ buried at different times and different depth 不同字母表示相同埋藏深度和时间下显著差异。 The different letter in the same buried depth and same time indicate significant difference. |
在20 cm深埋2个月条件下, T2A-1、MH63、LC和WRTZ的种子失活率分别为76.5%、77.5%、64.0%和60.0%。T2A-1的种子失活率与LC和MH63相比均没有显著差异, 但显著高于WRTZ。在深埋4个月和6个月, T2A-1、MH63、LC和WRTZ的种子失活率均达99.0%以上(图 4)。
综上可知, T2A-1的种子活力保持能力与MH63相似, 二者均显著强于LC, 但均显著弱于杂草稻WRTZ。
3 讨论 3.1 T2A-1与受体水稻的生存竞争能力比较出苗率是评价转基因水稻杂草化的第1步, 环境因素(如土壤质量和种子在土壤中的深度)和种子本身的萌发特性决定着植物的出苗率[18]。本试验农田环境下, 复合性状转基因水稻T2A-1的出苗率与受体水稻MH63没有显著差异。这说明导入外源基因没有改变受体水稻的出苗率。从这一特性来说, 复合性状转基因水稻T2A-1没有自身杂草化的风险。这与黄鹞[19]研究复合性状转基因水稻T1c-19与受体‘明恢63’的出苗率结果一致。
竞争能力的强弱是判断转基因水稻自身杂草化风险的主要因子, 且转基因水稻的竞争能力与环境条件密切相关。本试验中, 在农田无杂草竞争的环境下T2A-1在单种和与MH63混种下的竞争能力与受体MH63相似, 说明在本试验条件下外源基因没有显著改变受体水稻的竞争能力, T2A-1具有较低的杂草化风险。李继坤[17]在单种自然虫压(16.3%)条件下发现复合性状转基因水稻T1c-19的相对适合度显著高于受体MH63, 在混种自然虫压(15.4%)下发现T1c-19的相对适合度与受体MH63相比没有显著差异。本试验中虽然没有调查靶标虫压, 但目测观察试验期间各试验材料均没有发生卷叶和白穗, 说明本试验靶标虫压非常低。这可能是环境(特别是不同的虫压)引起的综合结果。由于虫压对抗虫转基因水稻的竞争能力有显著影响, 还需进一步开展T2A-1在不同靶标虫压下竞争能力的研究。
从抽穗期来看, T2A-1与受体水稻MH63一致, 说明转基因没有改变受体水稻的抽穗期。这一结果与崔荣荣等[8]和黄鹞[19]的结果一致。种子的落粒率是水稻与杂草最大的区别之一[2, 20], 如果转基因水稻具有较高的落粒率, 那么将更有机会逃避收割并在自然环境中生存[21]。在评价转基因作物杂草化风险时, 落粒性是一项重要的考察指标。本试验发现复合性状转基因水稻T2A-1的落粒率与受体MH63相比没有显著差异, 这说明导入抗性基因没有影响MH63的落粒性, 从这方面来说, T2A-1的杂草化风险很低。这也与崔荣荣等[8]和黄鹞[19]的研究结果相似。
种子活力是反映种子在各种条件下具有的潜在萌发与出苗能力[22-23]。因此, 通过检测不同水稻种子的活力保存时间, 可以判断转基因水稻的种子是否具有更强的繁衍能力[7]。本试验结果显示T2A-1的种子活力保持能力与MH63相似, 说明导入外源基因没有显著改变受体水稻的种子生存能力, 这说明T2A-1的杂草化风险很低。这与黄鹞[19]发现T1c-19种子活力保持能力与受体MH63没有显著差异的结果一致, 但与崔荣荣等[8]发现抗草铵膦转基因水稻‘明恢86B’的种子活力保持能力显著低于受体‘明恢86’的结果不一致。这可能是试验时的环境条件以及转基因水稻自身基因型不同导致的。
考察转基因水稻能否在环境中自生繁衍是判断转基因作物是否具有杂草化潜力的重要因子。崔荣荣[8]和黄鹞[19]发现抗草铵膦转基因水稻86B和受体水稻‘明恢86’以及复合性状转基因水稻的B2A68、T1c-19和受体水稻MH63的各小区中均无自生苗出现。本试验中没有详细调查T2A-1与MH63产生自生苗的情况, 还有待于进一步开展T2A-1能否形成自生苗的试验, 同时在试验过程中设置防鸟网, 防止种子被鸟取食, 影响试验结果。
3.2 T2A-1与常规稻的生存竞争能力比较在自然农田环境下, T2A-1在相同处理(单种或混种)下的出苗率与本地常规稻均没有显著差异。从这方面来说, 复合性状转基因水稻T2A-1没有自身杂草化的风险。前人也有类似的研究结果, 如黄鹞[19]在农田环境下发现T1c-19在相同处理下的出苗率与当地常规杂交稻‘丰两优香1号’相比没有显著差异。
T2A-1的落粒率显著低于南京本地常规稻LC, 说明T2A-1的杂草化风险很低。崔荣荣等[8]发现抗草铵膦转基因水稻‘明恢86B’的落粒率同常规杂交稻‘汕优63’相当, 黄鹞等[24]发现复合性状转基因水稻B2A68的落粒率显著高于常规稻‘宁粳4号’, Huang等[2]发现复合性状转基因水稻T1c-19的落粒率显著低于常规杂交稻‘丰两优香1’号。上述研究结果的差异与转基因水稻和常规水稻自身的特点相关。
T2A-1的种子活力保持能力显著强于本地常规稻LC, 说明‘T2A-1’存在一定的杂草化风险。崔荣荣等[8]和黄鹞[19]的研究结果表明, 抗草铵膦转基因水稻‘明恢86B’和复合性状转基因水稻B2A68的种子活力保持能力显著低于常规杂交稻‘汕优63’和常规稻‘宁粳4号’。Huang等[2]还发现T1c-19种子活力保持能力与常规稻‘丰两优香1号’相似。这说明转基因水稻的种子活力保持能力与自身的基因型以及环境条件密切相关。
3.3 T2A-1与杂草稻的生存竞争能力比较在自然农田环境下, 复合性状转基因水稻T2A-1在相同处理(单种和混种)下的出苗率与泰州杂草稻(WRTZ)相比均没有显著差异, 从这方面来说, T2A-1的杂草化风险与杂草稻相当。在单种和混种条件下, T2A-1的剑叶面积、单株干生物量、穗长、百粒质量和单株产量均显著高于WRTZ, 说明在此试验条件下T2A-1具有比泰州杂草稻更强的竞争能力, 但T2A-1的落粒率和种子活力保持能力显著低于WRTZ。从这两方面来说, T2A-1杂草化风险低于WRTZ。虽然本试验未调查WRTZ的自生苗, 但杂草稻作为杂草具有自我繁衍能力, 因此WRTZ比T2A-1应具有更强杂草性。综上所述, 虽然与WRTZ相比, T2A-1在剑叶面积、单株干生物量、穗长、百粒质量和单株产量方面具有优势, 但从杂草的本质特性自我延续性来看, 显著低于WRTZ。如果T2A-1环境释放, T2A-1与WRTZ发生基因漂移, T2A-1的优势性状可能会在杂交后代中体现, 形成具有更强竞争能力的杂交后代, 给水稻田杂草稻的防除带来更大的困难。
尽管T2A-1与MH63、LC和WRTZ相比存在一定的竞争优势, 但因其落粒性低、种子活力保持能力弱, 因此潜在杂草化的可能性不大。然而, 本试验以及其他转基因水稻生存竞争能力报道均未设置虫压和除草剂选择压, 因此有待于开展在不同靶标虫压和除草剂选择压下的竞争能力试验。在种子活力保存能力的试验中, 选取的样本量较少, 可能会对结果造成一定的影响。在实际种植T2A-1过程中, 散落在田间的种子量远远超过本试验设置的量, 因此还应研究大样本T2A-1的种子活力保存能力。另外, 种子的发芽势也是评价竞争力的重要指标[25]。如果转基因水稻的种子能在更短的时间内萌发, 就能更快地抢占生存空间, 从而建立竞争优势。本试验未对T2A-1的发芽势进行评价, 这也是不足之处。在评价转基因水稻风险时, 单纯考虑1个或几个因素的影响是不够的, 全面了解转基因水稻在不同环境下的生存竞争能力, 将有助于获得更加充分的风险评估资料。因此, 仍需要进一步对复合性状转基因水稻T2A-1在不同环境压力(如除草剂选择压和虫压等)、不同地区等条件下的杂草化风险进行深入评估。
| [1] |
Snow A A, Culley T M, Campbell L G, et al. Long-term persistence of crop alleles in weedy populations of wild radish(Raphanus raphanistrum)[J]. New Phytologist, 2010, 186(2): 537-548. DOI:10.1111/j.1469-8137.2009.03172.x |
| [2] |
Huang Y, Li J K, Qiang S, et al. Transgenic restorer rice line T1c-19 with stacked cry1C*/bar genes has low weediness potential without selection pressure[J]. Journal of Integrative Agriculture, 2016, 15(5): 1046-1058. DOI:10.1016/S2095-3119(15)61219-9 |
| [3] |
张晶旭.杂交水稻参与杂草稻起源的证据及抗除草剂转基因水稻生态风险研究[D].南京: 南京农业大学, 2015. Zhang J X. Evidence of hybrid rice's involvement in the origin of weedy rice and ecological risk of herbicide resistant transgenic rice[D]. Nanjing: Nanjing Agricultural University, 2015(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10307-1017044230.htm |
| [4] |
Nakai S C, Hoshikawa K, Shimono A, et al. Transportability of confined field trial data from cultivation to import countries for environmental risk assessment of genetically modified crops[J]. Transgenic Research, 2015, 24(6): 929-944. DOI:10.1007/s11248-015-9892-6 |
| [5] |
Lu B R, Yang C. Gene flow from genetically modified rice to its wild relatives:assessing potential ecological consequences[J]. Biotechnology Advances, 2009, 27(6): 1083-1091. DOI:10.1016/j.biotechadv.2009.05.018 |
| [6] |
Liu C Y, Li J J, Gao J H, et al. A built-in mechanism to mitigate the spread of insect-resistance and herbicide-tolerance transgenes into weedy rice populations[J]. PLoS One, 2012, 7(2): e31625. DOI:10.1371/journal.pone.0031625 |
| [7] |
Shivrain V K, Burgos N R, Anders M M, et al. Gene flow between ClearfieldTM rice and red rice[J]. Crop Protection, 2007, 26(3): 349-356. DOI:10.1016/j.cropro.2005.09.019 |
| [8] |
崔荣荣, 韦颖, 孟攀潘, 等. 抗草铵膦转基因水稻明恢86B杂草化潜力评价[J]. 水稻科学, 2012, 26(4): 467-475. Cui R R, Wei Y, Meng P P, et al. Assessmenton potential weediness of transgenic glufosinate-resistant rice Minghui86B[J]. Chinese Journal of Rice Science, 2012, 26(4): 467-475 (in Chinese with English abstract). |
| [9] |
余柳青, 渠开山, 周勇军, 等. 抗除草剂转基因水稻对稻田杂草种群的影响[J]. 中国水稻科学, 2005, 19(1): 68-73. Yu L Q, Qu K S, Zhou Y J, et al. Effect of transgenic rice with glufosinate-resistance on weed populations in paddy field[J]. Chinese Journal of Rice Science, 2005, 19(1): 68-73 (in Chinese with English abstract). |
| [10] |
Jung H I, Kuk Y I, Kim H Y, et al. Resistance levels and fitness of protoporphyrinogen oxidase(PROTOX)inhibitor-resistant transgenic rice in paddy fields[J]. Field Crops Research, 2010, 115(2): 125-131. DOI:10.1016/j.fcr.2009.10.010 |
| [11] |
Chun Y J, Kim D I, Park K W, et al. Fitness cost and competitive ability of transgenic herbicide-tolerant rice expressing a protoporphyrinogen oxidase gene[J]. Journal of Ecology and Environment, 2013, 36(1): 39-47. DOI:10.5141/ecoenv.2013.005 |
| [12] |
Tu J M, Zhang G A, Datta K, et al. Field performance of transgenicelite commercial hybrid rice expressing Bacillus thuringiensis δ-endotoxin[J]. Nature Biotechnology, 2000, 18(10): 1101-1104. DOI:10.1038/80310 |
| [13] |
Chen L Y, Snow A A, Wang F, et al. Effects of insect-resistance transgenes on fecundity in rice(Oryza sativa, Poaceae):a test for underlying costs[J]. American Journal of Botany, 2006, 93(1): 94-101. DOI:10.3732/ajb.93.1.94 |
| [14] |
张富丽, 刘勇, 佟洪金, 等. 不同虫压下转Bt基因水稻与非转基因水稻生态适合度差异[J]. 应用与环境生物学报, 2012, 18(1): 35-41. Zhang F L, Liu Y, Tong H J, et al. Differences in ecological fitness between Bt transgenic rice and conventional rice under insect-infestation pressures[J]. Chinese Journal of Applied and Environmental Biology, 2012, 18(1): 35-41 (in Chinese with English abstract). |
| [15] |
Chen H, Tang W, Xu C G, et al. Transgenic indica rice plants harboring a synthetic cry2A* gene of Bacillus thuringiensis exhibit enhanced resistance against lepidopteran rice pests[J]. Theoretical and Applied Genetics, 2005, 111(7): 1330-1337. DOI:10.1007/s00122-005-0062-8 |
| [16] |
Yang Y J, He J J, Dong B Q, et al. Effects of two Bt rice lines T2A-1 and T1C-19 on the ecological fitness and detoxification enzymes of Nilaparvata lugens(Hemiptera:Delphacidae)from different populations[J]. Journal of Economic Entomology, 2012, 106(4): 1887-1893. |
| [17] |
李继坤.复合性状转cry1C*/bar基因水稻Tlc-19向杂草稻的基因漂移及杂交后代适合度的研究[D].南京: 南京农业大学, 2016. Li J K. Study on the gene flow of hybrid rice tlc-19 transformed from cry1C*/bar to weedy rice and the fitness of hybrid progeny[D]. Nanjing: Nanjing Agricultural University, 2016(in Chinese with English abstract). |
| [18] |
Martinkova Z, Honek A. Asymmetrical intraspecific competition in Echinochloa crus-galli is related to differences in the timing of seedling emergence and seedling vigour[J]. Plant Ecology, 2011, 212(11): 1831-1839. DOI:10.1007/s11258-011-9953-8 |
| [19] |
黄鹞.两种抗虫抗除草剂复合性状转基因水稻的杂草化潜力研究[D].南京: 南京农业大学, 2015. Huang Y. Study on the weed potential of two insect resistant and herbicide resistant transgenic rice[D]. Nanjing: Nanjing Agricultural University, 2015(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10307-1017045610.htm |
| [20] |
Lin Z W, Griffith M E, Li X R, et al. Origin of seed shattering in rice(Oryza sativa L.)[J]. Planta, 2007, 226(1): 11-20. DOI:10.1007/s00425-006-0460-4 |
| [21] |
杨绍华, 杨玲, 李建君, 等. 水稻落粒性的研究进展[J]. 天津农业科学, 2011, 17(3): 112-114. Yang S H, Yang L, Li J J, et al. Research progress of the seed shattering in rice[J]. Tianjin Agricultural Sciences, 2011, 17(3): 112-114 (in Chinese with English abstract). |
| [22] |
Song X L, Wang Z, Qiang S. Agronomic performance of F1, F2 and F3 hybrids between weedy rice and transgenic glufosinate-resistant rice[J]. Pest Management Science, 2011, 67(8): 921-931. DOI:10.1002/ps.2132 |
| [23] |
宋小玲, 强胜, 彭于发. 抗草甘膦转基因大豆(Glycine mac L. Merri)杂草性评价的试验实例[J]. 中国农业科学, 2009, 42(1): 145-153. Song X L, Qiang S, Peng Y F. An experimental case of safety assessment of weediness of transgenic glyphosate-resistant soybean(Glycine mac L. Merri)[J]. Scientia Agricultura Sinica, 2009, 42(1): 145-153 (in Chinese with English abstract). |
| [24] |
黄鹞, 王建, 戴伟民, 等. 复合性状转基因水稻B2A68在南京地区杂草化的风险评估[J]. 杂草科学, 2014, 32(1): 60-68. Huang Y, Wang J, Dai W M, et al. The risk assessment of potential weediness of gene stacked rice B2A68 in Nanjing area[J]. Weed Science, 2014, 32(1): 60-68 (in Chinese with English abstract). |
| [25] |
李伟, 郭建夫, 袁红旭, 等. 抗真菌转基因水稻生态适合度评价[J]. 生态学报, 2014, 34(10): 2581-2588. Li W, Guo J F, Yuan H X, et al. Assessment on the ecological fitness of anti-fungal transgenic rice[J]. Acta Ecologica Sinica, 2014, 34(10): 2581-2588 (in Chinese with English abstract). |




