文章信息
- 徐园园, 李竹帛, 王惠玉, 李林, 王镇, 李英, 侯喜林, 刘同坤
- XU Yuanyuan, LI Zhubo, WANG Huiyu, LI Lin, WANG Zhen, LI Ying, HOU Xilin, LIU Tongkun
- 不结球白菜BrABF3基因的克隆与功能分析
- Cloning and function analysis of BrABF3 gene in non-heading Chinese cabbage
- 南京农业大学学报, 2020, 43(5): 838-845
- Journal of Nanjing Agricultural University, 2020, 43(5): 838-845.
- http://dx.doi.org/10.7685/jnau.201912066
-
文章历史
- 收稿日期: 2019-12-30
2. 苏州农业职业技术学院, 江苏 苏州 215008
2. Suzhou Polytechnic Institute of Agriculture, Suzhou 215008, China
不结球白菜(Brassica rapa ssp. chinensis)原产于中国, 现已逐渐成为世界性蔬菜, 深受各国消费者喜爱[1]。不同品种的不结球白菜在开花时间上有很大差异。抽薹开花是受多基因控制的数量性状, 也是不结球白菜很重要的农艺性状之一[2-3]。但是, 在实际生产中早期抽薹会严重影响不结球白菜产量和品质, 因此从分子水平来研究不结球白菜的开花调控机制极其重要[4]。
十字花科植物花的形成受内源因素和外界环境的共同作用, 开花基因和植物激素在成花过程中发挥着十分重要的作用[5]。不结球白菜与模式植物拟南芥(Arabidopsis thaliana)均为十字花科植物, 因此拟南芥成花调控机制的研究对不结球白菜开花的研究有很大的借鉴意义。研究表明, 拟南芥开花调控的主要途径有:春化途径、光周期途径、赤霉素途径、自主途径、温敏途径和年龄途径[6-7]。
植物激素脱落酸(ABA)参与植物生长发育的各个方面, 包括种子成熟与休眠、植物开花与果实成熟等[8]。ABA对植物开花的作用最初是基于ABA缺陷型突变体的早期开花表型提出的, 表明ABA抑制开花[9]。Razem等[10]的研究证明ABA通过上调开花抑制因子FLC(FLOWERING LOCUS C)来延迟开花。也有研究表明, ABA能激活成花基因FT(FLOWERING LOCUS T)以促进开花[11]。由此可知, ABA对植物开花具有正调节和负调节的作用。
ABF3(ABSCISIC ACID RESPONSIVE ELEMENT-BINDING FACTOR 3)是ABFs/ABRE转录因子中的成员, 属于bZIP转录因子A亚族[12]。ABF3基因有ABF1、ABF2/AREB1、ABF4/AREB2 等3个同源基因, 能够与ABA诱导基因的启动子区域结合, 共同调节下游基因的表达, 响应多种逆境胁迫信号[12-13]。研究表明, ABF3 基因在拟南芥中过表达, 可明显提高其抗旱、抗寒、抗氧化和耐高温能力[13]。除拟南芥外, ABF3 基因超表达还能够提高烟草[14]、莴苣[15]、水稻[16]、谷子[17]、大豆[18]等植物的耐旱性。
目前, 关于ABF3 基因在植物开花中的研究还比较少见。因此, 本研究从不结球白菜‘苏州青’品种中获得BrABF3 基因全长, 对BrABF3进行亚细胞定位分析, 预测其启动子motif元件, 并分析BrABF3 在不同品种不结球白菜中不同生长时期的表达情况, 旨在进一步研究BrABF3 基因在不结球白菜开花中的作用, 为进一步提高不结球白菜的产量和品质奠定基础。
1 材料与方法 1.1 不结球白菜BrABF3 基因的克隆供试材料为不结球白菜品种‘苏州青’‘CX-49’和‘五月慢’, 由南京农业大学白菜系统生物学实验室提供。
在白菜数据库中找到BrABF3 的序列, 用Primer Premier 5.0软件设计BrABF3 -F/R等引物, 引物序列见表 1。用RNA Simple Total RNA Kit(TaKaRa)提取‘苏州青’叶片总RNA, 用PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit(TaKaRa)反转录成cDNA进行PCR扩增。反应体系(20 μL):cDNA模板1 μL, 正、反引物各1 μL, 2×Primer STAR Max DNA聚合酶10 μL, ddH2O 7 μL。反应程序:95 ℃ 5 min; 95 ℃ 30 s, 58 ℃ 2 min, 72 ℃ 10 min, 30个循环; 4 ℃保存。PCR产物用10 g · L-1琼脂糖凝胶电泳进行检测。采用凝胶提取试剂盒(天根生化科技有限公司)回收目的片段, 并将目的片段连接到pMD18-T载体(TaKaRa)后, 转化至大肠杆菌DH5α感受态细胞(全式金生物技术有限公司)中, 挑取阳性单克隆并进行PCR鉴定后, 送至南京擎科生物科技有限公司测序。
| 引物名称Primer name | 引物序列Primer sequence(5′→3′) |
| BrABF3-F/R | ATGGGTTCTCAATTTAACTT/CTATAGCTTCTGCTCTTTGT |
| gateway-BrABF3-F/R | CACCATGGGTTCTCAATTTAACTT/CTATAGCTTCTGCTCTTTGT |
| qBrABF3-F/R | AAGGACGATGACGATGGAAG/GGCTGTTCCCTAACCACACC |
| qIPP2-F/R | GGAGCTGAGAGATTCCGTTG/GAACCACCACTGAGGACGAT |
从NCBI数据库中下载不同物种ABF3蛋白的氨基酸序列, 用DNAMAN 6.0软件对氨基酸序列进行比对分析。采用MEGA 7.0软件对氨基酸进行系统进化树分析, 研究BrABF3在进化过程中的保守性以及与其他物种的亲缘关系。
1.3 gateway技术构建载体 1.3.1 BrABF3 基因片段的PCR扩增采用gateway技术构建BrABF3 载体, 在正向引物的5′端加上CACC序列, 设计gateway引物(表 1), 并用高保真酶进行扩增。PCR反应程序:98 ℃ 30 s, 98 ℃ 30 s, 57 ℃ 30 s, 72 ℃ 30 s, 35个循环; 72 ℃ 10 min, 4 ℃保温。PCR产物用10 g · L-1琼脂糖凝胶电泳进行检测, 切胶回收目的片段。
1.3.2 BP重组反应将回收产物与入门载体pENTRTM/D-TOPOⓇ进行重组反应。反应体系为6.0 μL, 其中含目的基因PCR产物2.0 μL, pENTRTM/D-TOPOⓇ载体1.0 μL, Salt Solution 1.0 μL, Sterile Water 2.0 μL。离心后将混合体系于25 ℃水浴30 min。将反应产物转化至DH5α感受态细胞, 然后均匀涂布于含卡那霉素(50 mg · L-1)的LB平板上, 再将平板置于37 ℃培养箱中培养16 h; 挑取单克隆在含有50 mg · L-1的LB培养基中振荡培养, 提取质粒进行PCR检测; 将片段大小正确的扩增产物进行测序, 结果正确即可获得重组质粒pENTR/D-TOPO-BrABF3 。
1.3.3 LR重组反应用限制性内切酶Mlu对重组质粒pENTR/D-TOPO-BrABF3 进行单酶切, 并与pMDC43进行LR重组反应。反应总体系为3.0 μL, 其中含线性化的pENTR/D-TOPO-BrABF3 1.0 μL, 目的载体pMDC43 1.0 μL, GatewayTM LR ClonaseⓇ Ⅱ Enzyme Mix 1.0 μL。离心后将混合体系于25 ℃水浴30 min。将反应产物转化DH5α感受态细胞后均匀涂布于含卡那霉素(50 mg · L-1)的LB平板上, 再将平板置于37 ℃培养箱中培养16 h; 挑取单克隆在含有50 mg · L-1的LB培养基中振荡培养, 提取质粒进行PCR检测; 将片段大小正确的扩增产物进行测序, 获得亚细胞定位载体pMDC43-BrABF3 -GFP。
1.4 BrABF3亚细胞定位分析采用液氮冻融法将构建好的融合表达载体pMDC43-BrABF3 -GFP转入农杆菌GV3101。将载体菌液均匀涂布于含50 mg · L-1卡那霉素和100 mg · L-1利福平的LB平板上, 于28 ℃培养箱中倒置培养48 h后, 挑取阳性单克隆进行PCR检测。对片段大小正确的PCR产物进行测序, 测序结果正确的即为pMDC43-BrABF3 -GFP转化成功的GV3101菌株。
将检测正确的菌液接种至含有卡那霉素和利福平的LB培养基中, 28 ℃ 180 r · min-1振荡培养20 h; 取1%(体积分数)的菌液接种到相同的LB培养基中, 28 ℃ 180 r · min-1振荡培养至D600为1.0, 4 000 r · min-1离心5 min后收集菌体; 用注射缓冲液[含100 mmol · L-1 MgCl2、10 mmol · L-1 MES(pH5.7)、150 μmol · L-1乙酰丁香酮]重悬菌体至D600为0.8, 室温下放置5 h; 用注射器将含pMDC43-BrABF3 -GFP的农杆菌菌液注射入30 d苗龄的本氏烟草叶片背面, 用H2B-RFP进行细胞核标记。将注射后的烟草置于人工气候室培养3 d, 在激光共聚焦显微镜下观察BrABF3蛋白的亚细胞定位。
1.5 BrABF3 启动子序列分析利用PlantCARE在线软件对BrABF3 基因转录起始位点前1 499 bp长度的启动子序列进行motif元件分析, 寻找该启动子保守区域中潜在的转录调控元件。
1.6 开花时间统计分析对不结球白菜品种‘CX-49’不同组织(根、茎、叶)BrABF3 基因的表达进行RT-qPCR分析, 并用ABA溶液喷施BrABF3 基因稳定表达的不结球白菜叶片。‘CX-49’播种1个月后, 用100 μmol · L-1 ABA溶液喷施叶片, 对照组喷施相同体积的无菌水。每隔2 d喷1次, 共喷6次, 直至开花, 观察不结球白菜植株开花情况, 记录每株开花时的叶片数。试验组和对照组各统计10株, 计算开花时叶片数的平均值。采用Excel 2016软件绘图。
1.7 BrABF3 基因的RT-qPCR分析待ABA处理的‘CX-49’开花时, 分别取处理组和对照组叶片, 用Simple Total RNA Kit提取其总RNA, 用PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit反转录成cDNA, 用无菌水稀释5倍后作为模板。以不结球白菜IPP 2 基因作为内标基因, 设计荧光定量PCR引物, 引物序列见表 1。RT-qPCR的反应体系为20 μL: SYBR Premix Ex Taq 10 μL, cDNA 1 μL, 正、反引物各1 μL, ddH2O 7 μL。3次重复。采用2-ΔΔCT法计算BrABF3 的相对表达量。
以不结球白菜‘苏州青’和‘五月慢’2个品种为材料, 将其种植于16 h光照/8 h黑暗、22 ℃的人工气候室中, 分别在幼苗期、基叶期、开花前期、抽薹期和开花期5个时期取样, 提取总RNA, 反转录和实时荧光定量PCR操作过程同上。
2 结果与分析 2.1 不结球白菜BrABF3 基因的克隆以不结球白菜‘苏州青’的cDNA为模板, 通过同源克隆获得目的基因全长。通过测序和分析基因序列可知, BrABF3 基因含有1个长度为1 242 bp的开放阅读框(ORF), 编码413个氨基酸(图 1), GenBank登录号为MT300106。

|
图 1 不结球白菜BrABF3 基因的核苷酸序列及其编码的氨基酸序列 Fig. 1 Nucleotide sequence of BrABF3 gene and its encoded amino acid sequence in non-heading Chinese cabbage *表示终止密码子。 * represents stop codon. |
从NCBI网站中下载甘蓝型油菜、萝卜、拟南芥、山萮菜、亚麻荠和野甘蓝(原变种)6个物种的ABF3氨基酸序列, 用DNAMAN 6.0软件对所得的序列进行氨基酸序列比对(图 2-A), 结果表明不结球白菜ABF3蛋白与甘蓝型油菜、萝卜、拟南芥、山萮菜、亚麻芥及野甘蓝(原变种)的同源性分别为99.27%、87.67%、75.44%、75.93%、72.89%、95.67%。根据不同物种ABF3蛋白的氨基酸序列构建进化树(图 2-B), 结果表明不结球白菜与甘蓝型油菜的亲缘关系比较近。
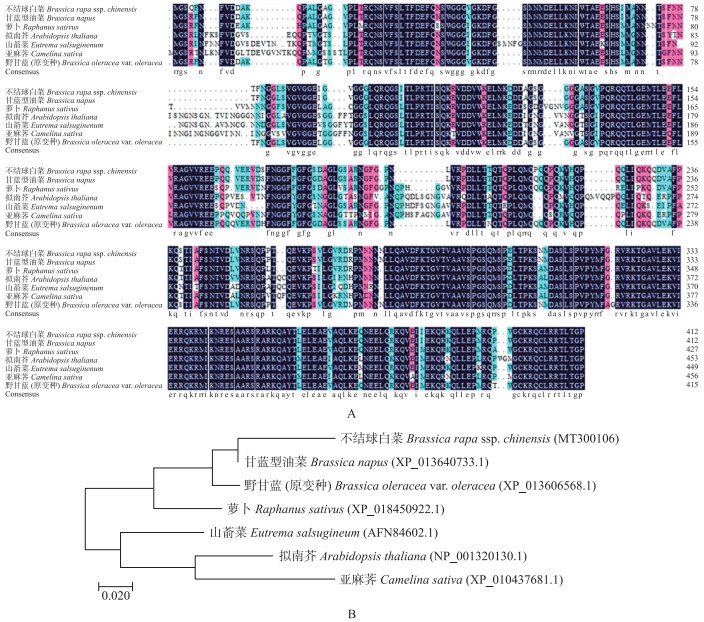
|
图 2 不结球白菜与其他物种ABF3同源氨基酸序列比对(A)及进化树分析(B) Fig. 2 The alignment of amino acid of ABF3 from non-heading Chinese cabbage and other plants(A)and phylogentic tree analysis(B) |
将含有pMDC43-BrABF3 -GFP的农杆菌注射烟草48 h后, 在激光共聚焦显微镜下观察, 发现BrABF3形成融合蛋白的GFP在细胞核上发光, 并且绿色荧光与核标签的红色荧光重合(图 3), 说明BrABF3蛋白定位在细胞核上, 该基因可能具有转录因子的功能。
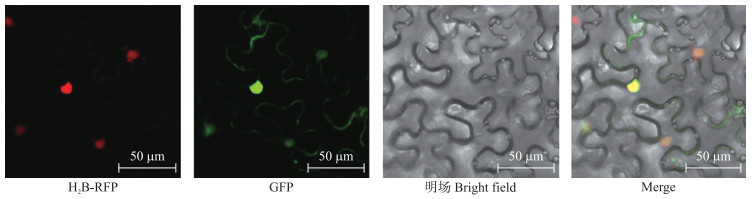
|
图 3 BrABF3在本氏烟草叶片中的亚细胞定位 Fig. 3 Subcellular localization of BrABF3 in leaves of Nicotiana benthamiana H2B-RFP:H2B-RFP激发光下的红色荧光信号; GFP:GFP激发光下的绿色荧光信号; Merge:GFP、H2B-RFP和明场的叠加。 H2B-RFP:The red fluorescence signals of H2B-RFP; GFP:The green fluorescence signals; Merge:The merge of GFP, H2B-RFP and bright field. |
PlantCARE分析结果(表 2)表明:BrABF3启动子序列中除包含大量启动子基本核心元件TATA-box和CAAT-box外, 还含有12个参与光响应的元件(ATCT-motif、I-box、MRE、LAMP-element、GT1-motif、Box 4、G-box、Box Ⅱ、GATA-motif、ACE、TCT-motif和GA-motif)、4个参与植物激素反应的元件(包括生长素响应元件TGA-element、脱落酸顺式作用响应元件ABRE、水杨酸顺式作用响应元件TCA-element和茉莉酸顺式作用响应元件TGACG-motif)、参与低温反应的顺式作用响应元件(LTR)、参与防御和应激反应的顺式作用响应元件(TC-rich repeats)和3个其他顺式作用元件。分析结果表明BrABF3 基因的表达可能受光照、植物激素和逆境胁迫等环境条件的调控。
| 位点名称 Site name |
基序 Motif sequence |
位点功能 Function of site |
| TATA-box | ATTATA/TATATA/ATATAT | 转录起始-30核心启动子元件 Core promoter element around -30 of transcription start |
| GAAT-box | CCAAT/CAAT/CAAAT | 启动子和增强子区的一般顺式作用元件 Common cis-acting element in promoter and enhancer regions |
| ATCT-motif | AATCTAATCC | 参与部分光响应的保守DNA模块元件 Part of a conserved DNA module involved in light responsiveness |
| I-box | TAGATAACC | 部分光响应元件 Part of a light responsive element |
| MRE | AACCTAA | 参与光反应的MYB结合位点 MYB binding site involved in light responsiveness |
| LAMP-element | CTTTATCA | 部分光响应元件 Part of a light responsive element |
| GT1-motif | GGTTAA | 光响应元件 Light responsive element |
| Box 4 | ATTAAT | 参与部分光响应的保守DNA模块元件 Part of a conserved DNA module involved in light responsiveness |
| G-box | CACGTT | 光响应顺式作用调控元件 cis-acting regulatory element involved in light responsiveness |
| Box Ⅱ | CCACGTGGC | 部分光响应元件 Part of a light responsive element |
| GATA-motif | AAGATAAGATT | 部分光响应元件 Part of a light responsive element |
| ACE | CTAACGTATT | 参与光反应的顺式作用元件 cis-acting element involved in light responsiveness |
| TCT-motif | TCTTAC | 部分光响应元件 Part of a light responsive element |
| GA-motif | ATAGATAA | 部分光响应元件 Part of a light responsive element |
| TGA-element | AACGAC | 生长素响应元件 Auxin-responsive element |
| ABRE | GCCGCGTGGC | 脱落酸顺式作用响应元件 cis-acting element involved in the abscisic acid responsiveness |
| TGACG-motif | TGACG | 茉莉酸顺式作用响应元件 cis-acting regulatory element involved in the MeJA responsiveness |
| TCA-element | CCATCTTTTT | 水杨酸顺式作用响应元件 cis-acting element involved in salicylic acid responsiveness |
| LTR | CCGAAA | 参与低温反应的顺式作用响应元件 cis-acting element involved in low-temperature responsiveness |
| TC-rich repeats | GTTTTCTTAC | 参与防御和应激反应的顺式作用响应元件 cis-acting element involved in defense and stress responsiveness |
| MSA-like | (T/C)C(T/C)AACGG(T/C)(T/C)A | 参与细胞周期调控的顺式作用元件 cis-acting element involved in cell cycle regulation |
| MBSI | AAAAAAC(G/C)GTTA | 参与类黄酮生物合成基因调控的MYB结合位点 Binding site involved in flavonoid biosynthetic genes regulation |
| ARE | AAACCA | 厌氧诱导必不可少的顺式作用调节元件 cis-acting regulatory element essential for the anaerobic induction |
开花时间统计分析结果表明, ABA处理后, 不结球白菜‘CX-49’开花时的基叶数为6片左右, 对照组为10片左右, 即喷施ABA的试验组比对照组少4片左右, 且差异显著, 说明ABA可以使不结球白菜提前开花。
2.6 不结球白菜BrABF3 基因的RT-qPCR分析由图 4-A可知:BrABF3 基因在叶片中能够稳定表达。如图 4-B所示:ABA试验组中BrABF3 基因的表达量极显著高于对照组(P < 0.01), 表明BrABF3 基因受ABA的诱导表达。‘苏州青’和‘五月慢’是不结球白菜的2个不同的春化型品种, 在实际生产中, ‘苏州青’开花时间明显早于‘五月慢’。BrABF3 基因的相对表达量在2个品种开花前差异显著(图 4-C), 表明BrABF3 基因的表达可能与开花时间有关。
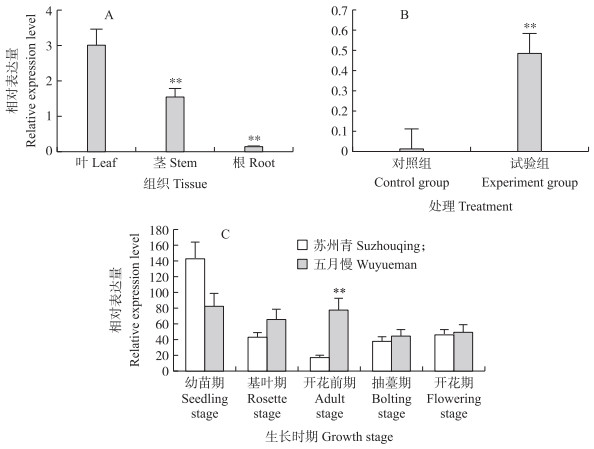
|
图 4 不结球白菜中BrABF3 基因的相对表达量 Fig. 4 The relative expression level of BrABF3 gene in non-heading Chinese cabbage A.‘CX-49’不同组织中BrABF3 基因的相对表达量; B. ABA处理‘CX-49’后BrABF3 基因的相对表达量; C.不结球白菜‘苏州青’和‘五月慢’在不同的生长时期中BrABF3 基因的相对表达量。* *P < 0.01。 A.The relative expression of BrABF3 gene in different tissues of 'CX-49';B.The relative expression level of BrABF3 gene in'CX-49'after ABA-treated; C.The relative expression level of BrABF3 gene during the different growth stages in'Suzhouqing'and'Wuyueman'. * *P < 0.01. |
开花是高等植物从营养生长阶段向生殖生长阶段过渡必不可少的过程[19]。ABA是植物体内重要的内源激素之一, 外源ABA可诱导植物自身产生内源ABA, 对相关基因的表达产生影响, 从而增强植物的抗逆性。有研究发现, 外源ABA的喷施会使拟南芥组织中ABF基因上调, 增强拟南芥的耐盐性[20]。本研究结果表明, BrABF3 基因启动子序列含有参与脱落酸反应的顺式作用元件ABRE, 说明ABA可能通过ABRE元件调控BrABF3 基因的表达, 具体调控机制有待进一步研究。通过亚细胞定位可知, BrABF3蛋白定位在细胞核上, 这可能与其具有转录因子功能有关。对BrABF3 启动子序列分析发现, BrABF3 基因的表达可能受光、植物激素和逆境胁迫等条件的调控。在不结球白菜不同开花时期‘苏州青’和‘五月慢’开花前BrABF3 的相对表达量差异显著。ABA处理可以使不结球白菜的开花时间提前, 并且BrABF3 基因受ABA的诱导表达。开花关键基因CO、FT等也在叶脉中表达[21], 但BrABF3 是否与这些基因间存在互作或者相互调控还需要深入研究。
ABF是bZIP转录因子, 可调节含ABRE元件的基因对ABA的反应[22], bZIP转录因子主要由2部分组成:一个是碱性结构域, 包括20个氨基酸, 识别特定序列的DNA序列并与之结合; 另一个是亮氨酸拉链区域, 该区域的亮氨酸会形成一个α螺旋结构, 作用于特异DNA序列, 形成结合前的二聚体。bZIP蛋白通过与含有A-box(TACGTA)、C-box(CACGTC)和G-box(CACGTG)这些顺式元件的启动子发生作用进行基因表达的调控[23]。除了含有典型的bZIP结构域, AREB/ABF类转录因子还具有4个保守结构域, 包括位于N端的C1、C2和C3的转录激活结构域和位于C端的C4结构域。作为C端的保守结构域, C4结构域能够抑制蛋白水解酶KEG对ABF3的水解[24]。有研究表明, ABF3 基因能与NF-Y复合物相互作用, 并与SOC1 (SUPPRESSOR OF OVEREXPRESSION OF CONSTANS 1)启动子区域结合, 从而促进开花[25]。SOC1 在所有营养和生殖组织中都普遍存在, 当它在脉管组织或茎尖中表达时会加速开花[26-27], 这与ABA信号的调节因子ABI3(ABSCISIC ACID-INSENSITIVE 3)、ABI4(ABSCISIC ACID-INSENSITIVE 4)、ABI5(ABSCISIC ACID-INSENSITIVE 5) 在开花时间上起阻遏作用[28-31]结果相反, 也进一步说明了ABA对开花时间兼具有正调节和负调节的双重作用。
本研究通过结合前人对ABF3 基因的研究, 以不结球白菜BrABF3 作为研究对象, 推测该基因不仅参与植物ABA信号途径的胁迫反应, 也能调节植物的开花时间。该结论对进一步研究ABA介导的不结球白菜开花具有较大的参考价值。
| [1] |
侯喜林. 不结球白菜育种研究新进展[J]. 南京农业大学学报, 2003, 26(4): 111-115. Hou X L. Advances in breeding of non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 2003, 26(4): 111-115 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2003.04.026 |
| [2] |
张学铭.白菜类作物抽薹开花的遗传分析[D].北京: 中国农业科学院, 2014. Zhang X M. Genetic analysis of the bolting and flowering time in Brassica rapa[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-82101-1014326481.htm |
| [3] |
张韬, 王超. 春甘蓝抽薹特性的研究(Ⅱ):遗传特性分析[J]. 东北农业大学学报, 2003, 34(4): 408-413. Zhang T, Wang C. Study on inheritance of bolting character in spring cabbage[J]. Journal of Northeast Agricultural University, 2003, 34(4): 408-413 (in Chinese with English abstract). |
| [4] |
户秋稳.优质晚抽薹四倍体不结球白菜创制及生物学特性研究[D].南京: 南京农业大学, 2015. Hu Q W. The creating and biological property research of high quality and late-bolting tetraploid non-heading Chinese cabbage[D]. Nanjing: Nanjing Agricultural University, 2015(in Chinese with English abstract). http://d.wanfangdata.com.cn/thesis/Y3184158 |
| [5] |
王小权, 李晟男, 张俊利, 等. 拟南芥和十字花科蔬菜花序发育调控机制研究进展[J]. 园艺学报, 2018, 45(9): 1727-1738. Wang X Q, Li S N, Zhang J L, et al. Progress in regulation mechanism of inflorescence development in Arabidopsis and cruciferous vegetables[J]. Acta Horticulturae Sinica, 2018, 45(9): 1727-1738 (in Chinese with English abstract). |
| [6] |
Song Y H, Shim J S, Kinmonth-Schultz H A, et al. Photoperiodic flowering:time measurement mechanisms in leaves[J]. Annual Review of Plant Biology, 2015, 66(1): 441-464. DOI:10.1146/annurev-arplant-043014-115555 |
| [7] |
Fornara F, de Montaigu A, Coupland G. SnapShot:control of flowering in Arabidopsis[J]. Cell, 2010, 141(3): 550-550. DOI:10.1016/j.cell.2010.04.024 |
| [8] |
Finkelstein R R, Gampala S S L, Rock C D. Abscisic acid signaling in seeds and seedlings[J]. The Plant Cell, 2002, 14(Suppl): S15-S45. |
| [9] |
Domagalska M A, Sarnowska E, Nagy F, et al. Genetic analyses of interactions among gibberellin, abscisic acid, and brassinosteroids in the control of flowering time in Arabidopsis thaliana[J]. PLoS One, 2010, 5(11): e14012. DOI:10.1371/journal.pone.0014012 |
| [10] |
Razem F A, El-Kereamy A, Abrams S R, et al. The RNA-binding protein FCA is an abscisic acid receptor[J]. Nature, 2006, 439(7074): 290-294. DOI:10.1038/nature04373 |
| [11] |
Conti L, Galbiati M, Tonelli C. ABA and the floral transition[M]//Zhang D P. Abscisic Acid: Metabolism, Transport and Signaling. Dordrecht: Springer, 2014: 365-384.
|
| [12] |
Choi H I, Hong J H, Ha J O, et al. ABFs, a family of ABA-responsive element binding factors[J]. The Journal of Biological Chemistry, 2000, 275(3): 1723-1730. DOI:10.1074/jbc.275.3.1723 |
| [13] |
Bensmihen S, Rippa S, Lambert G, et al. The homologous ABI5 and EEL transcription factors function antagonistically to fine-tune gene expression during late embryogenesis[J]. The Plant Cell, 2002, 14(6): 1391-1403. DOI:10.1105/tpc.000869 |
| [14] |
Kim J B, Kang J Y, Kim S Y. Over-expression of a transcription factor regulating ABA-responsive gene expression confers multiple stress tolerance[J]. Plant Biotechnology Journal, 2004, 2(5): 459-466. DOI:10.1111/j.1467-7652.2004.00090.x |
| [15] |
Vanjildorj E, Bae T W, Riu K Z, et al. Overexpression of Arabidopsis ABF3 gene enhances tolerance to drought and cold in transgenic lettuce(Lactuca sativa)[J]. Plant Cell Tissue and Organ Culture, 2005, 83(1): 41-50. |
| [16] |
Oh S J, Song S I, Kim Y S, et al. Arabidopsis CBF3/DREB1A and ABF3 in transgenic rice increased tolerance to abiotic stress without stunting growth[J]. Plant Physiology, 2005, 138(1): 341-351. |
| [17] |
张雁明, 王莉, 张彬, 等. 谷子ABF3基因对PEG胁迫的响应[J]. 山西农业大学学报(自然科学版), 2013, 33(3): 191-196. Zhang Y M, Wang L, Zhang B, et al. The response of ABF3 gene to PEG stress in foxtail millet(Setaria italica L.)[J]. Journal of Shanxi Agricultural University(Natural Science Edition), 2013, 33(3): 191-196 (in Chinese with English abstract). |
| [18] |
Kim H J, Cho H S, Pak J H, et al. Confirmation of drought tolerance of ectopically expressed AtABF3 gene in soybean[J]. Molecular and Cells, 2018, 41(5): 413-422. |
| [19] |
Bäurle I, Dean C. The timing of developmental transitions in plants[J]. Cell, 2006, 125(4): 655-664. DOI:10.1016/j.cell.2006.05.005 |
| [20] |
Fujita Y, Fujita M, Satoh R, et al. AREB1 is a transcription activator of novel ABRE-dependent ABA signaling that enhances drought stress tolerance in Arabidopsis[J]. The Plant Cell, 2005, 17(12): 3470-3488. DOI:10.1105/tpc.105.035659 |
| [21] |
Takada S, Goto K. TERMINAL FLOWER2, an Arabidopsis homolog of HETEROCHROMATIN PROTEIN1, counteracts the activation of FLOWERING LOCUS T by CONSTANS in the vascular tissues of leaves to regulate flowering time[J]. The Plant Cell, 2003, 15(12): 2856-2865. DOI:10.1105/tpc.016345 |
| [22] |
Uno Y, Furihata T, Abe H, et al. Arabidopsis basic leucine zipper transcription factors involved in an abscisic acid-dependent signal transduction pathway under drought and high-salinity conditions[J]. Proc Natl Acad Sci USA, 2000, 97(21): 11632-11637. DOI:10.1073/pnas.190309197 |
| [23] |
Jakoby M, Weisshaar B, Dröge-Laser W, et al. bZIP transcription factors in Arabidopsis[J]. Trends in Plant Science, 2002, 7(3): 106-111. DOI:10.1016/S1360-1385(01)02223-3 |
| [24] |
Chen Y T, Liu H X, Stone S, et al. ABA and the ubiquitin E3 ligase KEEP ON GOING affect proteolysis of the Arabidopsis thaliana transcription factors ABF1 and ABF3[J]. The Plant Journal, 2013, 75(6): 965-976. DOI:10.1111/tpj.12259 |
| [25] |
Hwang K, Susila H, Nasim Z, et al. Arabidopsis ABF3 and ABF4 transcription factors act with the NF-YC complex to regulate SOC1 expression and mediate drought-accelerated flowering[J]. Molecular Plant, 2019, 12(4): 489-505. DOI:10.1016/j.molp.2019.01.002 |
| [26] |
Hepworth S R, Valverde F, Ravenscroft D, et al. Antagonistic regulation of flowering-time gene SOC1 by CONSTANS and FLC via separate promoter motifs[J]. The EMBO Journal, 2002, 21(16): 4327-4337. DOI:10.1093/emboj/cdf432 |
| [27] |
Searle I. The transcription factor FLC confers a flowering response to vernalization by repressing meristem competence and systemic signaling in Arabidopsis[J]. Genes & Development, 2006, 20(7): 898-912. |
| [28] |
Kurup S, Jones H D, Holdsworth M J. Interactions of the developmental regulator ABI3 with proteins identified from developing Arabidopsis seeds[J]. The Plant Journal, 2000, 21(2): 143-155. DOI:10.1046/j.1365-313x.2000.00663.x |
| [29] |
Rohde A, de Rycke R, Beeckman T, et al. ABI3 affects plastid differentiation in dark-grown Arabidopsis seedlings[J]. The Plant Cell, 2000, 12(1): 35-52. |
| [30] |
Wang Y P, Li L, Ye T T, et al. The inhibitory effect of ABA on floral transition is mediated by ABI5 in Arabidopsis[J]. Journal of Experimental Botany, 2013, 64(2): 675-684. DOI:10.1093/jxb/ers361 |
| [31] |
Shu K, Chen Q, Wu Y R, et al. ABSCISIC ACID-INSENSITIVE 4 negatively regulates flowering through directly promoting Arabidopsis FLOWERING LOCUS C transcription[J]. Journal of Experimental Botany, 2016, 67(1): 195-205. |




