文章信息
- 王玉龙, 张存政, 刘凤权
- WANG Yulong, ZHANG Cunzheng, LIU Fengquan
- 重金属汞的抗体制备及免疫分析研究进展
- Research progress in antibody developments and immunoassays for heavy metal mercury
- 南京农业大学学报, 2020, 43(5): 800-807
- Journal of Nanjing Agricultural University, 2020, 43(5): 800-807.
- http://dx.doi.org/10.7685/jnau.202006006
-
文章历史
- 收稿日期: 2020-06-05
2. 江苏省农业科学院植物保护研究所, 江苏 南京 210014
2. Institute of Plant Protection, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
汞(Hg)作为典型的高毒性重金属, 常以有机态(甲基汞:CH3Hg+)和无机态(Hg2+)形式存在, 可损伤中枢神经系统和肾脏, 引起共济失调、震颤、听力和视力障碍等病症[1]。人为排放(如化石燃料燃烧、氯碱工业)和自然排放(如火山喷发、地热)是Hg污染的主要来源, 经过大气循环和水生态系统转运、富集, 最终通过食物链危害人类健康[2]。其高毒性突出了Hg微量分析的重要性, 尤其对农业和食品工业。
基于抗原抗体特异性结合反应的免疫检测方法具有高效、快速和低成本的优点, 可作为传统仪器检测[如原子吸收光谱法(AAS)和电感耦合等离子体质谱法(ICP-MS)]的辅助工具, 用于样品的高通量筛查[3-5]。理论上免疫检测技术适用于任何能产生合适抗体的靶标物分析。金属离子的抗体制备广义上属于小分子半抗原的抗体范畴, 但严格意义上来说, 其独特的半抗原结构使其成为一类特殊代表。前期研究表明, 诱导小分子抗体的半抗原通常含有芳香环或带电荷的极性区域[6]。金属离子结构简单, 同时具有电荷, 在机体内与生物分子发生强烈不可逆反应。一般情况下, 金属离子本身不能作为完整的抗原决定簇而引起免疫反应, 通常需与一些来自其他配体上的附加基团形成抗原决定簇[7-8]。螯合剂(chelator)是最为常用的一类配体, 通过与金属离子配位结合, 形成紧密稳定的具有完整抗原决定簇的复合物, 同时大大减弱带电金属离子与生物分子的反应能力[9-10]。而Wylie等[11]和Wang等[12]利用一类含有—SH结构的配体化合物(如谷胱甘肽、6-巯基烟酸), 其诱导的抗体能识别单独的Hg2+, 这大大简化金属-螯合剂复合物抗体只结合金属-螯合物, 对单独金属离子不识别, 从而需添加螯合剂的繁琐样品前处理过程。更重要的是, 该类型Hg2+抗体克服了金属-螯合剂抗体容易与其他金属离子存在交叉反应的缺陷, 对Hg2+特异性较高。这类抗体似乎超出了金属诱导特定抗体形成所需的抗原有效尺寸和结构要求范畴。因此基于该类特殊识别Hg2+以及识别传统Hg-螯合剂复合物的Hg抗体, 本文综述了关于重金属Hg特异性抗体的制备(半抗原结构)、抗体-抗原识别机制以及免疫检测方法研究进展。
1 Hg半抗原及抗体制备利用人工金属半抗原制备金属离子抗体最早可追溯到1985年, Reardan等[13]报道In3+-EDTA抗体对不同金属螯合物识别能力的研究。此后, 多种基于螯合剂(EDTA或DTPA)的金属离子抗体被研究报道[8, 14-17], 其中包含Hg2+-EDTA和Hg2+-DTPA单克隆抗体[18-20]。Hg2+与此类螯合剂配位结合, 形成1个类似笼状结构, 构成具有完整抗原决定簇的金属-螯合剂复合物(metal-chelate complex)(图 1)。此外, 该类螯合剂通常具有1个能够与载体蛋白质形成稳定共价键的活性基团(常称为双功能螯合剂, 如Aminobenzyl-EDTA、ITCBE、SCN-Bn-CHX-A”-DTPA等), 形成具有免疫原性的金属-螯合剂-载体蛋白复合物。
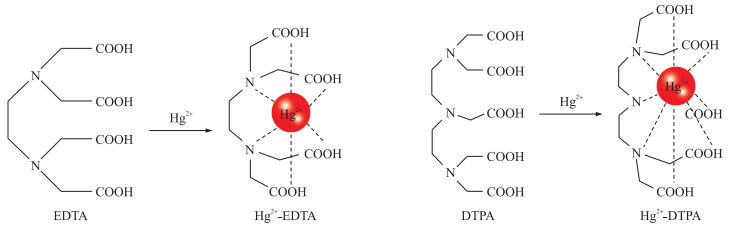
|
图 1 Hg2+与螯合剂(EDTA或DTPA)配位结合 Fig. 1 Coordination of Hg2+ and chelators(EDTA or DTPA) |
不同于金属-螯合剂半抗原中金属离子被包裹在螯合化合物分子内部, 一类特定的含巯基(—SH)化合物, 如谷胱甘肽(GSH)和6-巯基烟酸(MNA), 能最大化暴露金属离子, 被用来制备Hg半抗原[11-12]。Hg2+和—SH具有极高的亲和力(解离常数低至10-42), 使制备的Hg半抗原在生理条件下依然稳定。其中谷胱甘肽是由谷氨酸、半胱氨酸和甘氨酸组成的三肽, 半胱氨酸残基上的—SH, 在适当的条件下易与作为单价配体的汞离子紧密结合。此外, MNA中含有1个吡啶环和1个巯基, 吡啶环具有较强刚性, 有望大大增强抗原的免疫原性。
另外, 一类基于分子内羟汞化反应合成的有机汞半抗原, 其结构简单、化学性质稳定[21](表 1中Organomercury hapten 1)。水溶性的半抗原很容易通过其氨基与蛋白质载体共价结合, 利用该结构制备的抗体既能与汞的有机态(CH3Hg+)结合, 又能与其无机态(Hg2+)结合。
| 螯合剂/半抗原结构 Chelator/hapten structure |
全称 Full name |
文献 References |
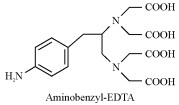 |
Aminobenzyl-ethylenediaminetetraacetic acid | [18] |
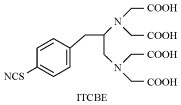 |
1-(4-isothiocyanobenzyl)-ethylenediamine N, N, N′, N′-tetraacetic acid | [19] |
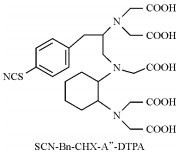 |
N-[2-amino-3-(p-isothiocyanatophenyl)propyl]-trans-cyclohexane-1, 2-diamine-N, N′, N′, N″, N″-diethylenetriaminepentaacetic acid | [20] |
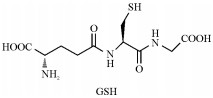 |
Glutathione | [11] |
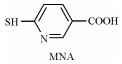 |
6-mercaptonicotinic acid | [12] |
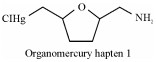 |
(5-methylmercuric chloride tetrahydrofuran-2-yl)-methylamine | [21] |
抗原-抗体相互作用或结合特性认知对基于抗体关联体系(如免疫分析、免疫治疗和诊断)至关重要, 尤其针对金属半抗原这样一类小分子半抗原的特殊子集。此外, Hg2+-GSH或Hg2+-MNA抗体独特的识别Hg2+特性, 超出了金属诱导特定抗体形成的分子大小和结构要求范畴。探究该类Hg抗原-抗体的识别机制, 有助于指导其他类似性质金属的抗体制备。
2.1 结构基础结构互补是任何一种抗原-抗体识别的基础理论, 金属离子与螯合剂结合, 形成特定的复合物构型, 如金属-EDTA六配位结构和金属-DTPA八配位结构。在这种情况下, 免疫系统似乎更倾向于对特定的金属-螯合物产生的复合体构象作出应答, 也就是说, 金属-螯合剂结构决定了抗体的亲合力和特异性。其中, 改变金属离子或螯合剂种类和结构均能导致金属-螯合剂抗体识别性能的差异。如在EDTA结构基础上引入环己基环(反式-1, 2-环己二胺四乙酸, CDTA), 使得CDTA化合物结构中的氮变得更具碱性, 这有助于增加氮-金属键的结合强度以及增加金属螯合物的稳定性, 导致抗Cd2+-EDTA抗体(E5)与Cd2+-CDTA的结合比Cd2+-EDTA复合物更紧密[22]。抗Pb2+-DTPA单克隆抗体(2C12)在半抗原连接区引入苄基或在DTPA结构上引入刚性亚环己基, 抗体的亲合力分别提高30倍和9 100倍[23]。此外, 抗Cd2+-EDTA抗体(2A81G5), 其亲合力与二价金属离子的大小有很好的相关性[24]。进一步研究显示, 不同金属离子大小对抗体亲和力的影响似乎不仅与离子半径有关, 而且还通过金属离子对整体金属-螯合剂复合体构象产生影响[22]。尽管对于目前已报道的Hg2+-EDTA和Hg2+-DTPA抗体的识别机制并无研究, 但对其他金属-螯合剂抗体(如E5和2A81G5)的结合特性规律研究, 可为该类Hg2+-螯合剂抗体提供强有力的借鉴。
大多数情况下, 金属-螯合剂抗体除了对目标金属离子具有很强的亲合力外, 或多或少存在与其他金属-螯合剂或者单独螯合剂结构结合的情况, 这也证明了该类抗体通过有限的分子接触识别金属-螯合剂半抗原, 即抗体与螯合物相互作用的同时, 也存在抗体与金属离子的直接作用[25-26]。换句话说, 这类抗体主要针对金属-螯合剂复合物整体, 而不仅仅是金属离子本身。
Hg2+-GSH和Hg2+-MNA抗体能识别单独的Hg2+, 这可能与该类配合体和Hg2+结合的特殊方式有关。Hg2+-螯合剂结构中, Hg2+与螯合剂配位结合, 其被掩盖在螯合剂分子中, 形成1个类似笼状结构; 而Hg2+-GSH或Hg2+-MNA, Hg2+只单独与—SH发生作用, 这种简单结合能最大化暴露Hg2+, 增加Hg2+被免疫系统视为1个单独表位的可能性, 而不仅仅作为1个较大的抗原决定簇的组成部分[11]。这类特殊抗体似乎颠覆了传统金属诱导特定抗体形成的分子大小和结构要求的认知。但需要说明的是, 该类情况并非无先例, 在伴有高铜血症和高钙血症的骨髓瘤患者中, 发现了能与铜和钙结合的抗体[27]。此外, 在骨科患者植入金属装置后, 也发现存在此类抗体[28]。这些研究表明, 在适当的条件下, 金属离子可以直接作为诱导抗体产生独立表位。
2.2 分子基础分子生物学和计算机科学的快速发展, 使得进一步探究金属抗原-抗体分子识别机制成为可能。目前对于Hg2+-EDTA和Hg2+-DTPA抗体识别机制缺乏研究, 但我们依然可以从前人对其他金属-螯合剂抗体的分子识别机制研究得到参考依据。一项对In3+-EDTA抗体(CHA255)的分子特征研究显示, 在抗体重链互补区(CDR3)存在1个组氨酸残基, 其直接与In3+配位结合[26]。然而, 在相应的Fe3+-EDTA复合物中并没有发现这种组氨酸配位, 这些解释了CHA255抗体对Fe3+-EDTA亲和识别较In3+-EDTA下降1个数量级的问题。此外, In3+-EDTA半抗原与抗体蛋白质或包埋的水分子之间的氢键、范德华力和离子对也参与该类金属抗体-抗原分子结合。也就是说, 若1种金属-螯合剂抗体可以为特定的金属离子提供高度的特异性, 就可以通过抗原结合位点上的特定氨基酸残基与金属离子直接作用[29]。
对Hg2+-GSH抗体(4A10)可变区测序发现, 其高变区含有1个不配对的半胱氨酸残基, 而该类不配对残基在鼠类抗体中是极为罕见的[6]。当对该半胱氨酸定点突变为酪氨酸或丝氨酸时, 抗体丧失对Hg2+的结合能力。此外, 在对2种与4A10抗体含有相同半胱氨酸残基位置的特异性流感抗体进行突变研究时发现, 有1种抗体能与Hg2+反应, 虽然结合力没有4A10强烈。这些结果表明, 可变区中不配对的半胱氨酸残基是Hg2+结合的绝对必要条件; 除此之外, 其他结构特征对于为Hg2+结合创造合适的环境也非常重要, 这进一步证明金属抗体与金属离子可以直接作用。
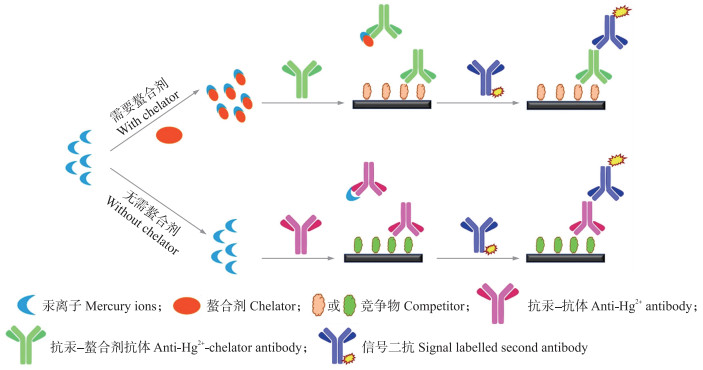
3 Hg免疫分析Hg免疫分析通常基于竞争模式, Hg2+-螯合剂或Hg2+只含有单个抗原表位, 其只能被单种抗体识别, 需要竞争物(competitor)和游离的Hg2+-螯合剂或Hg2+共同竞争抗体有限的抗原结合位点(图 2)。对于基于传统Hg2+-EDTA或Hg2+-DTPA抗体的免疫检测体系来说, 样品中添加过量的螯合剂是必不可少的操作步骤, 螯合剂结合样品中游离的目标Hg2+, 形成Hg2+-螯合剂复合物, 因为该类抗体只表现出对复合物强烈的结合能力。而Hg2+-GSH或Hg2+-MNA抗体, 因其能识别单独的Hg2+, 无需添加配体化合物, 大大简化了检测程序。多种不同信号转化的检测体系(经典ELISA、免疫层析试纸条、微流控免疫分析、电致发光免疫分析和流动注射化学发光免疫分析等)和样品处理技术(固相萃取、磁珠分离等)被用于Hg2+和有机汞[21]的快速免疫分析中, 检测对象覆盖水样、奶制品、农产品和化妆品等典型Hg2+潜在高残留样品(表 2)。
|
图 2 竞争免疫分析对Hg2+的检测 Fig. 2 Competitive immunoassay for Hg2+ detection 以固相ELISA为例, 包括Hg2+-螯合剂抗体和Hg2+-GSH或Hg2+-MNA抗体所参与的2种检测体系。 Take the case of the solid ELISA, including two detection systems based on anti-Hg2+-chelator antibody and anti-Hg2+-GSH or anti-Hg2+-MNA antibody. |
| 分析方法 Analytical methods |
抗体类型 Antibody type |
检测限/(ng·mL-1) LOD③ |
样品 Samples |
文献 References |
| 酶联免疫吸附分析(ELISA) Enzyme-linked immunosorbent assay(ELISA) |
Hg2+-ITCBE mAb① | 1.8 | 超纯水、自来水、池塘水和青菜 Ultrapure water, tap water, pool water and greenvegetable |
[19] |
| 酶联免疫吸附分析(ELISA) Enzyme-linked immunosorbent assay(ELISA) |
Hg2+-MNA mAb | 0.08 | 超纯水、自来水、河水、牛奶、面霜、洁面乳、海藻和青菜 Ultrapure water, tap water, river water, milk, night cream, facial cleanser, kelp and green vegetable |
[12] |
| 酶联免疫吸附分析(ELISA) Enzyme-linked immunosorbent assay(ELISA) |
Hg2+-GSH pAb② | 9.55 | 溪流水 Stream water |
[30] |
| 胶体金免疫层析试纸条(ICTS) Gold nanoparticle immunochromatographic test strip(ICTS) |
Hg2+-ITCBE mAb | 0.23 | 自来水 Tap water |
[31] |
| 化学发光ICTS Chemiluminescent ICTS |
Hg2+-MNA mAb | 0.2 | 湖水和丹参 Lake water and Salvia miltiorrhiza |
[32] |
| 电化学ICTS Electrochemistry ICTS |
Hg2+-MNA mAb | 0.03 | 矿泉水、自来水、河水和牛奶 Mineral water, tap water, river water and milk |
[33] |
| 表面增强拉曼散射ICTS Surface-enhanced Raman scattering ICTS |
Hg2+-MNA mAb | 4.5×10-4 | 自来水、河水、湖水、人类血清和人类尿液 Tap water, river water, lake water, human serum and urine |
[34] |
| 微流控免疫分析(MFIA) Microfluidic immunoassay(MFIA) |
Hg2+-EDTA mAb | 0.83 | 自来水、矿泉水和河水 Tap water, mineral water and river water |
[35] |
| 电致发光免疫分析(ECLIA) Electroluminescence immunoassay (ECLIA) |
Hg2+-MNA mAb | 6.2×10-3 | 护手霜和爽肤水 Hand cream and toner |
[36] |
| 流动注射化学发光免疫分析(FI-CLIA) Flow injection chemiluminescence immunoassay(FI-CLIA) |
Hg2+-MNA mAb | 0.015 | 自来水、湖水和河水 Tap water, lake water and river water |
[37] |
| 注:①单克隆抗体Monoclonal antibody; ②多克隆抗体Polyclonal antibody; ③最低检测限Limit of detection. |
||||
ELISA实质为一项基于固相微孔板的异相免疫分析, 主要通过酶催化实现信号放大检测[38-40]。辣根过氧化物酶-3, 3′, 5, 5′-四甲基联苯胺(HRP-TMB)是最为常用的酶底物体系, 肉眼观测溶液颜色的变化(蓝色深浅)或测定吸光度(测定硫酸终止后溶液D450)即可实现定性或定量检测。已报道的ELISA对于Hg2+的最低检测限均低至ng · mL-1[12, 19, 30], 非常适合大批量的样品筛查。此外, 该类方法与仪器检测方法结果比较一致, 在处理基质影响较低或前处理较简单的样品时, 甚至可以作为仪器方法的代替品。
3.2 免疫层析试纸条(ICTS)ICTS最典型的代表是早早孕检测试纸, 其特点是操作简单, 检测时间短(10~15 min), 所需样品体积小(100~200 μL)以及结果可视化(通过肉眼即可判断), 能够用于现场实时分析[41-43]。目前对于Hg2+开发出以胶体金为示踪物的传统ICTS或者以免疫层析为平台结合化学发光、电化学检测和表面增强拉曼散射等分析手段的多种高灵敏检测系统[31-34]。胶体金ICTS可根据不同样品中Hg2+的最大残留限量(MRL)设定其检测阈值(Cut-off), 通过肉眼判断消线与否, 实现Hg2+现场原位分析。
3.3 微流控免疫分析(MFIA)Date等[35]将微流控免疫分析和固相萃取(SPE)结合, 开发出一种小型、集成和自动化的Hg2+免疫快速检测装置。SPE结合免疫测定已被证实为一种低成本、高效益的检测系统, 在对环境样品中的农药免疫分析中, 具有去除多种农药交叉反应杂质的功能[44-45]。微流控免疫分析具有高度的集成和自动化, 并且装置小型化, 有助于降低检测成本[46-47]。该检测系统能在10 min内产生结果, 对饮用水中的Hg2+最低检测限达0.83 ng · mL-1, 远低于美国环境保护署(EPA)规定的饮用水最高Hg2+含量标准(2 ng · mL-1)。
3.4 电致发光免疫分析(ECLIA)材料科学的发展, 特别是基于纳米材料的光学探针体系被用于物质定量分析中。其中量子点(quantum dot)作为一类新的发光体, 在提升电致发光性能的同时, 又可通过不同生物分子的功能化, 为分析物的超灵敏定量检测提供优异的平台[48-49]。ECLIA对Hg2+的检测限达到6.2 pg · mL-1[36]。
3.5 流动注射化学发光免疫分析(FI-CLIA)FI-CLIA是流动注射分析与化学发光分析联用的一种方法。流动注射分析法采用自动化进样, 操作方便并且不受时间及外界条件影响, 可以弥补化学发光分析法本身依赖于时间并受各种化学和物理参数的影响, 导致选择性与重现性较差的缺陷[50-51]。在Hg2+的FI-CLIA中, 具有较大比表面积的树脂微球被用来作为固相载体吸附更多的蛋白竞争复合物, 以提升检测灵敏度[37]。此外, HRP催化的Luminol-PIP-H2O2发光体系保证了稳定强烈的光学信号。
4 总结与展望对Hg的免疫检测至今已发展约30年, 多种基于Hg2+-螯合剂、Hg2+-GSH或Hg2+-MNA的抗体(多克隆和单克隆抗体)被研究报道, 识别Hg的形态主要为Hg2+, 但也存在部分抗体识别有机汞。其中Hg2+-GSH或Hg2+-MNA抗体表现出区别于传统金属-螯合剂抗体只识别金属-螯合剂复合物的特点, 其能与单独的Hg2+结合。该类抗体的开发应用, 理论上证实在特定情况下, 金属离子可以作为1个独立表位被免疫系统识别; 检测方法应用上则避免了传统金属-螯合剂抗体需加入螯合剂的样品前处理过程, 有助于检测方法的简化。
对于Hg2+的免疫检测, 与其他有害物质快速检测有着相同的趋势, 即要求检测系统更加敏感、简单和便携, 但仍然存在着巨大挑战。其中, 非靶标金属离子对基于金属-螯合剂抗体免疫检测的干扰是一个共性问题。这一点在Hg2+-螯合剂抗体免疫检测系统中也依然存在, 特别是当真实样品中含有中、高浓度的非靶标金属离子时, 会产生严重的假阳性干扰。提高Hg2+-螯合剂抗体对目标Hg2+的特异性结合能力, 可以降低其他金属离子的交叉反应。通过合理的金属半抗原设计(如计算机辅助分子建模技术), 可以诱导产生亲合力更高的抗体。此外, 抗体工程化改造(如基于噬菌体展示抗体库的体外亲合成熟)可提升抗体的识别性能。无论是指导半抗原设计, 还是抗体改造, 对抗体-抗原识别机制的解析是获取高性能抗体的理论基础, 目前对于Hg-螯合剂抗体结合特性的研究急需加强。此外, 对于新型Hg2+-GSH和Hg2+-MNA抗体的分子基础进一步研究, 为制备其他具有类似性能的金属离子抗体意义重大。
免疫分析技术发展迅速, 尤其是新兴纳米材料的引入, 使得检测方法的敏感性有大幅提升。但值得注意的是, 经典的ELISA依然是Hg2+实际应用快速检测的主要技术。此外, 免疫层析试纸条在Hg2+现场快速检测中显示出独特优势, 特别是对于溶液样品。目前对于水样品中Hg的免疫检测研究较多, 需加强对复杂样品Hg检测的研究。固相萃取、磁珠分离等样品前处理技术[20], 可大大去除复杂样品基质干扰, 提升检测性能。提高免疫分析方法的稳定性以及经济实用性, 构建能满足复杂基质中Hg快速筛查需求的产品是Hg免疫检测研究的最终目标。
Hg抗体目前大多数为传统抗体, 纳米抗体(一种源于驼类动物中经人工重组表达其重链可变区VHH片段获得的单域重链抗体)的兴起, 无论是其易于基因操作(比如信号标签融合插入), 还是其易于保存(质粒存储)等特点, 似乎都为建立稳定、简便的Hg免疫分析提供借鉴, 这一点对于能够长期提供稳定抗体试剂产品尤其重要。此外, 纳米抗体独特的结构也为高性能Hg抗体的筛选提供了可能。
| [1] |
Suess E, Berg M, Bouchet S, et al. Mercury loads and fluxes from wastewater:a nationwide survey in Switzerland[J]. Water Research, 2020, 175: 115708. DOI:10.1016/j.watres.2020.115708 |
| [2] |
Szurdoki F, Kido H, Hammock B D. Development of assay for analysis of Hg2+based on sulfur-containing ligands[M]. Nelson J O, Karu A E, Wong R B. Immunoanalysis of Agrochemicals: Emerging Technologies. Washington:American Chemical Society, 1995: 248-264.
|
| [3] |
Luppa P B, Sokoll L J, Chan D W. Immunosensors:principles and applications to clinical chemistry[J]. Clinica Chimica Acta, 2001, 314(1/2): 1-26. |
| [4] |
Wen W, Yan X, Zhu C Z, et al. Recent advances in electrochemical immunosensors[J]. Analytical Chemistry, 2017, 89(1): 138-156. |
| [5] |
Banerjee R, Jaiswal A. Recent advances in nanoparticle-based lateral flow immunoassay as a point-of-care diagnostic tool for infectious agents and diseases[J]. Analyst, 2018, 143(9): 1970-1996. DOI:10.1039/C8AN00307F |
| [6] |
Westhoff C M, Lopez O, Goebel P, et al. Unusual amino acid usage in the variable regions of mercury-binding antibodies[J]. Proteins, 1999, 37(3): 429-440. DOI:10.1002/(SICI)1097-0134(19991115)37:3<429::AID-PROT10>3.0.CO;2-P |
| [7] |
Meares C F. Chelating agents for the binding of metal ions to antibodies[J]. Nuclear Medicine and Biology, 1986, 13(4): 311-318. |
| [8] |
Bartos A, Niedzielski P, Buczyłko K, et al. Nickel chelate complexes as a target for polyclonal antibodies raised in rabbits and mice[J]. International Journal of Environmental Analytical Chemistry, 2019. DOI:10.1080/03067319.2019.1691179 |
| [9] |
Price E W, Orvig C. Matching chelators to radiometals for radiopharmaceuticals[J]. Chemical Society Reviews, 2014, 43(1): 260-290. DOI:10.1039/C3CS60304K |
| [10] |
Safavy A, Smith D C, Bazooband A A, et al. Synthesis of the first diethylenetriaminepentahydroxamic acid(DTPH)bifunctional chelating agent[J]. Bioconjugate Chemistry, 2002, 13(2): 327-332. DOI:10.1021/bc010092x |
| [11] |
Wylie D E, Lu D, Carlson L D, et al. Monoclonal-antibodies specific for mercuric ions[J]. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(9): 4104-4108. DOI:10.1073/pnas.89.9.4104 |
| [12] |
Wang Y Z, Yang H, Pschenitza M, et al. Highly sensitive and specific determination of mercury(Ⅱ)ion in water, food and cosmetic samples with an ELISA based on a novel monoclonal antibody[J]. Analytical and Bioanalytical Chemistry, 2012, 403(9): 2519-2528. DOI:10.1007/s00216-012-6052-1 |
| [13] |
Reardan D T, Meares C F, Goodwin D A, et al. Antibodies against metal-chelates[J]. Nature, 1985, 316(6025): 265-268. DOI:10.1038/316265a0 |
| [14] |
Xiao M, Fu Q Q, Shen H C, et al. A turn-on competitive immunochromatographic strips integrated with quantum dots and gold nano-stars for cadmium ion detection[J]. Talanta, 2018, 178: 644-649. DOI:10.1016/j.talanta.2017.10.002 |
| [15] |
Mandappa I M, Ranjini A, Haware D J, et al. Immunoassay for the detection of lead ions in environmental water samples[J]. International Journal of Environmental Analytical Chemistry, 2012, 92(3): 334-343. DOI:10.1080/03067319.2010.525790 |
| [16] |
Xiang J J, Zhai Y F, Tang Y, et al. A competitive indirect enzyme-linked immunoassay for lead ion measurement using mAbs against the lead-DTPA complex[J]. Environmental Pollution, 2010, 158(5): 1376-1380. DOI:10.1016/j.envpol.2010.01.002 |
| [17] |
He H, Tang B, Sun C, et al. Preparation of hapten-specific monoclonal antibody for cadmium and its ELISA application to aqueous samples[J]. Frontiers of Environmental Science & Engineering in China, 2011, 5(3): 409-416. |
| [18] |
Zhang Y, Li X B, Liu G W, et al. Development of ELISA for detection of mercury based on specific monoclonal antibodies against mercury-chelate[J]. Biological Trace Element Research, 2011, 144(1/2/3): 854-864. |
| [19] |
Lou Y, Yang F L, Zhu X X, et al. Production of a specific monoclonal antibody against mercury-chelate complexes and its application in antibody-based assays[J]. Food and Agricultural Immunology, 2009, 20(1): 23-33. DOI:10.1080/09540100802626479 |
| [20] |
Sun H B, Wang M M, Wang J L, et al. Development of magnetic separation and quantum dots labeled immunoassay for the detection of mercury in biological samples[J]. Journal of Trace Elements in Medicine and Biology, 2015, 30: 37-42. DOI:10.1016/j.jtemb.2015.01.009 |
| [21] |
Prudenté C K, Sirios R S, Cote S. Synthesis and application of organomercury haptens for enzyme-linked immunoassay of inorganic and organic mercury[J]. Analytical Biochemistry, 2010, 404(2): 179-185. |
| [22] |
Jones R M, Yu H N, Delehanty J B, et al. Monoclonal antibodies that recognize minimal differences in the three-dimensional structures of metal-chelate complexes[J]. Bioconjugate Chemistry, 2002, 13(3): 408-415. DOI:10.1021/bc0155418 |
| [23] |
Khosraviani M, Blake R C, Pavlov A R, et al. Binding properties of a monoclonal antibody directed toward lead-chelate complexes[J]. Bioconjugate Chemistry, 2000, 11(2): 267-277. DOI:10.1021/bc9901548 |
| [24] |
Blake D A, Chakrabarti P, Khosraviani M, et al. Metal binding properties of a monoclonal antibody directed toward metal-chelate complexes[J]. Journal of Biological Chemistry, 1996, 271(44): 27677-27685. DOI:10.1074/jbc.271.44.27677 |
| [25] |
Delehanty J B, Jones R M, Bishop T C, et al. Identification of important residues in metal-chelate recognition by monoclonal antibodies[J]. Biochemistry, 2003, 42(48): 14173-14183. DOI:10.1021/bi034839d |
| [26] |
Love R A, Villafranca J E, Aust R M, et al. How the anti-(metal chelate)antibody CHA255 is specific for the metal ion of its antigen:X-ray structures for two Fab'/hapten complexes with different metals in the chelate[J]. Biochemistry, 1993, 32(41): 10950-10959. DOI:10.1021/bi00092a004 |
| [27] |
Baker B L, Hultquist D E. A copper-binding immunoglobulin from a myeloma patient. Studies of copper-binding site[J]. Journal of Biological Chemistry, 1978, 253(23): 8444-8451. |
| [28] |
Yang J, Merritt K. Detection of antibodies against corrosion products in patients after Co-Cr total joint replacements[J]. Journal of Biomedical Materials Research, 1994, 28(11): 1249-1258. DOI:10.1002/jbm.820281102 |
| [29] |
Blake R C, Pavlov A R, Khosraviani M, et al. Novel monoclonal antibodies with specificity for chelated uranium(Ⅵ):isolation and binding properties[J]. Bioconjugate Chemistry, 2004, 15(5): 1125-1136. DOI:10.1021/bc049889p |
| [30] |
Zhan X J, Xi T, Zhou P. Indirect competitive immunoassay for mercury ion determination using polyclonal antibody against the Hg-GSH complex[J]. Environmental Forensics, 2013, 14(2): 103-108. |
| [31] |
Xing C R, Liu L Q, Zhang X, et al. Colorimetric detection of mercury based on a strip sensor[J]. Analytical Methods, 2014, 6(16): 6247-6253. DOI:10.1039/C3AY42002G |
| [32] |
Wang X M, Liu F Q, Shao Q, et al. A novel chemiluminescent immunochromatographic assay strip for rapid detection of mercury ions[J]. Analytical Methods, 2017, 9(16): 2401-2406. DOI:10.1039/C7AY00231A |
| [33] |
Wang Y L, Wang L M, Wang S Y, et al. 'Green' immunochromatographic electrochemical biosensor for mercury(Ⅱ)[J]. Microchimica Acta, 2016, 183(9): 2509-2516. DOI:10.1007/s00604-016-1866-8 |
| [34] |
She P, Chu Y X, Liu C W, et al. A competitive immunoassay for ultrasensitive detection of Hg2+ in water, human serum and urine samples using immunochromatographic test based on surface-enhanced Raman scattering[J]. Analytica Chimica Acta, 2016, 906: 139-147. DOI:10.1016/j.aca.2015.12.021 |
| [35] |
Date Y, Aota A, Terakado S, et al. Trace-level mercury ion(Hg2+)analysis in aqueous sample based on solid-phase extraction followed by microfluidic immunoassay[J]. Analytical Chemistry, 2013, 85(1): 434-440. |
| [36] |
Zhang J, Wang M B, Yao X, et al. Highly sensitive electroluminescence immunoassay for Hg(Ⅱ)ions based on the use of CdSe quantum dots, the methylmercury-6-mercaptonicotinic acid-ovalbumin conjugate, and a specific monoclonal antibody[J]. Microchimica Acta, 2015, 182(3/4): 469-477. |
| [37] |
Xu M X, Chen M T, Dong T T, et al. Flow injection chemiluminescence immunoassay based on resin beads, enzymatic amplification and a novel monoclonal antibody for determination of Hg2+[J]. Analyst, 2015, 140(18): 6373-6378. DOI:10.1039/C5AN01131K |
| [38] |
Asensio L, González I, García T, et al. Determination of food authenticity by enzyme-linked immunosorbent assay(ELISA)[J]. Food Control, 2008, 19(1): 1-8. |
| [39] |
Berlina A N, Zherdev A V, Dzantiev B B. ELISA and lateral flow immunoassay for the detection of food colorants:state of the art[J]. Critical Reviews in Analytical Chemistry, 2019, 49(3): 209-223. |
| [40] |
Gao Y, Zhou Y Z, Chandrawati R. Metal and metal oxide nanoparticles to enhance the performance of enzyme-linked immunosorbent assay(ELISA)[J]. ACS Applied Nano Materials, 2020, 3(1): 1-21. DOI:10.1021/acsanm.9b02003 |
| [41] |
Akkapinyo C, Khownarumit P, Waraho-Zhmayev D, et al. Development of a multiplex immunochromatographic strip test and ultrasensitive electrochemical immunosensor for hepatitis B virus screening[J]. Analytica Chimica Acta, 2020, 1095: 162-171. DOI:10.1016/j.aca.2019.10.016 |
| [42] |
Matsumura Y, Enomoto Y, Takahashi M, et al. Metal(Au, Pt)nanoparticle-latex nanocomposites as probes for immunochromatographic test strips with enhanced sensitivity[J]. ACS Applied Materials & Interfaces, 2018, 10(38): 31977-31987. |
| [43] |
Wang Y L, Xu J L, Qiu Y L, et al. Highly specific monoclonal antibody and sensitive quantum dot beads-based fluorescence immunochromatographic test strip for tebuconazole assay in agricultural products[J]. Journal of Agricultural and Food Chemistry, 2019, 67(32): 9096-9103. DOI:10.1021/acs.jafc.9b02832 |
| [44] |
Li Z L, Wang S, Alice Lee N, et al. Development of a solid-phase extraction-enzyme-linked immunosorbent assay method for the determination of estrone in water[J]. Analytica Chimica Acta, 2004, 503(2): 171-177. DOI:10.1016/j.aca.2003.10.026 |
| [45] |
Tuzimski T, Rejczak T. Application of HPLC-DAD after SPE/QuEChERS with ZrO2-based sorbent in d-SPE clean-up step for pesticide analysis in edible oils[J]. Food Chemistry, 2016, 190: 71-79. DOI:10.1016/j.foodchem.2015.05.072 |
| [46] |
de Mello A J. Control and detection of chemical reactions in microfluidic systems[J]. Nature, 2006, 442(7101): 394-402. DOI:10.1038/nature05062 |
| [47] |
Jakeway S C, de Mello A J, Russell E L. Miniaturized total analysis systems for biological analysis[J]. Fresenius Journal of Analytical Chemistry, 2000, 366(6/7): 525-539. |
| [48] |
Li X Y, Wang R Y, Zhang X L. Electrochemiluminescence immunoassay at a nanoporous gold leaf electrode and using CdTe quantun dots as labels[J]. Microchimica Acta, 2011, 172(3/4): 285-290. |
| [49] |
Wu L, Ding F, Yin W M, et al. From electrochemistry to electroluminescence:development and application in a ratiometric aptasensor for aflatoxin B1[J]. Analytical Chemistry, 2017, 89(14): 7578-7585. DOI:10.1021/acs.analchem.7b01399 |
| [50] |
Lara-Ortega F J, López B G, Cambra M B, et al. Multicommuted flow injection analysis using chemiluminescence detection(MCFIA-CL)for olive oil analysis[J]. Food Analytical Methods, 2018, 11(6): 1804-1814. DOI:10.1007/s12161-018-1182-5 |
| [51] |
Zhou M, Chen Q Q, Wang A L, et al. Flow-injection chemiluminescence of the luminol-potassium periodate system enhanced by TGA-capped CdTe quantum dots for the determination of theophylline[J]. Luminescence, 2019, 34(7): 673-679. DOI:10.1002/bio.3652 |




