文章信息
- 王迎旭, 孙晔, 李玉花, 孙国祥, 汪小旵
- WANG Yingxu, SUN Ye, LI Yuhua, SUN Guoxiang, WANG Xiaochan
- 基于叶绿素荧光成像的温室黄瓜植株病害分类与病情监测
- Classification and monitoring of disease cucumber plants in greenhouse based on chlorophyll fluorescence imaging technology
- 南京农业大学学报, 2020, 43(4): 770-780
- Journal of Nanjing Agricultural University, 2020, 43(4): 770-780.
- http://dx.doi.org/10.7685/jnau.201910029
-
文章历史
- 收稿日期: 2019-10-22
近20年来, 黄瓜褐斑病(cucumber brown spot disease)与炭疽病(cucumber anthracnose)广泛发生于世界各国, 主要危害黄瓜叶片, 病斑类型复杂, 已成为黄瓜生产中重要的病害[1]。这2种患病黄瓜植株由于其病斑类似, 往往在种植过程中难以直接区分。若对植株所患病情区分错误, 不能对症下药, 则会严重危害正常的农业生产[2]。同时, 在植株发病早期, 人们往往用肉眼难以观察及预测其病害情况。因此, 黄瓜病害的早期识别以及病害种类的区分对保证温室黄瓜产量和质量非常重要。
传统农作物生长状况、病虫害的监测主要依靠农业生产者的经验判断, 需要通过人眼观察来推测植物生理状况。这种方法工作量大、效率低, 准确率不能保障, 不能满足日益增长的农业生产。目前, 温室作物监测系统主要集中于对环境物理参数信息的监测[3-4], 而植物生理状态监测系统的研究相对较弱。目前, 植物生理状态及病害的检测方法包括:机器视觉与深度学习[5-7]、近红外光谱[8]、多光谱[9]、高光谱图像[10-12]、偏振高光谱[13]等。其中, 马浚诚等[7]采用对植株不同种类病害的RGB图像进行深度学习CNN(卷积神经网络)算法的分类, 达到满意的效果。深度学习算法复杂度较高, 对硬件的要求也非常高, 致使时间及硬件成本需求较大。叶绿素荧光技术是通过对光合作用的分析, 提取特征参数, 大大简化特征提取的过程, 从而降低成本。尽管研究人员已经证明上述方法在对植物的病害检测中具有一定潜力, 但与它们相比, 叶绿素荧光技术具有植物无损“探针”之称, 主要通过监测植物光合作用时叶绿素电子由激发态转为基态时所产生的荧光强度, 来判断植物的光合作用强度, 进而判断植物的健康情况以及内部结构的变化[14-15]。当植物叶片受到病害威胁时, 叶绿素含量及其光合能力会发生改变, 叶绿素荧光强度也会随之改变, 且叶绿素荧光信号完全来自于观测植物, 没有背景噪声, 提高了检测精度。同时, 相较其他方法使用传感器对叶片进行参数测量易对叶片造成损伤, 对后续结果造成不良影响, 叶绿素荧光监测技术作为一种无损检测的方法, 可通过荧光的变化表现出光合作用的变化及能量的变化[16-17], 不会对植物产生任何损伤[18]。
叶绿素荧光检测技术已被应用于由病毒、细菌和真菌感染引起的生理状态变化的检测。在病害胁迫下植物叶片的Fv/Fm值相较于健康叶片呈下降趋势, 病原菌的入侵破坏了叶绿素合成和降解的动态平衡, 叶绿素合成受阻, 染病叶片叶绿体PSⅡ活性受到抑制[19-21]。Lei等[22]通过叶绿素荧光成像、稳态荧光和非光化学猝灭(NPQ)分析探讨病毒感染对烟草叶片光合作用的影响, 结果表明该技术可以作为研究植物病毒感染机制的方法。Tung等[23]利用叶绿素荧光成像技术检测烟草叶片的炭疽病, 以Fv/Fm图像分析烟草不同染病程度, 结果表明叶绿素荧光成像技术可实现病害区分及染病程度检测。Cen等[24]应用叶绿素荧光成像技术诊断柑橘黄龙病, 建立了柑橘叶片黄龙病诊断模型(健康、染病、缺素), 模型诊断精度最高可达97%。隋媛媛等[25]采用叶片上小区域的叶绿素荧光光谱对黄瓜进行病害检测和区分, 结果表明小区域的荧光光谱分析对病害的预测有一定效果。以上研究说明叶绿素荧光技术可用于检测植物的染病情况。但目前对黄瓜相似病害的区分研究较少, 且对植株叶绿素荧光的提取主要集中在叶片小面积区域, 不能充分反映整株植物的状态和健康情况。因此, 本文旨在设计一种可监测全植株染病状态的叶绿素荧光成像系统, 分析早期黄瓜褐斑病和炭疽病的发展状态, 并对2种病症进行区分, 为黄瓜褐斑病和炭疽病的识别与早期诊断提供新的方法。
1 材料与方法 1.1 试验材料选择水果黄瓜‘83-16’(山东省寿光市宏伟种业有限公司)为试验材料, 试验于2018年11月在南京农业大学工学院进行。将种子在温水中浸泡约8 h后, 转移到用湿纱布包裹的塑料袋中, 并放入28 ℃的培养箱。2 d后, 约70%的种子开始发芽(径向根长0.3~0.4 mm)。将发芽的种子移植到1个7×10孔的塑料育苗盘(30 cm×40 cm)中, 用消毒后的土壤在28 ℃的培养箱中进行培养。当幼苗长出3片真叶后, 选择长势大致相同的植株移栽至15 cm直径花盆中。3 d后, 选取长势大致相同的100株黄瓜作为试验样本, 其中40株接种褐斑病病菌, 40株接种炭疽病病菌, 另外20株作为对照组。花盆分别置于不同人工气候箱中进行隔离培养, 昼/夜培养时间为18 h/16 h, 平均温度为28 ℃/18 ℃, 相对湿度85%。其中接种病菌的样本在接种前采集1次荧光图像, 在接种后, 每24 h采集病害组和对照组黄瓜植株的荧光图像及叶片叶绿素和氮含量, 连续采集4次。一共获取5次荧光图像, 得到每株黄瓜不同染病程度下叶绿素荧光图像。本试验对黄瓜植株的对照样本共监测5 d, 每天的样本量为20;对最终产生病害的黄瓜样本除第0天未接种病菌外共监测4 d。从每种病害组中最终染病的样本中各选30个染病成功样本, 提取其荧光数据。数据中有100组正常生长的黄瓜植株叶绿素荧光数据, 褐斑病病害样本和炭疽病病害样本各120组。
1.2 叶绿素荧光成像系统构成及数据采集为了便于对温室黄瓜植株进行叶绿素荧光参数测量, 本试验设计开发了叶绿素荧光成像系统(图 1)。系统由高性能CCD相机(Lumenera Infinity3-1URC, 加拿大)、中心波长为460 nm的LED光源(BL100×100)、可编程直流电源(eTM-L305SP)和计算机(KH770 i7-4500 u)组成。8盏LED灯, 从4个方向照明, 每块LED板尺寸为100 mm×100 mm, 额定电压25 V。相机分辨率为1 280×720, 支持30帧·s-1的视频录制, 配有515 nm长通滤光片(NF515-02), 可以滤除激发光, 收集叶绿素激发的荧光。试验中采用55 mm偏振片(MC-CPL-55mm)滤除光束中的直射光。
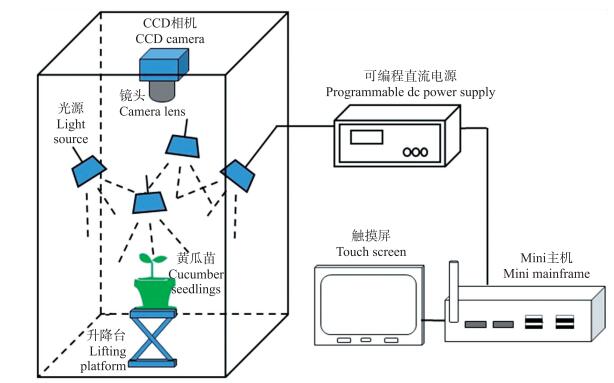
|
图 1 叶绿素荧光成像系统示意图 Fig. 1 Schematic diagram of chlorophyll fluorescence imaging system |
本系统中, 通过改变电压的大小得到试验所需的3种激发光:测量光、光化光和饱和光。经过调节电源电压, 并使用光强传感器(ZZ-S-LM-A)的检测和转换得出:当电压为20.0 V时, LED光源的光照强度满足测量光强度; 当电压为23.2 V时, 光照强度满足光化光强度; 当电压为25.0 V时, 光照强度满足饱和光强度。为了获得叶绿素荧光参数, 植物必须先在黑暗环境中放置一段时间, 进行暗适应。暗适应后, 通过运行程序可获得原始荧光数据F0(暗适应状态下的最小荧光)和Fm(暗适应状态下的最大荧光量), 在光化光下获得F(稳态荧光水平)。此时, PSⅡ反应中心部分打开; 经过一段时间的光化, 给出短时间饱和脉冲光, PSⅡ反应中心将处于完全封闭状态, 原本用于光合作用的能量将转化为叶绿素荧光和热量, 因此叶绿素荧光Fm′为测量光适应状态下的最大荧光。这个过程循环5次, 直到植株达到稳定的生理状态。最终得到此时的平均F和Fm′。采用下列公式计算出Fv/Fm(光系统Ⅱ最大光合量子效率)、ΦPSⅡ(光系统Ⅱ实际量子效率)、NPQ(非光化学淬灭)、qN(非光化学淬灭系数)和qP(光化学淬灭)的参数。利用荧光系统对每个黄瓜样品进行处理, 通过相机拍摄得到所需荧光数据共12幅(F0、Fm、F×5和Fm′×5), 再进一步对图像进行处理, 得到叶绿素荧光数据。
| $ {{F_{\rm{v}}}/{F_{\rm{m}}} = ({F_{\rm{m}}} - {F_0})/{F_{\rm{m}}}} $ | (1) |
| $ {{\varPhi _{{\rm{PS}}{\kern 1pt} {\rm{II}}}} = (F_m^\prime - F)/F_{\rm{m}}^\prime } $ | (2) |
| $ {NPQ = {F_{\rm{m}}}/F_{\rm{m}}^\prime - 1} $ | (3) |
| $ {qN = ({F_{\rm{m}}} - F_{\rm{m}}^\prime )/({F_{\rm{m}}} - F_0^\prime )} $ | (4) |
| $ qP = (F_m^\prime - F)/(F_m^\prime - F_0^\prime ) $ | (5) |
成像系统的具体技术路线如图 2所示。

|
图 2 成像系统技术路线图 Fig. 2 Technical roadmap of fluorescent image acquisition system |
为了进一步研究样品的叶绿素荧光参数与营养参数和叶绿素含量的关系, 在每次叶绿素荧光数据提取试验结束后, 采用便携式叶绿素仪(SPAD-502, 日本)和便携式植物营养仪(TYS-4N, 中国)测定样品的叶片叶绿素含量和氮含量。分别选取叶片上的3个点进行测量, 获得叶绿素含量和氮含量的3个读数, 并取平均值, 同时准确记录检测区域, 以便后续提取对应区域的荧光参数。
1.4 数据处理 1.4.1 病斑区域的分割病斑区域的分割是为了下一步更有效地提取病斑区域的特征。通过对图像的粗分割、精分割、病斑分割及病斑区域膨胀的方法获得病斑区域。由于本试验的试验环境封闭, 背景噪声较为单一, 因此首先采用RGB阈值分割的方法大致分割出植株区域, 完成第1步粗分割。然后采用中值滤波对点噪声进行清除, 完成对图像的精分割, 得到已去除背景的黄瓜植株的荧光RGB图像。再使用RGB阈值分割方法, 分割出图像病斑区域的模板, 最终对病斑区域的模板进行荧光图像的膨胀, 得到试验所需的病斑区域及周围感兴趣区域。由于有的病斑区域较小, 极易与噪声混淆, 从而对后续试验造成干扰, 试验没有使用RGB阈值分割方法直接分割出病斑区域, 而是在过程中加入中值滤波去除噪声; 并且, 在中间加入精分割的步骤可以有效避免病斑区域与噪声的混淆。
1.4.2 参数提取本试验采用Lab空间中的L(亮度)分量来表示图像中的荧光强度信息, 将黄瓜植株病斑区域的荧光RGB图像转化到Lab色彩空间进行表示, 再通过提取Lab色彩空间中的L分量, 得到每个像素点的亮度值。将这些像素点上的亮度值累加后再除以总体的像素点数量即可得到每幅荧光图像中荧光强度的平均值。通过相机采集, 每株植物都获得了12幅荧光图像, 将图像进行上述处理即可得到荧光参数F0、Fm、F和Fm′的数值。
1.4.3 参数分析在本试验中, 以褐斑病处理作为可控因素, 即对照组和病害组, 叶绿素含量和氮含量作为观测变量, 进行单因素方差分析。通过比较分析各种分类算法, 如:K-means、支持向量机(SVM)、极端梯度提升(XGBoost)、逻辑回归(LR)等, 最终选择2种在分类中表现较好的常用算法:SVM和XGBoost。
SVM算法是一种监督学习算法, 广泛应用于统计分类以及回归分析中, 本试验选用线性核(linear kernel)作为SVM的核函数[26]。XGBoost算法也是一种监督学习算法, 是将多个弱分类器集成在一起, 形成一个强分类器的算法, 并通过计算分类器的残差确定每个分类器的权重, 同时加入正则项防止数据过拟合, 在计算残差时对代价函数进行二阶泰勒展开, 得到的结果更加精确[27-28]。
单因素方差分析由IBM SPSS Statistics 19(IBM corporation, USA)完成, SVM算法由Matlab 2017(The MathWorks, Inc., Natick, MA, USA)完成, XGBoost算法由PyCharm(JetBrains, The Czech Republic)集成开发环境完成。
2 结果与分析 2.1 叶绿素荧光参数的提取将采集到的荧光图像(图 3-a)经过RGB阈值分割(R通道阈值约为20/255, G通道阈值约为160/255)得到粗分割后的图像(图 3-b), 图像粗分割后虽然大部分背景噪声被滤除, 但仍存在一些点噪声, 会影响后续处理。而中值滤波方法对于去除点噪声的效果卓越, 因此采用中值滤波(参数为5×5)对粗分割后的图像进一步处理得到精分割图像(图 3-c)。此步骤后, 背景噪声基本被滤除, 再次采用RGB阈值分割(G通道阈值约为170/255, B通道阈值约为110/255)得到病斑区域图像(图 3-d), 最终通过图像膨胀得到感兴趣的病害区域(图 3-e)。使用Matlab绘图区打开图像, 通过滑动数据游标观察得到具体阈值。由于各个植株拍摄环境及病害特征类似, 所以该分割适用于本试验所有样本。该分割方法是各种图像分割方法中速度最快、计算最简单的方法, 能满足本试验的要求。后续则对该区域进行荧光参数特征提取。其中, 健康植株进行到第4步提取病斑时出现全黑图像, 没有病斑点。因此, 使用精分割后的图像进行后续处理。由于少数早期病害的植株, 其病斑区域小, 病斑颜色变化不明显, 在提取病斑时表现和健康植株一样, 此时则与健康植株一样处理, 采用精分割后的图像进行后续操作。由于精分割后的图像是整株植物的图像, 早期病害植株整体叶绿素荧光较健康植株仍有差异, 所以这样操作对后续试验结果影响较小。

|
图 3 病斑区域提取过程 Fig. 3 Extraction process of disease spots area |
从表 1可见:病害组植株叶绿素含量及氮含量呈逐渐下降趋势, 对照组植株的叶绿素含量和氮含量基本保持稳定。同时, 病害组的氮含量及叶绿素含量的标准差比对照组大, 说明不同植株受病害影响的程度也有一定差异。病害组在接种后第2天, 其叶绿素含量和氮含量与对照组相比存在明显变化, 而对照组在监测期间基本无显著性差异。
| 接种后时间/d Time after inoculation |
褐斑病组Brown spot group | 炭疽病组Anthrax disease group | 对照组Control group | |||||
| 氮含量/(mg·g-1) Nitrogen content |
叶绿素含量(SPAD) Chlorophyll content |
氮含量/(mg·g-1) Nitrogen content |
叶绿素含量(SPAD) Chlorophyll content |
氮含量/(mg·g-1) Nitrogen content |
叶绿素含量(SPAD) Chlorophyll content |
|||
| 0 | 3.57±0.06a | 50.26±2.86a | 3.57±0.15a | 49.92±2.97a | 3.58±0.13ab | 49.72±2.76a | ||
| 1 | 3.42±0.23ab | 45.24±5.05b | 3.50±0.18a | 48.38±3.35a | 3.56±0.13ab | 48.81±3.72a | ||
| 2 | 3.31±0.22bc | 44.07±4.36bc | 3.48±0.16ab | 48.18±4.06a | 3.64±0.16a | 48.29±2.92a | ||
| 3 | 3.25±0.24cd | 43.31±4.95bc | 3.40±0.28bc | 46.12±2.98b | 3.49±0.14b | 47.71±3.73a | ||
| 4 | 3.14±0.39d | 42.15±4.99c | 3.36±0.36c | 43.28±5.83c | 3.58±0.16ab | 49.19±2.91a | ||
| 注:同列不同字母表示在0.05水平差异显著。The different letters in a column mean significant difference at 0.05 level. | ||||||||
接种病菌前, 2组病害组黄瓜植株的氮含量与叶绿素含量差异不大。而接种病菌后, 褐斑病组叶片的氮含量与叶绿素含量下降相对较快, 而炭疽病组的氮含量与叶绿素含量下降相对较慢。因此, 褐斑病与炭疽病对植株营养参数产生不同影响, 也为后续区分2种病害提供了理论基础。
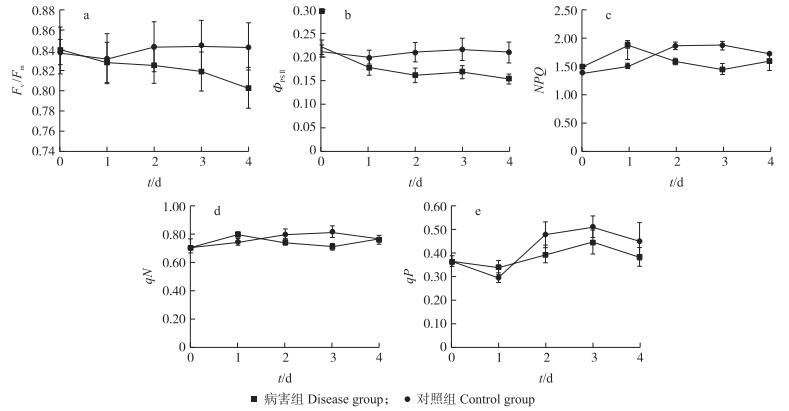
|
图 4 黄瓜植株叶绿素荧光参数变化 Fig. 4 Changes in chlorophyll fluorescence parameters of cucumber plants |
从图 5可知:病害组的Fv/Fm参数整体变化最为明显, 呈逐渐下降趋势, 而对照组基本保持稳定。参数ΦPSⅡ、NPQ、qN及qP的变化规律不明显, 病害组的ΦPSⅡ参数呈略微下降趋势, NPQ、qN与qP总体均呈上升趋势; 而对照组的ΦPSⅡ、NPQ、qN与qP基本保持稳定状态。单个叶绿素荧光参数虽然具有一定规律, 但远未达到对植株受到病害胁迫情况进行预测的程度, 因此, 需要结合各个荧光参数及各个荧光图像所提取的数据特征, 区分正常植株与患病植株, 对病害情况和种类进行预测。

|
图 5 黄瓜植株早期病害与晚期病害对比 Fig. 5 Comparison of early and late cucumber plant diseases |
通过12个荧光强度(F0、Fm、F×5和Fm′×5)和7个荧光参数(ΔF、Fv、Fv/Fm、ΦPSⅡ、NPQ、qN和qP)对黄瓜褐斑病植株、炭疽病植株及对照植株采用支持向量机(SVM)和极端梯度提升(XGBoost)算法进行分类, 并对其病害情况进行评估, 具体分类结果如表 2—表 5。
| 分类 Classify |
模板准确率/% Template accuracy rate |
基于SVM的病害预测结果 Disease prediction based on SVM |
预测准确率/% Forecast accuracy rate |
分类 Classify |
模板准确率/% Template accuracy rate |
基于SVM的病害预测结果 Disease prediction based on SVM |
预测准确率/% Forecast accuracy rate |
|||
| 对照组 Control group |
褐斑病组 Brown spot group |
对照组 Control group |
炭疽病组 Anthrax disease group |
|||||||
| 对照组Control group | 98.5 | 31 | 3 | 91.2 | 对照组Control group | 100.0 | 31 | 3 | 91.2 | |
| 褐斑病组 Brown spot group |
95.0 | 3 | 37 | 92.5 | 炭疽病组 Anthrax disease group |
96.3 | 5 | 35 | 87.5 | |
| 合计/平均Total/mean | 96.6 | 34 | 40 | 91.9 | 合计/平均Total/mean | 97.9 | 36 | 38 | 89.2 | |
| 分类 Classify |
模板准确率/% Template accuracy rate |
基于SVM的病害分类结果Disease classification based on SVM | 预测准确率/% Forecast accuracy rate |
||
| 对照组 Control group |
褐斑病组 Brown spot group |
炭疽病组 Anthrax disease group |
|||
| 对照组Control group | 90.1 | 26 | 4 | 4 | 76.4 |
| 褐斑病组Brown spot group | 95.0 | 1 | 38 | 1 | 95.0 |
| 炭疽病组Anthrax disease group | 92.5 | 5 | 2 | 33 | 82.5 |
| 合计/平均Total/mean | 92.9 | 32 | 44 | 38 | 85.1 |
| 分类 Classify |
模板准确率/% Template accuracy rate |
基于XGBoost的病害预测结果 Disease prediction based on XGBoost |
预测准确率/% Forecast accuracy rate |
分类 Classify |
模板准确率/% Template accuracy rate |
基于XGBoost的病害预测结果 Disease prediction based on XGBoost |
预测准确率/% Forecast accuracy rate |
|||
| 对照组 Control group |
褐斑病组 Brown spot group |
对照组 Control group |
炭疽病组 Anthrax disease group |
|||||||
| 对照组Control group | 100.0 | 31 | 3 | 91.2 | 对照组Control group | 100.0 | 31 | 4 | 88.2 | |
| 褐斑病组 Brown spot group |
98.7 | 1 | 39 | 97.5 | 炭疽病组 Anthrax disease group |
96.3 | 4 | 36 | 90.0 | |
| 合计/平均Total/mean | 99.3 | 32 | 42 | 94.6 | 合计/平均Total/mean | 97.9 | 34 | 40 | 89.2 | |
| 分类 Classify |
模板准确率/% Template accuracy rate |
基于XGBoost的病害分类结果Disease classification based on XGBoost | 预测准确率/% Forecast accuracy rate |
||
| 对照组 Control group |
褐斑病组 Brown spot group |
炭疽病组 Anthrax disease group |
|||
| 对照组Control group | 89.4 | 28 | 3 | 3 | 82.4 |
| 褐斑病组Brown spot group | 98.8 | 1 | 39 | 0 | 97.5 |
| 炭疽病组Anthrax disease group | 90.0 | 6 | 0 | 34 | 85.0 |
| 合计/平均Total/mean | 92.9 | 35 | 42 | 37 | 88.6 |
表 2和表 4展示的是2种算法对黄瓜植株对照组分别与褐斑病病害组和炭疽病病害组的2组分类结果。对于褐斑病, 分类算法给出的最高准确率为94.6%, 而炭疽病则最高为89.2%。表明分类算法对2种病害的区分均有不错的效果。
表 3和表 5展示的是2种算法对对照组与褐斑病组及炭疽病组的3组分类结果。对于3组分类, 分类算法达到的最高准确率为88.6%, 分类算法对于对照组和炭疽病组的误分率有明显提高, 而对于褐斑病, 2种分类算法的分类准确率都在95%以上。
结合4个表来看, 无论是2组分类还是3组分类, 褐斑病组分类准确率都比炭疽病组更高。可能的原因是试验中炭疽病的潜伏期较长, 病菌对植株叶绿体的破坏较慢所致; 也与患有褐斑病的黄瓜植株营养参数变化明显吻合。这说明褐斑病组对植株叶绿素的影响相比炭疽病组大。该结果相较于马浚诚等[7]使用卷积神经网络的方法对2种病斑区别较为显著的黄瓜植株RGB图片(霜霉病和白粉病)分类的准确率减少约5%。本试验采用的是病斑RGB图片类似的植株, 且采用的叶绿素荧光参数代替深度学习方法的图像特征提取过程, 将原先使用深度学习算法无差别分析每个像素点的方法优化为对荧光参数进行分类, 节约运算成本, 对植株病害分类的应用很有前景。
2.4 黄瓜炭疽病与褐斑病的早期监测试验发现, 病害组样本在接种24 h时叶片无明显变化, 在接种48 h左右部分叶片出现轻微病斑, 72 h后出现明显病斑, 因此, 将未发生明显变化的样本定义为病害早期样本(接种后1、2 d)共60(30×2)个, 将发生明显病害的样本定义为病害晚期样本(接种后3、4 d), 晚期样本也为60(30×2)个。早期病害样本与晚期病害样本如图 5所示。
表 6—表 9是使用SVM和XGBoost对病害程度进行分类的结果。表 6和表 8展示的是通过2种算法对对照组分别与褐斑病和炭疽病2种病害在病害早期和病害晚期的分类结果。褐斑病的病害程度分类准确率最高为87.8%, 炭疽病的病害程度分类准确率最高为85.1%, XGBoost算法分类准确率较SVM算法更高。相较于表 2和表 4, 在添加了分类条件后, 分类的准确率虽有下降, 但整体降幅不大, XGBoost算法的总体准确率仍然在85%以上。对褐斑病早期植株的分类准确率略高于晚期植株的分类准确率。对炭疽病早期植株的分类准确率略小于晚期植株的分类准确率。病害早期植株较晚期植株更容易被误分为对照组植株。
| 分类 Classify |
模板准确率/% Template accuracyrate |
基于SVM的病害情况预测结果 Disease prediction based on SVM |
预测准确率/% Forecast accuracy rate |
分类 Classify |
模板准确率/% Template accuracyrate |
基于SVM的病害情况预测结果 Disease prediction based on SVM |
预测准确率/% Forecast accuracy rate |
|||||
| 对照组 Control group |
褐斑病早期 Early stage of brown spot |
褐斑病晚期 Late stage of brown spot |
对照组 Control group |
炭疽病早期 Early stage of anthrax |
炭疽病晚期 Late stage of anthrax |
|||||||
| 对照组 Control group |
98.5 | 27 | 5 | 2 | 79.4 | 对照组 Control group |
100.0 | 29 | 3 | 2 | 85.3 | |
| 褐斑病早期 Early stage of brown spot |
85.0 | 0 | 17 | 3 | 85.0 | 炭疽病早期 Early stage of anthrax |
97.5 | 2 | 15 | 3 | 75.0 | |
| 褐斑病晚期 Late stage of brown spot |
92.5 | 0 | 3 | 17 | 85.0 | 炭疽病晚期 Late stage of anthrax |
97.5 | 1 | 2 | 17 | 85.0 | |
| 合计/平均 Total/mean |
93.2 | 27 | 25 | 22 | 82.4 | 合计/平均 Total/mean |
98.6 | 32 | 20 | 22 | 82.4 | |
| 分类 Classify |
模板准确率/% Template accuracy rate |
基于SVM病害分类及病害程度预测结果 Disease classification and disease degree prediction results based on SVM |
预测准确率/% Forecast accuracyrate |
||||
| 对照组 Control group |
褐斑病早期 Early stage of brown spot |
褐斑病晚期 Late stage of brown spot |
炭疽病早期 Early stage of anthrax |
炭疽病晚期 Late stage of anthrax |
|||
| 对照组Control group | 87.9 | 27 | 0 | 3 | 3 | 1 | 79.4 |
| 褐斑病早期Early stage of brown spot | 90.0 | 0 | 15 | 5 | 0 | 0 | 75.0 |
| 褐斑病晚期Late stage of brown spot | 95.0 | 0 | 5 | 15 | 0 | 0 | 75.0 |
| 炭疽病早期Early stage of anthrax | 87.5 | 4 | 0 | 0 | 13 | 3 | 65.0 |
| 炭疽病晚期Late stage of anthrax | 90.0 | 2 | 2 | 0 | 1 | 15 | 75.0 |
| 合计/平均 Total/mean |
89.8 | 33 | 22 | 23 | 17 | 19 | 74.6 |
| 分类 Classify |
模板准确率/% Template accuracyrate |
基于XGBoost的病害情况预测结果 Disease prediction based on XGBoost |
预测准确率/% Forecast accuracy rate |
分类 Classify |
模板准确率/% Template accuracyrate |
基于XGBoost的病害情况预测结果 Disease prediction based on XGBoost |
预测准确率/% Forecast accuracy rate |
|||||
| 对照组 Control group |
褐斑病早期 Early stage of brown spot |
褐斑病晚期 Late stage of brown spot |
对照组 Control group |
炭疽病早期 Early stage of anthrax |
炭疽病晚期 Late stage of anthrax |
|||||||
| 对照组 Control group |
97.0 | 31 | 3 | 0 | 91.2 | 对照组 Control group |
93.9 | 28 | 4 | 2 | 82.4 | |
| 褐斑病早期 Early stage of brown spot |
92.5 | 0 | 18 | 2 | 90.0 | 炭疽病早期 Early stage of anthrax |
87.5 | 2 | 16 | 2 | 80.0 | |
| 褐斑病晚期 Late stage of brown spot |
87.5 | 0 | 4 | 16 | 80.0 | 炭疽病晚期 Late stage of anthrax |
90.0 | 0 | 1 | 19 | 95.0 | |
| 合计/平均 Total/mean |
93.2 | 31 | 25 | 18 | 87.8 | 合计/平均 Total/mean |
90.4 | 30 | 21 | 23 | 85.1 | |
| 分类 Classify |
模板准确率/% Template accuracy rate |
基于XGBoost病害分类及病害程度预测结果 Disease classification and disease degree prediction results based on XGBoost |
预测准确率/% Forecast accuracyrate |
||||
| 对照组 Control group |
褐斑病早期 Early stage of brown spot |
褐斑病晚期 Late stage of brown spot |
炭疽病早期 Early stage of anthrax |
炭疽病晚期 Late stage of anthrax |
|||
| 对照组Control group | 92.4 | 30 | 0 | 0 | 3 | 1 | 88.2 |
| 褐斑病早期Early stage of brown spot | 92.5 | 0 | 17 | 2 | 1 | 0 | 85.0 |
| 褐斑病晚期Late stage of brown spot | 85.0 | 0 | 5 | 15 | 0 | 0 | 75.0 |
| 炭疽病早期Early stage of anthrax | 85.0 | 4 | 1 | 0 | 13 | 0 | 65.0 |
| 炭疽病晚期Late stage of anthrax | 87.5 | 2 | 0 | 1 | 2 | 15 | 75.0 |
| 合计/平均 Total/mean |
89.8 | 36 | 23 | 18 | 19 | 18 | 78.9 |
表 7与表 9是2种算法对黄瓜植株对照组、褐斑病早期组与晚期组及炭疽病早期与病害晚期组的5组分类结果。XGBoost分类器取得的分类准确率更高, 总体为78.9%。各个分组的分类准确率相对其他的分类结果都有明显下降, 最终分类成功率接近80%, 具有一定研究意义。褐斑病植株早期的分类准确率高于晚期, 而炭疽病植株晚期的分类准确率高于早期。
通过表 6—表 9中褐斑病早、晚期和炭疽病早、晚期准确率存在差异的试验结果, 推断出褐斑病早期与晚期的叶绿素变化不明显, 而病害组早期与对照组的变化相对明显, 因此病害早期植株的分类准确率略大于病害晚期植株的。炭疽病早期叶绿素变化不明显, 而晚期叶绿素变化较为明显, 与炭疽病相对褐斑病叶绿素和氮含量变化相对速度较慢的结果相对应。炭疽病菌相较于褐斑病菌可能有更长的潜伏时间。
综上, 由于褐斑病病害程度预测准确率整体较炭疽病高, 推测褐斑病对植株叶绿体的影响较炭疽病大。同时, XGBoost算法的分类结果比SVM算法整体较优, 可能的原因是XGBoost算法使用了一阶和二阶导数来优化损失函数, 使用正则项来解决过拟合的问题, 使分类结果更优。但总体来说, SVM算法也是一种运用较广、且算法原理较为成熟的方法, 可以根据实际情况选用。
3 结论本文通过设计叶绿素荧光图像采集系统对整株植物顶端部位的叶绿素荧光参数进行提取, 并分析发病黄瓜植株生长参数(叶绿素含量及氮含量)的变化。通过对叶绿素荧光参数(Fv/Fm、ΦPSⅡ、NPQ、qN、qP)的分析, 发现Fv/Fm随病害程度的加深而显著降低。将提取的荧光强度与荧光动力学参数结合, 并使用SVM算法及XGBoost算法对染病黄瓜植株进行分类和早期监测, 其中XGBoost算法对于黄瓜植株病害的分类准确率和病情分类准确率整体较高, 为较优算法。黄瓜褐斑病相较于炭疽病对于植株叶绿素的影响更为明显。该系统实现了温室黄瓜褐斑病和炭疽病的准确识别, 随着数据的进一步完善, 该系统可在现有基础上扩充病害种类, 进一步提升其应用价值。
| [1] |
吴桥.黄瓜褐斑病菌(Corynespora cassiicola)生物学特性、遗传多样性及防治基础研究[D].沈阳: 沈阳农业大学, 2017. Wu Q. The biological properties, genetic diversity and fundermental control of Corynespora cassiicola from cucumber brown spot[D]. Shenyang: Shenyang Agricultural University, 2017(in Chinses with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10157-1017124286.htm |
| [2] |
张凌云. 大棚黄瓜栽培常见病害问题与防治研究[J]. 农业与技术, 2018, 38(20): 100. Zhang L Y. Research on the problems and prevention of common diseases of cucumber cultivation in greenhouses[J]. Agriculture and Technology, 2018, 38(20): 100. |
| [3] |
吴宝忠, 任振辉, 王娟. 基于手机APP的温室大棚温湿度自动控制系统设计[J]. 中国农机化学报, 2018, 39(4): 68-71. Wu B Z, Ren Z H, Wang J. Design of automatic control system for temperature and humidity in greenhouse based on mobile phone APP[J]. Journal of Chinese Agricultural Mechanization, 2018, 39(4): 68-71. |
| [4] |
张宁, 谭亲跃, 张戈风. 温室地上环境因子模型研究综述[J]. 中国农学通报, 2019, 35(2): 93-99. Zhang N, Tan Q Y, Zhang G F. Ground environment factor model in greenhouse:a review[J]. Chinese Agricultural Science Bulletin, 2019, 35(2): 93-99. |
| [5] |
杜玉红, 孙文新. 基于计算机视觉技术的玉米叶绿素含量检测研究[J]. 农机化研究, 2017, 39(8): 199-201. Du Y H, Sun W X. Maize chlorophyll content detection based on computer vision technology[J]. Journal of Agricultural Mechanization Research, 2017, 39(8): 199-201. |
| [6] |
刘恩泽, 吴文福. 基于机器视觉的农作物表面多特征决策融合病变判断算法[J]. 吉林大学学报(工学版), 2018, 48(6): 1873-1878. Liu E Z, Wu W F. Agricultural surface multiple feature decision fusion disease judgment algorithm based on machine[J]. Journal of Jilin University(Engineering and Technology Edition), 2018, 48(6): 1873-1878. |
| [7] |
马浚诚, 杜克明, 郑飞翔, 等. 基于卷积神经网络的温室黄瓜病害识别系统[J]. 农业工程学报, 2018, 34(12): 186-192. Ma J C, Du K M, Zheng F X, et al. Disease recognition system for greenhouse cucumbers based on deep convolutional neural network[J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(12): 186-192. |
| [8] |
朱文静, 李林, 李美清, 等. 红外热成像与近红外光谱结合快速检测潜育期番茄花叶病[J]. 光谱学与光谱分析, 2018, 38(9): 2757-2762. Zhu W J, Li L, Li M Q, et al. Rapid detection of tomato mosaic disease in incubation period by infrared thermal imaging and near infrared spectroscopy[J]. Spectroscopy and Spectral Analysis, 2018, 38(9): 2757-2762. |
| [9] |
丁永军, 李民赞, 孙红, 等. 基于多光谱图像技术的番茄营养素诊断模型[J]. 农业工程学报, 2012, 28(8): 175-180. Ding Y J, Li M Z, Sun H, et al. Diagnosis model of tomato nutrient content based on multispectral images[J]. Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(8): 175-180. |
| [10] |
张爱武, 张泰配, 康孝岩, 等. 高光谱成像分析植物叶片滞尘前后光谱特征变化[J]. 农业工程学报, 2018, 34(19): 170-176. Zhang A W, Zhang T P, Kang X Y, et al. Changes of spectral characteristics of plant leaves before and after dust-retention under hyperspectral imaging[J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(19): 170-176. |
| [11] |
谢亚平, 陈丰农, 张竞成, 等. 基于高光谱技术的农作物常见病害监测研究[J]. 光谱学与光谱分析, 2018, 38(7): 2233-2240. Xie Y P, Chen F N, Zhang J C, et al. Study on monitoring of common diseases of crops based on hyperspectral technology[J]. Spectroscopy and Spectral Analysis, 2018, 38(7): 2233-2240. |
| [12] |
许凯雯.基于高光谱成像技术的大麦真菌病害早期检测的研究[D].杭州: 浙江大学, 2018. Xu K W. Study of the early detection of fungal disease of barley seedlings based on hyperspectral imaging technology[D]. Hangzhou: Zhejiang University, 2018(in Chinses with English abstract). https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&filename=1018162332.nh |
| [13] |
朱文静, 毛罕平, 李青林, 等. 偏振-高光谱多维光信息的番茄叶片营养诊断[J]. 光谱学与光谱分析, 2014, 34(9): 2500-2505. Zhu W J, Mao H P, Li Q L, et al. Study on the polarized reflectance-hyperspectral information fusion technology of tomato leaves nutrient diagnoses[J]. Spectroscopy and Spectral Analysis, 2014, 34(9): 2500-2505. |
| [14] |
Krause G H, Weis E. Chlorophyll fluorescence as a tool in plant physiology:Ⅱ. Interpretation of fluorescence signals[J]. Photosynthesis Research, 1984, 5(2): 139-157. |
| [15] |
Krause G H, Weis E. Chlorophyll fluorescence and photosynthesis:the basics[J]. Annual Review of Plant Physiology, 1991, 42(42): 313-349. |
| [16] |
Sharma D K, Fernández J O, Rosenqvist E, et al. Genotypic response of detached leaves versus intact plants for chlorophyll fluorescence parameters under high temperature stress in wheat[J]. Journal of Plant Physiology, 2014, 171(8): 576-586. |
| [17] |
Baker R N. Applications of chlorophyll fluorescence can improve crop production strategies:an examination of future possibilities[J]. J Exp Bot, 2004, 55(403): 1607-1621. |
| [18] |
Schächtl J, Huber G, Maidl F X, et al. Laser-induced chlorophyll fluorescence measurements for detecting the nitrogen status of wheat(Triticum aestivum L.)canopies[J]. Precision Agriculture, 2005, 6(2): 143-156. |
| [19] |
陈兵, 王克如, 李少昆, 等. 病害胁迫对棉叶光谱反射率和叶绿素荧光特性的影响[J]. 农业工程学报, 2011, 27(9): 86-93. Chen B, Wang K R, Li S K, et al. The effects of disease stress on spectra reflectance and chlorophyll fluorescence characteristics of cotton leaves[J]. Transactions of the Chinese Society of Agricultural Engineering, 2011, 27(9): 86-93. |
| [20] |
Bürling K, Hunsche M, Noga G. Use of blue-green and chlorophyll fluorescence measurements for differentiation between nitrogen deficiency and pathogen infection in winter wheat[J]. Journal of Plant Physiology, 2011, 168(14): 1641-1648. |
| [21] |
Chiu Y, Hsu W, Chang Y. Detecting cabbage seedling diseases by using chlorophyll fluorescence[J]. Engineering in Agriculture, Environment and Food, 2015, 8(2): 95-100. |
| [22] |
Lei R, Jiang H, Hu F, et al. Chlorophyll fluorescence lifetime imaging provides new insight into the chlorosis induced by plant virus infection[J]. Plant Cell Reports, 2016, 36(2): 1-15. |
| [23] |
Tung J, Goodwin P H, Hsiang T. Chlorophyll fluorescence for quantification of fungal foliar infection and assessment of the effectiveness of an induced systemic resistance activator[J]. European Journal of Plant Pathology, 2013, 136(2): 301-315. |
| [24] |
Cen H, Weng H, Yao J, et al. Chlorophyll fluorescence imaging uncovers photosynthetic fingerprint of Citrus huanglongbing[J]. Frontiers in Plant Science, 2017, 8: 1509. |
| [25] |
隋媛媛, 王庆钰, 于海业. 基于叶绿素荧光光谱指数的温室黄瓜病害预测[J]. 光谱学与光谱分析, 2016, 36(6): 1779-1782. Sui Y Y, Wang Q Y, Yu H Y. Prediction of greenhouse cucumber disease based on chlorophyll fluorescence spectrum index[J]. Spectroscopy and Spectral Analysis, 2016, 36(6): 1779-1782. |
| [26] |
鲁淑霞, 蔡莲香, 张罗幻. 基于零阶减小方差方法的鲁棒支持向量机[J]. 计算机科学, 2019, 46(11): 193-201. Lu S X, Cai L X, Zhang L H. Robust SVM based on zeroth order variance reduction[J]. Computer Science, 2019, 46(11): 193-201. |
| [27] |
王青松, 谢兴生, 佘颢. 基于CNN-XGBoost混合模型的短时交通流预测[J]. 测控技术, 2019, 38(4): 37-40, 67. Wang Q S, Xie X S, She H. Short-term traffic flow prediction based on CNN-XGBoost hybrid model[J]. Measurement & Control Technology, 2019, 38(4): 37-40, 67. |
| [28] |
Shi X, Wong Y D, Li M Z, et al. A feature learning approach based on XGBoost for driving assessment and risk prediction[J]. Accident Analysis & Prevention, 2019, 129: 170-179. |




