文章信息
- 宋昕昊, 杨丹, 季春雷, 王佩蓉, 张静静, 彭麟, 高修歌, 季辉, 江善祥
- SONG Xinhao, YANG Dan, JI Chunlei, WANG Peirong, ZHANG Jingjing, PENG Lin, GAO Xiuge, JI Hui, JIANG Shanxiang
- 马度米星铵对克氏原鳌虾肝胰腺药物代谢酶活性及其基因表达的影响
- Effects of maduramicin on the activity and gene expression level of hepatopancreas drug-metabolizing enzymes of Procambarus clarkia
- 南京农业大学学报, 2020, 43(4): 720-727
- Journal of Nanjing Agricultural University, 2020, 43(4): 720-727.
- http://dx.doi.org/10.7685/jnau.201909009
-
文章历史
- 收稿日期: 2019-09-04
马度米星铵属于单价糖苷聚醚离子载体抗生素, 其抗球虫活性强、抗虫谱广且球虫不易产生耐药性, 被广泛用于防治肉鸡球虫病[1]。大部分马度米星铵以药物原型经鸡的粪便排出[2], 粪便作为水体肥料进入水中, 导致马度米星铵污染水体等生态环境。据报道, 人误食马度米星铵会导致横纹肌溶解等中毒症状, 因而进入水体的马度米星铵作为外源污染物, 可能对水产动物健康和人类食品安全构成潜在威胁[3]。水体中的马度米星铵进入水生动物体内后进行生物转化, 这一过程中药物代谢酶起重要作用, 可将马度米星铵等外源性化学物进行代谢分解, 降低药物浓度, 从而起到解毒作用。研究药物代谢酶活性对马度米星铵的响应, 可以筛选出敏感的生物标志物检测水体中马度米星铵污染。
药物代谢酶包括Ⅰ相药物代谢酶和Ⅱ相药物代谢酶。Ⅰ相药物代谢酶以细胞色素P450(CYP450)最为重要, 它是一类亚铁血红素蛋白的超家族酶系, 广泛存在于生物体中, 参与多种内源化学物和外源化学物在生物体内的代谢[4]。Ⅱ相药物代谢酶主要为谷胱甘肽S-转移酶(GST)、葡萄糖醛酸转移酶(UGT)、N-乙酰基转移酶(NAT)等, 主要作用是与Ⅰ相代谢产物结合, 使有毒化合物某些官能团失活, 或者增加其水溶性, 加快代谢产物排除[5-6]。在水产动物药物代谢酶活性方面, 国内外的研究主要集中于污染物对酶活性的影响[7-10]。因此, 深入研究水产动物药物代谢酶变化对揭示外源性污染物的生态毒性具有重要科学意义。
克氏原鳌虾又称小龙虾, 是淡水鳌虾的一种, 对外界环境有很强的适应能力。因其摄食性广、生存力强, 常作为一种检测水环境污染的指示动物[11]。目前, 国内外尚未见马度米星铵对克氏原螯虾药物代谢酶影响的相关报道。因此, 本试验研究了不同剂量的马度米星铵对克氏原鳌虾肝胰腺中药物代谢酶的影响, 以期探讨药物代谢酶对马度米星铵的生物响应并探索适合指示马度米星铵污染水体的生物标志物, 为评估马度米星铵对水体环境产生的风险提供理论依据。
1 材料与方法 1.1 试验药物和试剂马度米星铵(纯度>91.9%)购于浙江汇能生物股份有限公司; 考马斯亮蓝蛋白测定试剂盒购于南京建成科技有限公司; NAT、GST、UGT、CYP450酶联免疫分析试剂盒均购于上海江莱生物科技有限公司; Total RNA Kit Ⅰ购于Omega公司; RNAiso Plus、PrimeScriptTM RT reagent Kit with gDNA Eraser、SYBR Premix Ex Taq Ⅱ均购于TaKaRa公司。其他常规试剂均为国产分析纯。
1.2 试验主要仪器微型旋涡混合仪(XW-80A), 上海沪西分析仪器厂有限公司; 高速台式冷冻离心机(3K15, Sigma公司); PCR仪(T100型)、荧光定量PCR仪(CFX96型)、全自动酶标仪(iMark), 美国Bio-Rad公司; 电子分析天平(BS.210S型), 北京赛多利斯天平有限公司。
1.3 试验动物与饲养平均体质量为(21±2.05)g的健康雄性克氏原鳌虾, 购于江苏省淡水研究所, 饲养于南京农业大学实验动物中心。饲养虾水是经24 h曝气的自来水, pH值为7.0~7.4, 水温保持在(21±2)℃, 水中溶氧6.0 mg·L-1以上。每2 d换1次水, 每天饲喂相当于虾体质量1%的不含抗生素等药物的饵料(螺丝肉)。虾在PCV框中预饲养1周, 饲养密度为24尾/框, 预养结束后, 分组试验。
1.4 试验分组与给药采用药浴给药方法, 根据克氏原鳌虾对马度米星铵的半数致死浓度(LC50)[12], 设定低、中、高3个剂量组, 分别为LC50的1/100(0.7 mg·L-1)、1/20(3.5 mg·L-1)和1/10(7.0 mg·L-1), 另设空白对照组。试验用192尾雄性克氏原鳌虾, 每组48尾。试验期间每天定点喂食, 每2 d换1次药浴液, 每次采样前禁食12 h。在给药后的7、14、21和28 d取样, 每组每个时间点取12尾, 迅速取肝胰腺组织用预冷的0.15 mol·L-1 KCl溶液清洗血液后, 在液氮中快速冷冻后于-80 ℃保存, 用于后续测定。
1.5 肝胰腺代谢酶活性的测定 1.5.1 肝微粒体制备本试验肝微粒体制备采用钙离子沉淀法[13]。将肝胰腺从-80 ℃冰箱中取出称质量, 以1:5的比例(质量体积比)加入匀浆液(0.05 mol·L-1 Tris-HCl, 含0.01 mol·L-1 EDTA、0.15 mol·L-1 KCl、100 g·L-1蔗糖), 冰浴匀浆5 min, 然后4 ℃、10 000 g离心20 min, 吸出上清液, 每1 mL液体加入0.1 mL CaCl2(88 mmol·L-1)混合, 冰浴10 min后, 4 ℃、15 000 g离心40 min, 用缓冲液洗涤1次, 所得沉淀用悬浮液(0.05 mol·L-1 Tris-HCl, 含0.01 mol·L-1 EDTA、0.15 mol·L-1 KCl、200 mL·L-1甘油)混悬, -80 ℃保存。
1.5.2 肝微粒体蛋白含量和CYP450含量测定将肝微粒体悬液取出, 采用Bradford法[14]测定蛋白含量, 最终将蛋白浓度均稀释成1 mg·mL-1。采用细胞色素CYP450酶联免疫分析试剂盒测定虾CYP450含量。
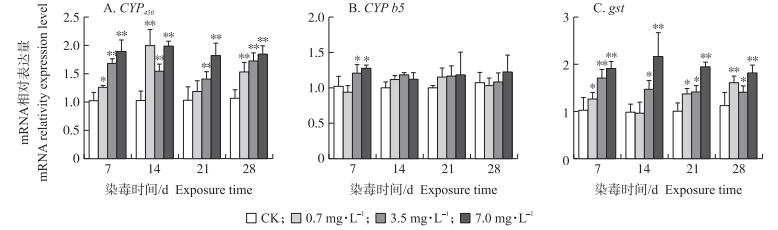
1.5.3 CYP b5含量测定取0.2 mL微粒体悬液与1.8 mL Tris-HCl(0.05 mol·L-1)混合, 加入4~5 mg连二亚硫酸钠, 充分混匀后, 用紫外分光光度计测定吸光值(A424和A490)。CYP b5含量(nmol·mg-1)计算公式为:
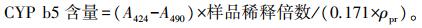
|
式中:0.171为吸光系数; ρpr为样品蛋白质质量浓度(mg·mL-1)。
1.5.4 氨基比林-N-脱甲基酶(APND)活性测定参照文献[15], 取0.1 mol·L-1 Tris-HCl(pH7.4)缓冲液1.7 mL, 加入微粒体悬液0.1 mL、氨基比林(24 g·L-1)0.1 mL, 25 ℃水浴2 min后, 加入10 mmol·L-1 NADPH 0.1 mL, 25 ℃水浴30 min。再加入150 g·L-1ZnSO40.35 mL, 混匀, 冰浴5 min, 加入饱和Ba(OH)2 0.35 mL, 混匀, 室温放置5 min后, 2 500 g离心10 min, 自来水下冷却。每孔吸取100 μL加入96孔板, 再加入100 μL Nash试剂, 混匀, 每组3个平行, 放于酶标仪中测定D420值。
1.5.5 红霉素-N-脱甲基酶(ERND)活性测定将底物更换为4 mmol·L-1的红霉素[16], 其余步骤参照APND活性测定。
1.5.6 苯胺-4一羟化酶(AH)活性测定AH活性测定参照文献17], 取1 mL 1 mmol·L-1 NADPH溶液和0.5 mL苯胺溶液, 混匀, 25 ℃水浴2 min。加入0.5 mL微粒体悬液, 25 ℃水浴30 min, 加入预冷的200 g·L-1 TCA 1 mL, 冰浴5 min, 13 500 g离心10 min, 取1 mL上清液于新的试管, 加入1 mL 10 g·L-1酚和1 mL碳酸钠, 混匀, 室温静置30 min, 吸取200 μL于96孔板, 每组3个重复, 放于酶标仪中测定D630值。
1.5.7 GST、UGT和NAT活性测定分别使用NAT、GST和UGT酶联免疫分析试剂盒测定虾NAT、GST和UGT活性。
1.6 肝胰腺CYP450、CYP b5和gst基因表达水平测定 1.6.1 肝胰腺总RNA提取和cDNA合成及引物设计将-80 ℃保存的肝胰腺组织解冻后, 根据OMEGA试剂盒说明书提取总RNA, 用TaKaRa反转录试剂盒进一步反转录成cDNA。根据GenBank上发表的克氏原鳌虾的gst、CYP b5和CYP450基因序列, 运用Primer Premier 5.0软件设计引物, 引物由南京擎科生物科技有限公司合成。引物序列详见表 1。
| 目的基因 Target gene |
引物对序列 Primer pairs sequences(5′→3′) |
GenBank序列号 GenBank ID |
| CYP450 | GGAAATTCGAGACCAGCAAATAC/GATACCAGCCTCAAACTCACC | KT894938.1 |
| CYP b5 | ACTAAAGCAATAACTCCTCC/CTTCTTAATCCCTACCTCCT | NC014342.1 |
| gst | ACTTAGAGACGGACTTCCAG/CGAGGGCGAACTTCACGG | HQ414581.1 |
| 18S | CTGTGATGCCCTTAGATGTT/GCGAGGGGTAGAACATCCAA | X90672.1 |
使用TaKaRa(SYBR® Premix Ex Taq Ⅱ)试剂盒用于RT-qPCR分析。将cDNA稀释5倍, 荧光定量反应体系25 μL:荧光预混液12.5 μL, 上、下游引物各0.5 μL, DNA模板2 μL和灭菌水9.5 μL。反应过程:95 ℃ 30 s; 95 ℃ 5 s; 60 ℃ 30 s, 40个循环; 95 ℃ 10 s; 65 ℃ 5 s; 95 ℃ 5 s。
1.7 数据处理及分析数据结果均以平均值±标准误(x±SE)表示, 用GraphPad 5绘制柱状图, 采用SPSS 22.0软件进行单因素方差分析。运用LSD法检验确定处理组与对照组间的差异显著性。
2 结果与分析 2.1 马度米星铵对克氏原鳌虾肝胰腺Ⅰ相药物代谢酶的影响 2.1.1 对CYP450和CYP b5含量的影响如图 1所示:0.7 mg·L-1马度米星铵处理21和28 d后, CYP450含量均显著高于对照组(P < 0.05), 而7.0 mg·L-1马度米星铵处理7、14、21和28 d后, CYP450含量均显著高于对照组(P < 0.05)。各组克氏原鳌虾肝胰腺CYP b5含量各时间点相比对照组均有波动, 但差异均不显著(P > 0.05)。

|
图 1 不同浓度马度米星铵对克氏原鳌虾肝胰腺细胞色素P450(CYP450)和细胞色素b5(CYP b5)含量的影响(n=6) Fig. 1 Effects of different concentration of maduramicin on the contents of cytochrome P450(CYP450)and cytochrome b5(CYP b5)in hepatopancreas of Procambarus clarkia *表示在同一时间点与对照组差异显著(P < 0.05)。下同。 Compared with control group at the same time point, *P < 0.05. The same as follows. |
如图 2-A所示:3.5 mg·L-1马度米星铵处理7、21和28 d后, APND活性均显著高于对照组(P < 0.05), 而7.0 mg·L-1马度米星铵处理14和21 d后, APND活性均显著高于对照组(P < 0.05), 且7 mg·L-1马度米星铵处理7和28 d后, APND活性均极显著高于对照组(P < 0.01)。
|
图 2 不同浓度马度米星铵对克氏原鳌虾肝胰腺Ⅰ相药物代谢酶活性的影响(n=6) Fig. 2 Effects of different concentration of maduramicin on the metabolic enzyme activities of phase Ⅰ drugs in hepatopancreas of P.clarkia APND:氨基比林-N-脱甲基酶Aminopyrine-N-demethylase; ERND:红毒素-N-脱甲基酶Erythromycin-N-demethylase; AH:苯胺-4-羟化酶Aniline-4-hydroxylase. **表示在同一时间点与对照组组间差异极显著(P < 0.01)。下同。Compared with control group at the same time point, **P < 0.01. The same as follows. |
如图 2-B所示:0.7 mg·L-1马度米星铵处理7、14和28 d后, ERND活性均显著高于对照组(P < 0.05), 3.5 mg·L-1马度米星铵处理7、21和28 d后, ERND活性均显著高于对照组(P < 0.05), 而7.0 mg·L-1马度米星铵处理7、14和28 d后, ERND活性均极显著高于对照组(P < 0.01)。
2.1.4 对AH活性的影响如图 2-C所示:0.7 mg·L-1马度米星铵处理14、21和28 d后, AH活性均显著高于对照组(P < 0.05), 而7.0 mg·L-1马度米星铵处理7、14、21和28 d后, AH活性均显著高于对照组(P < 0.05)。
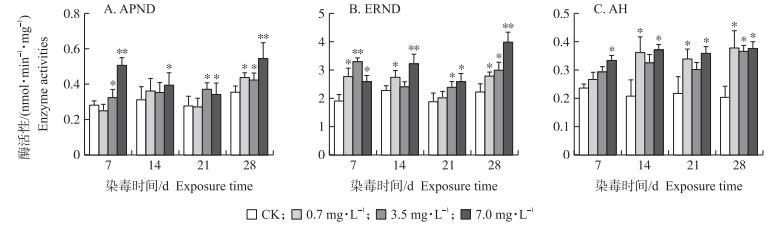
2.2 马度米星铵对克氏原鳌虾Ⅱ相药物代谢酶活性的影响 2.2.1 对GST活性的影响如图 3-A所示:3.5 mg·L-1马度米星铵处理14、21和28 d后, GST活性均显著高于对照组(P < 0.05), 7.0 mg·L-1马度米星铵处理7、14、21和28 d后, GST活性均显著高于对照组(P < 0.05)。
|
图 3 不同浓度马度米星铵对克氏原鳌虾肝胰腺Ⅱ相药物代谢酶活性影响(n=6) Fig. 3 Effect of different concentration of maduramicin on the metabolic enzyme activities of phase Ⅱ drugs in hepatopancreas of P.clarkia GST:谷胱甘肽S-转移酶Glutathione S-transferase; UGT:尿苷二磷酶葡萄糖醛酸转移酶Uridine diphospho-glucuronyl transferase; NAT:N-乙酰基转移酶N-acetyltransferase. |
如图 3-B所示:0.7 mg·L-1马度米星铵处理21和28 d后, UGT活性均显著高于对照组(P < 0.05), 7.0 mg·L-1马度米星铵处理7、14、21和28 d后, UGT活性均显著高于对照组(P < 0.05)。
2.2.3 对NAT活性的影响如图 3-C所示:0.7 mg·L-1马度米星铵处理21和28 d后, NAT活性均显著高于对照组(P < 0.05), 3.5 mg·L-1马度米星铵处理14、21和28 d后, NAT活性均显著高于对照组(P < 0.05), 7.0 mg·L-1马度米星铵处理7、14、21和28 d后, NAT活性均显著高于对照组(P < 0.05)。
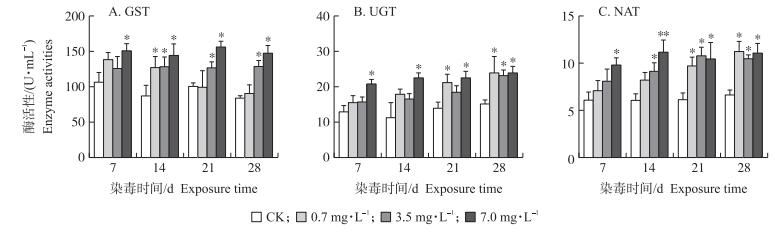
2.3 马度米星铵对克氏原鳌虾肝胰腺药物代谢酶相关基因mRNA表达量的影响 2.3.1 对CYP450 mRNA表达量的影响如图 4-A所示:0.7 mg·L-1马度米星铵处理14和28 d后, CYP450 mRNA相对表达量均极显著高于对照组(P < 0.01), 3.5和7.0 mg·L-1马度米星铵处理7、14、21和28 d后, CYP450 mRNA相对表达量均极显著高于对照组(P < 0.01)。
|
图 4 不同浓度马度米星铵对克氏原鳌虾肝胰腺药物代谢酶相关基因的mRNA相对表达量的影响(n=6) Fig. 4 Effect of different concentration of maduramicin on mRNA relative expression level of drug-metabolizing |
如图 4-B所示:3.5和7.0 mg·L-1马度米星铵处理7 d后, CYP b5 mRNA相对表达量均显著高于对照组(P < 0.05)。其他马度米星铵处理时间段的各组CYP b5 mRNA相对表达量相比对照组均无显著性差异(P > 0.05)。
2.3.3 对gst mRNA表达量的影响如图 4-C所示:0.7 mg·L-1马度米星铵处理7、21和28 d后, gst mRNA相对表达量均显著高于对照组(P < 0.05), 3.5 mg·L-1马度米星铵处理7、14、21和28 d后, gst mRNA相对表达量均显著高于对照组(P < 0.05), 7 mg·L-1马度米星铵处理7、14、21和28 d时, gst mRNA相对表达量均极显著高于对照组(P < 0.01)。
3 讨论 3.1 马度米星铵对克氏原鳌虾肝胰腺Ⅰ相药物代谢酶的影响CYP450酶系是生物对外源有机物代谢的第1阶段酶系, 由于其可被外源污染物诱导或抑制而使其活性(含量)显著增加或降低, CYP450常被用来作为生物标记物诊断环境污染。CYP450和CYP b5是药物代谢途径中最重要的电子传递系统, 在药物代谢中发挥非常重要的作用, 因此, 通常用CYP450和CYP b5含量变化来推断药物代谢酶活性是否被诱导或抑制[18]。APND、ERND和AH分别代表CYP2B、CYP3A和CYP2E1活性, 是生物体内参与外源性化合物Ⅰ相代谢反应过程中重要的解毒酶。CYP2B主要代谢亲脂性药物和固醇类药物, 使其转化为易于排泄的代谢产物, 从而起到解毒作用[19]。研究显示水产动物的CYP3A主要参与大部分亲脂性有机化合物的代谢, 其活性可受到药物、环境因素等影响[20]。CYP2E1是参与大部分药物和环境毒物代谢的关键酶。目前, 有关药物对CYP450基因表达及其酶活性影响的研究在甲壳类动物中较为匮乏。本实验室率先在此领域展开相关研究。
本研究结果显示, 马度米星铵可以诱导肝胰腺的总CYP450酶系含量。其中代表CYP3A的ERND活性变化最明显, 这可能是因为马度米星铵是亲脂性药物, 而CYP3A主要是代谢亲脂性药物的关键酶, 所以使其更易受到影响。王国永[21]报道的聚醚类离子载体抗生素对肉鸡CYP3A37具有诱导现象, 与本结果相一致。符贵红等[22]也发现脂溶性较高的氧氟沙星在草鱼肾细胞中对细胞色素P450 3A的诱导作用。基因表达水平方面, CYP450基因的表达量明显上调, 并且总体变化趋势存在剂量效应关系。CYP b5基因的表达量在7 d显著上调, 之后回到对照组表达量水平, 结合之前测定的CYP b5含量变化的趋势, 推测马度米星铵虽然早期可以诱导该基因的转录, 但在CYP b5转录翻译及翻译后修饰仍起重要作用, 故其含量未发生明显变化。总体而言, 马度米星铵对3种亚型酶的诱导程度不同, 说明不同亚型的CYP450酶的底物与外源性化合物亲和力不同, 或者结合位点不同, 故外源化合物对不同亚型CYP450酶的诱导具有一定程度的选择性, 表现为不同亚型酶被诱导时间的先后或诱导程度存在差异。
3.2 马度米星铵对克氏原鳌虾肝胰腺Ⅱ相药物代谢酶的影响GST、UGT和NAT是生物体内重要的Ⅱ相代谢酶。GST可以促使谷胱甘肽与亲电子性的外源化学物结合, 促进其排泄, 同时可减少外源性化学物与细胞成分的共价结合, 从而发挥解毒效果[23]。目前有关GST活性对污染物暴露的指示作用在水产动物中的研究较多。如王重刚等[9]研究苯并(a)芘、芘及其混合物暴露对梭鱼肝脏谷胱甘肽硫转移酶活性呈诱导作用。UGT也是体内重要的Ⅱ相代谢酶之一, 内外源性化合物及毒性代谢物清除与解毒的机制是其经UGT催化转化为极性较强的结合物, 后经肾脏排出体外, 从而完成内外源性化学物以及毒性代谢物在体内的代谢消除[24-25]。NAT主要作用为催化乙酰基团从乙酰CoA转移到其作用底物芳香胺及杂环胺类物质上, 在哺乳动物上主要参与活化或灭活芳香胺类药物[25-6]。
本研究中, 马度米星铵可使克氏原螯虾的GST活性显著升高, 推测可能是在马度米星铵胁迫下, 克氏原鳌虾通过激活体内GST, 以应对药物对机体各重要成分的损害作用。Oliveira等[27]在研究土霉素对斑马鱼的毒性作用时也发现了GST活性被显著诱导的现象; 聂湘平等[28]研究发现环丙沙星显著诱导异育银鲫和剑尾鱼GST活性。从处理14 d开始, GST活性呈良好的剂量效应关系, 初步判断GST可能作为指示马度米星铵污染水体的指示物, 后续将进一步探究。马度米星铵各剂量组的UGT活性与对照组相比均有所升高, 推测在马度米星铵胁迫下, 加快了UGT对非结核型胆红素选择性催化, 将其快速转化为水溶性胆红素葡萄糖醛酸结合物, 加速从干细胞分泌至胆汁中消除, 使解毒过程加快。在暴露期间, 克氏原鳌虾肝胰腺中gst基因表达量显著上调, 说明马度米星铵能迅速诱导gst基因的表达, 催化GSH等内源性化学物与Ⅰ相代谢产物结合, 从而减少外源性化学物与细胞成分的共价结合, 降低外源性化学物对机体产生的危害。随着暴露时间的延长, 并未有抑制现象出现, 这也间接解释了克氏原鳌虾对马度米星铵的耐受程度较高。Sabatini等[29]报道MC-LR拌料饲喂溪蟹时, 其肝胰腺中GST活性增加70%, GSH含量减少50%。总体来看, 3种Ⅱ相代谢酶对马度米星铵的响应中, GST较理想, 而UGT和NAT变化规律较差, 仅能得出总体呈诱导趋势, 不能作为良好的指示物。
综上所述, 马度米星铵能显著诱导克氏原鳌虾肝胰腺Ⅰ相和Ⅱ相药物代谢酶, 在试验期间无克氏原鳌虾死亡, 表明诱导药物代谢酶可以促进机体解毒, 增强其耐受性。Ⅰ相代谢酶ERND和Ⅱ相代谢酶GST对马度米星铵的响应较为敏感, 因此初步可将2种酶活性变化作为早期指示物, 进行多时段联合测定, 增强马度米星铵污染暴露指示的敏感性和有效性, 为评价马度米星铵在水体环境中的风险评估提供依据。
| [1] |
万恩怀, 邓俊良, 张述芳. 马杜霉素对肉仔鸡的毒性研究进展[J]. 畜牧与兽医, 2006, 38(4): 52-55. Wan E H, Deng J L, Zhang S F. Advances in studies on the toxicity of maduramycin to broilers[J]. Animal Husbandry and Veterinary Medicine, 2006, 38(4): 52-55 (in Chinese). DOI:10.3969/j.issn.0529-5130.2006.04.024 |
| [2] |
Bastianello S S, Fourie, N, Prozesky L, et al. Cardiomyopathy of ruminants induced by the litter of poultry fed on rations containing the ionophore antibiotic, maduramicin.Ⅰ. Epidemiology, clinical signs and clinical pathology[J]. The Onderstepoort Journal of Veterinary Research, 1991, 58: 291-296. |
| [3] |
邹建芳, 李娟, 李鹏, 等. 1例马杜霉素中毒并文献复习[J]. 中国职业医学, 2009, 36(6): 485-488. Zou J F, Li J, Li P, et al. 1 case of maduramycin poisoning and literature review[J]. China Occupational Medicine, 2009, 36(6): 485-488 (in Chinese). |
| [4] |
李晓宇, 刘皋林. CYP450酶特性及其应用研究进展[J]. 中国临床药理学与治疗学, 2008, 13(8): 942-946. Li X Y, Liu G L. Research advances on the characteristics and applications of CYP450 metabolic enzyme[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2008, 13(8): 942-946 (in Chinese with English abstract). DOI:10.3969/j.issn.1009-2501.2008.08.023 |
| [5] |
Baker S C, Arlt V M, Indra R, et al. Cytochrome P450 activity in muscle-invasive bladder cancer:a novel sub-group[J]. Urologic Oncology, 2017, 35(10): 608. |
| [6] |
韩永龙, 李丹, 孙习鹏, 等. 中药对Ⅱ相药物代谢酶GST和UGT的影响[J]. 中国药房, 2010, 21(3): 274-276. Han Y L, Li D, Sun X P, et al. Effect of traditional Chinese medicine on phase Ⅱ drug metabolizing enzymes GST and UGT[J]. China Pharmacy, 2010, 21(3): 274-276 (in Chinese). |
| [7] |
Ishizuka M, Hoshi H, Minamoto N, et al. Alterations of cytochrome P450-dependent monooxygenase activities in Eriocheir japonicus in response to water pollution[J]. Environmental Health Perspectives, 1996, 104(7): 774-778. DOI:10.1289/ehp.96104774 |
| [8] |
Taysse L, Chambras C, Marionnet D, et al. Basal level and induction of cytochrome P450, EROD, UDPGT and GST activities in carp(Cyprinus carpio)immune organs(spleen and head kidney)[J]. Bulletin of Environmental Contamination and Toxicology, 1998, 60: 300-305. DOI:10.1007/s001289900625 |
| [9] |
王重刚, 陈奕欣, 郑微云, 等. 苯并(a)芘、芘及其混合物暴露对梭鱼肝脏谷胱甘肽硫转移酶活性的影响[J]. 海洋科学, 2004, 28(3): 40-43. Wang C G, Chen Y X, Zhen W Y, et al. Effects of exposure to benzo(a)pyrene, pyrene and their mixtures on hepatic glutathione-S-thiotransferase activity in Mugil so-iuy[J]. Marine Sciences, 2004, 28(3): 40-43 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-3096.2004.03.010 |
| [10] |
武小燕, 彭颖, 廖伟, 等. 布洛芬对黄颡鱼Ⅰ相代谢酶及其抗氧化系统的影响[J]. 环境科学学报, 2013, 33(4): 1208-1214. Wu X Y, Peng Y, Liao W, et al. Effects of Ibuprofen on the phase Ⅰ metabolic enzymes and antioxidant defence system of the Yellow Catfish(Pelteobagrus fulvidraco)[J]. Acta Scientiae Circumstantiae, 2013, 33(4): 1208-1214 (in Chinese with English abstract). |
| [11] |
Suárez-Serrano A, Alcaraz C, Ibáñez C, et al. Procambarus clarkii as a bioindicator of heavy metal pollution sources in the lower Ebro River and Delta[J]. Ecotoxicology and Environmental Safety, 2010, 73(3): 280-286. |
| [12] |
刘晓晓, 滕佩, 倪涵, 等. 马度米星铵对克氏原螯虾鳃组织的毒性[J]. 畜牧与兽医, 2018, 50(5): 46-50. Liu X X, Teng P, Ni H, et al. Effect of maduramycin ammonium on the gill tissue of crayfish[J]. Animal Husbandry and Veterinary Medicine, 2018, 50(5): 46-50 (in Chinese with English abstract). |
| [13] |
简暾昱, 徐帆, 廖春龙, 等. 3种方法测定大鼠肝微粒体蛋白含量的比较[J]. 中国药师, 2011, 14(3): 342-345. Jian D Y, Xu F, Liao C L, et al. Comparison of three methods for determining of rat liver microsomal protein content[J]. China Pharmacist, 2011, 14(3): 342-345 (in Chinese with English abstract). DOI:10.3969/j.issn.1008-049X.2011.03.012 |
| [14] |
Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. |
| [15] |
Nelson C H, Kirby B J, Lu N, et al. Evaluation of cytochrome P450- and transporter-mediated drug-drug interactions with the farnesoid x receptor agonist GS-9674 and phenotypic probe substrates and inhibitors/inducers[J]. Journal of Hepatology, 2017, 66(1): S151. |
| [16] |
唐跃年, 张顺国, 李岚, 等. 肝细胞微粒体的制备和细胞色素P450氧化酶活性测定[J]. 中国医院药学杂志, 1998, 18(12): 535-536. Tang Y N, Zhang S G, Li L, et al. Preparation of human liver microsomes and determination of cytochrome P450[J]. Chinese Journal of Hospital Pharmacy, 1998, 18(12): 535-536 (in Chinese with English abstract). DOI:10.3321/j.issn:1001-5213.1998.12.003 |
| [17] |
Fu Z D, Klaassen C D. Short-term calorie restriction feminizes the mRNA profiles of drug metabolizing enzymes and transporters in livers of mice[J]. Toxicology and Applied Pharmacology, 2014, 274(1): 137-146. DOI:10.1016/j.taap.2013.11.003 |
| [18] |
王辉, 郑进, 代蓉, 等. 傣医解药雅解沙把对大鼠肝药酶活性的影响[J]. 中国民族医药杂志, 2012, 18(11): 52-55. Wang H, Zheng J, Dai R, et al. Effect of Yajieshaba on the activities of drug-metabolism enzymes in rat liver microsome[J]. Journal of Medicine and Pharmacy of Chinese Minorities, 2012, 18(11): 52-55 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-6810.2012.11.025 |
| [19] |
陈大健.鲫鱼肝微粒体细胞色素P450酶系的初步研究[D].南京: 南京农业大学, 2006. Chen D J. A Preliminary study on hepatic microsomal cytochrome P450 in Carassius autatus[D]. Nanjing: Nanjing Agricultural University, 2006(in Chinese with English abstract). http://cdmd.cnki.com.cn/article/cdmd-10307-2007010127.htm |
| [20] |
McArthur A G, Hegelund T, Cox R L, et al. Phylogenetic analysis of the cytochrome P4503(CYP3)gene family[J]. Journal of Molecular Evolution, 2003, 57(2): 200-211. |
| [21] |
王永国.氟苯尼考与聚醚类离子载体抗球虫药在肉鸡体内的相互作用初步研究[D].南京: 南京农业大学, 2012. Wang Y G. Priliminary interaction study of florfenicol with polyether ionophore coccidiostats in broiler chickens[D]. Nanjing: Nanjing Agricultural University, 2012(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10307-1013282739.htm |
| [22] |
符贵红, 杨先乐, 喻文娟, 等. 草鱼肾细胞中细胞色素P4503A基因诱导表达及其酶活性分析[J]. 中国水产科学, 2011, 18(4): 720-727. Fu G H, Yang X L, Yu W J, et al. Induction of CYP3A gene and enzyme activity expression in kidney cell of grass carp(Ctenopharyngodori idellus)[J]. Journal of Fishery Sciences of China, 2011, 18(4): 720-727 (in Chinese with English abstract). |
| [23] |
Jin Y X, Zhang X X, Shu L J, et al. Oxidative stress response and gene expression with atrazine exposure in adult female zebrafish(Danio rerio)[J]. Chemosphere, 2010, 78(7): 846-852. DOI:10.1016/j.chemosphere.2009.11.044 |
| [24] |
Lazarus P, Sun D X. Potential role of UGT pharmacogenetics in cancer treatment and prevention:focus on tamoxifen and aromatase inhibitors[J]. Drug Metabolism Reviews, 2010, 42(1): 182-194. |
| [25] |
滕佩, 刘晓晓, 李艳萍, 等. 克氏原螯虾可食性组织中马度米星铵残留量的UPLC-MS/MS检测方法研究[J]. 畜牧与兽医, 2018, 50(4): 55-59. Teng P, Liu X X, Li Y P, et al. Development of and ultra-performance liquid chromatography-tandem mass spectrometry method for determination of maduramicin in edible tissues of red swamp crayfish[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(4): 55-59 (in Chinese with English abstract). |
| [26] |
高世勇, 季宇彬. 芳香胺N-乙酰化转移酶的研究进展[J]. 中国药理学通报, 2008, 24(1): 1-4. Gao S Y, Ji Y B. Research advance of arylamine N-acetyltransferase[J]. Chinese Pharmacological Bulletin, 2008, 24(1): 1-4 (in Chinese with English abstract). DOI:10.3321/j.issn:1001-1978.2008.01.002 |
| [27] |
Oliveira R, McDonough S, Ladewig J C L, et al. Effects of oxytetracycline and amoxicillin on development and biomarkers activities of zebrafish(Danio rerio)[J]. Environmental Toxicology and Pharmacology, 2013, 36(3): 903-912. DOI:10.1016/j.etap.2013.07.019 |
| [28] |
聂湘平, 陈菊芳, 王翔, 等. 环丙沙星在异育银鲫(Allogynogenetic crucian)体内的积累分布及其毒性效应[J]. 生态学报, 2008, 28(1): 246-252. Nie X P, Chen J F, Wang X, et al. Bioaccumulation of ciprofloxacin in Allogynogenetic crucian carp and its toxic effects[J]. Acta Ecologica Sinica, 2008, 28(1): 246-252 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-0933.2008.01.028 |
| [29] |
Sabatini S E, Brena B M, Pirez M, et al. Oxidative effects and toxin bioaccumulation after dietary microcystin intoxication in the hepatopancreas of the crab Neohelice(Chasmagnathus)granulata[J]. Ecotoxicology and Environmental Safety, 2015, 120: 136-141. DOI:10.1016/j.ecoenv.2015.05.041 |




