文章信息
- 高珍珍, 张超, 景丽荣, 胡元亮
- GAO Zhenzhen, ZHANG Chao, JING Lirong, HU Yuanliang
- 7种硒化多糖在小鼠体内外免疫活性的比较
- The comparison of seven selenizing polysaccarides in vitro and in vivo immune-enhancing activity in mouse
- 南京农业大学学报, 2020, 43(4): 705-713
- Journal of Nanjing Agricultural University, 2020, 43(4): 705-713.
- http://dx.doi.org/10.7685/jnau.201908044
-
文章历史
- 收稿日期: 2019-08-28
2. 南京农业大学动物医学院, 江苏 南京 210095
2. College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China
近年来, 中药多糖对促进机体的特异性免疫与非特异性免疫均具有广泛的影响[1-3], 其生物活性已成为研究领域的热点。硒是维持机体正常生理活动所必需的微量营养元素, 其在提高机体免疫力、抗氧化应激、抗癌变、防治心血管疾病和克山病等方面发挥着举足轻重的作用[4]。硒的存在形式包括无机硒和有机硒, 与无机硒相比, 有机硒具有毒副作用小、更利于机体吸收利用的优点。硒多糖作为有机硒的一种, 其生物活性普遍高于硒和多糖[5-7]。
本课题组在前期研究中, 通过活性追踪、正交设计和活性比较手段筛选出增强免疫活性较强的硒化当归多糖(sCAPS)、硒化山药多糖(sDOP)、硒化党参多糖(sCPPS)、硒化淫羊藿多糖(sEPS)、硒化大蒜多糖(sGPS)、硒化百合多糖(sLP)和硒化白术多糖(sAMP)共7种硒化多糖(sPS)及其最佳修饰条件[8-11]。本试验比较了修饰试剂亚硒酸钠(Na2SeO3)和7种硒化多糖单独或与PHA、脂多糖(LPS)共同刺激对小鼠脾脏淋巴细胞增殖的影响, 筛选出效果较好的3种硒化多糖, 设置高、中、低3个浓度进一步比较它们在体内增强免疫活性的效果, 旨在筛选出增强免疫活性较好的硒化多糖及最佳剂量, 为研制多糖类免疫佐剂提供理论依据。
1 材料与方法 1.1 硒化多糖的制备分别采用硝酸-亚硒酸钠方法制备7种硒化多糖(sPS), 苯酚-硫酸法测定多糖含量, 氢化物发生-原子荧光光谱法测定硒含量[]。其中, 硒化当归多糖(sCAPS), 糖含量50.9%, 硒含量12.98 mg·g-1; 硒化山药多糖(sDOP), 糖含量90.55%, 硒含量6.88 mg·g-1; 硒化党参多糖(sCPPS), 糖含量56.2%, 硒含量11.86 mg·g-1; 硒化淫羊藿多糖(sEPS), 糖含量42.92%, 硒含量7.2 mg·g-1; 硒化大蒜多糖(sGPS), 糖含量52.6%, 硒含量11.36 mg·g-1; 硒化百合多糖(sLP), 糖含量57.49%, 硒含量39.78 mg·g-1; 硒化白术多糖(sAMP), 糖含量50.61%, 硒含量11.27 mg·g-1。按糖含量用RPMI1640培养液稀释成100 μg·mL-1, 沸水浴30 min灭菌, 4 ℃保存备用。
1.2 主要试剂小牛血清(杭州四季青生物有限公司), 56 ℃水浴灭活30 min, 分装, -20 ℃保存备用; RPMI1640培养液和培养基(Gibco), 用三蒸水配制, 加入双抗(青、链霉素各100 IU·mL-1), 使用前加入10%的小牛血清作为细胞生长液; 植物血凝素(PHA, Sigma公司)用RPMI1640培养液配制成200 μg·mL-1; 脂多糖(LPS, Sigma)用RPMI1640培养液配制成100 μg·mL-1, -20 ℃保存; 四甲基偶氮唑蓝(MTT)溶液配制, 精确称取0.5 g四唑盐(Sigma), 用100 mL PBS溶解(pH7.4), 终浓度为5.0 mg·mL-1, 微孔滤膜过滤除菌, 4 ℃避光保存; 红细胞裂解液(139.6 mmol·L-1 NH4Cl, 16.96 mmol·L-1 Tris, 用1 mol·L-1 HCl调pH值至7.2, 微孔滤膜过滤除菌, 4 ℃保存); 卵清蛋白(OVA, Sigma); 二甲基亚砜(DMSO), 分析纯, 上海凌峰化学试剂有限公司; IgG、IgM、IL-2、IL-4和IFN-γ测试试剂盒, 购自BOSTER生物科技有限公司。
1.3 主要仪器ECLIPSS TS100-F型倒置显微镜, 北京瑞科中仪科技有限公司; CO2培养箱, 美国Thermo公司; 75-2A型微量振荡器, 上海医用分析仪器厂; Multiskan FC型酶标仪, 赛默飞世尔(上海)仪器有限公司; 96孔细胞培养板和24孔细胞培养板, 德国Nunclon公司; Thermo高速冷冻离心机, 美国Thermo公司; CX31显微镜, 日本奥林巴斯公司。
1.4 体外试验测定各硒化多糖对小鼠脾淋巴细胞安全浓度及增殖的影响在24孔板中将各sSP和Na2SeO3用含有双抗的RPMI1640培养液分别自100 μg·mL-1倍比稀释至0.098 μg·mL-1共11个浓度梯度(100、50、25、12.5、6.25、3.125、1.563、0.781、0.391、0.196和0.098 μg·mL-1)。根据Luo等[]提供的方法制备小鼠脾脏淋巴细胞, 台盼蓝染色计数。活细胞数大于95%时, 调整细胞浓度为2.5×106 mL-1后, 接种到96孔细胞培养板中, 每孔100 μL, 再分别加入各浓度的sSP和Na2SeO3溶液, 每孔100 μL, 每个浓度重复4孔。同时设不加药物的细胞对照孔和不加细胞空白调零孔。置于37.5 ℃、5% CO2条件下培养44 h后, 加入MTT, 每孔30 μL; 继续培养4 h, 将96孔细胞培养板1 500 r·min-1离心10 min, 弃上清液, 然后加入DMSO裂解液, 每孔100 μL; 将96孔细胞培养板置于微量振荡器上, 振荡5 min使沉淀完全溶解, 按MTT法用酶联免疫检测仪测定570 nm波长处的光吸收值(A570)。
根据前期安全浓度的测定结果, 取3.125、1.563、0.782、0.391和0.196 μg·mL-1 5个浓度的各sPS和Na2SeO3溶液测定淋巴细胞最高增殖率。同上法制备淋巴细胞, 调整细胞浓度为5×106 mL-1, 分成3份, 1份加入PHA溶液(终浓度为10 μg·mL-1), 1份加入LPS溶液(终浓度为5 μg·mL-1), 分别接种到96孔细胞培养板, 每孔100 μL, 然后每孔加入各浓度sPS 100 μL, 每个样品重复4孔, 另1份为细胞对照组(CC, 仅加细胞培养液)。另设PHA对照组(加细胞培养液和PHA)和LPS对照组(加细胞培养液和LPS)。测定细胞的A570值, 再按下式计算淋巴细胞最高增殖率。淋巴细胞最高增殖率=(A多糖组-A对照组)/A对照组×100%, 式中A为多糖最高增殖组的平均值或对照组4个孔的平均值。
1.5 体内试验测定各硒化多糖对小鼠免疫活性的影响取6周龄ICR小鼠288只, 随机均分为12组, 雌雄各半, 适应性饲养1周后, 除空白对照组外用OVA进行皮下免疫, 2周后二免。在首次免疫的同时, 9个硒化多糖组分别(按多糖含量)灌胃150、100和50 μg·mL-1的sCAPS、sCPPS和sGPS 0.4 mL, 硒化试剂组灌胃10 μg·mL-1 Na2SeO3 0.4 mL, 免疫对照(VC)组和空白对照(BC)组灌胃等量生理盐水, 每天1次, 连续3 d。分别于首免后7、21和35 d每组随机抽取8只小鼠摘眼球采血, 分离血清, 用ELISA试剂盒测定IgG、IgM、IL-2、IL-4和IFN-γ含量。剖检小鼠, 取脾脏固定, 石蜡切片, HE染色, 观察组织学变化。
1.6 数据处理数据均以平均数±标准差(x±SD)表示。用SPSS 20.0软件进行方差分析和Duncan’s多重比较。分析0.05水平的差异显著性。
2 结果与分析 2.1 各硒化多糖对淋巴细胞的安全浓度安全浓度测定结果显示:sCAPS和sCPPS在12.5 μg·mL-1, sGPS、sAMP、sEPS和sDOP在6.25 μg·mL-1, sLP和Na2SeO3在3.125 μg·mL-1时的细胞A570值不小于细胞对照组(P > 0.05), 因此可将这些浓度分别定为其对淋巴细胞的最大安全浓度。为方便在同一水平进行比较, 将其最大安全浓度统一设定为3.125 μg·mL-1。
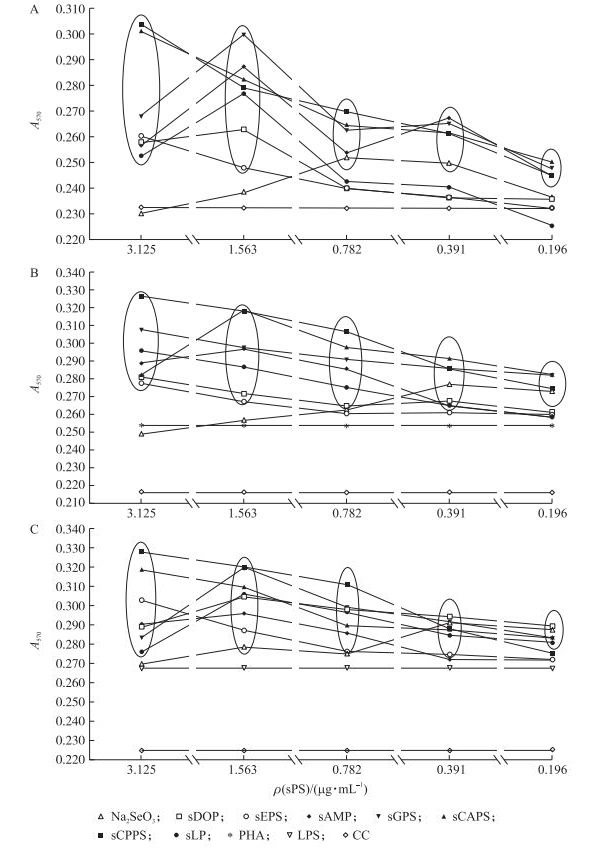
2.2 各硒化多糖对淋巴细胞增殖及最高增殖率的影响 2.2.1 各硒化多糖对淋巴细胞增殖的影响由图 1可见:硒多糖单独刺激淋巴细胞时sCAPS、sCPPS、sGPS和sAMP在3.125~0.196 μg·mL-1, sLP在1.563~0.391 μg·mL-1, sEPS和sDOP在3.125~1.563 μg·mL-1的A570值均显著大于细胞对照组(P < 0.05)(图 1-A)。硒多糖协同PHA刺激淋巴细胞时, sCAPS、sCPPS和sGPS在3.125~0.196 μg·mL-1, sLP、sAMP和sDOP在3.125~0.391 μg·mL-1, sEPS在3.125~1.563 μg·mL-1, Na2SeO3在0.391~0.196 μg·mL-1的A570值均显著大于细胞对照组(P < 0.05)(图 1-B)。硒多糖协同LPS刺激淋巴细胞时, sCAPS、sLP和sDOP在3.125~0.196 μg·mL-1, sCPPS在3.125~0.391 μg·mL-1, sAMP和sEPS在3.125~0.782 μg·mL-1, sGPS和Na2SeO3在1.563~0.196 μg·mL-1的A570值均显著大于细胞对照组(P < 0.05)(图 1-C)。
|
图 1 硒化多糖(sPS)单独刺激(A)或与PHA(B)、LPS(C)共同刺激时淋巴细胞的增殖变化
Fig. 1 The lymphocyte proliferation of every group in single stimulation of sPS(A), in synergistical stimulation of sPS or with PHA(B), LPS(C)
圈内与圈外数据差异显著(P < 0.05)。Data in and out of circle differ significantly(P < 0.05). sCAPS:硒化当归多糖Selenizing Chinese Angelica polysaccharide; sDOP:硒化山药多糖Selenizing Dioscorea oppositae thunb polysaccharides; sCPPS:硒化党参多糖Selenizing Codonopsis pilosula polysaccharide; sEPS:硒化淫羊藿多糖Selenizing Epimedium polysaccharide; sGPS:硒化大蒜多糖Selenizing garlic polysaccharide; sLP:硒化百合多糖Selenizing lily polysaccharide; sAMP:硒化白术多糖Selenizing Atractylodes macrocephala polysaccharide; PHA:PHA对照PHA control; LPS:LPS对照LPS control; CC:细胞对照Cell control. |
由图 2可知:单独刺激时, sCPPS组的淋巴细胞最高增殖率最高(30.93%), 其次为sCAPS(29.85%)、sGPS(29.31%)组, 这3组均显著高于其他组(P < 0.05)(图 2-A); 与PHA共同刺激时, sCPPS组的淋巴细胞最高增殖率最高(51.27%), 其次为sCAPS(47.57%)、sGPS(42.36%)组, 这3组均显著高于其他组(P < 0.05)(图 2-B); 与LPS共同刺激时, sCPPS组的淋巴细胞最高增殖率最高(45.78%), 其次为sGPS(42.11%)、sCAPS(41.67%)组, 这3组均显著高于其他组(P < 0.05)(图 2-C)。

|
图 2 硒化多糖(sPS)单独刺激(A)或与PHA(B)、LPS(C)共同刺激时淋巴细胞的最高增殖率 Fig. 2 The highest lymphocyte proliferation rate of every group in single stimulation of sPS(A), in synergistical stimulation of sPS or with PHA(B), LPS(C) 柱上标注不同字母者表示差异显著(P < 0.05)。 Bars marked without the same superscripts differ significantly(P < 0.05). |
由表 1可知:在首免后7、21和35 d, 各硒化多糖组和Na2SeO3组的IgG含量均显著高于BC组和VC组(P < 0.05), 100 μg·mL-1sCPPS组的IgG含量最高, 显著高于其他组(P < 0.05)。
| 组别 Groups |
ρ/(μg·mL-1) | 首免后不同时间的IgG含量/(μg·mL-1) IgG content of different time after first immunization | ||
| 7 d | 21 d | 35 d | ||
| 150 | 372.24±7.27e | 706.29±27.12f | 695.33±8.92f | |
| sCAPS | 100 | 414.38±12.76c | 798.90±28.67c | 757.24±14.86d |
| 50 | 383.67±9.29d | 767.24±22.45d | 716.52±8.93e | |
| 150 | 437.00±8.85b | 836.05±13.42b | 817.00±9.08b | |
| sCPPS | 100 | 448.67±7.02a | 957.71±16.97a | 882.24±14.50a |
| 50 | 372.00±7.76e | 737.71±14.42e | 690.57±16.53fg | |
| 150 | 416.76±10.40c | 855.81±26.07b | 781.29±15.96c | |
| sGPS | 100 | 411.76±9.72c | 787.24±21.56cd | 717.48±20.40e |
| 50 | 363.43±4.40ef | 685.81±19.47f | 676.05±8.74gh | |
| Na2SeO3 | 10 | 357.48±8.26f | 639.62±10.12g | 667.71±7.16h |
| VC | 326.29±12.90g | 615.57±8.90h | 570.57±24.05i | |
| BC | 254.14±5.34h | 460.57±7.10i | 425.57±16.49j | |
| 注:1)VC:免疫对照Immune control; BC:空白对照组Blank control. 2)表中数据标注小写字母不同表示差异显著(P < 0.05)。Data without the same small letters mean significant difference at 0.05 level.下同。The same bellow. | ||||
由表 2可知:在首免后7、21和35 d, 各硒化多糖组和Na2SeO3组的IgM含量均高于或显著高于BC组和VC组(P < 0.05)。在首免后7 d, 100 μg·mL-1 sCAPS组的IgM含量最高, 显著高于除100 μg·mL-1sCPPS组外的其他组(P < 0.05)。在首免后21 d, 100 μg·mL-1sCPPS组的IgM含量最高, 显著高于其他组(P < 0.05)。在首免后35 d, 100 μg·mL-1sCAPS、150 μg·mL-1 sCPPS、100 μg·mL-1 sCPPS和100 μg·mL-1 sGPS的IgM含量显著高于其他组(P < 0.05), 其中, 100 μg·mL-1 sGPS组最高, 但4组之间差异不显著。
| 组别 Groups |
ρ/(μg·mL-1) | 首免后不同时间的IgM含量/(pg·mL-1) IgM content of different time after first immunization | ||
| 7 d | 21 d | 35 d | ||
| 150 | 3.24±0.04bc | 2.85±0.05de | 2.50±0.11bc | |
| sCAPS | 100 | 3.71±0.10a | 3.20±0.09b | 2.84±0.04a |
| 50 | 3.36±0.07b | 2.95±0.05c | 2.63±0.07b | |
| 150 | 3.16±0.06c | 2.92±0.04cd | 2.78±0.05a | |
| sCPPS | 100 | 3.58±0.09a | 3.51±0.14a | 2.85±0.15a |
| 50 | 2.99±0.04d | 2.62±0.03f | 2.61±0.21b | |
| 150 | 3.24±0.30bc | 3.19±0.10b | 2.59±0.07bc | |
| sGPS | 100 | 3.34±0.11b | 3.00±0.10c | 2.91±0.19a |
| 50 | 2.86±0.13d | 2.91±0.07cd | 2.61±0.07b | |
| Na2SeO3 | 10 | 2.85±0.03d | 2.77±0.04e | 2.55±0.05bc |
| VC | 2.69±0.04e | 2.57±0.05f | 2.45±0.05c | |
| BC | 2.29±0.09f | 2.42±0.13g | 1.77±0.17d | |
由表 3可知:在首免后7、21和35 d, 各硒化多糖组和Na2SeO3组的IL-2含量高于或显著高于BC组和VC组(P < 0.05)。在首免后7 d, 100 μg·mL-1 sCAPS组的IL-2含量最高, 显著高于其他组(P < 0.05)。在首免后21 d和35 d 100 μg·mL-1 sCPPS组的IL-2含量最高, 显著高于其他组(P < 0.05)。
| 组别 Groups |
ρ/(μg·mL-1) | 首免后不同时间的IL-2含量/(pg·mL-1) IL-2 content of different time after first immunization | ||
| 7 d | 21 d | 35 d | ||
| 150 | 470.76±11.02d | 553.60±12.20de | 515.91±5.95ef | |
| sCAPS | 100 | 561.42±10.04a | 622.93±11.68b | 600.18±13.20c |
| 50 | 499.20±6.47c | 583.11±13.06c | 590.22±14.00c | |
| 150 | 530.13±15.89b | 589.51±10.93c | 632.53±13.54b | |
| sCPPS | 100 | 539.38±17.72b | 648.53±11.84a | 664.53±13.81a |
| 50 | 487.11±9.79c | 556.44±8.03de | 527.29±9.95e | |
| 150 | 528.71±14.68b | 560.71±7.44d | 572.09±15.82d | |
| sGPS | 100 | 532.27±10.77b | 544.71±13.33e | 510.58±16.34fg |
| 50 | 497.42±8.25c | 524.44±11.64f | 499.20±9.15g | |
| Na2SeO3 | 10 | 472.18±10.68d | 510.93±8.82g | 502.04±10.77fg |
| VC | 460.80±9.05d | 489.60±11.59h | 483.20±12.42h | |
| BC | 428.09±11.26e | 434.49±8.17i | 422.76±10.49i | |
由表 4可知:在首免后7、21和35 d, 各硒化多糖组和Na2SeO3组的IFN-γ含量高于或显著高于BC组和VC组(P < 0.05)。在首免后7 d, 100 μg·mL-1sCPPS组的IFN-γ含量最高, 显著高于除100 μg·mL-1sCAPS组外的其他组(P < 0.05)。在首免后21 d, 100 μg·mL-1sCPPS组的IFN-γ含量最高, 且显著高于除100 μg·mL-1sCAPS和150 μg·mL-1sGPS之外的其他组(P < 0.05)。在首免后35 d, sCPPS 100 μg·mL-1组的IFN-γ含量最高且显著高于除sGPS 150 μg·mL-1外的其他组(P < 0.05)。
| 组别 Groups |
ρ/(μg·mL-1) | 首免后不同时间的IFN-γ含量/(ng·mL-1) IFN-γ content of different time after first immunization | ||
| 7 d | 21 d | 35 d | ||
| 150 | 293.65±20.03b | 424.90±19.33d | 298.33±22.40fg | |
| sCAPS | 100 | 401.46±18.48a | 476.46±22.48a | 350.42±11.59bc |
| 50 | 361.35±19.23b | 450.42±20.20bc | 330.63±16.27cde | |
| 150 | 354.58±11.59c | 432.71±21.69cd | 344.17±25.27bcd | |
| sCPPS | 100 | 403.02±20.70a | 485.83±17.94a | 383.75±13.66a |
| 50 | 274.38±22.77c | 390.00±19.94e | 321.25±19.94de | |
| 150 | 360.83±16.82b | 467.60±9.82ab | 366.04±18.69ab | |
| sGPS | 100 | 361.88±19.64b | 447.81±18.65bcd | 332.19±17.79cde |
| 50 | 285.31±23.30c | 380.10±27.72ef | 316.56±13.83ef | |
| Na2SeO3 | 10 | 274.90±15.52c | 370.73±16.38ef | 331.15±24.42cde |
| VC | 217.08±21.23d | 365.52±18.82f | 291.56±16.77gh | |
| BC | 159.79±223.17e | 314.48±14.48g | 272.29±19.41h | |
由表 5可知:在首免后7、21和35 d, 各硒化多糖组和Na2SeO3组的IL-4含量高于或显著高于BC组和VC组(P < 0.05)。在首免后7 d, 100 μg·mL-1 sCPPS组的IL-4含量最高且显著高于除100 μg·mL-1 SCAPS组外的其他组(P < 0.05)。在首免后21 d, 100 μg·mL-1, sCPPS组的IL-4含量最高且显著高于其他组(P < 0.05)。在首免后35 d, 100 μg·mL-1 sCPPS组的IL-4含量最高且显著高于除100 μg·mL-1 SCAPS组外的其他组(P < 0.05)。
| 组别 Groups |
ρ/(μg·mL-1) | 首免后不同时间IL-4含量/(pg·mL-1) IL-4 content of different time after first immunization | ||
| 7 d | 21 d | 35 d | ||
| 150 | 241.72±3.25ef | 291.72±3.18c | 253.43±4.78ef | |
| sCAPS | 100 | 271.75±4.32a | 310.12±4.47b | 278.60±4.04ab |
| 50 | 248.23±3.35d | 292.54±2.55c | 268.20±3.41d | |
| 150 | 246.42±3.57de | 297.82±8.61c | 270.92±3.80cd | |
| sCPPS | 100 | 274.64±2.74a | 317.54±3.67a | 283.71±5.96a |
| 50 | 238.99±1.79fg | 280.08±6.10d | 253.27±5.73ef | |
| 150 | 266.14±5.30b | 309.04±4.72b | 276.20±5.56bc | |
| sGPS | 100 | 257.81±4.22c | 297.08±5.16c | 264.40±6.92d |
| 50 | 242.46±4.15ef | 284.62±5.03d | 256.24±6.98e | |
| Na2SeO3 | 10 | 234.95±7.72g | 278.43±4.22d | 247.00±3.21f |
| VC | 211.11±6.16h | 267.13±7.35e | 233.63±4.43g | |
| BC | 195.92±4.53i | 215.23±4.20f | 207.15±8.57h | |
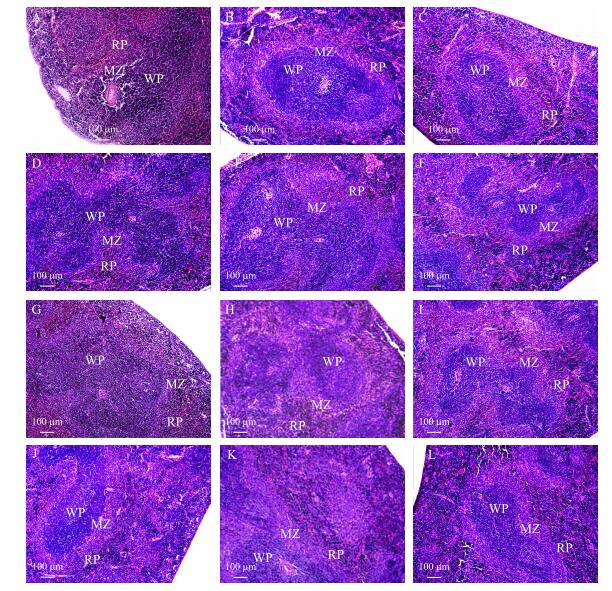
由图 3可知:免疫各组小鼠脾脏的白髓(WP)和红髓(RP)边界比空白组更清晰, 硒化多糖各组小鼠脾脏白髓(WP)面积均大于BC组和VC组, 硒化多糖各组小鼠脾脏边缘区(MZ)淋巴细胞数量均多于BC组和VC组, 硒化多糖高、中剂量组小鼠的脾脏白髓面积明显增大、边缘区淋巴细胞数量明显增多。其中, 100 μg·mL-1sCPPS组(图 3-E)白髓和边缘区面积增加最明显。
|
图 3 各组小鼠脾组织学变化(HE染色, ×100)
Fig. 3 Histological changes of spleen in each group(HE Staining, ×100)
A. sCAPS 150 μg·mL-1; B. sCAPS 100 μg·mL-1; C. sCAPS 50 μg·mL-1; D. sCPPS 150 μg·mL-1; E. sCPPS 100 μg·mL-1; F. sCPPS 50 μg·mL-1; G. sGPS 150 μg·mL-1; H. sGPS 100 μg·mL-1; I. sGPS 50 μg·mL-1; J. Na2SeO3 10 μg·mL-1; K.免疫对照组Vaccination control group; L.空白对照组Blank control group. RP:红髓Red pulp; WP:白髓White pulp; MZ:边缘区Marginal zone. |
淋巴细胞增殖是反映机体细胞免疫的重要指标, 由于体外试验具有所需时间短、条件易于控制等优点, 所以免疫类增强药物的初步筛选一般选择体外试验[11-12]。脾脏为机体最大的免疫器官, 是T、B淋巴细胞聚集的部位[13]。PHA是T淋巴细胞增殖的刺激原, 可以促进T淋巴细胞增殖; LPS是B淋巴细胞增殖的刺激原, 可以促进B淋巴细胞增殖[11]。淋巴细胞增殖率的高低直接反映细胞免疫活性的强弱。本试验结果显示, 硒化多糖的增强免疫活性显著强于修饰试剂Na2SeO3, sCPPS、sGPS和sCAPS 3种硒化多糖的体外免疫活性较强。
硒是维持机体正常生理活动所必需的微量营养元素, 但硒摄入过量则会引起中毒, 对机体造成损伤。多数国家营养学会推荐成人硒摄入量为60~400 μg·d-1, 硒的中毒量是800 μg·d-1[14-15]。同时由于离体试验脱离了机体内复杂的环境, 缺乏整体协调, 所以体外试验并不能完全代替体内的试验结果[16]。因此, 本试验筛选出体外活性效果较好的sCAPS、sCPPS和sGPS, 进一步比较3种sPS在体内的免疫增强作用。免疫球蛋白是由浆细胞合成和分泌的一组能与抗原发生特异性结合的球蛋白, 是体液免疫的主要抗体, 血清中抗体的高低在一定程度上反映机体对疾病的抵抗能力[17]。IgG在动物体内的合成和分泌时效长、含量高, 在感染或人工免疫后, IgG是血清中最主要的抗体。IgM是机体抗感染和免疫刺激后首先产生的抗体成分, 产量少, 时效短, 但是在早期免疫防御中起重要作用[18]。本试验结果显示, 各sPS均能提高OVA的体液免疫应答, 且强于无机硒Na2SeO3, sCPPS在浓度为100 μg·mL-1时的免疫增强作用最强。
细胞免疫主要由T淋巴细胞分化成效应特异性T淋巴细胞和分泌因子而发挥免疫作用[17]。T淋巴细胞主要包括Th1和Th2两个细胞亚群, Th1和Th2之间的动态平衡在维持生物体的正常免疫功能中起重要作用[19-21]。IL-2和IFN-γ由Th1细胞分泌, IL-4由Th2细胞分泌[22-25]。本试验结果显示, 3种硒化多糖的3个浓度作用于OVA免疫的小鼠后, sCPPS 100 μg·mL-1增加机体IL-2、IFN-γ和IL-4含量的能力最强, 从而更好地协调、增强机体的细胞免疫应答。
在机体中, 免疫器官是以淋巴组织为主参与免疫的。脾脏作为机体主要免疫器官之一, 是机体进行细胞免疫和体液免疫的重要场所[26]。小鼠的脾脏组织主要由白髓和红髓构成, 其中白髓由外周淋巴鞘和脾小体组成, 红髓位于白髓周围, 在白髓与红髓之间的区域为边缘区, 是结构较疏松的淋巴组织。外周淋巴鞘由大量T细胞、少量巨噬细胞和交错突细胞等构成, 当细胞发生免疫反应时, 白髓中的外周淋巴鞘增厚, T细胞增殖。脾小体由大量的B细胞组成, 脾小体数量的增加可以促进机体产生抗体[27]。本试验结果显示, 相比于BC组和VC组, 高、中浓度硒化多糖组小鼠的脾脏白髓面积增大、边缘区细胞数量增多。其中, sCPPS在浓度为100 μg·mL-1组的白髓和边缘区面积增加最明显。表明, 硒化多糖对免疫器官有很好的改善和刺激作用。
| [1] |
Wang Q J, Meng X Y, Zhu L, et al. A polysaccharide found in Paulownia fortunei flowers can enhance cellular and humoral immunity in chickens[J]. International Journal of Biological Macromolecules, 2019, 130: 213-219. |
| [2] |
曾涵芳, 张林, 陈孟姣, 等. 黄芪多糖对H2O2诱导的奶牛乳腺上皮细胞氧化损伤及凋亡的影响[J]. 南京农业大学学报, 2019, 42(5): 903-910. Zeng H F, Zhang L, Chen M J, et al. Effects of Astragalus polysaccharides on H2O2 induced oxidative damage and apoptosis in bovine mammary epithelial cells[J]. Journal of Nanjing Agricultural University, 2019, 42(5): 213-219 (in Chinese with English abstract). DOI:10.7685/jnau.201809040 |
| [3] |
孙新堂. 植物多糖的生物活性及其在畜牧业中的应用[J]. 畜牧与兽医, 2019, 51(8): 135-137. Sun X T. Biological activity of polysaccharides in plant and their application in animal husbandry[J]. Animal Husbandry & Veterinary Medicine, 2019, 51(8): 135-137 (in Chinese with English abstract). |
| [4] |
Fairweather-Tait S J, Bao Y P, Broadley M R, et al. Selenium in human health and disease[J]. Antioxidants & Redox Signaling, 2011, 14(7): 1337-1383. |
| [5] |
Malinowska E, Klimaszewska M, Strączek T, et al. Selenized polysaccharides-biosynthesis and structural analysis[J]. Carbohydrate Polymers, 2018, 198: 407-417. |
| [6] |
徐兵河, 宋雪梅, 孙燕, 等. 硒酸酯多糖Ⅱ期临床结果[J]. 中国新药杂志, 1998, 7(4): 258. Xu B H, Song X M, Sun Y, et al. Report on phaseⅡ clinical trial of κ-selenocarrageenan in cancer patients[J]. Chinese New Drugs Journal, 1998, 7(4): 258 (in Chinese with English abstract). |
| [7] |
赵美英, 蔡文德, 肖祖建. 富硒香菇活性多糖对实验大鼠免疫缺陷干预及其影响因素研究[J]. 中国公共卫生, 2000, 16(10): 901-902. Zhao M Y, Cai W D, Xiao Z J. The research on Se-Lentinan's intervention to SD rat's immunodeficiency[J]. China Public Health, 2000, 16(10): 901-902 (in Chinese with English abstract). |
| [8] |
Qiu S L, Chen J, Qin T, et al. Effects of selenylation modification on immune-enhancing activity of garlic polysaccharide[J]. PLoS One, 2014, 9(1): e86377. |
| [9] |
Liu J, Chen X, Yue C J, et al. Effect of selenylation modification on immune-enhancing activity of Atractylodes macrocephala polysaccharide[J]. International Journal of Biological Macromolecules, 2015, 72: 1435-1440. |
| [10] |
Hou R R, Chen J, Yue C J, et al. Modification of lily polysaccharide by selenylation and the immune-enhancing activity[J]. Carbohydrate Polymers, 2016, 142: 73-81. |
| [11] |
Qin T, Chen J, Wang D Y, et al. Optimization of selenylation conditions for Chinese Angelica polysaccharide based on immune-enhancing activity[J]. Carbohydrate Polymers, 2013, 92(1): 645-650. |
| [12] |
Luo L, Zheng S S, Huang Y F, et al. Preparation and characterization of Chinese yam polysaccharide PLGA nanoparticles and their immunological activity[J]. International Journal of Pharmaceutics, 2016, 511(1): 140-150. |
| [13] |
刘俊英, 曾广仙, 熊金蓉, 等. 黄芪多糖对创伤应激小鼠胸腺、脾脏淋巴细胞中NF-κB mRNA与IL-10 mRNA表达影响的形态计量学研究[J]. 中国体视学与图像分析, 2004, 9(1): 21-24. Liu J Y, Zeng G X, Xiong J R, et al. Effects of astragalus polysaccha-ride on expression of NF-κB mRNA and IL-10 mRNA in lymphocytes of thymus and spleen of traumatic stress Mice[J]. Chinese Journal of Stereology and Image Analysis, 2004, 9(1): 21-24 (in Chinese with English abstract). |
| [14] |
Tinggi U. Essentiality and toxicity of selenium and its status in Australia:a review[J]. Toxicology Letters, 2003, 137(1/2): 103-110. |
| [15] |
dos Santos M, da Silva Júnior F M R, Muccillo-Baisch A L. Selenium content of Brazilian foods:a review of the literature values[J]. Journal of Food Composition and Analysis, 2017, 58: 10-15. |
| [16] |
马丽娜, 叶祖光, 张广平. 从体外成分变化-体内代谢-生物效应拮抗解析附子甘草配伍减毒作用机制[J]. 中国中药杂志, 2019, 44(19): 4165-4170. Ma L N, Ye Z G, Zhang G P. Analysis on mechanism of toxicity reduction through compatibility of Aconiti Lateralis Radix Praeparata-Glycyrrhizae Radixet Rhizoma from in vitro component changes, in vivo metabolism and biological effects antagonism[J]. China Journal of Chinese Materia Medica, 2019, 44(19): 4165-4170 (in Chinese with English abstract). |
| [17] |
van Dissel J T, Arend S M, Prins C, et al. Ag85B-ESAT-6 adjuvanted with IC31® promotes strong and long-lived Mycobacterium tuberculosis specific T cell responses in naïve human volunteers[J]. Vaccine, 2010, 28(20): 3571-3581. |
| [18] |
Hussan M T, Khan M, Jahan M R. Tissue distribution of B-lymphocyte subsets(IgA, IgG and IgM)in the mucosa and lymphoid tissues of broilers immunized with Gumboro vaccine[J]. Bangladesh Journal of Veterinary Medicine, 2014, 11(1): 13-19. |
| [19] |
Liu Z G, Xing J, Zheng S S, et al. Ganoderma lucidum polysaccharides encapsulated in liposome as an adjuvant to promote Th1-bias immune response[J]. Carbohydrate Polymers, 2016, 142: 141-148. |
| [20] |
Langenkamp A, Messi M, Lanzavecchia A, et al. Kinetics of dendritic cell activation:impact on priming of TH1, TH2 and nonpolarized T cells[J]. Nature Immunology, 2000, 1(4): 311-316. |
| [21] |
Mohanan D, Slütter B, Henriksen-Lacey M, et al. Administration routes affect the quality of immune responses:a cross-sectional evaluation of particulate antigen-delivery systems[J]. Journal of Controlled Release, 2010, 147(3): 342-349. |
| [22] |
Sauzullo I, Mastroianni C M, Mengoni F, et al. Long-term IFN-gamma and IL-2 response for detection of latent tuberculosis infection in healthcare workers with discordant immunologic results[J]. Journal of Immunological Methods, 2014, 414: 51-57. |
| [23] |
Lee J S, Kwon J S, Won D P, et al. Study on macrophage activation and structural characteristics of purified polysaccharide from the liquid culture broth of Cordyceps militaris[J]. Carbohydrate Polymers, 2010, 82(3): 982-988. |
| [24] |
Okamura M, Lillehoj H, Raybourne R, et al. Cell-mediated immune responses to a killed Salmonella enteritidis vaccine:lymphocyte proliferation, T-cell changes and interleukin-6(IL-6), IL-1, IL-2, and IFN-γ production[J]. Comparative Immunology Microbiology & Infectious Diseases, 2004, 27(4): 255-272. |
| [25] |
Gui L, Zeng Q Y, Xu Z G, et al. IL-2, IL-4, IFN-γ or TNF-α enhances BAFF-stimulated cell viability and survival by activating Erk1/2 and S6K1 pathways in neoplastic B-lymphoid cells[J]. Cytokine, 2016, 84: 37-46. |
| [26] |
Yuan J, Liu J G, Hu Y L, et al. The immunological activity of Propolis flavonoids liposome on the immune response against ND vaccine[J]. International Journal of Biological Macromolecules, 2012, 51(4): 400-405. |
| [27] |
Bo R N, Zheng S S, Xing J, et al. The immunological activity of Lycium barbarum polysaccharides liposome in vitro and adjuvanticity against PCV2 in vivo[J]. International Journal of Biological Macromolecules, 2016, 85: 294-301. |




