文章信息
- 俞雯雯, 袁炳钦, 冯汝晴, 郑镇桂, 刘灵锐, 陈勇
- YU Wenwen, YUAN Bingqin, FENG Ruqing, ZHENG Zhengui, LIU Lingrui, CHEN Yong
- 嘴突凸脐蠕孢菌作为微生物除草剂的潜力研究
- Study on the potential of Exserohilum rostratum as a microbial herbicide
- 南京农业大学学报, 2020, 43(4): 613-620
- Journal of Nanjing Agricultural University, 2020, 43(4): 613-620.
- http://dx.doi.org/10.7685/jnau.201910018
-
文章历史
- 收稿日期: 2019-10-17
杂草是农业生态系统中的重要植物资源, 但它会与作物争夺水分、养料、光照、空间, 降低农产品的品质, 妨碍作物收获, 影响粮食生产并造成经济损失。因此, 防除杂草成为农业生产领域长期的研究课题。千金子[Leptochloa chinensis (L.) Nees]是千金子属一年生禾本科杂草, 广泛分布在各大水稻产区[1]。近年来, 随着水稻轻型栽培技术的大面积推广和选择性除草剂的普遍应用, 稻田杂草群落结构发生了巨大变化, 千金子在南方稻区发生并迅速蔓延, 己经成为仅次于稗草的恶性杂草, 甚至在部分稻田的危害已经超过稗草, 是中国水稻田最难防除的恶性杂草之一, 严重抑制水稻的生长发育[2-5]。
目前, 千金子防治主要依赖化学除草剂。然而化学农药的大量使用带来杂草抗药性、农药残留、环境污染等严重问题, 直接威胁农业生产安全[6]。近年来具有选择性强、作物产生抗药性概率低、对人体和环境安全性高等优点的微生物除草剂逐渐受到国内外研究学者的重视[7-9]。微生物除草剂指利用植物病原微生物或其代谢产物来防治杂草的制剂[10], 文献报道包括真菌和细菌在内有40多个属、80多个种的微生物具有防控杂草的能力[11]。在全球范围内, 市场上现有13种源自微生物或天然分子的生物除草剂[12-13]。而用来防治千金子的微生物除草剂报道甚少。
本课题组研究发现嘴突凸脐蠕孢菌(Exserohilum rostratum)对千金子具有较强的致病性, 对水稻以及其他多种作物安全[14]。本研究通过测定不同pH值、培养温度、光照、养分、碳氮源对菌株产孢量的影响, 以及不同温度、pH值和常用农药对孢子萌发的影响, 进而详细研究其生物学特性及其孢子悬浮液与常用农药混配后孢子萌发特性, 为该菌株的大批量生产和应用到实际生产中提供相关数据, 并为其作为制剂的开发、利用奠定基础。
1 材料与方法 1.1 试验材料及供试菌株嘴突凸脐蠕孢菌(Exserohilum rostratum)Y9511来自华南农业大学农学院杂草研究实验室, 保藏编号为GDMCC No:60535。
8种农药为丙草胺[先正达(苏州)作物保护有限公司]、恶唑酰草胺(美国富美实公司)、氰氟草酯(安徽众邦生物工程有限公司)、莠灭净(广西易多收生物科技有限公司)、春雷霉素(华北制药集团爱诺限公司)、苯甲嘧菌酯(瑞士先正达作物保护有限公司)、多菌灵(安徽广信农化股份有限公司)、苯甲丙环唑(瑞士先正达作物保护有限公司), 均由华南农业大学杂草研究实验室杨开强提供。
常规PDA培养基:40.1 g马铃薯葡萄糖琼脂, 5~8 g琼脂粉, 1 000 mL H2O, 121 ℃高压灭菌30 min。完全培养基:100 g蔗糖, 0.5 g MgSO4·7H2O, 3 g NH4NO3, 0.1 g FeSO4·7H2O, 2 g KH2PO4, 17 g琼脂, 1 000 mL H2O, 121 ℃高压灭菌30 min。缺少碳源、氮源、磷、硫、钾、铁、镁培养基的配制见表 1。
| 处理 Treatment |
D(+)-蔗糖 D(+)-sucrose |
MgSO4·7H2O | NH4NO3 | FeSO4·7H2O | KH2PO4 | MgCl2 | FeCl3 | Na2SO4 | NaH2PO4 | KCl | NaCl | 琼脂 Agar |
| X1 | 100 | 0.5 | 3 | 0.1 | 2 | 17 | ||||||
| X2 | 0.5 | 3 | 0.1 | 2 | 0.1 | 17 | ||||||
| X3 | 100 | 0.5 | 0.1 | 2 | 17 | |||||||
| X4 | 100 | 0.5 | 3 | 0.1 | 0.67 | 17 | ||||||
| X5 | 100 | 3 | 2 | 0.247 | 0.060 | 17 | ||||||
| X6 | 100 | 0.5 | 3 | 0.1 | 1.376 | 17 | ||||||
| X7 | 100 | 3 | 0.1 | 2 | 0.173 | 17 | ||||||
| X8 | 100 | 0.5 | 3 | 2 | 0.031 | 17 | ||||||
| 注:X1:完全培养基; X2:缺碳培养基; X3:缺氮培养基; X4:缺磷培养基; X5:缺硫培养基; X6:缺钾培养基; X7:缺镁培养基; X8:缺铁培养基。下同。 Note:X1:Complete medium; X2:Carbon-deficient medium; X3:Nitrogen-deficient medium; X4:Phosphorus-deficient medium; X5:Sulfur-deficient medium; X6:Potassium-deficient medium; X7:Magnesium-deficient medium; X8:Iron-deficient medium. The same as follows. | ||||||||||||
按表 1配制不同的培养基, 分别接种菌株Y9511进行产孢培养, 每个处理6次重复。30 ℃恒温培养14 d后在显微镜下用血球计数板测定产孢量。
1.2.2 微量元素铜和锌在完全培养基(X1)中分别加入0.01%硫酸铜、硫酸锌配制供试培养基, 接种菌株Y9511后培养, 培养方法和产孢测定方法同1.2.1节。
1.2.3 碳源和氮源在去除碳源的完全培养基中分别加入100 g的葡萄糖、蔗糖、麦芽糖、可溶性淀粉和α-乳糖配制出不同碳源的培养基, 按1.2.1节的方法观察产孢量。
1.2.4 温度挑取适量菌株Y9511菌丝至PDA培养平板中央, 分别置于5、10、15、20、25、28、30、32、35、38、40 ℃恒温培养箱中培养, 每个处理6次重复。14 d后用血球计数板镜检产孢量[15]。
1.2.5 初始pH值用1 mol·L-1的NaOH和HCl调节以配制pH值分别为3.02、4.60、5.20、6.24、7.83、8.60、9.50的PDA培养基, 后接种菌株Y9511进行培养, 每个处理6次重复。30 ℃恒温培养14 d后用血球计数板镜检产孢量。
1.3 影响菌株Y9511孢子萌发的因素 1.3.1 温度菌株Y9511培养7 d后, 用无菌水洗下孢子, 4层纱布过滤去除菌丝体, 稀释孢子悬液至每个视野约10个孢子备用, 下同。取20 μL孢子悬液滴加在凹玻片的凹槽处, 置于垫着湿润滤纸的培养皿内, 在5、10、15、20、25、28、30、32、35、37、40 ℃恒温培养箱内培养24 h后, 使用显微镜观察孢子的萌发情况。每个处理重复4次, 每个重复观察100个孢子。孢子萌发率=孢子萌发数/观测孢子总数×100%。
1.3.2 初始pH值用1 mol·L-1的HCl和NaOH溶液调节备用的孢子悬浮液pH值, 使孢子悬浮液pH值分别为3.02、4.60、5.20、6.24、7.83、8.60、9.50, 在显微镜下观察孢子的萌发情况, 方法同1.3.1节。
1.3.3 农药按农药的田间推荐剂量(1×)、亚致死剂量(0.2×)、次亚致死剂量(0.1×)算出每个培养皿(直径90 mm)的使用量(保证每皿的有效成分不变)。按照表 2用超纯水稀释配制不同基础浓度的农药, 与适量备用的孢子悬液充分混匀, 加入载玻片后, 置于垫有滤纸的培养皿内, 添加超纯水至水面刚好浸没载玻片, 摇匀后在30 ℃培养箱培养24 h后镜检观察孢子萌发状况, 以未加农药的培养皿作为空白对照, 测定孢子萌发抑制率。每个处理重复3次。孢子萌发抑制率=(对照萌发率-药剂处理萌发率)/对照萌发率×100%[16]。
| 农药名称 Herbicide name |
属性 Properties |
剂型 Dosage form |
基础浓度(稀释倍数)Base concentration(dilution ratio) | 每皿用量/mL Dosage per dish |
||
| 1× | 0.2× | 0.1× | ||||
| 300 g·L-1丙草胺 Pretilachlor |
除草剂 Herbicide |
乳油 Emulsifiable concentrate |
1 000 | 5 000 | 10 000 | 3.608 |
| 10%恶唑酰草胺 Metamifop |
除草剂 Herbicide |
乳油 Emulsifiable concentrate |
1 000 | 5 000 | 10 000 | 2.863 |
| 20%氰氟草酯 Cyhalofop-butyl |
除草剂 Herbicide |
可分散油悬浮剂 Oil miscible suspension |
1 000 | 5 000 | 10 000 | 1.336 |
| 40%莠灭净 Ametryn |
除草剂 Herbicide |
可湿性粉剂 Wettablepowder |
100 | 500 | 1 000 | 1.145 |
| 2%春雷霉素 Kasugamycin |
杀菌剂 Industrial bactericide |
水剂 Aqueous solutions |
1 000 | 5 000 | 10 000 | 4.008 |
| 325 g·L-1苯甲嘧菌酯 Benazoxystrobin |
杀菌剂 Industrial bactericide |
悬浮剂 Flowable agent |
1 000 | 5 000 | 10 000 | 1.527 |
| 80%多菌灵 Carbendazim |
杀菌剂 Industrial bactericide |
可湿性粉剂 Wettablepowder |
1 000 | 5 000 | 10 000 | 2.385 |
| 300 g·L-1苯甲丙环唑 Benzopropionazole |
杀菌剂 Industrial bactericide |
乳油 Emulsifiable concentrate |
10 000 | 50 000 | 100 000 | 6.681 |
试验数据采用SPSS 20.0数据处理系统和Excel 2016进行统计分析, 试验结果方差分析后进行Duncan’s多重比较检验各处理间的差异。
2 结果与分析 2.1 不同营养成分对菌落生长的影响从表 3可见:与完全培养基(X1)相比, 缺乏碳(X2)、磷(X4)、硫(X5)、钾(X6)、镁(X7)元素的培养基均显著抑制Y9511菌株的生长, 培养3~7 d的菌落直径显著受到抑制。缺乏氮(X3)、铁(X8)元素处理下, 菌株Y9511的生长快于完全培养基(X1), 在整个培养过程中与其他处理差异显著。微量元素铜和锌对菌株Y9511的生长有显著抑制作用, 加入微量元素铜和锌的培养基上菌株的菌落直径在培养3、4、5、6和7 d时低于完全培养基(X1)。
| 处理 Treatment |
不同培养时间的菌落直径/cm Colony diameter under different culture time | ||||
| 3 d | 4 d | 5 d | 6 d | 7 d | |
| X1 | 4.13±0.05d | 5.77±0.06c | 6.85±0.02c | 8.83±0.16b | 10.18±0.03b |
| X2 | 2.98±0.03f | 4.38±0.05f | 5.12±0.04g | 6.12±0.03f | 7.12±0.04f |
| X3 | 4.90±0.04b | 6.92±0.03a | 9.13±0.03a | 10.52±0.03a | 12.23±0.02a |
| X4 | 2.70±0.04g | 3.45±0.03h | 4.68±0.03h | 5.52±0.02g | 6.40±0.03h |
| X5 | 2.63±0.02g | 4.20±0.00g | 5.33±0.02f | 6.50±0.00e | 7.38±0.03e |
| X6 | 3.67±0.02e | 4.72±0.02e | 5.60±0.03e | 6.20±0.00f | 6.53±0.02g |
| X7 | 4.38±0.02c | 5.62±0.03d | 6.25±0.03d | 7.02±0.04d | 7.52±0.02d |
| X8 | 5.02±0.04a | 6.32±0.06b | 7.42±0.03b | 8.23±0.03c | 9.05±0.04c |
| ZnSO4 | 1.63±0.03h | 2.05±0.04i | 2.85±0.03i | 4.08±0.10h | 5.98±0.05i |
| CuSO4 | 0.00±0.00i | 0.48±0.03j | 0.85±0.02j | 1.07±0.02i | 1.25±0.02j |
| 注:不同字母表示处理间差异显著(P<0.05)。下同。 Note:Different lowercase letters indicate significant difference at 0.05 level. The same as follows. | |||||
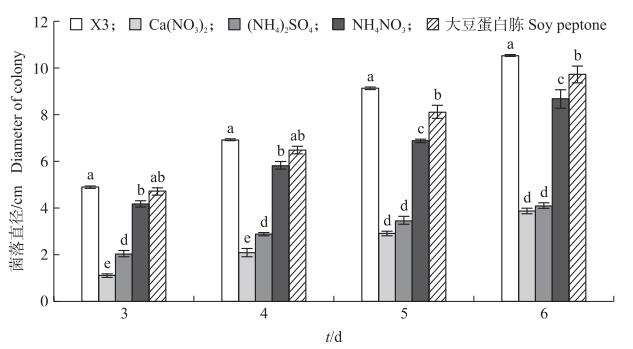
不同碳、氮源对Y9511菌落生长影响不同。在供试的5种碳源中, 以可溶性淀粉为碳源时Y9511生长最快, 与其他处理相比差异显著, 其次是D(+)-蔗糖。以葡萄糖、麦芽糖和α-乳糖为碳源的培养基, Y9511生长较缺乏碳源培养基(X2)处理慢, 且差异显著(图 1)。加入供试的4种氮源后, 与缺少氮源的培养基(X3)相比, 菌株Y9511生长均受到抑制, 且差异显著(图 2), 说明菌株无法利用这4种氮源, 加入氮源会抑制菌株生长。

|
图 1 不同碳源菌株Y9511对菌落生长的影响 Fig. 1 Effects of different carbon sources on strain Y9511 colony growth |
|
图 2 不同氮源对菌株Y9511菌落生长的影响 Fig. 2 Effects of different nitrogen sources on strain Y9511 colony growth |
从表 4可见:菌株Y9511在缺乏元素碳、氮、磷、镁、铁的培养基中的产孢量显著低于完全培养基(X1);与X1相比, 缺钾和缺铜的培养基上菌株Y9511不产孢, 说明钾和铜是菌株Y9511产孢必不可少的元素; 缺硫和锌的培养基菌株Y9511产孢量显著高于X1, 说明缺乏元素硫和锌的培养基更有助于产孢。
| 处理 Treatment |
孢子数/106 mL-1 Spore number |
| X1 | 1.47±0.10b |
| X2 | 0.31±0.04cd |
| X3 | 0.51±0.02c |
| X4 | 0.29±0.01cd |
| X5 | 3.76±0.20a |
| X6 | 0.00±0.00d |
| X7 | 0.10±0.01d |
| X8 | 0.58±0.08c |
| ZnSO4 | 3.75±0.20a |
| CuSO4 | 0.00±0.00d |
| X2(对照)Carbon deficiency(CK) | 0.31±0.04b |
| 葡萄糖Glucose | 0.03±0.01c |
| 蔗糖Sucrose | 1.47±0.10a |
| 麦芽糖Maltose | 0.02±0.01c |
| 可溶性淀粉Soluble starch | 0.03±0.01c |
| α-乳糖α-lactose | 0.38±0.03b |
| X3(对照)Nitrogen deficiency(CK) | 0.51±0.02b |
| Ca(NO3)2 | 0.13±0.01c |
| (NH4)2SO4 | 0.00±0.00c |
| NH4NO3 | 1.47±0.10a |
| 大豆蛋白胨Soy peptone | 0.12±0.02c |
菌株Y9511在供试的5种碳源培养基中均能产孢, 与以蔗糖作为碳源的培养基相比, 以葡萄糖、麦芽糖、α-乳糖和可溶性淀粉为碳源菌株Y9511产孢量均显著降低, 表明产孢最适碳源为蔗糖。在供试的4种氮源培养基中, 以(NH4)2SO4作为氮源菌株Y9511不能产孢, 以Ca(NO3)2和大豆蛋白胨为氮源的培养基产孢量显著低于以NH4NO3为氮源的培养基, 且以NH4NO3为氮源的培养基产孢量高于缺氮培养基, 说明菌株Y9511产孢的最适氮源为NH4NO3。
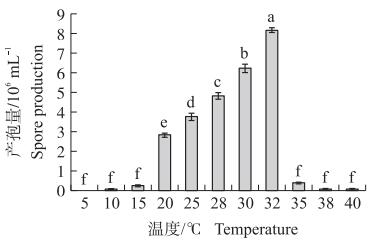
2.3 温度和pH对产孢量的影响由图 3可见:菌株Y9511除在5 ℃外的其他温度下均可产孢, 但低于15 ℃或高于35 ℃产孢量较小。在20~32 ℃, 随温度升高产孢量显著增加, 其中在32 ℃培养14 d产孢量最大, 达8.15×106 mL-1, 与其他处理差异显著。
|
图 3 不同温度对菌株Y9511产孢量的影响 Fig. 3 Effect of different temperature onspore productions of strain Y9511 |
由图 4可见:菌株Y9511在pH3~9条件下均能产孢。产孢量以pH值6.24时最高, 达2.77×106 mL-1, 与其他处理相比差异显著; 其次是pH值7.83和5.20。两者差异不显著; pH值为3.02和9.5时孢子数目最低, 说明过酸或过碱均不利于该菌株的产孢。

|
图 4 不同pH值对菌株Y9511产孢量的影响 Fig. 4 Effect of different pH value on sporeproduction of strain Y9511 |
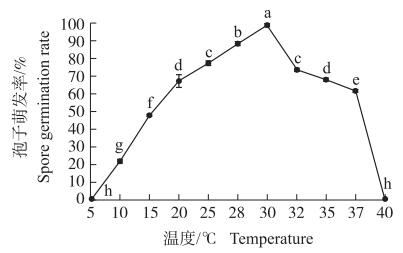
从图 5可见:在5 ℃培养时菌株Y9511孢子不能萌发; 10~30 ℃培养下, 菌株Y9511孢子萌发率随温度升高而增加, 30 ℃时孢子萌发率最高, 为98.5%, 与其他处理差异显著, 之后随温度升高而下降。
|
图 5 不同温度对菌株Y9511孢子萌发的影响 Fig. 5 Effect of different temperature on sporegermination of strain Y9511 |
菌株Y9511孢子在pH值3~9均能萌发, 萌发率为50%~90%, 其中pH值为6.24时, 孢子萌发率最高, 为85.8%, 其次是pH7.83, 为84.8%, 两者差异不显著, 但显著高于其他处理(图 6)。表明该菌株Y9511孢子萌发最适pH值为6.24~7.83。

|
图 6 不同pH值对菌株Y9511孢子萌发的影响 Fig. 6 Effect of different initial pH value onspore germination of strain Y9511 |
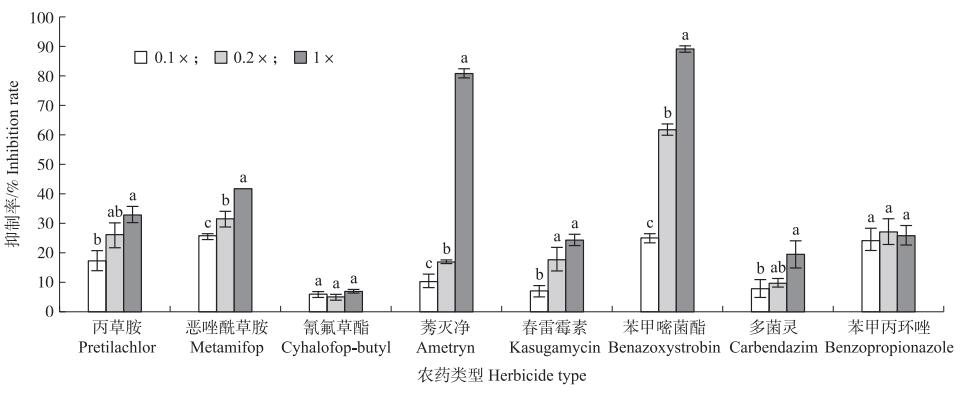
供试的8种农药对菌株Y9511孢子萌发均具有抑制作用, 且因农药种类以及浓度的不同而呈现差异, 抑制率为5.0%~89.4%(图 7)。除了氰氟草酯和苯甲丙环唑3种处理浓度下的萌发抑制率无显著差异外, 其他农药对孢子萌发抑制率均随浓度增加而增加, 其中恶唑酰草胺、莠灭净、苯甲嘧菌酯的3种浓度间均有显著差异。常规浓度下, 苯甲嘧菌酯的抑制率最高, 达89.4%, 与其他处理相比差异显著; 其次是莠灭净, 抑制率为81.1%;最低为氰氟草酯, 抑制率为7.0%;其他农药抑制率为19.5%~42.1%。亚致死浓度下, 抑制率最高同样是苯甲嘧菌酯, 为61.8%, 与其他组差异显著; 抑制率最低是氰氟草酯, 为5.0%。次亚致死浓度下, 抑制率为5.8%~25.6%, 其中恶唑酰草胺、苯甲嘧菌酯、苯甲丙环唑抑制率较高, 三者间无显著差异。总之, 菌株Y9511与供试农药氰氟草酯相容性最好, 3种处理浓度下抑制率最高仅为7%;其次是多菌灵, 3种浓度下抑制率为7.8%~19.5%;相容性最差的是苯甲嘧菌酯, 其抑制率为25.1%~85.4%。
|
图 7 不同农药除草剂和杀菌剂对菌株Y9511孢子萌发的影响 Fig. 7 Effect of different herbicides and fungicides on spore germination of strain Y9511 1×:田间推荐剂量; 0.2×:亚致死剂量; 0.1×:次亚致死剂量。 1×:Field recommended dose; 0.2×:Sub-lethal dose; 0.1×:Sub-sublethal dose. |
真菌除草制剂利用活的孢子和菌丝发挥其防治作用, 但其应用经常受到各种非生物胁迫的影响, 主要包括湿度、紫外线照射以及高温, 所以具有良好生长特性的真菌菌株通常用于杂草的生物防治, 且研究植物病原体生物学特性对于生物除草剂的开发具有重要意义[17-18]。
培养基是微生物发酵工业及微生物学研究的基础, 目前常用培养基主要包括PDA、查氏、蛋白胨、清水琼脂、完全培养基等[19]。已报道的对草莓根腐病菌、茄子褐纹病菌的生物学特性研究结果表明, 其最适培养基为PDA培养基; 枸杞根腐病的致病菌之一的单隔镰孢菌其最佳培养基为豆芽汁琼脂培养基[20-21]。本研究中, 通过完全培养基缺素培养探究了多种元素对菌株生长的影响, 研究结果表明, 菌株Y9511生长需要碳、磷、硫等3种元素, Y9511菌株的生长受到氮、铁的抑制, 微量元素铜和锌抑制Y9511菌株的生长; 培养基添加元素碳、氮、磷、镁、铁促进产孢, 钾和锌不可或缺, 缺硫有助于产孢。
真菌会对各种碳、氮源进行选择性利用, 且其利用碳、氮源的能力也因真菌种类差异而有所差别[19]。本试验中, 在供试的5种碳源中, 菌株对可溶性淀粉和D(+)-蔗糖的利用率较好, 而对于葡萄糖、麦芽糖和α-乳糖的利用率较弱; 以蔗糖为碳源的培养基产孢量最大, 为1.47×106 mL-1。在供试的4种氮源中, 与缺少氮源的培养基相比, 菌株生长均受到抑制, 说明菌株无法利用这4种氮源, 且加入氮源会抑制菌株生长; 4种氮源中, NH4NO3为氮源的培养基产孢量最大, 为1.47×106 mL-1。
温度与细胞质膜的流动关联密切, 影响酶促反应速率和真菌对营养物质的吸收以及代谢; pH值会影响真菌对营养物质的吸收以及酶促反应的效率, 因此温度、pH值是影响真菌生长的重要因素[19]。本研究中, Y9511在低于15 ℃和高于35 ℃的条件下产孢受到抑制, 32 ℃时产孢量达到最大值, 为8.15×106 mL-1; pH值在低于3.02和高于9.50时, 产孢量较低, pH值为6.24时, 产孢量达到最大值, 为2.77×106 mL-1; 30 ℃时孢子萌发率最高, 达98.5%;pH值为6.24时, 孢子萌发率达到最大值, 为85.8%。研究结果与陈勇等[22]对尖角突脐孢的生物学特性研究具有相似之处, 如产孢适合温度相差不大, 硝酸铵作为氮源产孢水平较好; 但因为菌株的菌种不同也存在一定的差异, 如菌株生长的最适pH值和碳源不同。菌株Y9511在田间利用最好避开夏季高温或冬季低温时节。然而, 在实际应用中, 对于嘴突凸脐孺孢菌控制千金子所需的温度、湿度、初始pH以及光照条件仍有待研究。
目前, 千金子对多种除草剂产生交互抗性, 针对化学除草剂使用面临的环境、食品安全等问题以及对杂草绿色防控技术的需求, 研发新型生物除草剂已经成为杂草防控的研究重点。但现阶段农业生产上, 生物除草剂的使用还是无法替代化学除草剂。研究发现, 微生物除草剂与某些低剂量的化学除草剂复配使用能有效提高防除效果, 且复配使用能够减少化学除草剂的相对使用量, 从而在一定程度上降低化学除草剂对环境危害[23-25]; 复配使用能够有效扩大单一菌体的杀草谱, 从一定程度上降低防除杂草的成本, 以及改变菌体对寄主的专一选择性等多种作用[26]。因此, 对于生物除草剂与化学除草剂混配使用的研究对除草剂开发具有重大意义。本文通过对嘴突凸脐蠕孢菌与不同化学农药混配的孢子萌发率评价了其与化学农药混配使用的可能性。通过与8种农药的混配, 我们得出:供试农药中, 氰氟草酯和莠灭净对该菌株孢子萌发影响较小, 相容性最好, 而苯甲嘧菌酯对孢子萌发影响最大, 相容性最差。与农药混配时, 最好选用对菌株孢子萌发抑制率较低的农药。
本研究对嘴突凸脐蠕孢菌菌株Y9511的生物学特性结果表明, 将其作为生物除草剂进行大规模生产是可行的, 且与化学农药混配的孢子萌发试验表明, 其作为生物农药与化学农药混配使用是可行的, 但对混配后的实际应用以及效果还需进一步探究。嘴突凸脐蠕孢菌作为微生物除草剂很有潜力, 但对其致病机制以及具体侵染过程尚有待进一步研究。
| [1] |
文马强.湖南直播稻田千金子对氰氟草酯的抗性测定及抗性生化机理研究[D].长沙: 湖南农业大学, 2017. Wen M Q. Study on resistance determination and biochemical mechanism of Leptochloa chinensis(L.)Nees to cyhalofop-butyl in paddy field of Hunan Province[D]. Changsha: Hunan Agricultural University, 2017(in Chinese with English abstract). |
| [2] |
陆云梅, 傅华欣, 顾文, 等. 水稻田千金子发生危害与防除对策[J]. 杂草科学, 2001, 19(1): 9-10. Lu Y M, Fu H X, Gu W, et al. Damage of Leptochloa chinensis in rice fields and its strategy for control[J]. Weed Science, 2001, 19(1): 9-10 (in Chinese with English abstract). DOI:10.3969/j.issn.1003-935X.2001.01.003 |
| [3] |
程勤海, 丰青, 陆志杰, 等. 浙江省海宁市直播稻田千金子大发生原因及治理对策[J]. 杂草科学, 2011, 29(2): 60-62. Cheng Q H, Feng Q, Lu Z J, et al. Causes and countermeasures of the direct seeding rice field in Haining City, Zhejiang Province[J]. Weed Science, 2011, 29(2): 60-62 (in Chinese with English abstract). DOI:10.3969/j.issn.1003-935X.2011.02.016 |
| [4] |
Yu J X, Gao H T, Pan L, et al. Mechanism of resistance to cyhalofop-butyl in Chinese sprangletop[Leptochloa chinensis(L.)Nees][J]. Pesticide Biochemistry and Physiology, 2017, 143: 306-311. DOI:10.1016/j.pestbp.2016.11.001 |
| [5] |
吴尚, 张纪利, 李保同, 等. 千金子对水稻生长的影响及其经济阈值[J]. 中国农业科学, 2015, 48(3): 469-478. Wu S, Zhang J L, Li B T, et al. Influence of Leptochloa chinensis on the growth of paddy rice and its economic threshold[J]. Scientia Agricultura Sinica, 2015, 48(3): 469-478 (in Chinese with English abstract). |
| [6] |
Green J M. Current state of herbicides in herbicide-resistant crops[J]. Pest Management Science, 2014, 70(9): 1351-1357. DOI:10.1002/ps.3727 |
| [7] |
王利, 朱朝华. 生物除草剂研究进展[J]. 广西热带农业, 2008(1): 15-17. Wang L, Zhu C H. Study progress on bioherbicide[J]. Guangxi Tropical Agriculture, 2008(1): 15-17 (in Chinese). DOI:10.3969/j.issn.2095-0764.2008.01.008 |
| [8] |
Reino J L, Hernandez-Galan R, Duran-Patron R, et al. Virulence-toxin production relationship in isolates of the plant pathogenic fungus Botrytis cinerea[J]. Journal of Phytopathology, 2004, 152(10): 563-566. DOI:10.1111/j.1439-0434.2004.00896.x |
| [9] |
苑丽蒲. 我国微生物农药的应用现状及发展前景[J]. 化工设计通讯, 2016, 42(12): 110-111. Yuan L P. Application status and development prospect of microbial pesticides in China[J]. Chemical Engineering Design Communications, 2016, 42(12): 110-111 (in Chinese with English abstract). DOI:10.3969/j.issn.1003-6490.2016.12.098 |
| [10] |
韩川.用于微生物除草剂的杂草病原真菌的筛选与评价[D].北京: 中国农业科学院, 2012. Han C. The selection and evaluation of pathogenic fungi using for microbial herbicide[D]. Beijing: Chinese Academy of Agricultural Sciences, 2012(in Chinese). |
| [11] |
屈洋, 冯佰利. 杂草生物控制技术研究进展[J]. 中国农学通报, 2019, 35(4): 108-115. Qu Y, Feng B L. Weed biological control technology:research progress[J]. Chinese Agricultural Science Bulletin, 2019, 35(4): 108-115 (in Chinese with English abstract). |
| [12] |
Charudattan R. Biological control of weeds by means of plant pathogens:significance for integrated weed management in modern agro-ecology[J]. BioControl, 2001, 46(2): 229-260. DOI:10.1023/A:1011477531101 |
| [13] |
Cordeau S, Triolet M, Wayman S, et al. Bioherbicides:dead in the water? a review of the existing products for integrated weed management[J]. Crop Protection, 2016, 87: 44-49. DOI:10.1016/j.cropro.2016.04.016 |
| [14] |
陈勇, 俞雯雯, 卢文涛, 等.一株嘴突凸脐蠕孢菌在防治水田杂草千金子中的应用:201910128106.2[P]. 2020-01-16. Chen Y, Yu W W, Lu W T, et al. A strain of Exserohilum rosttratum and its application in the prevention and control of weeds in the paddy field:201910128106.2[P]. 2020-01-16(in Chinese). |
| [15] |
方中达. 植病研究方法[M]. 北京: 中国农业出版社, 2001: 122-125. Fang Z D. Plant Disease Research Method[M]. Beijing: China Agriculture Press, 2001: 122-125 (in Chinese). |
| [16] |
强翠翠.盾壳霉对两种除草剂的敏感性评价及谷氨酰胺合成酶功能研究[D].武汉: 华中农业大学, 2018. Qiang C C. Sensitivity evaluation of two herbicides and the function of glutamine synthetase[D]. Wuhan: Huazhong Agricultural University, 2018(in Chinese with English abstract). |
| [17] |
Fernando T H P S, Jayasinghe C K, Wijesundera R L C. Cell wall degrading enzyme secretion by Colletotrichum acutatum the causative fungus of secondary leaf fall of Hevea brasiliensis[J]. Mycological Research, 2001, 105(2): 195-201. DOI:10.1017/S0953756200003324 |
| [18] |
Ortiz-Urquiza A, Keyhani N O. Stress response signaling and virulence:insights from entomopathogenic fungi[J]. Current Genetics, 2015, 61(3): 239-249. DOI:10.1007/s00294-014-0439-9 |
| [19] |
马迪.园林植物国槐溃疡病致病真菌的生物学特性和致病酶活性的研究[D].聊城: 聊城大学, 2018. Ma D. Biological characteristics and pathogenic enzyme activity studies on pathogenic fungi causing Sophora japonica Canker[D]. Liaocheng: Liaocheng University, 2018(in Chinese with English abstract). |
| [20] |
陈瑶, 王树雪, 魏艳敏, 等. 草莓根腐病菌C16-4的分离鉴定及生物学特性研究[J]. 果树学报, 2012, 29(4): 638-643. Chen Y, Wang S X, Wei Y M, et al. Studies on isolation, identification and biological characteristics of pathogenic fungus strain C16-4 of strawberry root rot[J]. Journal of Fruit Science, 2012, 29(4): 638-643 (in Chinese with English abstract). |
| [21] |
朱晓峰, 刘宏军, 席军强, 等. 枸杞根腐病病原菌的生物学特性研究[J]. 经济林研究, 2015(4): 128-132. Zhu X F, Liu H J, Xi J Q, et al. Biological characteristics of root rot pathogen in Lycium barbarum[J]. Nonwood Forest Research, 2015(4): 128-132 (in Chinese with English abstract). |
| [22] |
陈勇, 倪汉文, 李晓晶, 等. 大批量生产尖角突脐孢菌孢子技术[J]. 江西农业大学学报, 2009, 31(3): 530-536. Chen Y, Ni H W, Li X J, et al. A technique for mass-production of conidia of Exserohilum monoceras[J]. Acta Agriculturae Universitatis Jiangxiensis, 2009, 31(3): 530-536 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-2286.2009.03.029 |
| [23] |
Weaver M A, Jin X, Hoagland R E, et al. Improved bioherbicidal efficacy by Myrothecium verrucaria via spray adjuvants or herbicide mixtures[J]. Biological Control, 2009, 50(2): 150-156. |
| [24] |
赵美娜.马唐生防菌Col-68(Colletotrichum hanaui)发酵工艺及菌药复配的相关研究[D].金华: 浙江师范大学, 2012. Zhao M N. Optimization of the liquid fermentation condition and formulation of the biocontrol fungus Col-68(Colletotrichum hanaui)with chemical herbicides for control of Digitaria sanguinalis[D]. Jinhua: Zhejiang Normal University, 2012(in Chinese with English abstract). |
| [25] |
周文冠, 孟永杰, 陈锋, 等. 除草剂研发及其复混使用的现状与展望[J]. 草业科学, 2018, 35(1): 93-105. Zhou W G, Meng Y J, Chen F, et al. Current status and research progress of development and tankmix application of herbicides[J]. Pratacultural Science, 2018, 35(1): 93-105 (in Chinese with English abstract). |
| [26] |
游景茂, 谢甲涛, 付艳苹, 等. 除草剂精禾草克和乙草胺对油菜菌核病生防菌盾壳霉生长和寄生的影响[J]. 中国生物防治, 2010, 26(3): 340-346. You J M, Xie J T, Fu Y P, et al. Effect of quizalofop-ethyl and acetochlor on the growth and parasitism of sclerotial parasite Coniothyrium minitans[J]. Chinese Journal of Biological Control, 2010, 26(3): 340-346 (in Chinese with English abstract). |




