文章信息
- 钟秋怡, 徐霞, 张震, 丁艳锋, 王绍华, 李刚华
- ZHONG Qiuyi, XU Xia, ZHANG Zhen, DING Yanfeng, WANG Shaohua, LI Ganghua
- 叶面喷施N-乙酰-L-半胱氨酸对机插水稻缓苗的调节效应
- The effect of foliar spraying N-acetyl-L-cysteine on the recovery stage of machine-transplanted rice
- 南京农业大学学报, 2020, 43(4): 605-612
- Journal of Nanjing Agricultural University, 2020, 43(4): 605-612.
- http://dx.doi.org/10.7685/jnau.201908012
-
文章历史
- 收稿日期: 2019-08-06
农业机械化作为现代农业的重要体现, 是今后农业发展的必然趋势[1]。水稻是我国种植面积第二大的主要粮食作物, 推进水稻机械化种植是现代化农业的重要任务之一[2-4]。机插水稻由于移栽过程受伤严重, 水分吸收与蒸腾之间的平衡被打破, ROS积累, 破坏细胞及光合器官的稳定性, 秧苗产生氧化应激, 栽后生长发育、分蘖发生均受到影响, 缓苗期较手栽稻延长1周左右, 始蘖通常发生在栽后10~15 d, 低位分蘖率低, 因而限制产量潜力的发挥[5-7]。如何缩短机插水稻缓苗期, 一直是关键技术需求和重大研究问题。
移栽前喷施适宜的植物生长调节剂, 能调控秧苗的生理过程, 激活抗氧化防御机制, 提高其对抗植株受伤的能力[8-9]。如移栽前喷施三十烷醇, 能提高栽后秧苗叶绿素含量, 增强抗氧化酶活性, 缓解氧化损伤, 促进分蘖发生[10]; 叶面喷施胺鲜酯, 能提高移栽后秧苗光合速率, 减少H2O2含量, 降低MDA含量, 缩短机插水稻缓苗期[11]。
N-乙酰-L-半胱氨酸(NAC)作为生物中通用的抗氧化剂, 可以通过提高细胞内半胱氨酸的浓度促进GSH形成, 从而促进超氧自由基的清除[12]。研究发现, NAC促进Cd胁迫下龙葵中GSH的合成, 保护其免受氧化应激损伤[13]; 对Pb胁迫下的烟草喷施NAC能提高SOD、APX、CAT活性, 保护光合器官[14]。本文使用不同浓度NAC在移栽前对秧苗进行叶面喷施处理, 考查秧苗在移栽后形态指标、分蘖发生情况及抗氧化系统相关指标, 阐述叶面喷施NAC对机插水稻缓苗的调节效应, 为水稻机插快速缓苗物化产品研发提供依据。
1 材料与方法 1.1 试验材料及设计试验选用常规粳稻品种‘宁粳7号’作为材料, 于2017年水稻季在江苏省丹阳市延陵镇宝林村南京农业大学实验基地(31°54′N, 119°28′E)进行盆栽试验, 塑料桶高35 cm, 内径34 cm, 桶内土层高25 cm, 装土15 kg。供试土壤为当地水稻土, 含N 1.12 g·kg-1、P 0.47 g·kg-1、K 1.95 g·kg-1。
待秧苗长至3叶1心期(秧龄21 d)时, 选择长势相近的秧苗进行处理, 连续2 d傍晚分别叶面喷施含0.5% Tween-20的不同浓度NAC溶液(CK:0 μmol·L-1 NAC; F-NAC20:20 μmol·L-1 NAC; F-NAC200:200 μmol·L-1 NAC; F-NAC2000:2 000 μmol·L-1 NAC), 使调节剂沾满叶片表面, 利于吸收。在第2次喷施1 d后, 每个处理选择长势一致的秧苗剪根并保留2 cm根系(模拟机械移栽切根系造成的植株伤害)移栽至塑料桶中, 每个处理设3个重复, 每个重复30桶。每桶3穴, 每穴3苗。栽培管理措施与当地常规高产栽培习惯一致。
1.2 测定指标及方法于移栽当天(剪根前)和移栽后2、5、7、10 d分别获取地上部和地下部干、鲜样待测。
1.2.1 形态指标测定株高:用直尺测量秧苗茎基部至绿色叶片最顶端的距离。茎基宽:用直尺测量秧苗根系着生部位以上1 cm处的宽度。根系形态指标:在移栽后2、5 d将秧苗根系完整从土壤中挖出, 洗净后使用Epson Perfection V700 Photo扫描仪扫描, 并用WinRhizo Pro2004a分析获取根尖数、根长、根系直径、根系表面积、根系体积等指标。干物质量:将秧苗从根系着生部位分成地上部、地下部, 在105 ℃下杀青30 min, 烘干至恒质量后分别称量。每个处理设3个重复, 每个重复测定10株。
1.2.2 光合色素含量测定将新鲜叶片样品剪碎混匀后称取0.1 g样品置于离心管中, 用10 mL 95%乙醇溶液在避光条件下浸提48 h, 将上清液混匀后在479、649、665 nm波长下测定吸光值, 根据公式计算叶绿素a、b和类胡萝卜素含量。
1.2.3 抗氧化系统指标测定H2O2、MDA含量及抗氧化酶活性:称取0.3 g新鲜样品, 采用Jiang等[15]的方法制备提取液, 用南京建成生物公司提供的试剂盒测定H2O2含量, 用硫代巴比妥酸法测定MDA含量[16], 参照李合生[17]的方法测定SOD、POD、CAT、GR、APX活性。AsA-GSH循环:称取0.3 g新鲜样品, 用Anderson等[18]的方法测定抗坏血酸(ascorbate, AsA)、氧化型抗坏血酸(dehydroascorbate, DHA)、谷胱甘肽(glutathione, GSH)、氧化型谷胱甘肽(oxidized glutathione, GSSG)含量。
1.2.4 茎蘖动态考察移栽后每个重复选取长势相似的1穴秧苗每隔7 d定点统计分蘖数量, 拔节后统计拔节期、抽穗期、成熟期的茎蘖数或有效穗, 每个处理设3个重复。
1.3 数据处理及分析使用Microsoft Excel 2016分析数据并绘图, 用SPSS 20.0统计软件进行多重比较。
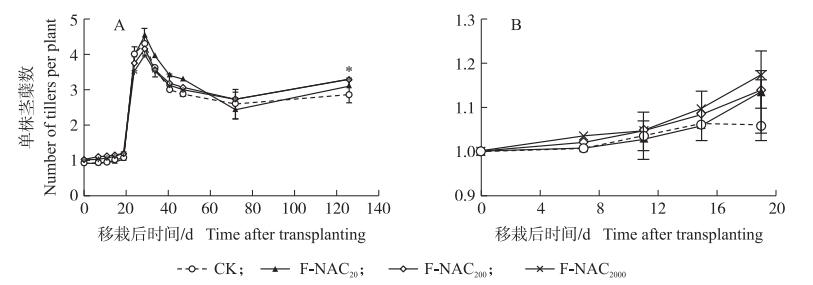
2 结果与分析 2.1 叶面喷施NAC对水稻秧苗机插移栽后分蘖的影响叶面喷施NAC对移栽后秧苗分蘖启动有促进作用(图 1), 效果随NAC浓度升高而增加(图 1-B)。移栽后7 d, 单株茎蘖数CK为1.01, F-NAC20、F-NAC200、F-NAC2000处理分别为1.01、1.02、1.04;移栽后15 d, F-NAC20、F-NAC200、F-NAC2000处理单株茎蘖数分别比CK提高0.2%、2.4%、3.3%;成熟时, CK单株有效穗数为2.9, F-NAC2000处理单株有效穗数为3.3(图 1-A)。
|
图 1 叶面喷施N-乙酰-L-半胱氨酸(NAC)对水稻秧苗移栽后茎蘖数的影响
Fig. 1 Effects of foliar spraying N-acetyl-L cysteine(NAC)on the number of tillerper plant of rice seedling after transplanting
图B为图A中移栽后1~19 d数据的放大。Figure B is the enlargement of Figure A 1-19 days’ date. *P < 0.05. CK:0 μmol·L-1 NAC; F-NAC20:20 μmol·L-1 NAC; F-NAC200:200 μmol·L-1 NAC; F-NAC2000:2 000 μmol·L-1 NAC.下同。The same below. |
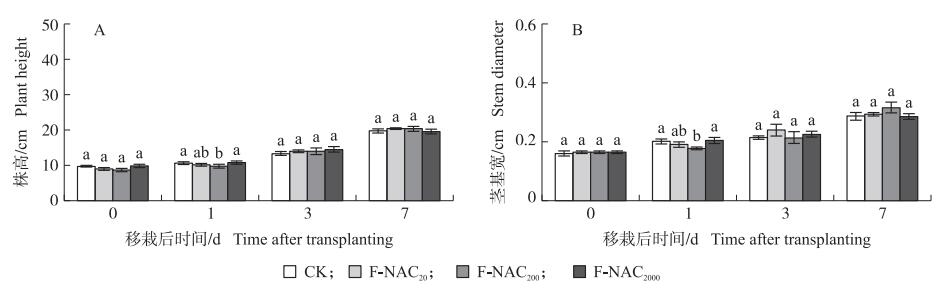
叶面喷施NAC对移栽前秧苗株高无显著影响, 但对移栽后株高有影响, 移栽后1 d, F-NAC200处理株高显著低于CK, 随后NAC对株高影响不显著(图 2-A)。移栽后1 d, F-NAC200处理的茎基宽显著低于CK(图 2-B)。
|
图 2 叶面喷施NAC对水稻秧苗移栽后株高(A)和茎基宽(B)的影响 Fig. 2 Effects of foliar spraying NAC on the plant height(A)and stem diameter(B)of rice seedling after transplanting 不同字母表示处理间差异显著(P < 0.05)。下同。 Different letters mean significant difference between treatments(P < 0.05). The same below. |
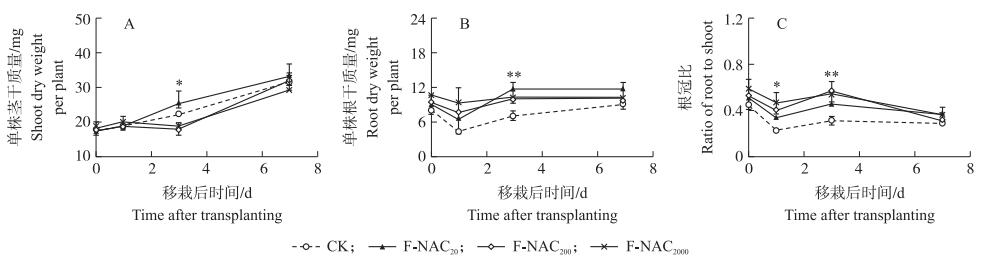
叶面喷施NAC对移栽后3 d茎干质量影响显著, 其中F-NAC20处理茎干质量较CK提高14.9%, F-NAC200、F-NAC2000处理茎干质量较CK分别减少19.4%、14.9%(图 3-A)。
|
图 3 叶面喷施NAC对秧苗移栽后干物质积累的影响 Fig. 3 Effects of foliar spraying NAC on dry matter accumulation ofrice seedling before and after transplanting *P < 0.05, **P < 0.01.下同。 The same as follows. |
移栽后, 不同处理根干质量呈先降低后升高的趋势(图 3-B)。叶面喷施不同浓度NAC均能提高移栽后秧苗的根干质量, 其中移栽后3 d, NAC对根干质量影响达显著水平, F-NAC20、F-NAC200、F-NAC2000处理根干质量较CK分别提高66.7%、42.9%、47.6%。
秧苗移栽后根冠比变化趋势与根干质量相似, 呈先降低后升高趋势(图 3-C)。NAC处理秧苗的根冠比均高于CK, 其中移栽后1 d时影响达显著水平, 3 d时达极显著水平, F-NAC2000处理根冠比在移栽后1和3 d均极显著高于CK。
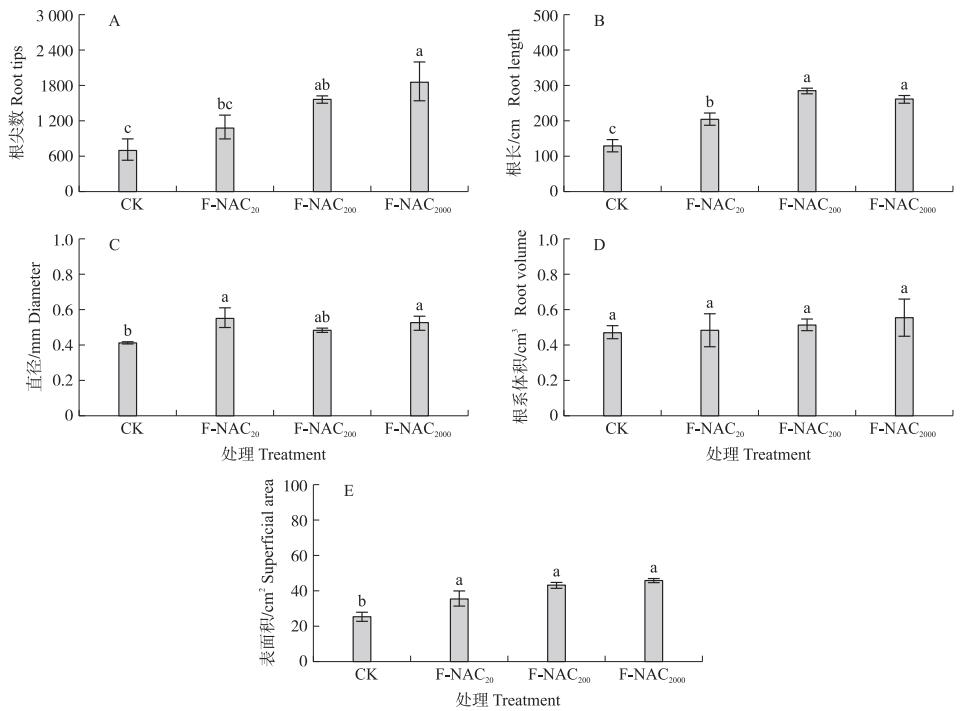
移栽后5 d水稻秧苗根系扫描结果显示, NAC处理极显著影响根尖数、根长、根直径和根表面积, 对根体积影响不显著(图 4)。根尖数随NAC浓度增加而增多, 其中F-NAC200、F-NAC2000处理根尖数显著多于CK, 分别提高121.4%、164.7%(图 4-A)。F-NAC20、F-NAC200、F-NAC2000处理根长均显著高于CK, 分别提高58.3%、121.4%、101.0%(图 4-B)。F-NAC20与F-NAC2000处理根系直径显著增加, 其中F-NAC20处理根粗较CK提高33.8%(图 4-C)。NAC处理根表面积均显著增加, 且增幅随NAC浓度升高而增大, 其中F-NAC2000处理较CK提高81.7%(图 4-E)。
|
图 4 叶面喷施NAC对水稻秧苗移栽后5 d根系形态的影响 Fig. 4 Effects of foliar spraying NAC on root morphology of rice seedling5 days after transplanting |
叶面喷施NAC极显著降低移栽当天(剪根前)的秧苗叶绿素含量。移栽后, CK中叶绿素含量从0.95 mg·g-1急剧降至0.48 mg·g-1, 而NAC处理的叶绿素含量变化平缓, 其中F-NAC20与F-NAC2000处理叶绿素含量增加。NAC对叶绿素含量的显著影响体现在移栽7 d以后, F-NAC2000处理栽后7、10 d的叶绿素含量分别较CK提高3.3%、23.5%(图 5-A)。
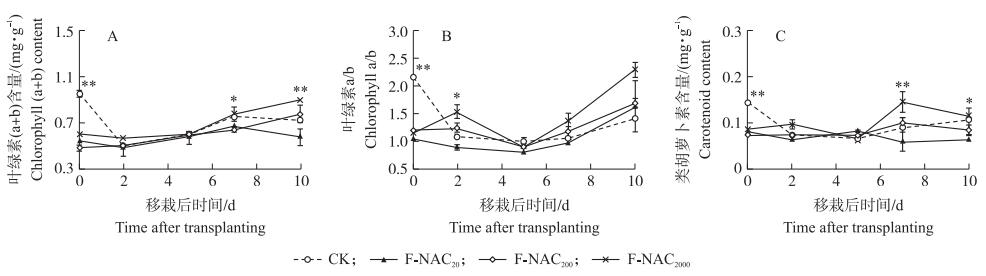
|
图 5 叶面喷施NAC对水稻秧苗移栽后光合色素含量的影响 Fig. 5 Effects of foliar spraying NAC on photosynthetic pigments content ofrice seedling leaf before and after transplanting |
叶面喷施NAC后, Chl a/b同样被极显著抑制。移栽后, 秧苗Chl a/b因叶绿素含量降低呈现先降低后升高的变化趋势, NAC处理叶绿素变化较平稳, 移栽后2 d F-NAC2000处理的Chl a/b达1.54, 较CK提高43.6%(图 5-B)。
叶面喷施NAC极显著降低移栽时秧苗的类胡萝卜素含量。在移栽后其含量同样呈现先急剧降低后缓慢升高的变化趋势, NAC处理的类胡萝卜素含量变幅比CK小, 对其含量的显著影响体现在移栽7 d以后, 其中F-NAC2000处理栽后7、10 d类胡萝卜素含量较CK分别提高61.9%、3.2%(图 5-C)。
2.4 叶面喷施NAC对水稻秧苗机插移栽后抗氧化系统的影响 2.4.1 对抗氧化酶活性的影响移栽前, 喷施NAC后秧苗叶片中超氧化物歧化酶(SOD)活性受到抑制, 但影响不显著。移栽后, CK中SOD活性先降低, 至移栽后5 d时开始升高, 而NAC处理中SOD活性在移栽后即呈现上升趋势, 其中各浓度处理在移栽后2 d均显著低于CK, 移栽后5 d, F-NAC200、F-NAC2000处理中SOD活性极显著高于CK, 分别较CK提高73.1%、48.6%(图 6-A)。
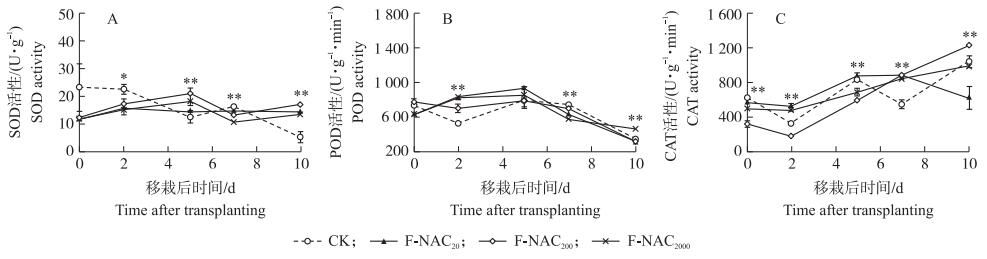
|
图 6 叶面喷施NAC对移栽后水稻秧苗叶片抗氧化酶活性的影响 Fig. 6 Effects of foliar spraying NAC on antioxidant enzyme activities ofrice seedling leaf before and after transplanting |
移栽前, NAC处理对秧苗喷施后叶片中过氧化物酶(POD)活性影响不显著。但极显著影响移栽后2、7、10 d的POD活性。移栽后2 d, F-NAC20、F-NAC200、F-NAC2000处理中POD活性均极显著高于CK, 增幅分别达60.7%、34.3%、59.4%;移栽后7 d, F-NAC20、F-NAC2000处理中POD活性极显著低于CK(图 6-B)。
NAC极显著影响移栽前后秧苗叶片中过氧化氢酶(CAT)活性。移栽前, 各浓度NAC处理中CAT活性均极显著低于CK, F-NAC200的抑制程度最大; 移栽后2 d, F-NAC20、F-NAC2000中CAT活性极显著高于CK, 移栽5 d以后, F-NAC20中CAT活性逐渐降低, 而其余2个NAC处理中CAT活性仍呈现升高趋势(图 6-C)。
2.4.2 对AsA-GSH循环的影响移栽前, NAC处理极显著影响叶片中抗坏血酸过氧化物酶(APX)活性, 其中F-NAC200、F-NAC2000处理APX活性提高, 而F-NAC20处理酶活性受抑制。但NAC对移栽后APX活性影响不显著(图 7-A)。NAC处理显著提高栽后2 d的叶片中还原型抗坏血酸(AsA)含量, F-NAC20、F-NAC200、F-NAC2000处理AsA含量比CK分别增加36.7%、67.7%、131.3%, 其中F-NAC200处理AsA含量显著高于CK, F-NAC2000处理AsA含量极显著高于CK(图 7-B)。NAC虽然对栽后2、5 d的叶片中AsA/DHA有促进作用, 但影响不显著(图 7-C)。
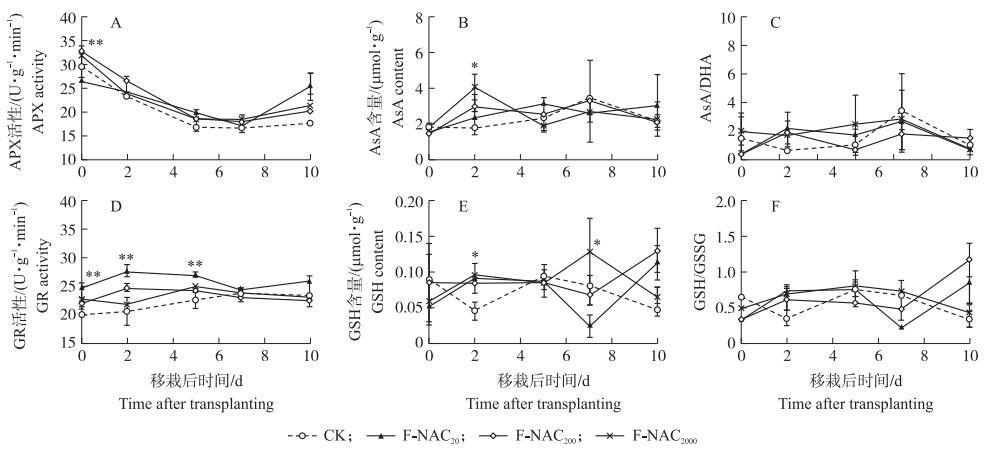
|
图 7 叶面喷施NAC对水稻秧苗移栽后叶片AsA-GSH循环的影响 Fig. 7 Effects of foliar spraying NAC on AsA-GSH pool of rice seedling leaf before and after transplanting |
NAC处理极显著提高秧苗移栽前及移栽后5 d的谷胱甘肽还原酶(GR)活性, F-NAC20处理对GR的促进效果最为明显, 在移栽前及移栽后2、5 d GR活性分别较CK提高24.1%、34.1%、19.9%(图 7-D)。NAC处理显著提高移栽后2、7 d的还原型谷胱甘肽(GSH)含量, 栽后2 d, 各浓度NAC处理的GSH含量显著高于CK; 栽后7 d, F-NAC20、F-NAC200处理中GSH含量降低至最低值, 而F-NAC2000处理中GSH含量再次升高, 显著高于CK(图 7-E)。NAC对GSH/GSSG具有一定的提升效果, 但影响不显著(图 7-F)。
2.4.3 对H2O2与MDA含量的影响NAC处理显著影响移栽前秧苗叶片中H2O2的含量, F-NAC20处理中H2O2含量显著高于CK, 其余2个NAC处理中H2O2含量低于CK。NAC处理显著降低秧苗移栽后5 d内叶片中H2O2含量, 栽后2、5 d F-NAC2000处理中H2O2含量均极显著低于CK, 分别比CK降低25.7%、10.3%(图 8-A)。
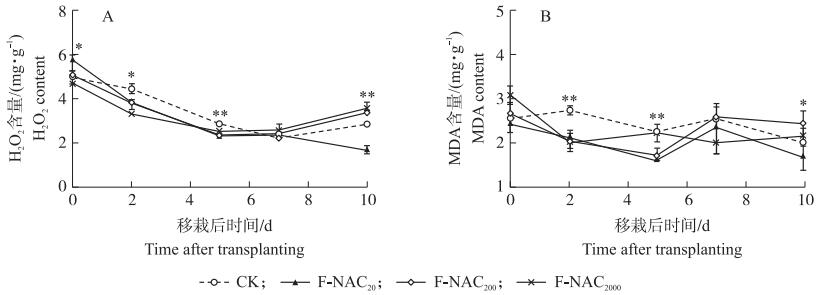
|
图 8 叶面喷施NAC对水稻秧苗机插移栽后叶片H2O2(A)与MDA(B)含量的影响 Fig. 8 Effects of foliar spraying NAC on the H2O2(A)and MDA(B)contents ofrice seedling leaf before and after transplanting |
NAC处理对移栽前叶片中MDA含量影响不显著。移栽后2、5 d NAC处理中秧苗叶片MDA含量极显著降低, 其中在栽后2 d, F-NAC20、F-NAC200、F-NAC2000处理的MDA含量均极显著低于CK, 降幅分别达23.6%、26.3%、26.3%(图 8-B)。
3 讨论 3.1 叶面喷施NAC可以缩短机插水稻缓苗期本研究发现, 叶面喷施NAC对地上部性状无显著影响, 甚至表现一定的“胁迫”症状, 但能促进根系生长, 表现在根尖数、根长以及根粗显著升高。已有研究证明, 苗期发根力及根系性状各项指标与株高、穗数、单株产量等地上部农艺性状显著相关[], NAC处理中秧苗移栽后低位分蘖发生情况优于CK, 成熟期有效穗数显著高于CK, 表明叶面喷施NAC通过提升栽后秧苗的发根力, 提高根量, 增加根长, 促进机插秧扎根立苗, 吸收养分, 有益于促进低位分蘖发生, 缩短机插水稻缓苗期。
3.2 NAC缓解氧化损伤是缩短水稻机插缓苗期的原因NAC提高秧苗抗氧化能力, 保护细胞及光合器官的稳定性在光合色素变化中有所体现, 叶面喷施NAC后, 秧苗叶绿素与类胡萝卜素含量极显著低于CK。移栽后, 秧苗因为遭受机械损伤, 植物因ROS水平不平衡产生氧化应激反应[3], 过量ROS积累产生毒性, 导致光合色素降解, 而NAC处理中叶绿素与类胡萝卜含量变化平缓, 无急剧下降趋势。研究指出逆境下叶绿素a降解速度快于叶绿素b, 叶绿素a/b随氧化损伤程度升高而降低[23]。本研究中NAC处理不仅使叶绿素a/b变化平缓, F-NAC200、F-NAC2000处理中该比值在移栽后短期内升高至高于CK的水平, 体现出NAC缓解植株伤害造成的氧化损伤以及减少叶绿素和类胡萝卜素降解的调节效应, 有利于提高移栽后秧苗的光合能力, 促进养分的积累, 以供受损根系修复及低位分蘖的发生。另外, NAC缓解光合色素的降解, 进而可能保护叶绿体形态的完整性, 有利于光合电子传递, 减少活性氧的产生。
POD是一种形成H2O2重要的酶, 较高的GSH/GSSG值能够使细胞维持较好的氧化还原状态[24]。本研究NAC处理中, POD在移栽后短期内被激活, 同时SOD活性受到抑制, CAT与GR的活性极显著提高, 并伴随着GSH的大量积累, 提高GSH/GSSG值, 显著降低H2O2含量, 缓解氧化损伤。MDA通常作为反映细胞膜脂过氧化程度的指标[25], 在本研究中, 秧苗在移栽受到伤害后, NAC处理使所受氧化损伤得到减少, MDA含量极显著降低。Li等[10]的研究证明, 水稻机插后水分吸收与蒸腾的失衡造成氧化损伤, 影响秧苗栽后生长, 缓苗期较长, 缓解氧化损伤有利于缩短缓苗期。NAC是一种生物中通用的抗氧化剂, 能够促进体内自由基清除剂的积累[9]; NAC可以减轻UV-B、除草剂引起的氧化应激[26-27]; NAC通过促进GSH的生物合成保护龙葵免受Cd胁迫造成的氧化损伤[13]。本研究结果与前人对NAC调控胁迫下植物抗氧化能力的研究结果类似:移栽前喷施NAC主要通过提高GR活性, 促进GSH的积累, 加强秧苗清除活性氧的能力, 减少H2O2含量, 保护细胞及光合器官免受氧化损伤, 从而改善秧苗在移栽后的生长状况, 有利于缩短缓苗期。
移栽前叶面喷施NAC能缓解机插水稻造成植株伤害的负面影响。NAC通过促进根系生长, 恢复吸收能力, 为秧苗栽后的生长提供养分, 同时调节抗氧化系统, 缓解氧化损伤, 减少叶绿素降解, 从而有效缩短机插秧缓苗期, 促进栽后分蘖发生。其中叶面喷施2 000 μmol·L-1 NAC效果最好。
| [1] |
杜永林, 缪学宽, 李刚华, 等. 江苏机插水稻大面积均衡增产共性特征分析[J]. 作物学报, 2014, 40(12): 2183-2191. Du Y L, Miao X K, Li G H, et al. Common characteristics of balanced yield increase in a large area of mechanical transplanted rice in Jiangsu Province[J]. Acta Agronomica Sinica, 2014, 40(12): 2183-2191 (in Chinese with English abstract). |
| [2] |
袁月明, 马旭. 水稻种植机械化的现状及芽播机械化的展望[J]. 农机化研究, 2004, 26(1): 41-43. Yuan Y M, Ma X. The progress of rice planting mechanization and prospect of bud-sowing mechanization in China[J]. Journal of Agricultural Mechanization Research, 2004, 26(1): 41-43 (in Chinese with English abstract). DOI:10.3969/j.issn.1003-188X.2004.01.012 |
| [3] |
于林惠, 李刚华, 徐晶晶. 基于高产示范方的机插水稻群体特征研究[J]. 中国水稻科学, 2012, 26(4): 451-456. Yu L H, Li G H, Xu J J. Population characteristics of machine-transplanted japonica high-yield demonstrartion fields[J]. Chinese Journal of Rice Science, 2012, 26(4): 451-456 (in Chinese with English abstract). DOI:10.3969/j.issn.1001-7216.2012.04.010 |
| [4] |
张文毅, 袁钊和, 吴崇友, 等. 水稻种植机械化进程分析研究:水稻种植机械化由快速向高速发展的进程[J]. 中国农机化, 2011, 32(1): 19-22. Zhang W Y, Yuan Z H, Wu C Y, et al. Research on the process of rice planting mechanization:process of rice planting mechanization developing fastly to rapidly[J]. Chinese Agricultural Mechanization, 2011, 32(1): 19-22 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-7205.2011.01.004 |
| [5] |
李刚华, 于林惠, 侯朋福, 等. 机插水稻适宜基本苗定量参数的获取与验证[J]. 农业工程学报, 2012, 28(8): 98-104. Li G H, Yu L H, Hou P F, et al. Calculation and verification of quantitative parameters of optimal planting density of machine-transplant rice[J]. Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(8): 98-104. DOI:10.3969/j.issn.1002-6819.2012.08.015 |
| [6] |
Reid J F, Zhang Q, Noguchi N, et al. Agricultural automatic guidance research in North America[J]. Computers and Electronics in Agriculture, 2000, 25(1): 155-167. |
| [7] |
Czarnocka W, Karpiński S. Friend or foe? Reactive oxygen species production, scavenging and signaling in plant response to environmental stresses[J]. Free Radical Biology and Medicine, 2018, 122: 4-20. DOI:10.1016/j.freeradbiomed.2018.01.011 |
| [8] |
Small C C, Degenhardt D. Plant growth regulators for enhancing revegetation success in reclamation:a review[J]. Ecological Engineering, 2018, 118: 43-51. DOI:10.1016/j.ecoleng.2018.04.010 |
| [9] |
Rademacher W. Plant growth regulators:backgrounds and uses in plant production[J]. Journal of Plant Growth Regulation, 2015, 34(4): 845-872. DOI:10.1007/s00344-015-9541-6 |
| [10] |
Li X C, Zhong Q Y, Li Y X, et al. Triacontanol reduces transplanting shock in machine-transplanted rice by improving the growth and antioxidant systems[J]. Frontiers in Plant Science, 2016, 7: 872. |
| [11] |
李小春.植物生长调节物质对机插粳稻缓苗返青的影响[D].南京: 南京农业大学, 2016. Li X C. The effect of plant growth regulators on machine-transplanted Japonica during the recovery[D]. Nanjing: Nanjing Agricultural University, 2016(in Chinese with English abstract). |
| [12] |
Hasanuzzaman M, Nahar K, Anee T I, et al. Glutathione in plants:biosynthesis and physiological role in environmental stress tolerance[J]. Physiology and Molecular Biology of Plants, 2017, 23(2): 249-268. DOI:10.1007/s12298-017-0422-2 |
| [13] |
Deng X P, Xia Y, Hu W, et al. Cadmium-induced oxidative damage and protective effects of N-acetyl-L-cysteine against cadmium toxicity in Solanum nigrum L.[J]. Journal of Hazardous Materials, 2010, 180(1/2/3): 722-729. |
| [14] |
Maodzeka A. Genotypic differences in tolerance to lead(Pb)toxicity in tobacco(Nicotiana tabacum), associated physiological mechanisms and the possible alleviatory role of N-acetyl cysteine(NAC)[D]. Zhejing: Zhejiang University, 2015.
|
| [15] |
Jiang M, Zhang J. Water stress-induced abscisic acid accumulation triggers the increased generation of reactive oxygen species and up-regulates the activities of antioxidant enzymes in maize leaves[J]. J Exp Bot, 2002, 53(379): 2401-2410. DOI:10.1093/jxb/erf090 |
| [16] |
Yu X Z, Lin Y J, Fan W J, et al. The role of exogenous proline in amelioration of lipid peroxidation in rice seedlings exposed to Cr(Ⅵ)[J]. International Biodeterioration & Biodegradation, 2017, 123(9): 106-112. |
| [17] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. Li H S. Principles and Techniques of Plant Physiological Biochemical Experiment[M]. Beijing: Higer Education Press, 2000 (in Chinese). |
| [18] |
Anderson J V, Chevone B I, Hess J L. Seasonal variation in the antioxidant system of eastern white pine needles:evidence for thermal dependence[J]. Plant Physiol, 1992, 98(2): 501-508. |
| [19] |
朱德峰, 林贤青, 曹卫星. 超高产水稻品种的根系分布特点[J]. 南京农业大学学报, 2000, 23(4): 5-8. Zhu D F, Lin X Q, Cao W X. Characteristics of root distribution of super high-yielding rice varieties[J]. Journal of Nanjing Agricultural University, 2000, 23(4): 5-8 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2000.04.002 |
| [20] |
Ju C X, Buresh R J, Wang Z Q, et al. Root and shoot traits for rice varieties with higher grain yield and higher nitrogen use efficiency at lower nitrogen rates application[J]. Field Crops Research, 2015, 175: 47-55. DOI:10.1016/j.fcr.2015.02.007 |
| [21] |
Kanbar A, Toorchi M, Shashidhar H E. Relationship between root and yield morphological characters in rainfed low land rice(Oryza sativa L.[J]. Cereal Research Communications, 2009, 37(2): 261-268. DOI:10.1556/CRC.37.2009.2.14 |
| [22] |
梁永书, 周军杰, 南文斌, 等. 水稻根系研究进展[J]. 植物学报, 2016, 51(1): 98-106. Liang Y S, Zhou J J, Nan W B, et al. Progress in rice root system research[J]. Chinese Bulletin of Botany, 2016, 51(1): 98-106 (in Chinese with English abstract). |
| [23] |
Kasajima I. Difference in oxidative stress tolerance between rice cultivars estimated with chlorophyll fluorescence analysis[J]. BMC Research Notes, 2017, 10(1): 168. DOI:10.1186/s13104-017-2489-9 |
| [24] |
May M J, Vernoux T, Leaver C, et al. Glutathione homeostasis in plants:implications for environmental sensing and plant development[J]. Journal of Experimental Botany, 1998, 49(321): 649-667. |
| [25] |
de Dios Alché J. A concise appraisal of lipid oxidation and lipoxidation in higher plants[J]. Redox Biology, 2019, 23(5): 101136. |
| [26] |
Iriti M, Castorina G, Picchi V, et al. Acute exposure of the aquatic macrophyte Callitriche obtusangula to the herbicide oxadiazon:the protective role of N-acetylcysteine[J]. Chemosphere, 2009, 74(9): 1231-1237. DOI:10.1016/j.chemosphere.2008.11.025 |
| [27] |
Malanga G, Kozak R G, Puntarulo S. N-acetylcysteine-dependent protection against UV-B damage in two photosynthetic organisms[J]. Plant Science, 1999, 141(2): 129-137. |




