文章信息
- 冯芳, 蔡豪亮, 刘文豪, 陈志刚
- FENG Fang, CAI Haoliang, LIU Wenhao, CHEN Zhigang
- 姜黄素与大豆蛋白的结合性及相互作用机制研究
- Study on the complexation and interaction mechanism of curcumin with soybean proteins
- 南京农业大学学报, 2020, 43(3): 537-546
- Journal of Nanjing Agricultural University, 2020, 43(3): 537-546.
- http://dx.doi.org/10.7685/jnau.201906034
-
文章历史
- 收稿日期: 2019-06-19
2. 河南向上食品有限公司, 河南 鹤壁 456250
2. Henan Xiangshang Food Co. Ltd., Hebi 456250, China
姜黄素(curcumin)是一种脂溶性的荧光分子[1], 是从姜黄根茎中提取的生物活性多酚化合物[2], 目前是世界上销量最大的天然食用色素之一[3]。姜黄素除具有多种药理活性外, 还在世界范围内被广泛用作香料(例如咖喱)、调味剂等, 因此成为国内外的研究热点。但姜黄素的水溶性极低, 而且在中性及碱性条件下不稳定, 易氧化, 易受到光照降解, 这极大地限制了它的应用[4]。
天然低共熔溶剂(NADES)是一类由活细胞的主要代谢产物例如糖、糖醇、有机酸、氨基酸等形成的黏性液体, 作为一种新型的绿色溶剂, 表现出从植物中溶解和提取多种化合物的巨大潜力[5]。而NADES对天然产物具有很强的稳定作用, 对天然产物的提取及进一步应用非常重要[6]。
目前, 蛋白质和酚类化合物之间的结合作用引起了越来越多的关注, 因为形成的结合物除具有作为纳米载体的潜力外, 还可以提升疏水性生物活性物质的溶解度、稳定性、生物利用度等[7-8]。Yang等[9]研究表明, 姜黄素与牛血清白蛋白的结合能够增加姜黄素的稳定性。大豆7S和11S蛋白作为大豆分离蛋白的主要组分, 约占组分的80%以上, 与大豆分离蛋白的性质密切相关[10]。大豆7S蛋白是相对分子质量为(150~200)×103的三聚体共轭型糖蛋白[11], 主要由α′(约71×103)、α(约67×103)和β(约50×103)亚基组成[12]。大豆11S蛋白是相对分子质量为(300~380)×103的六聚体非糖蛋白[11], 主要由酸性亚基[(35~37)×103]和碱性亚基(20×103)通过二硫键连接在一起[13], 结构的不同, 导致2种蛋白质功能性质的差异, 例如大豆11S蛋白具有良好的凝胶保水性, 而大豆7S蛋白具有良好的乳化性[14]。除此之外, 与动物蛋白相比, 植物蛋白更有希望成为生物活性物质的载体, 因为植物蛋白具有丰富的可再生资源和较低的成本[15]。
本研究通过研究姜黄素与大豆7S、11S蛋白的结合以及优化结合条件, 得到姜黄素与不同蛋白质的结合量、复溶率等, 并研究了与蛋白质结合后姜黄素的热稳定性及光稳定性; 通过荧光光谱测定结合常数及结合位点数, 傅里叶变换红外光谱分析蛋白质二级结构的变化, 并进一步研究姜黄素与蛋白质之间的相互作用, 旨在为水不溶性生物活性物质的利用提供一定的理论基础。
1 材料与方法 1.1 试剂与仪器姜黄素标准品(纯度≥98%)购于中国食品药品检定研究院; 脱脂大豆粉(纯度≥ 90%)购于秦皇岛金海食品工业有限公司; 三羟甲基氨基甲烷(Tris)购于北京索莱宝科技有限公司; 溴化钾购于国药集团化学试剂有限公司; 乙醇(分析纯)购于国药集团化学试剂有限公司。氯化胆碱(≥98.0%)、甘油(≥99.0%)、乙二醇、1, 2-丙二醇(AR)、葡萄糖(≥99.5%)、丙氨酸(≥99.0%)均购于阿拉丁化学试剂有限公司。
磁力搅拌器购自美国赛默飞世尔科技公司; 紫外可见分光光度计购自北京莱伯泰科仪器有限公司; 傅里叶变换红外光谱仪购自美国Thermo Electron公司; Varioskan Flash多功能酶标仪购自美国赛默飞世尔科技公司。
1.2 NADES的制备采用Huang等[16]的方法制备NADES。将NADES的2个成分进行混合, 并置于95 ℃水浴磁力搅拌器内, 搅拌直至形成均一、稳定的溶液(表 1)。将制备好的NADES转移至顶空进样瓶, 放置干燥器中直至恒质量。
| 天然低共熔溶剂NADES | 成分1 Component 1 | 成分2 Component 2 | 摩尔比Mole ratio |
| ChGly | 氯化胆碱Choline chloride | 甘油Glycerin | 1:1 |
| EGAla | 乙二醇Ethylene glycol | 丙氨酸Alanine | 1:1 |
| 3EGAla | 乙二醇Ethylene glycol | 丙氨酸Alanine | 3:1 |
| PGAla | 1, 2-丙二醇1, 2-propylene glycol | 丙氨酸Alanine | 1:1 |
| PGCh | 1, 2-丙二醇1, 2-propylene glycol | 氯化胆碱Choline chloride | 1:1 |
| GluCh | 葡萄糖Glucose | 氯化胆碱Choline chloride | 1:1 |
用95%(体积分数)乙醇精确配制质量浓度为5、4、2.5、2、1 μg · mL-1的姜黄素标准溶液。取适量溶液进行紫外全波长扫描, 确定姜黄素最佳检测波长为426 nm, 并测定不同质量浓度姜黄素的吸光值。以姜黄素质量浓度为横坐标, 吸光值为纵坐标绘制标准曲线, 得到的标准曲线为:y=0.131 5x+0.035 1(R2=0.992 8), 质量浓度范围为1~5 μg · mL-1。
1.4 大豆7S、11S蛋白的制备采用Liu等[17]的方法制备大豆7S及11S蛋白。
1.5 姜黄素-蛋白结合物的制备及条件优化 1.5.1 姜黄素添加量将0.25 g冷冻干燥的大豆7S、11S蛋白分别溶于5 mL水中, 蛋白质量浓度为50 g · L-1, 室温下搅拌1 h后, 分别添加10、20、30、40、50 mg的姜黄素于蛋白溶液中, 避光室温条件下于磁力搅拌器上搅拌4 h, 8 000 r · min-1离心20 min后, 吸取上清液测定吸光值。
1.5.2 水溶液含醇量将0.25 g冷冻干燥的大豆7S、11S蛋白分别溶于5 mL含0%、10%、20%、30%、40%(体积分数)乙醇的水溶液中, 蛋白质量浓度为50 g · L-1, 室温下搅拌1 h后, 将1.5.1节中选择的最佳姜黄素含量加入蛋白溶液中, 避光室温条件下于磁力搅拌器上搅拌4 h, 8 000 r · min-1离心20 min后, 吸取上清液测定吸光值。
1.5.3 搅拌温度将0.25 g冷冻干燥的大豆7S、11S蛋白分别溶于5 mL 1.5.2节中选择的最适含醇量的水溶液中, 蛋白质量浓度为50 g · L-1, 分别在20、30、40、50、60 ℃下搅拌1 h后, 将1.5.1节中选择的最佳姜黄素含量加入蛋白溶液中, 避光条件下继续在磁力搅拌器上搅拌4 h, 8 000 r · min-1离心20 min后, 吸取上清液测定吸光值。
1.6 姜黄素-蛋白结合量的测定以及结合物的复溶取姜黄素-大豆蛋白结合后的上清液0.1 mL, 溶于2 mL 95%乙醇中, 在426 nm下测定吸光值, 根据建立的标准曲线计算结合后姜黄素的含量。
将冷冻干燥后5 mg姜黄素-蛋白结合物粉末溶于0.5 mL水中, 涡旋振荡, 静置30 min后, 8 000 r · min-1离心20 min, 取0.1 mL上清液, 在426 nm下测定吸光值。
1.7 姜黄素-蛋白结合物在不同溶剂中的稳定性 1.7.1 光稳定性在5 mL离心管中加入2 mL溶剂(水、95%乙醇及NADES)和姜黄素-蛋白结合物粉末5 mg, 涡旋振荡直至无明显颗粒, 并置于25 ℃光照条件下; 与此同时, 另一组置于25 ℃黑暗条件下。各组样品每20 min吸取100 μL, 95%乙醇稀释后在426 nm下测定吸光值。
1.7.2 热稳定性在5 mL离心管中加入2 mL溶剂(水、95%乙醇及NADES)和姜黄素-蛋白结合物粉末5 mg, 涡旋振荡直至无明显颗粒。分别在40、60、80 ℃条件下, 加热30、60、90、120、150 min, 吸取上清液20 μL, 用95%乙醇稀释后在426 nm下测定吸光值。
1.8 姜黄素与蛋白质的相互作用机制 1.8.1 姜黄素-蛋白结合物的荧光光谱将蛋白质溶于Tris-HCl缓冲液(pH7.4)中, 使质量浓度为0.01 mg · mL-1。将姜黄素溶于Tris-HCl(pH7.4)缓冲液中, 制作浓度梯度为2~200 μmol · L-1的姜黄素溶液。将2 mL蛋白溶液与不同浓度的姜黄素溶液按体积比1 : 1混合, 得到姜黄素终浓度为1~100 μmol · L-1, 整个过程在避光条件下完成[18]。以280 nm为激发波长, 记录300~450 nm的发射波长。以未结合蛋白质溶液作为对照。
荧光猝灭是由各种分子相互作用诱导的荧光团的荧光量子产率降低导致的, 例如激发态反应、分子重排、能量转移、基态复合物形成和碰撞猝灭等[19]。荧光猝灭机制一般分为动态猝灭和静态猝灭, 如果猝灭机制属于动态猝灭, 则应遵循Stern-Volmer方程[20]:
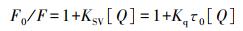
|
(1) |
式中:F0和F分别代表在不存在和存在猝灭剂(小分子)时的稳态荧光强度; KSV代表Stern-Volmer猝灭常数; Kq代表生物分子的猝灭速率常数; [Q]代表猝灭剂浓度; τ 0为没有猝灭剂的蛋白质的平均寿命, 生物聚合物的平均荧光寿命为10-8 s[21]。对于静态猝灭过程, 猝灭剂、荧光强度以及结合常数之间遵循如下公式:
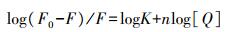
|
(2) |
式中:K表示姜黄素与蛋白质的结合常数, 表示结合发生的程度; n为每个蛋白分子的结合位点数, 通过曲线的斜率与截距来确定[19]。根据公式, 以log[Q]-log(F0-F)/F作图, 得到线性回归方程。
1.8.2 姜黄素-蛋白结合物的傅里叶变换红外光谱称取30 mg干燥溴化钾与100 mg姜黄素-蛋白结合物混合, 用玛瑙研钵研磨至细粉末状, 置于专用压片机中, 在10 N压力下保持60 s, 压制成均匀透明的圆形薄片, 用纯溴化钾压片作为空白对照。试验条件:光谱分辨率4 cm-1, 扫描次数为每秒32次, 波段扫描范围4 000~400 cm-1。由于酰胺Ⅰ带(1 600~1 700 cm-1)谱峰主要归属于C=O键伸缩振动, 可以反映蛋白质的二级结构信息[22], 因此对酰胺Ⅰ带进行基线校正, 平滑处理, 并在二阶导数基础上采用Gauss分峰拟合, 多次拟合使残差达到最小(R2≥ 0.999)[23]。计算拟合图谱中各子峰面积, 得到各二级结构的相对百分含量。
1.9 数据统计与分析数据表示为平均值±标准差(x±SD)。采用IBM SPSS Statistics 20软件进行数据分析, 并用OriginPro 9.1软件绘图。使用Peakfit v4.12软件拟合红外光谱图。
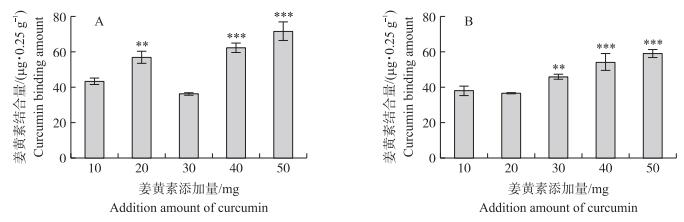
2 结果与分析 2.1 姜黄素-蛋白结合物最优条件的选择 2.1.1 姜黄素添加量由图 1可见:随着姜黄素添加量的增加, 姜黄素结合量整体呈增加趋势。但是当大豆7S蛋白中姜黄素添加量为30 mg及大豆11S蛋白中姜黄素添加量为20 mg时, 这2种蛋白质的姜黄素结合量比添加量均为10 mg时还要低。因此, 在后续条件优化过程中, 选择姜黄素最佳添加量为40 mg。
|
图 1 不同姜黄素添加量对大豆7S(A)和11S(B)蛋白结合物形成的影响 Fig. 1 Effect of different curcumin addition amounts on the formation of soybean 7S(A) and 11S(B)protein complexations * * P < 0.01, * * * P < 0.001. The same as follows. |
由图 2-A可见:当含醇量为20%时, 大豆7S蛋白与姜黄素的结合量最大, 是含醇量为0%、10%时的2倍左右。由图 2-B可见:大豆11S蛋白与姜黄素的结合量随着含醇量的增加而降低, 含醇量为0%时的结合量是含醇量20%、30%时的5~7倍; 当含醇量在20%以上时结合量显著降低, 试验中观察到蛋白质大多絮凝沉淀。

|
图 2 不同含醇量对大豆7S(A)和11S(B)蛋白结合物形成的影响 Fig. 2 Effect of different ethanol contents on the formation of soybean 7S(A) and 11S(B)protein complexations |
试验过程中, 添加姜黄素后随着温度从20 ℃升高至60 ℃, 蛋白质逐渐形成絮凝沉淀, 这是因为姜黄素与蛋白质之间的相互作用导致蛋白质溶解度降低, 形成聚集和沉淀, 因此选择20 ℃为最佳搅拌温度。
综上, 姜黄素-蛋白质结合的最优条件为:40 mg姜黄素与0.25 g大豆7S蛋白溶于含醇量20%的水溶液中, 搅拌温度20 ℃, 结合量为184.9 μg · 0.25 g-1; 40 mg姜黄素与0.25 g大豆11S蛋白溶于水溶液中, 搅拌温度20 ℃, 结合量为59.0 μg · 0.25 g-1。
2.2 姜黄素-蛋白质结合物的复溶由图 3-A可见:姜黄素与大豆7S蛋白结合后, 蛋白质外观表现为明亮的黄色。姜黄素-大豆7S蛋白结合物复溶后, 水溶液中未见有明显的悬浮颗粒, 溶液浊度增加(图 3-B)。通过对姜黄素-蛋白质结合物的显微镜观察(图 3-C), 发现姜黄素在溶于水后, 存在很多未溶解的姜黄素颗粒, 外观表现为姜黄素在水中溶解性低, 有很多悬浮的小颗粒。当姜黄素与蛋白质结合后, 未溶解的姜黄素颗粒明显减少。通过对复溶后的姜黄素含量进行测定, 与大豆7S蛋白结合的姜黄素复溶率为70%, 与大豆11S蛋白结合的姜黄素复溶率为83%。

|
图 3 姜黄素-大豆7S蛋白结合物 Fig. 3 Curcumin-soybean 7S protein complexation A.冻干蛋白的外观形态; B.姜黄素-蛋白结合物复溶于水; C.光学显微镜图(×100);a.大豆7S蛋白; b.姜黄素-大豆7S蛋白结合物; c.姜黄素。 A. Appearance of freeze-dried protein; B. Resolubilization of the curcumin-protein complexations; C. Optical microscopy(×100);a. Soybean 7S protein; b. Curcumin-soybean 7S protein complexation; c.Curcumin. |
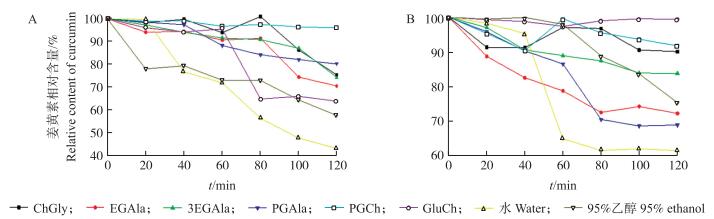
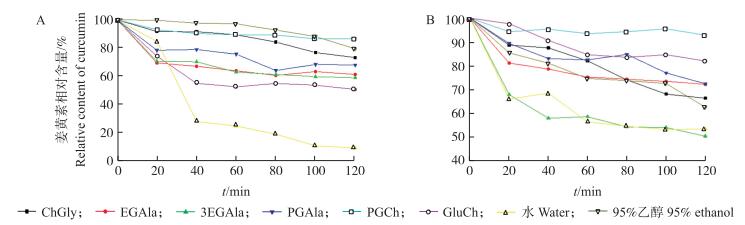
由图 4和图 5可见:姜黄素-蛋白质结合物在光照条件下, 120 min时姜黄素相对含量分别从100%降至43%~96%(大豆7S蛋白)、10%~87%(大豆11S蛋白); 在黑暗条件下, 120 min时姜黄素相对含量分别从100%降至61%~99%(大豆7S蛋白)、50%~92%(大豆11S蛋白), 与光照条件相比, 黑暗条件下姜黄素相对含量高, 说明黑暗条件能够减缓溶液中姜黄素降解, 但是不能完全阻止姜黄素降解。整体来看, 姜黄素-大豆7S蛋白结合物的光稳定性高于姜黄素-大豆11S蛋白结合物的光稳定性, 这与姜黄素结合的蛋白质种类有关。
|
图 4 姜黄素-大豆7S蛋白结合物在不同溶剂中的光稳定性(A.光照; B.黑暗) Fig. 4 Photostability of curcumin-soybean 7S protein complexation in different solvents(A. Light; B. Dark) |
|
图 5 姜黄素-大豆11S蛋白结合物在不同溶剂中的光稳定性(A.光照; B.黑暗) Fig. 5 Photostability of curcumin-soybean 11S protein complexation in different solvents(A. Light; B. Dark) |
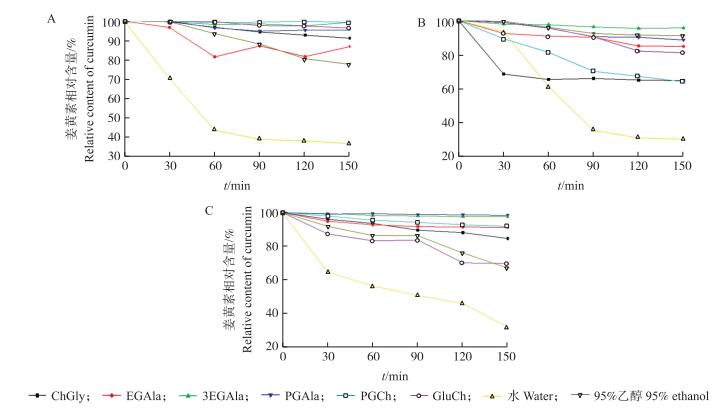
由图 6和图 7可见:在40、60和80 ℃下, 150 min时姜黄素-大豆7S蛋白结合物水溶液中姜黄素相对含量分别为84.8%、46.9%和1.6%;姜黄素-大豆11S蛋白结合物水溶液中姜黄素相对含量分别为37.0%、30.0%和31.7%, 整体变化不大, 这可能与姜黄素结合的蛋白质种类有关。随着温度的升高, NADES中姜黄素相对含量没有太大的变化, 约为90%。因为姜黄素与蛋白质的结合物导致蛋白质变性温度的改变, 在80 ℃时, 没有看到明显的蛋白质沉淀絮凝。相同条件下, 未结合的姜黄素相对含量约为86%, 而结合后的姜黄素相对含量均为95%左右, 说明结合后的姜黄素热稳定性有所提高。

|
图 6 不同温度下姜黄素-大豆7S蛋白结合物的热稳定性(A. 40 ℃; B. 60 ℃; C. 80 ℃) Fig. 6 Thermal stability of curcumin-soybean 7S protein complexation at different temperatures |
|
图 7 不同温度下姜黄素-大豆11S蛋白结合物的热稳定性(A. 40 ℃; B. 60 ℃; C. 80 ℃) Fig. 7 Thermal stability of curcumin-soybean 11S protein complexation at different temperatures |
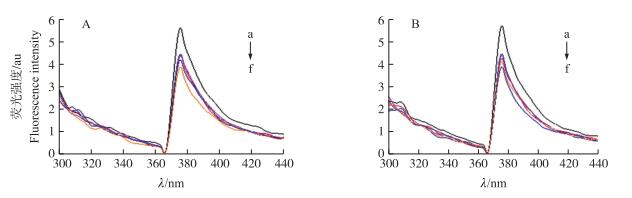
由图 8可见:在372 nm处, 随着姜黄素(猝灭剂)浓度的增加, 2种蛋白的荧光强度有规律降低, 但是最大发射峰的位置并没有发生变化, 表明姜黄素与蛋白质相互作用, 并导致蛋白质内源荧光的猝灭。
|
图 8 姜黄素作为猝灭剂的大豆7S(A)和11S(B)蛋白荧光猝灭光谱 Fig. 8 Fluorescence quenching spectra of soybean 7S(A)and 11S(B)proteins with curcumin as quencher added 蛋白质量浓度为0.005 mg · mL-1; a—f:姜黄素浓度分别为0、10、20、40、60、100 μmol · L-1。 The protein concentration is 0.005 mg · mL-1; a-f:Concentrations of curcumin are 0, 10, 20, 40, 60, 100 μmol · L-1, respectively. |
姜黄素与大豆7S、11S蛋白结合的Stern-Volmer猝灭曲线见图 9。根据式(1)得:猝灭速率常数姜黄素-大豆7S蛋白为5.8×103 L · mol-1, 姜黄素-大豆11S蛋白为1.2×103 L · mol-1。生物大分子的平均荧光寿命为10-8 s, 因此动态猝灭常数姜黄素-大豆7S蛋白为5.8×1011 L · mol-1 · s-1, 姜黄素-大豆11S蛋白为1.2×1011 L · mol-1 · s-1。研究表明, 各种猝灭剂对生物大分子的最大动态猝灭常数为2.0×1010 L · mol-1 · s-1[17], 姜黄素与大豆7S、11S蛋白相互作用的动态猝灭常数均大于最大动态猝灭常数, 因此姜黄素引起大豆7S、11S蛋白的荧光猝灭为静态猝灭, 推测姜黄素与大豆7S、11S蛋白结合生成不发光的复合物。
|
图 9 姜黄素与大豆7S(A)和11S(B)蛋白结合的Stern-Volmer方程 Fig. 9 Stern-Volmer quenching plot of curcumin with soybean 7S(A)and 11S(B)proteins F0/F:蛋白质荧光强度/姜黄素-蛋白质结合物荧光强度Fluorescence intensity of protein/fluorescence intensity of curcumin-protein complexation; c:蛋白质溶液中添加的姜黄素浓度Concentration of curcumin in protein solution. |
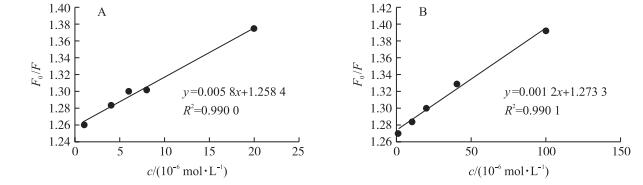
通过图 10, 可以得出姜黄素与大豆7S、11S蛋白的结合常数分别为4.2×104和2.5×104 L · mol-1, 结合位点数分别为0.51和0.64, 说明姜黄素与蛋白质生成摩尔比约为1 : 2的结合物。
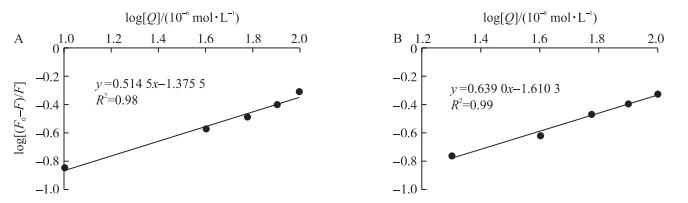
|
图 10 姜黄素-蛋白质结合物函数图 Fig. 10 Plot of curcumin-protein complexation A.姜黄素-大豆7S蛋白Curcumin-soybean 7S protein; B.姜黄素-大豆11S蛋白Curcumin-soybean 11S protein. [Q]:猝灭剂浓度Quencher concentration. |
与姜黄素结合后的蛋白在2 000 cm-1处红外光谱出现了明显的升高(图 11), 表明姜黄素与蛋白质发生了相互作用。酰胺Ⅰ带中各子峰与二级结构的对应关系为:1 612 cm-1附近的吸收峰为蛋白质和多肽的侧链吸收; 1 618~1 640 cm-1为β-折叠结构; 1 640~1 649 cm-1为无规则卷曲结构; 1 650~1 660 cm-1为α-螺旋结构; 1 660~1 700 cm-1为β-转角结构。通过对酰胺Ⅰ带的分析, 结果(表 2)显示, 与姜黄素结合后的蛋白与未结合蛋白相比, 大豆7S蛋白的α-螺旋、β-折叠以及无规则卷曲的含量增加, 而β-转角含量降低; 大豆11S蛋白的α-螺旋、无规则卷曲含量增加, 而β-折叠和β-转角含量降低。

|
图 11 姜黄素-大豆7S和11S蛋白结合物的红外光谱图 Fig. 11 FT-IR spectra of curcumin-soybean 7S and 11S protein complexations |
| 蛋白质Proteins | α-螺旋/% α-helix | β-折叠/% β-sheet | β-转角/% β-turn | 无规则卷曲/% Random coil |
| 姜黄素-大豆7S蛋白Curcumin-soybean 7S protein | 16.81±0.12 | 32.92±0.08 | 33.67±0.06 | 16.60±0.02 |
| 大豆7S蛋白Soybean 7S protein | 15.71±0.06 | 30.04±0.04 | 37.88±0.04 | 16.05±0.01 |
| 姜黄素-大豆11S蛋白Curcumin-soybean 11S protein | 17.05±0.17 | 28.90±0.17 | 27.96±0.24 | 26.08±0.07 |
| 大豆11S蛋白Soybean 11S protein | 15.83±0.19 | 30.50±0.27 | 37.40±0.34 | 15.55±0.14 |
蛋白质与多酚的结合位点数能够影响二者的结合程度, 而浓度是影响结合位点数的一个重要因素[24]。随着姜黄素添加量的增加, 姜黄素含量出现减少的情况, 推测可能是由于此时蛋白质与姜黄素结合不紧密, 而随着姜黄素添加量的增加, 姜黄素与蛋白的接触机会更多, 因此姜黄素结合量呈上升趋势。姜黄素在水中溶解性低, 因此不利于与蛋白结合, 而适量乙醇(20%, 体积分数)的添加能够增加姜黄素的溶解性, 有利于姜黄素-蛋白结合物的形成。在蛋白质与多酚形成复合物的过程中, 温度是重要因素之一。随着温度升高, 蛋白质首先解聚变性, 絮凝沉淀, 因此不利于与姜黄素结合, 结合强度下降。
姜黄素作为一种着色剂, 对蛋白质有很强的染色能力[25]。蛋白质与酚类物质的相互作用能够导致水溶液中结合物的浊度增加[26]。由于姜黄素的分子结构中含有酚羟基、双键等较为活泼的基团, 因此姜黄素在一些条件下不稳定, 例如光照能够促使姜黄素失活褪色[27]。与水相比, 姜黄素在NADES中的降解较慢, 因为NADES是通过氢键相互作用, 氢键作用可以稳定酚类化合物的结构[6], 提高稳定性。随温度升高, 姜黄素含量显著降低, 分析可能是因为姜黄素水溶性极低, 因此与溶液间的相互作用较弱, 随温度升高, 分子热运动加剧, 导致姜黄素降解。姜黄素在NADES与乙醇中的降解趋势相似, 但当温度升高后, 由于乙醇具有挥发性, 溶剂减少, 溶质析出, 因此在较高温度条件下, NADES比乙醇更适合溶解姜黄素。结合后的姜黄素热稳定性有所提高, 可能是由于溶液中除了姜黄素分子间、姜黄素与溶液间的相互作用以外, 还有姜黄素与蛋白质间的氢键相互作用, 这进一步增加了姜黄素的热稳定性, 而且随温度升高, 蛋白质解聚程度变大, 与姜黄素的作用更紧密, 因此稳定性更高。姜黄素与蛋白质结合可以改善姜黄素的稳定性, 与蛋白质的类型和性质密切相关, 通过荧光光谱法可知, 姜黄素与大豆7S蛋白和大豆11S蛋白的结合强度均较弱[28]。蛋白质二级结构的变化, 在一定程度上说明了蛋白质在与姜黄素结合过程中, 可能使蛋白质多肽链的骨架伸展, 影响了蛋白质的稳定性, 导致部分蛋白质解折叠。
在本研究中, 姜黄素-蛋白质结合的最优条件为:40 mg姜黄素与0.25 g大豆7S蛋白溶于含醇量20%的水溶液中, 搅拌温度20 ℃, 结合量为184.9 μg · 0.25g-1; 40 mg姜黄素与0.25 g大豆11S蛋白溶于水溶液中, 搅拌温度20 ℃, 结合量为59.0 μg · 0.25g-1。与大豆7S、11S蛋白结合后的姜黄素在NADES中的光、热稳定性均有所提高。荧光光谱表明, 姜黄素引起大豆7S、11S蛋白的荧光猝灭为静态猝灭, 并且二者结合可能生成了摩尔比约为1 : 2的不发光复合物。傅里叶红外光谱反映出蛋白质二级结构的改变, 说明姜黄素引起了蛋白质部分二级结构的展开与折叠。
综上所述, 姜黄素与大豆7S、11S蛋白相互作用, 并使用NADES作为溶剂, 克服了姜黄素水溶性低、稳定性差的缺陷, 为实际应用提供了理论支持, 并为其他不溶性生物活性物质与大分子的结合提供了新思路。
| [1] |
Barik A, Priyadarsini K I, Mohan H R. Photophysical studies on binding of curcumin to bovine serum albumin[J]. Photochemistry and Photo-biology, 2007, 77(6): 597-603. DOI:10.1562/0031-8655(2003)0770597PSOBOC2.0.CO2 |
| [2] |
Pröhl M, Schubert U S, Weigand W, et al. Metal complexes of curcumin and curcumin derivatives for molecular imaging and anticancer therapy[J]. Coordination Chemistry Reviews, 2016, 307: 32-41. DOI:10.1016/j.ccr.2015.09.001 |
| [3] |
Bengmark S, 刘青. 植物源保护剂姜黄素的研究进展[J]. 现代药物与临床, 2009, 24(1): 22-31. Bengmark S, Liu Q. Research progress on curcumin, a plant-derived protective agent[J]. Modern Pharmacy and Clinic, 2009, 24(1): 22-31 (in Chinese). |
| [4] |
Tønnesen H H. Solubility and stability of curcumin in solutions containing alginate and other viscosity modifying macromolecules. Studies of curcumin and curcuminoids[J]. Pharmazie, 2006, 61(8): 696-700. |
| [5] |
González C G, Mustafa N R, Wilson E G, et al. Application of natural deep eutectic solvents for the"green"extraction of vanillin from Vanilla pods[J]. Flavour and Fragrance Journal, 2018, 33(1): 91-96. DOI:10.1002/ffj.3425 |
| [6] |
Dai Y T, Verpoorte R, Choi Y H. Natural deep eutectic solvents providing enhanced stability of natural colorants from safflower( Carthamus tinctorius )[J]. Food Chemistry, 2014, 159: 116-121. DOI:10.1016/j.foodchem.2014.02.155 |
| [7] |
Kaya-Celiker H, Mallikarjunan K. Better nutrients and therapeutics delivery in food through nanotechnology[J]. Food Engineering Reviews, 2012, 4(2): 114-123. DOI:10.1007/s12393-012-9050-3 |
| [8] |
Yallapu M M, Jaggi M, Chauhan S C. Curcumin nanoformulations:a future nanomedicine for cancer[J]. Drug Discovery Today, 2012, 17(1/2): 71-80. |
| [9] |
Yang M, Wu Y, Li J, et al. Binding of curcumin with bovine serum albumin in the presence of Ɩ-carrageenan and implications on the stability and antioxidant activity of curcumin[J]. Journal of Agricultural and Food Chemistry, 2013, 61(29): 7150-7155. DOI:10.1021/jf401827x |
| [10] |
Rosenberg M, Rosenberg Y, Frenkel L. Microencapsulation of model oil in wall matrices consisting of SPI and maltodextrins[J]. AIMS Agriculture and Food, 2016, 1(1): 33-51. DOI:10.3934/agrfood.2016.1.33 |
| [11] |
Keerati-u-rai M, Corredig M. Heat-induced changes in oil-in-water emulsions stabilized with soy protein isolate[J]. Food Hydrocolloids, 2009, 23(8): 2141-2148. DOI:10.1016/j.foodhyd.2009.05.010 |
| [12] |
Ruíz-Henestrosa V P, Sánchez C C, Escobar M D M Y, et al. Interfacial and foaming characteristics of soy globulins as a function of pH and ionic strength[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2007, 309(1/2/3): 202-215. |
| [13] |
Tarone A G, Fasolin L H, Perrechil F D A, et al. Influence of drying conditions on the gelling properties of the 7S and 11S soy protein fractions[J]. Food and Bioproducts Processing, 2013, 91(2): 111-120. |
| [14] |
Staswick P E, Hermodson M A, Nielsen N C. Identification of the cystines which link the acidic and basic components of the glycinin subunits[J]. The Journal of Biological Chemistry, 1984, 259(21): 13431-13435. |
| [15] |
Chen F, Li B, Tang C. Nanocomplexation between curcumin and soy protein isolate:influence on curcumin stability/bioaccessibility and in vitro protein digestibility[J]. Journal of Agricultural and Food Chemistry, 2015, 63(13): 3559-3569. DOI:10.1021/acs.jafc.5b00448 |
| [16] |
Huang Y, Feng F, Chen Z G, et al. Green and efficient removal of cadmium from rice flour using natural deep eutectic solvents[J]. Food Chemistry, 2018, 244: 260-265. DOI:10.1016/j.foodchem.2017.10.060 |
| [17] |
Liu C, Wang H L, Cui Z M, et al. Optimization of extraction and isolation for 11S and 7S globulins of soybean seed storage protein[J]. Food Chemistry, 2007, 102: 1310-1316. DOI:10.1016/j.foodchem.2006.07.017 |
| [18] |
Bourassa P, Kanakis C D, Tarantilis P, et al. Resveratrol, genistein, and curcumin bind bovine serum albumin[J]. The Journal of Physical Chemistry B, 2010, 114(9): 3348-3354. DOI:10.1021/jp9115996 |
| [19] |
Cheng Z, Liu R, Jiang X, et al. The interaction between cepharanthine and two serum albumins:multiple spectroscopic and chemometric investigations[J]. Luminescence, 2014, 29(5): 504-515. DOI:10.1002/bio.2576 |
| [20] |
Gao D, Tian Y, Bi S, et al. Studies on the interaction of colloidal gold and serum albumins by spectral methods[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2005, 62(4/5): 1203-1208. |
| [21] |
Zhao X C, Liu R T, Teng Y, et al. The interaction between Ag+ and bovine serum albumin:the interaction between Ag+ and bovine serum albumin:a spectroscopic investigation[J]. Science of the Total Environment, 2011, 409(5): 892-897. DOI:10.1016/j.scitotenv.2010.11.004 |
| [22] |
刘勤勤, 朱科学, 郭晓娜, 等. 茶多酚与大豆分离蛋白的相互作用[J]. 食品科学, 2015, 36(17): 43-47. Liu Q Q, Zhu K X, Guo X N, et al. Spectroscopic analysis of interaction between tea polyphenol and soy protein isolate[J]. Food Science, 2015, 36(17): 43-47 (in Chinese with English abstract). DOI:10.7506/spkx1002-6630-201517009 |
| [23] |
刘春雷, 孙立斌, 李相昕, 等. 大豆7S和11S蛋白二级结构与表面疏水性相关性的研究[J]. 食品科学, 2015, 36(17): 28-32. Liu C L, Sun L B, Li X X, et al. Correlation of secondary structures of 7S and 11S soybean proteins and their surface hydrophobicity[J]. Food Science, 2015, 36(17): 28-32 (in Chinese with English abstract). DOI:10.7506/spkx1002-6630-201517006 |
| [24] |
许铭珠.葡萄皮花青素提取物与蛋白质的相互作用及其对色素稳定性的影响[D].无锡: 江南大学, 2015. Xu M Z. Interaction of protein with grape skin anthocyanins extracts(GSAE)and its effect on the stability of GSAE[D]. Wuxi: Jiangnan University, 2015(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10295-1015431304.htm |
| [25] |
唐课文, 周丹. 从姜黄中提取姜黄素的研究[J]. 天然产物研究与开发, 2004, 16(3): 231-234. Tang K W, Zhou D. Study on extraction of curcumin from turmeric[J]. Natural Product Research and Development, 2004, 16(3): 231-234 (in Chinese). DOI:10.3969/j.issn.1001-6880.2004.03.015 |
| [26] |
綦菁华, 蔡同一, 庞美霞, 等. 影响蛋白质-酚类聚合物形成的因素研究[J]. 中国食品学报, 2009, 9(6): 78-82. Qi J H, Cai T Y, Pang M X, et al. Studies on the influencing factors for formative polymer of protein with phenols[J]. Journal of Chinese Institute of Food Science and Technology, 2009, 9(6): 78-82 (in Chinese with English abstract). DOI:10.3969/j.issn.1009-7848.2009.06.013 |
| [27] |
郑君花.姜黄色素的提取、稳定化及其应用研究[D].贵阳: 贵州大学, 2015. Zheng J H. The extraction, stabilization and application of curcumin[D]. Guiyang: Guizhou University, 2015(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10657-1015911020.htm |
| [28] |
陈国珍. 荧光分析法[M]. 北京: 科学出版社, 1990: 201-217. Chen G Z. Fluorescence Analysis[M]. Beijing: Science Press, 1990: 201-217 (in Chinese). |




