文章信息
- 王彬, 刘俊泽, 陈志杰, 黄凯, 李延森, 李春梅
- WANG Bin, LIU Junze, CHEN Zhijie, HUANG Kai, LI Yansen, LI Chunmei
- 甘蔗提取物对敌草快诱导断奶仔猪氧化损伤的防护效果及肠道微生物参与的机制
- Protective effects of sugar cane extract against oxidative damage induced by diquat and mechanism mediated by intestinal microbiota in weaned piglets
- 南京农业大学学报, 2020, 43(3): 514-522
- Journal of Nanjing Agricultural University, 2020, 43(3): 514-522.
- http://dx.doi.org/10.7685/jnau.201906025
-
文章历史
- 收稿日期: 2019-06-17
2. 江苏食品药品职业技术学院, 江苏 淮安 223005
2. Jiangsu Food & Pharmaceutical Science College, Huai'an 223005, China
动物机体保持氧化还原稳态对于发挥机体细胞、组织和器官的正常功能非常重要[1]。在养猪生产中, 仔猪遭遇氧化应激时, 会影响生产性能甚至继发感染疾病, 给养猪业带来较大损失[2-3]。随着动物营养研究广度和深度的不断拓展, 研究开发天然植物源的动物保健品和功能性饲料已成为研究热点, 具有良好的发展前景[4-5]。随着分析检测技术逐渐成熟, 对于植物源酚类物质的研究领域也从茶等常见植物种类, 转向生物活性更高的植物加工过程中的副产品。甘蔗(Saccharum officinarum), 属于多年生高大实心草木, 根状茎粗壮发达, 杆高3~6 m, 在我国广西、广东、福建、海南等南方热带地区广泛种植[6]。甘蔗除含有丰富的蔗糖外, 还含有大量对动物机体有益的多酚类抗氧化物质, 具有促生长、抑菌、抗氧化、抗病毒、抗癌细胞、抗应激和免疫刺激等功能[6]。鉴于甘蔗中活性成分的多种生物学作用, 本团队已在前期分析了甘蔗提取物(SCE)中含有58.7 mg · kg-1总多酚、17.5 mg · kg-1迷迭香酸和47.1 mg · kg-1总黄酮[7]。本试验以应用敌草快诱导肠道氧化损伤的仔猪为实验动物模型, 研究日粮添加甘蔗提取物对肠道损伤的防护效果及防护机制, 为开发甘蔗提取物在功能性饲料中的应用提供试验基础。
1 材料与方法 1.1 试验设计采用单因素随机分组, 选取28头质量相近21日龄断奶的长×大二元阉公猪, 随机分为4个处理, 每个处理7个重复, 每个重复1头仔猪。4个处理组分别为对照(Cont)组、敌草快(Diqu)组、SCE1组和SCE2组。预试期3 d。在预试期内, 分别饲喂不同比列的猪场保育舍颗粒料和本次试验自行配制的对照组粉料, 各组分别按照3/4颗粒料+1/4粉料、2/4颗粒料+2/4粉料、1/4颗粒料+3/4粉料的顺序逐渐过渡到完全粉料。正式试验期24 d, 在未注射敌草快的前21 d试验期内, 前2组饲喂基础日粮, 后2组在基础日粮中分别添加1%(质量分数)SCE和2%SCE。后3组在第21天早晨空腹腹腔注射10 mg · kg-1敌草快溶液, 对照组注射等剂量的生理盐水。试验期内, 每个重复均为单笼饲养, 自由饮水, 每天饲喂4次(07:30、11:00、14:30和18:30)。开始投料的前30 min内, 在保证不浪费的前提下, 吃得快的料槽及时补料, 保证每个料槽均有少量余料。
试验基础日粮为玉米-豆粕型, 参照NRC(2012)仔猪营养需要标准配制, 基础日粮组成及营养水平见表 1。前2组仅饲喂基础日粮, SCE1组将玉米添加量相应减少1%, SCE2组将玉米添加量减少1.7%、乳清粉减少0.5%而鱼粉增加0.2%。
| 原料组成Component | 水平 | 营养组成2 Nutrient compoent | 水平 | |
| 玉米 Corn meal | 66.50 | 消化能3 Digestive energy | 14.61 | |
| 豆粕 Soybean meal | 18.80 | 粗蛋白 Crude protein | 17.09 | |
| 乳清粉 Whey powder | 4.30 | 钙 Calcium | 0.71 | |
| 鱼粉 Fish meal | 4.00 | 总磷 Total phosphorus | 0.55 | |
| 大豆油 Soybean oil | 2.60 | 可消化磷 Available phosphorus | 0.33 | |
| 赖氨酸 L-lysine | 0.62 | 赖氨酸 L-lysine | 1.23 | |
| 蛋氨酸 L-methionine | 0.19 | 蛋氨酸+胱氨酸 L-methionine+cystine | 0.68 | |
| 苏氨酸 Threonine | 0.21 | 苏氨酸 Threonine | 0.73 | |
| 色氨酸 Tryptophan | 0.04 | 色氨酸 Tryptophan | 0.20 | |
| 磷酸氢钙 Calcium hydrophosphate | 0.74 | |||
| 石粉 Limestone powder | 0.70 | |||
| 食盐 Salt | 0.30 | |||
| 预混料1) Premix | 1.00 | |||
| 注: 1)每kg预混料中所含的原料:海泡石(载体)881.29 g, 五水硫酸铜18 g, 一水硫酸亚铁15.48 g, 氯化钴(1%)15 g, 一水硫酸锰7.5 g, 一水硫酸锌6.36 g, 胆碱(VB4.5%)30 g, 氯化锌1.8 g, 碘化钾(1%)1.17 g, 亚硒酸钠0.9 g, 维生素(V)A 85.5万IU, VD3 18万IU, VE 2 025 IU, VK3 225 mg, VB1 225 mg, VB2 450 mg, VB6 270 mg, VB12 2.25 mg, 烟酸2 250 mg, 叶酸90 mg, 泛酸钙1 125 mg, 生物素11.25 mg, 抗氧化剂4.5 mg; 2)营养组成水平为计算值; 3)消化能单位为MJ · kg-1。 | ||||
| Note: 1)Premix provided the following complete diet per kg:sepiolite(carrier)881.29 g, copper(as CuSO4 · 5H2O)18 g, ferrous sulfate monohydrate 15.48 g, cobalt chloride 15 g, manganese sulfate monohydrate 7.5 g, zinc sulphate monohydrate 6.36 g, choline 30 g, zinc chloride 1.8 g, potassium iodide 1.17 g, sodium selenite 0.9 g, vitamin(V)A 855 thousand IU, VD3 180 thousand IU, VE 2 025 IU, VK3 225 mg, VB1 225 mg, VB2 450 mg, VB6 270 mg, VB12 2.25 mg, niacin 2 250 mg, folic acid 90 mg, calcium pantothenate 1 125 mg, biotin 11.25 mg, antioxidant 4.5 mg. 2)Nutrient compoent level was calculated values.3)The unit of digestive energy was MJ · kg-1. | ||||
在试验期内, 分别于第21和24天清晨逐头空腹称体质量, 记录初始体质量和终末体质量, 计算平均日增重。同时每天记录采食量, 计算平均日采食量。基于采食量和日增重数据, 计算料重比。
1.3 样品采集试验结束当天, 清晨空腹称后, 仔猪颈动脉放血致死, 每头采集血液10 mL, 室温静置1 h后, 3 000 r · min-1离心15 min, 收集血清, 分装于Ependorf管中, 4 ℃冷藏。同时每头仔猪分离并收集结肠内容物2份, 迅速没入液氮速冻, -80 ℃保存。
1.4 血清氧化应激指标和免疫球蛋白测定按照南京建成科技有限公司的试剂盒说明书测定MDA含量, GSH-Px、DAO、SOD活性及T-AOC水平和血清免疫球蛋白(IgA、IgG和IgM)水平。
1.5 肠道微生物DNA提取结肠食糜总微生物DNA提取采用Qiagen公司的QIAamp DNA Stool Mini Kit。稍有改动:加入ASL缓冲液后, 95 ℃孵育10 min, 用以同时裂解革兰阴性菌和革兰阳性菌的细胞。提取的DNA用10 g · L-1凝胶电泳检测其完整性。用微量紫外分光光度计ND-1000测定其核酸浓度(ng · μL-1)及纯度(D260/D280), 并于-20 ℃保存备用。
1.6 PCR扩增及文库的构建将所提取的结肠食糜微生物DNA稀释到10 ng · μL-1, 用于文库的构建和后续的16S rRNA扩增子测序。用带barcode的特异引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增细菌16S rRNA基因的V4区。PCR反应体系(50 μL)为:2 μL DNA(10 ng · μL-1), 1 μL TransStartⓇ Fastpfu DNA Polymerase, 10 μL 5×TransStartⓇ FastPfu Buffer, 1 μL上游引物(10 μmol · L-1), 1 μL下游引物(10 μmol · L-1), 4 μL 2.5 mmol · L-1 dNTP mixture, 31 μL Nuclease-free water。PCR反应条件为:95 ℃ 3 min; 95 ℃ 30 s, 54 ℃ 30 s, 72 ℃ 45 s, 25个循环; 72 ℃ 10 min, 4 ℃保存。
PCR产物用15 g · L-1琼脂糖凝胶电泳, 使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收纯化PCR产物。将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行定量检测, 之后按照每个样本的测序量要求, 进行相应比例的混合, 在Illumina MiSeq PE250上进行高通量测序。
1.7 生物信息学分析首先对测得的双端序列fq数据进行过滤处理, 过滤序列尾部质量值20以下的碱基, 设置50 bp的窗口, 过滤质控后50 bp以下的序列, 得到清洁数据, 然后根据双端测序的重叠关系用FLASH软件将成对的序列拼接成一条序列。设置参数为:最小重叠长度为10 bp; 拼接序列的重叠区允许的最大错配比例为10%。
用Usearch软件去除嵌合体和单序列, 再用uparse软件按照97%相似性序列进行操作性单元(OTU)聚类, 得到代表序列。为了得到每个OTU对应的物种分类信息, 采用RDP Classifier算法(默认)对相似度97%的OTU代表序列进行比对分析(Silva数据库), 并在各个水平(界、门、纲、目、科、属、种)注释其群落的物种信息。至此, 得到后续分析需要的3个关键数据:OTU丰度表、fasta格式OTU代表序列、OTU的物种注释表。
参照McMurdie等[8]开发的流程, 使用R软件的Pholoseq包进行后续的一系列多样性分析并绘图, 计算α多样性指数:OTU数、Chao1指数、Shannon指数和Simpson指数。OTU数和Chao1指数反映样品中群落的丰富度, 即群落中物种的数量, 而不考虑群落中每个物种的丰度情况。Shannon及Simpson指数反映群落的多样性, 受样品群落中物种丰富度和物种均匀度的影响。前面3个指数越大, 最后1个指数越小, 说明样品中的物种越丰富。
β多样性分析是基于非进化距离Bray-Curtis距离来进行计算。为了进一步展示样品间物种多样性差异, 使用主坐标分析(principal coordinates analysis, PCoA)的方法展示样品间的差异。同时, 为了测试样品间群落β多样性的差异, 利用R软件vegan包进行ADONIS统计分析(基于Bray-Curtis的相似性), 得到差异P值和基于β离散的P值。
参照Love等[9]的方法, 用R软件的DESeq2包进行OTU差异分析。DESeq2包是基于负二项分布模型, 对计数数据进行处理, 通过处理过的计数数据的中位数估计归一化因子。主要包括3步:构造1个dds对象; 直接用DESeq函数进行归一化处理; 用results函数提取差异结果。筛选标准定为校正P值小于0.10。
1.8 数据统计与分析试验的生长性能、氧化应激指标和免疫球蛋白数据, 运用肖维勒准则进行异常数值筛选。采用SPSS 21.0统计软件进行单因素方差分析和Tukey ’s多重比较, 差异显著性水平设为0.05。
鉴于微生物在各个分类水平上的相对丰度数据不符合正态分布, 采用R软件stats基础包的Wilcox ’s rank-sum非参数检验法分析各个处理间微生物相对含量的差异, 差异显著性水平设为0.05。
2 结果与分析 2.1 甘蔗提取物对敌草快诱导肠道氧化损伤仔猪生长性能的影响由表 2可以看出:在72 h平均日增重方面, 由于注射敌草快后仔猪表现出明显的呕吐现象, Diqu组和SCE1组仔猪体质量呈现负增长, SCE2组显著大于Diqu组和SCE1组(P<0.05), 与注射生理盐水的Cont组相比差异不显著(P>0.05)。在平均日采食量方面, 注射敌草快的3个试验组均显著低于对照组(P<0.05), 同时SCE2组显著高于Diqu组(P<0.05)。SCE2组料重比显著高于其他3组(P<0.05)。
| 项目Item | Cont | Diqu | SCE1 | SCE2 |
| 初始体质量/kg Initial body weight | 12.430±1.070 | 13.970±0.829 | 14.090±0.620 | 13.530±0.869 |
| 终末体质量/kg Ultimate body weight | 13.940±1.251 | 13.090±0.769 | 13.430±0.778 | 14.130±0.868 |
| 平均日增重/(g·d-1)Average daily gain | 0.505±0.062a | -0.295±0.081b | -0.219±0.122b | 0.200±0.054a |
| 平均日采食量/(g·d-1)Average daily feed intake | 0.786±0.080a | 0.255±0.049c | 0.286±0.051bc | 0.471±0.036b |
| 料重比 Feed/gain | 1.585±0.078b | -1.145±0.626c | 0.601±0.701bc | 2.687±0.496a |
| 注: 1)Cont:对照组Control group; Diqu:敌草快(10 mg · kg-1)组Diquat group; SCE1、SCE2:分别添加1%、2% SCE及10 mg · kg-1敌草快处理1% SCE, 2% SCE and 10 mg · kg-1 diquat supplemetation group。2)同行肩标不同小写字母表示差异显著(P<0.05)。Means within a row with different superscripts significantly differ(P<0.05).下同。The same below. | ||||
由表 3可以看出:与对照组相比, 注射敌草快后, Diqu组、SCE1组和SCE2组的3种免疫球蛋白水平均显著降低(P<0.05), SCE1组和SCE2组降低的幅度要小于Diqu组。与Diqu组相比, SCE1组和SCE2组IgM水平显著升高(P<0.05)。上述结果表明, 腹腔注射敌草快降低了仔猪的免疫力, 添加1%SCE和2%SCE能提高机体免疫力。
| 项目Item | Cont | Diqu | SCE1 | SCE2 |
| IgA | 39.14±1.18a | 25.60±1.33b | 28.06±1.53b | 29.81±1.64b |
| IgG | 86.95±3.70a | 60.41±2.38b | 62.21±4.41b | 67.10±3.29b |
| IgM | 6.20±0.08a | 2.79±0.20c | 4.61±0.29b | 5.25±0.22b |
血液二胺氧化酶(DAO)是肠道损伤的重要标志物, 其含量在一定程度反映肠道通透性。由表 4可以看出:与Diqu组相比, SCE1组和SCE2组DAO含量、SOD活性呈升高的趋势。与Diqu组相比, SCE1组仔猪血清GSH-Px活性显著增加(P<0.05)。MDA含量和T-AOC在4组间差异均不显著(P>0.05)。
| 项目Item | Cont | Diqu | SCE1 | SCE2 |
| 二胺氧化酶含量/(U·L-1)Diamine oxidase(DAO)content | 38.97±4.98 | 29.75±7.60 | 30.10±4.50 | 34.43±2.57 |
| 超氧化物岐化酶活性/(U·L-1)Superoxide dismutase(SOD)activity | 1 334.00±72.33 | 1 238.00±57.08 | 1 321.00±47.85 | 1 317.00±31.11 |
| 谷胱甘肽过氧化酶活性/(U·L-1)Glutathione peroxidase(GSH-Px) | 11.01±1.58ab | 5.48±0.19b | 14.17±1.97a | 9.28±1.24ab |
| 丙二醛含量/(nmol·mL-1)Malondialdehyde(MDA)content | 9.20±0.40 | 9.59±0.87 | 8.90±0.52 | 9.00±0.55 |
| 总抗氧化能力/(mmol·g-1)Total antioxidant capability(T-AOC) | 1.44±0.15 | 1.10±0.08 | 1.31±0.12 | 1.30±0.11 |
如图 1所示:4个试验组间的OTU和Chao1指数均无显著差异。相比饲喂基础日粮组(Cont), 敌草快处理组(Diqu)、敌草快+SCE处理的SCE1组和SCE2组的Shannon和Simpson指数均显著升高(P<0.05), 表明敌草快和不同水平的SCE处理改变了仔猪结肠微生物的多样性。

|
图 1 SCE对断奶仔猪肠道微生物α多样性的影响 Fig. 1 Effects of dietary SCE on intestinal α diversity in weaned piglets |
基于bray curtis非进化距离的PCoA分析(图 2)表明:4个组间的结肠微生物β多样性具有显著差异。基于bray curtis非进化距离的ADONIS分析结果也证实了这一结果:4个组组间差异显著(P=0.007), beta dispersion组内差异不显著(P=0.128)。敌草快处理组与对照组的结肠微生物的β多样性差异极显著, 在PCoA图上完全不重叠。而添加SCE1和SCE2处理介于二者中间, 但是添加SCE2后仔猪微生物β多样性与对照组更接近, 说明添加2% SCE可在仔猪氧化应激条件下保护仔猪肠道微生物物种多样性, 以缓解敌草快造成的氧化损伤。
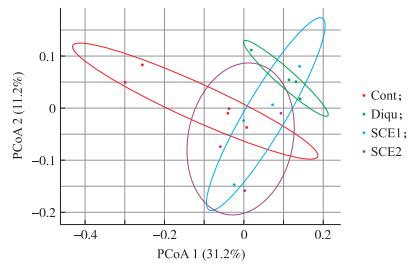
|
图 2 SCE对断奶仔猪肠道微生物β多样性影响的PCoA图 Fig. 2 PCoA anglisis of effects of dietary SCE on intestinal β diversity in weaned piglets |
物种注释分析结果表明:全部仔猪结肠的微生物物种在门(Phylum)水平上绝对优势菌群是厚壁菌门(Firmicutes), 占56.13%(图 3), 其次是拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)。统计差异分析结果表明:与对照组相比, 敌草快处理显著提高结肠中的Spirochaetae、Euryarchaeota和Verrucomicrobia门微生物的相对丰度(P<0.05), 增幅高达20倍左右, 表明敌草快处理明显诱导仔猪肠道的氧化应激。而SCE2组的这3个门的相对丰度显著低于Diqu组(P<0.05)。
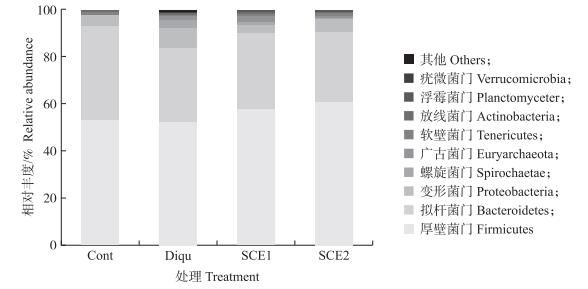
|
图 3 SCE对断奶仔猪肠道微生物门水平物种组成的影响 Fig. 3 Effects of dietary SCE on microbial species composition at the level of intestinal phylum in weaned piglets |
在属水平上, 排名前15的物种相对丰度(图 4)表明, unidentified Bacteroidete、Lactobacillus、Prevotella 9和Eubacterium rectale group是属水平的绝对优势属。统计差异分析结果表明, Diqu、SCE1和SCE2组的Prevotella 9相对含量显著高于对照组(P=0.028)。敌草快处理显著降低结肠中的Lactobacillus、Eubacterium rectale group的相对丰度(P<0.05), 提高Clostridium sensu stricto 1和Ruminococcaceae UCG-002的相对丰度(P<0.05)。SCE2组的Lactobacillus、Eubacterium rectale group的相对丰度显著高于Diqu组(P<0.05), 而Clostridium sensu stricto 1和Ruminococcaceae UCG-002的相对丰度显著低于Diqu组(P<0.05)。
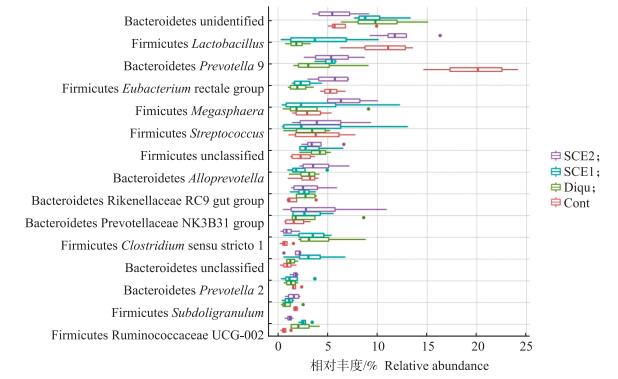
|
图 4 SCE对断奶仔猪肠道微生物属水平物种组成的影响 Fig. 4 Effects of dietary SCE on microbial species composition at the level of intestinal genus in weaned piglets |
与对照组(Cont组)相比, 敌草快处理组(Diqu组)上调154个OTU的相对丰度, 同时下调70个OTU的相对丰度。如图 5-A所示, 敌草快处理上调以下属的OTU丰度:Parabacteroides、Rikenellaceae RC9 gut group、Escherichia-Shigella、Clostridium sensu stricto 1、Clostridium sensu stricto 6。同时下调Faecalibacterium、Lactobacillus的OTU丰度。
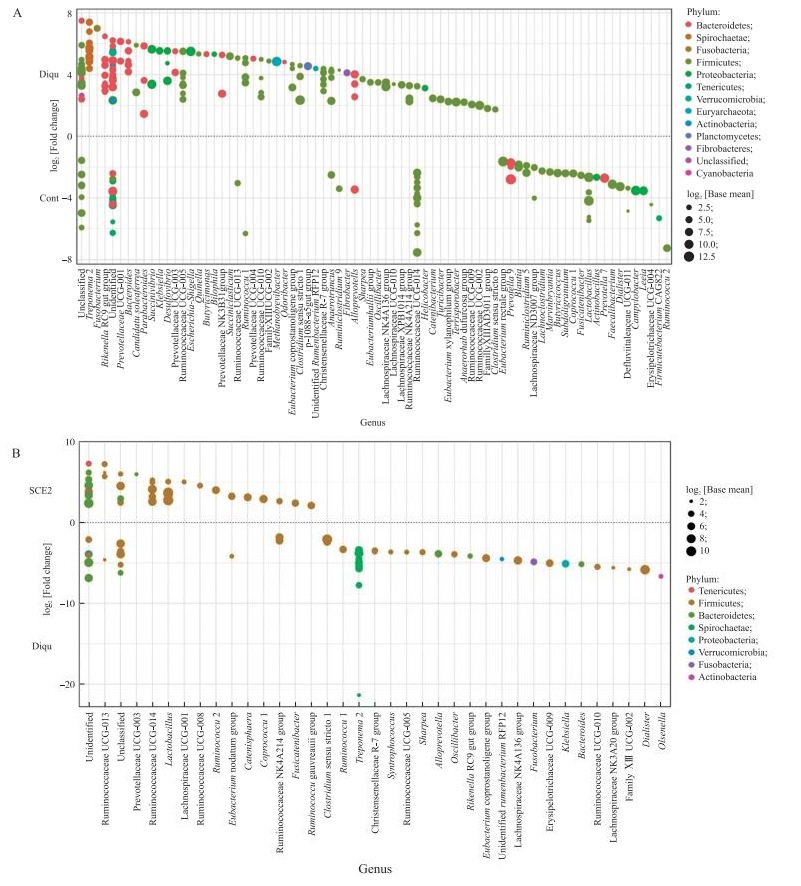
|
图 5 SCE对断奶仔猪结肠微生物OTU的丰度影响 Fig. 5 Effects of dietary SCE on OTU abandance of colonic microbe of piglets Ruminococcus:瘤胃球菌属; Faecalibacterium:粪杆菌属; Lactobacillus:乳杆菌属; Clostridium:梭菌属; Escherichia-Shigella:大肠杆菌志贺菌属; Parabacteroides:副杆菌属; Rikenella:理研菌属; Bacteroidales:拟杆菌属; Klebsiella:克雷伯氏菌属; Sharpea:夏普氏菌属。 |
与敌草快处理组(Diqu组)相比, SCE2处理上调36个OTU的相对丰度, 同时下调51个OTU的相对丰度。值得注意的是, SCE2处理上调Lactobacillus、Ruminococcus 2、Ruminococcus gauvreauii group、Eubacterium nodatum group的OTU丰度(图 5-B)。同时下调Clostridium sensu stricto 1、Rikenella RC9 gut group、Klebsiella、Sharpea的OTU丰度。
3 讨论利用敌草快在仔猪中建立氧化应激模型, 探索氧化损伤的发病机制和新的防治途径逐渐成为研究热点[2, 10]。注射敌草快72 h内, 仔猪表现出明显的呕吐现象, 平均日增重呈现负增长。血清中免疫球蛋白含量的多少与机体的免疫功能有关, 通常认为免疫球蛋白含量越高, 机体的免疫能力越强[11]。本试验结果显示, 注射敌草快72 h后免疫球蛋白IgA、IgG、IgM均大幅度下降, 提示仔猪的免疫机能出现紊乱。血清抗氧化指标的高低可以反映机体的氧化应激水平[2, 11]。本试验结果显示, 注射敌草快72 h后谷胱甘肽过氧化酶在敌草快诱导模型中显著降低, 也提示氧化损伤模型构建成功。
已有研究证实, 多种肠道疾病的发生都伴随肠道微生态紊乱——拟杆菌目(Bacteroidales)和乳酸杆菌属(Lactobacillus)等有益菌减少, 而肠杆菌目(Enterobacteriales)和埃希氏杆菌属(Escherichia)等有害菌增加[12-13]。本试验结果显示, 注射敌草快后显著降低Faecalibacterium和Lactobacillus属的丰度, 增加Parabacteroides、Rikenella RC9 gut group、Escherichia-Shigella、Clostridium sensu stricto 1、Clostridium sensu stricto 6属的丰度。Lactobacillus作为常见的肠道有益菌, 有逆转肠道失衡的潜力, 可以增强肠道的免疫防御机能, 同时抵抗外源病原微生物的入侵[14]。Faecalibacterium prausnitzii作为健康动物常驻的细菌, 占总细菌数的5%。有研究报道口服F.prausnitzii的某些菌株可以抵抗2, 4, 6-三硝基苯磺酸诱导的肠炎, 提示其可能是潜在的抗炎症益生菌[15]。Clostridium sensu stricto 1和Clostridium sensu stricto 6均属于Clostridium clusterⅠ, 具有潜在的致病能力[16]。敌草快诱导氧化损伤可能是通过减少潜在有益菌同时增加潜在致病菌实现的。
抗生素滥用是世界很多国家都面临的严重问题, 过度使用抗生素会加速耐药细菌的蔓延, 严重危害人和动物的健康[17-18]。天然生长促进剂(natural growth promoters, NGP), 如益生菌(probiotics)、益生元(prebiotics)和植物源提取物(phytobiotics)已经被开发并用作抗生素的替代物[5, 19]。实际上, 这些天然生长促进剂均是通过调节肠道微生物实现其功能。益生菌作为有活性的微生物, 如乳酸菌和双歧杆菌[20]。益生元可以被某些特定的肠道微生物所利用进而发挥作用, 如不易消化的寡糖和多不饱和脂肪酸[21]。植物源提取物包含一系列活性化合物, 促进肠道有益微生物的定殖等[5]。本研究旨在解析甘蔗提取物对敌草快诱导仔猪肠道氧化损伤的防护效果及微生物参与的机制。甘蔗提取物的有效成分为谷氨酸、谷氨酰胺和酚类物质(多酚、黄酮、迷迭香酸)[7]。谷氨酰胺显著降低小鼠结肠炎症及上皮细胞凋亡, 同时抑制肠黏膜NF-κB(p65)信号通路[22]。也有研究表明, 植物源酚类物质具有抗氧化、抗炎症、抗癌细胞增殖等生物活性效果[7]。本试验结果显示, 添加2% SCE有效缓解敌草快诱导的氧化损伤, 提高血清中IgA、IgG、IgM的含量。
越来越多的研究表明, 很多共生菌(如乳酸菌和双岐杆菌)的定殖可以增强小肠黏膜的屏障功能及天然免疫机能, 以此来抵抗外源病原体的侵入, 防止疾病的发生、发展[20, 23]。肠道微生物是人及动物肠道的重要组成部分, 对机体的营养代谢和健康具有重要作用。日粮饮食改变是影响肠道微生物变化的主要因素, 日粮的改变能够在24 h内快速影响微生物组成, 反之肠道微生物可参与宿主的营养物质消化吸收、能量代谢、过敏、自身免疫疾病等多方面调节过程[24-25]。本试验结果表明, SCE2组的结肠微生物β多样性与对照组更接近, 与敌草快组有显著差异。表现为上调Lactobacillus和Ruminococcus gauvreauii group的丰度, 下调Clostridium sensu stricto 1、Rikenella RC9 gut group、Klebsiella、Sharpea的丰度。Ruminococcus gauvreauii group的某些菌株可以降解黏蛋白产生丙酸, 为宿主提供能量, 也促进自身的定殖。同时, 机体黏蛋白的降解会促使宿主补偿产生更多的黏蛋白, 进而降低宿主蛋白的沉积。有益微生物的定殖可以促进宿主免疫系统的发育, 进而促进肠道健康[26]。Klebsiella是潜在的致病菌源, 在发生免疫障碍甚至炎症的机体肠道中数量迅速增加[27]。
综上所述, 日粮添加2% SCE可以在一定程度上提高敌草快诱导氧化损伤仔猪的生长性能, 改善仔猪肠道微生物物种多样性以缓解敌草快造成的氧化损伤, 缓解途径是增加有益菌丰度的同时降低有害菌的丰度。
| [1] |
Yin J, Ren W K, Liu G, et al. Birth oxidative stress and the development of an antioxidant system in newborn piglets[J]. Free Radical Research, 2013, 47(12): 1027-1035. DOI:10.3109/10715762.2013.848277 |
| [2] |
Yin J, Wu M M, Xiao H, et al. Development of an antioxidant system after early weaning in piglets[J]. Journal of Animal Science, 2014, 92(2): 612-619. |
| [3] |
Yin J, Ren W K, Wu XS, et al. Oxidative stress-mediated signaling pathways:a review[J]. Journal of Food Agriculture & Environment, 2013, 11(2): 132-139. |
| [4] |
Gao P F, Ma C, Sun Z, et al. Feed-additive probiotics accelerate yet antibiotics delay intestinal microbiota maturation in broiler chicken[J]. Microbiome, 2017, 5: 91. DOI:10.1186/s40168-017-0315-1 |
| [5] |
Huang P, Zhang Y, Xiao K P, et al. The chicken gut metagenome and the modulatory effects of plant-derived benzylisoquinoline alkaloids[J]. Microbiome, 2018, 6: 211. DOI:10.1186/s40168-018-0590-5 |
| [6] |
王彬, 李延森, 李春梅, 等. 甘蔗提取物的活性成分与生理功能研究进展[J]. 畜牧与兽医, 2018, 50(1): 137-139. Wang B, Li Y S, Li C M, et al. Research advance on active comositions and physiological functions of sugar cane extracts[J]. Animal Husbandary & Veterinary Medicine, 2018, 50(1): 137-139 (in Chinese with English abstract). |
| [7] |
Wang B, Li Y S, Mizu M, et al. Protective effect of sugar cane extract against dextran sulfate sodium-induced colonic inflammation in mice[J]. Tissue Cell, 2017, 49(1): 8-14. DOI:10.1016/j.tice.2016.12.008 |
| [8] |
McMurdie P J, Holmes S. Phyloseq:an R package for reproducible interactive analysis and graphics of microbiome census data[J]. PLoS One, 2013, 8(4): e61217. DOI:10.1371/journal.pone.0061217 |
| [9] |
Love M I, Huber W, Anders S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2[J]. Genome Biology, 2014, 15(12): 550. DOI:10.1186/s13059-014-0550-8 |
| [10] |
Yin J, Liu M F, Ren W K, et al. Effects of dietary supplementation with glutamate and aspartate on diquat-induced oxidative stress in piglets[J]. PLoS One, 2015, 10(4): e0122893. DOI:10.1371/journal.pone.0122893 |
| [11] |
Yin F G, Jiang W M, Guan S, et al. Glutamine and animal immune function[J]. Journal of Food Agriculture & Environment, 2010, 8(3/4): 135-141. |
| [12] |
Parker A, Lawson M A E, Vaux L, et al. Host-microbe interaction in the gastrointestinal tract[J]. Environmental Microbiology, 2018, 20(7): 2337-2353. DOI:10.1111/1462-2920.13926 |
| [13] |
Gilbert J A, Blaser M J, Caporaso J G, et al. Current understanding of the human microbiome[J]. Nature Medicine, 2018, 24(4): 392-400. DOI:10.1038/nm.4517 |
| [14] |
Baarlen P V, Wells J M, Kleerebezem M. Regulation of intestinal homeostasis and immunity with probiotic lactobacilli[J]. Trends in Immunology, 2013, 34(5): 208-215. |
| [15] |
Miquel S, Martin R, Rossi O, et al. Faecalibacterium prausnitzii and human intestinal health[J]. Current Opinion in Microbiology, 2013, 16(3): 255-261. DOI:10.1016/j.mib.2013.06.003 |
| [16] |
Lopetuso L R, Scaldaferri F, Petito V, et al. Commensal Clostridia:leading players in the maintenance of gut homeostasis[J]. Gut Pathogens, 2013, 5(1): 23. DOI:10.1186/1757-4749-5-23 |
| [17] |
Munk P, Knudsen B E, Lukjacenko O, et al. Abundance and diversity of the faecal resistome in slaughter pigs and broilers in nine European countries[J]. Nature Microbiology, 2018, 3(8): 898-908. DOI:10.1038/s41564-018-0192-9 |
| [18] |
Pal C, Bengtsson-Palme J, Kristiansson E, et al. The structure and diversity of human, animal and environmental resistomes[J]. Microbiome, 2016, 4: 54. DOI:10.1186/s40168-016-0199-5 |
| [19] |
Hu Y F, Yang X, Qin J J, et al. Metagenome-wide analysis of antibiotic resistance genes in a large cohort of human gut microbiota[J]. Nature Communications, 2013, 4: 2151. DOI:10.1038/ncomms3151 |
| [20] |
Lew L C, Hor Y Y, Yusoff N A A, et al. Probiotic Lactobacillus plantarum P8 alleviated stress and anxiety while enhancing memory and cognition in stressed adults:a randomised, double-blind, placebo-controlled study[J]. Clinical Nutrition, 2018, 24: 1-12. |
| [21] |
Corrigan A, de Leeuw M, Penaud-Frezet S, et al. Phylogenetic and functional alterations in bacterial community compositions in broiler ceca as a result of mannan oligosaccharide supplementation[J]. Applied Environmental Microbiology, 2015, 81(10): 3460-3470. |
| [22] |
Ren W K, Wang K, Yin J, et al. Glutamine-lnduced secretion of intestinal secretory immunoglobulin A:a mechanistic perspective[J]. Frontiers in Immunology, 2016, 7: 503. |
| [23] |
Grander C, Adolph T E, Wieser V, et al. Recovery of ethanol-induced Akkermansia muciniphila depletion ameliorates alcoholic liver disease[J]. Gut Microbiota, 2017. DOI:10.1136/gutjn1-2016-313432 |
| [24] |
Song Y, Malmuthuge N, Li FY, et al. Colostrum feeding shapes the hindgut microbiota of dairy calves during the first 12 h of life[J]. FEMS Microbiology Ecology, 2019, 95: fiy203. |
| [25] |
Simon J C, Marchesi J R, Mougel C, et al. Host-microbiota interactions:from holobiont theory to analysis[J]. Microbiome, 2019, 7: 5. DOI:10.1186/s40168-019-0619-4 |
| [26] |
Crost E H, Tailford L E, le Gall G, et al. Utilisation of mucin glycans by the human gut symbiont Ruminococcus gnavus is strain-dependent[J]. PLoS One, 2013, 8(10): e76341. DOI:10.1371/journal.pone.0076341 |
| [27] |
Zhu J, Liao M, Yao Z T, et al. Breast cancer in postmenopausal women is associated with an altered gut metagenome[J]. Microbiome, 2018, 6: 136. DOI:10.1186/s40168-018-0515-3 |




