文章信息
- 胡媛媛, 王照英, 张懿熙, 刘泽文
- HU Yuanyuan, WANG Zhaoying, ZHANG Yixi, LIU Zewen
- 球孢白僵菌 NJBb2101 发酵液对 Sf9 细胞的增殖抑制和凋亡诱导作用
- The effects of the fermentation filtrate from Beauveria bassiana NJBb2101 on the cell viability and apoptosis of Sf9 cells
- 南京农业大学学报, 2020, 43(3): 446-451
- Journal of Nanjing Agricultural University, 2020, 43(3): 446-451.
- http://dx.doi.org/10.7685/jnau.201908010
-
文章历史
- 收稿日期: 2019-08-05
生物农药的研究最早出现于19世纪50年代,到20世纪90年代才得以迅猛发展。我国对生物农药研究可追溯到20世纪50年代,近年来生物农药发展迅速,截至 2015 年,其中有效成分已有 115 个,产品达到3 000 个左右[1] 。在所有的生物农药种类中,微生物农药的占比最大,几乎所有大规模使用的生物农药都来源于微生物。微生物农药按照有效成分,可分为活体微生物农药和微生物代谢产物制剂[2] 。与传统化学农药相比,微生物农药具有很多优点,比如对人畜低毒、对环境友好、对天敌安全、不易产生抗药性等,有利于农业生态的稳定和有害生物防控的可持续性[1, 3] 。
微生物杀虫剂是微生物农药的重要组成部分,一般可以分为 3大类,即细菌杀虫剂、真菌杀虫剂和病毒杀虫剂。真菌杀虫剂是目前种类最多的微生物杀虫剂,原种来源于 100 多个属、800 多个种,其中应用最为广泛的是白僵菌、绿僵菌、淡紫拟青霉、蜡蚧轮枝菌和虫霉等。例如球孢白僵菌广泛应用于防治蛴螬、茶小叶蝉和玉米螟[4-5] 。真菌杀虫剂既可以通过活体方式侵染昆虫,造成昆虫死亡;也可以通过释放有毒成分抑制昆虫系统功能,导致昆虫死亡[6-7] 。由于直接利用真菌活体作为杀虫剂存在一定的限制,比如活 体保存困难、环境因子影响、施用手段限制等,真菌杀虫剂更倾向于使用来源于真菌的次生物质。通过发酵提纯、体外合成等方式能够大量获得真菌的次生物质,比较成功的例子有白僵菌素、绿僵菌素 A 等[8-9] 。
本试验利用已经明确具有较好杀虫效果的球孢白僵菌菌株 NJBb2101,通过培养基发酵获得释放到培 养基中的次生代谢物质,测定发酵液对昆虫细胞的增殖抑制和对细胞凋亡的促进作用,为球孢白僵菌次生 物质在害虫防治中的应用提供研究基础。
1 材料与方法 1.1 供试材料球孢白僵菌(Beauveria bassiana)菌株 NJBb2101 于 2015 年 7 月采集于江苏省农业科学院试验田,通过 5.8S ribosomal DNA 测序验证和褐飞虱侵染重测序验证[10] ,保存于南京农业大学杀虫剂药理与昆虫神经 毒理学实验室。
草地贪夜蛾卵巢细胞系 Sf9,由南京农业大学植物保护学院杀虫剂药理与昆虫神经毒理学实验室提 供。从液氮中取出冻存的 Sf9 细胞,置于 28 ℃水浴中快速摇晃,使其迅速融化。待其完全融化后,用移液 器将融化后的细胞直接转移至含有 5 mL SF900Ⅲ培养基的细胞培养瓶中,摇匀平放至细胞恒温培养箱,28 ℃静置培养。平均每 2 d 换液或传代 1 次。细胞换液时,将旧培养基弃去,加入含 5% FBS 的 SF900Ⅲ 培养基 5 mL。细胞生长状况良好时贴壁,呈饱满圆球状。
1.2 球孢白僵菌发酵液的制备发酵液的制备步骤:1)活化:将 4 ℃保存的球孢白僵菌用吐温-80 溶解,取 100 μL 涂于 PDA 平盘上,置于恒温培养箱中,28 ℃培养 7 d,待孢子长满平盘后 4 ℃保存备用。2)孢子计数:用 4 mL 吐温-80 吹打 至孢子掉落,用擦镜纸过滤使孢子充分分散混匀,稀释 10 倍,用血球计数板计数。血球计数板采用 25×16 规格,计算公式为:孢子数/ mL-1 = 80 个小格内孢子数/ 80×400×104×稀释倍数。3)培养:取 1 mL 孢子液于 50 mL 液体 PDA 培养基中,置于 28 ℃ 、200 r·min-1摇床培养 144 h(6 d)。同时将 1 瓶不加孢子的液体 PDA 培养基设置为对照一起同等条件培养。4)收集计量:将培养 144 h 的菌液分装到 50 mL 离心管中,每 管装 25 mL,4 ℃ 、4 000 g 离心 20 min,取上清发酵液,用 25 mm×0.22 μm 规格滤头过滤后分装到 5 mL 离 心管中待用;并通过-80 ℃冷冻抽干的方法称量培养 144 h 后发酵液中的干物质质量,保存待用。
1.3 Sf9 细胞的增殖抑制率测定。利用 CCK-8 方法[11]测定 Sf9 细胞的增殖抑制率。在 96 孔板中配制 100 μL 的处理细胞悬液(最佳浓 度为 105 mL-1,否则检测结果不稳定),将培养板置于培养箱中培养 24 h(28 ℃ ,相对湿度 80%以上);向每 孔加入 10 μL CCK 溶液;将培养板置于培养箱内孵育 3 h;用酶标仪测定 450 nm 处的吸光度(A)。细胞活 力计算公式为:细胞活力= [A(加药)-A(空白)] / [A(0 加药)-A(空白)] ×100%。式中:细胞活力为细胞 增殖活力或细胞毒性活力;A(加药)为具有培养基、细胞、CCK 溶液和发酵液的孔的吸光度;A(空白)为具 有培养基和 CCK 溶液而没有细胞的孔的吸光度;A(0 加药)为具有培养基、细胞、CCK 溶液而没有发酵液 的孔的吸光度。
1.4 Sf9 细胞凋亡检测用 24 孔细胞培养板培养 Sf9 细胞,然后将获得的发酵液干物质按照不同终浓度溶解到 Sf9 细胞培养 基中,每个浓度重复 3 次,分别通过吖啶橙-溴化乙锭(AO/ EB)染色法和 Annexin V-FITC/PI 染色-流式细 胞仪法进行细胞凋亡检测,并根据公式计算细胞凋亡率,统计分析低浓度(LD,0.48 mg·mL-1 )、高浓度 (HD,1.92 mg·mL-1)与对照(CK)之间的差异。
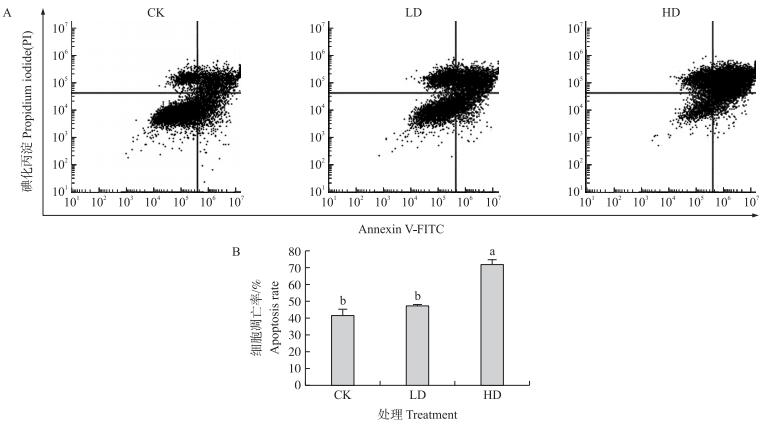
1.4.1 吖啶橙-溴化乙锭(AO / EB)染色检测细胞凋亡具体方法[12]如下:1)使用前根据用量将 AO 溶液 和 EB 溶液按 1 : 1(体积比)混合成工作液,现用现配。2)Sf9 为贴壁细胞,可以去掉培养基,用 PBS 洗 2 次 去除残余培养基和未贴壁细胞,加入新的 PBS;如果需要观察全部细胞特性,保留未贴壁细胞,可以直接在 培养基中加入工作液。3)向每 mL 培养基或 PBS 中加入 20 μL 工作液,室温放置 2 ~5 min 后于荧光显微 镜下观察,每个样本观察 200 个细胞,分别统计活细胞(VN)、早期凋亡细胞( VA)、非凋亡的死亡细胞 (NVN)和晚期凋亡细胞(NVA)的数目,根据计算公式得出细胞凋亡指数和坏死细胞率。计算公式为:
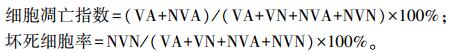
|
(1) |
具体检测步骤如下[13-14] :1)用不含 EDTA 的胰酶消化后,300 g、4 ℃离心 5 min,收集细胞。胰酶消化时间不宜过长,以防引起假阳性。2)用预冷的 PBS 洗涤细胞 2 次,每 次 300 g、4 ℃离心 5 min,收集(1~5)×105 细胞。3)加入 100 μL 1×结合缓冲液重悬细胞。4)加入 5 μL Annexin V-FITC 和 5 μL PI 染色液,轻轻混匀,避光、室温反应 10 min。5)加入 400 μL 1×结合缓冲液,混 匀,样品在 1 h 内用流式细胞仪或荧光显微镜检测。流式细胞仪分析:V-FITC 最大激发光波长为 488 nm,最大发射波长为 525 nm,V-FITC 的绿色荧光在 FL1 通道检测;PI-DNA 复合物的最大激发波长为 535 nm,最大发射波长为 615 nm,PI 的红色荧光在 FL2 或者 FL3 通道检测。用 CellQuest 等软件进行分析,绘制散 点图,V-FITC 为横坐标,PI 为纵坐标。每个样品采集 10 000 events。典型的试验中,细胞可以分为 3 个亚 群,活细胞仅有低强度的背景荧光,早期凋亡细胞仅有较强的绿色荧光,晚期凋亡细胞有绿色和红色荧光 双重染色。荧光显微镜分析:滴 1 滴染色后的细胞悬浮液于载玻片上,用盖玻片覆盖细胞后,于荧光显微 镜下观察,Annexin V-FITC 荧光信号呈绿色,PI 荧光信号呈红色。
1.5 统计分析利用 SPSS 软件 v18.0.0 分析差异显著性。每个处理至少重复 3 次,计算平均值和标准误。根据单因 素方差分析(One-way ANOVA)结果标注差异显著性。
2 结果与分析 2.1 球孢白僵菌发酵液对 Sf9 细胞的增殖抑制作用从固体培养基中分离球孢白僵菌孢子,并进行细胞计数。按照 2.7×107 CFU·mL-1的浓度接入液体培 养基中,144 h 摇床培养后,离心去除菌体,对培养基进行-80 ℃ 冷冻抽干获得发酵液中的干物质,质量浓 度为 24.02 mg·mL-1。将获得的发酵液干物质按照不同终浓度溶解到 Sf9 细胞培养基中。预试验结果显 示:发酵液干物质质量浓度低于 0.12 mg·mL-1时对细胞几乎没有影响,而高于 1.92 mg·mL-1时则无法测到D值,因此将测试浓度区间设置在 0.12~1.92 mg·mL-1,梯度为 0.12、0.24、0.48、0.96、1.92 mg·mL-1。
如图 1-A 所示,不同浓度发酵液产物处理细胞 24 h 后,光学显微镜下可明显观察到细胞数量随着浓度的升高而降低,0.24 mg·mL-1时细胞出现皱缩,细胞没有破裂;1.92 mg·mL-1时细胞数量明显减少且大多 数呈皱缩形态。如图 1-B 所示,随着发酵液产物浓度的升高,对细胞表现出显著的抑制作用。浓度-抑制 率线性回归方程为 y = -1.521x+4.946(R2 = 0.948),抑制中浓度(IC50)= 0.907 mg·mL-1,95%置信区间为 0.500~3.075 mg·mL-1(图 1-C)。根据预试验结果和抑制率曲线,设置高、低剂量 2 个处理,分别为 0.48 mg·mL-1(low dose,LD)和 1.92 mg·mL-1(high dose,HD)。
|
图 1 球孢白僵菌发酵液产物对 Sf9 细胞活力的影响 Fig. 1 Effects of the fermentation filtrate of Beauveria bassiana on Sf9 cell viability A.在球孢白僵菌发酵液产物质量浓度分别为 0、0.12、0.24、0.48、0.96、1.92 mg·mL-1时处理 Sf9 细胞 24 h 后,细胞的数量和形态观察图;B.球孢白僵菌发酵液产物处理 Sf9 细胞 24 h 后,在 450 nm 下用 CCK-8 法测得的细胞活力;C.对 B 中的数据进行线性回归方程处理(其中,发 酵液产物浓度为 0.12 mg·mL-1时,细胞活力为(104.063±35.049)%,故在线性回归时舍去)。不同小写字母表示 0.05 水平差异显著,下同。 A. Cell morphology observation after treatments with different concentrations(0,0.12,0.24,0.48,0.96 and 1.92 mg·mL-1)of the fermentation filtrate of B. bassiana;B. Cell viability of Sf9 at 24 h after treatments with different concentrations of the fermentation filtrate of B. bassiana;C. Linear-regression analysis of cell viability 24 h after treatments with the fermentation filtrate(The fermentation concentration is 0.12 mg·mL-1,cell viability is(104.063± 35.049)%,omitted from the linear aggression analysis). The different letters indicate significant difference at 0.05 level. The same as follows. |
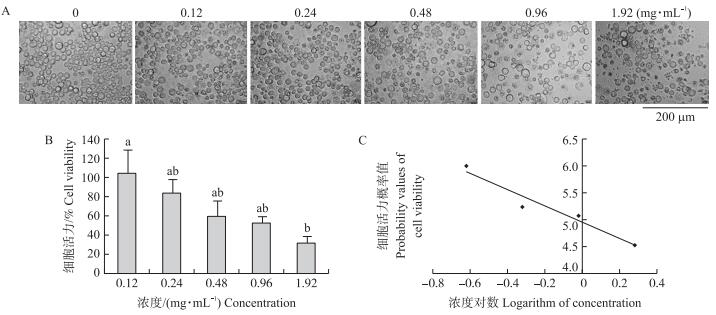
在荧光显微镜下(图 2-A)观察,可见 4 种细胞形态:活细胞(VN),核染色质着绿色并呈正常结构;早 期凋亡细胞(VA),核染色质着绿色呈固缩状或圆珠状;晚期凋亡细胞(NVA),核染色质为橘红色并呈固 缩状或圆珠状;非凋亡的死亡细胞(NVN),核染色质着橘红色,核膜消失,没有明显结构。
|
图 2 利用 AO / EB 染色检测球孢白僵菌发酵液处理对 Sf9 细胞凋亡的影响 Fig. 2 Effects of the fermentation filtrate of B. bassiana on Sf9 apoptosis determined by AO / EB method A. 通过 AO/ EB 染色后,显微镜下观察的细胞染色分类图;B. 球孢白僵菌发酵液产物处理 Sf9 细胞 24 h 后,通过 AO/ EB 染色后的荧光观测图,LD(low dose)与 HD(high dose)分别为 0.48 和 1.92 mg·mL-1;C. 通过统计 Merge 中 4 种染色细胞数算出 的细胞凋亡率。 A. The classification of cells stained by AO/ EB;B. Apoptosis detection by AO/ EB method of Sf9 in 24 hours after treatments by the fermentation filtrate of B. bassiana,with LD and HD of 0.48 and 1.92 mg·mL-1;C. The counting and calculation of apoptotic rate in different treatments. |
球孢白僵菌发酵液产物不同浓度处理 Sf9 细胞并用 AO/ EB 染色后,在荧光显微镜(图 2-B)下发现,随着浓度提高,红色荧光逐渐加强,绿色荧光逐渐减弱。CK、LD 和 HD 处理细胞凋亡率分别为(17.01± 2.02)%、(32.33±4.84)%和(72.33±10.49)%。CK 与 LD 处理没有显著差异,CK 与 HD 处理差异显著,LD 和 HD 处理间差异显著(图 2-C)。
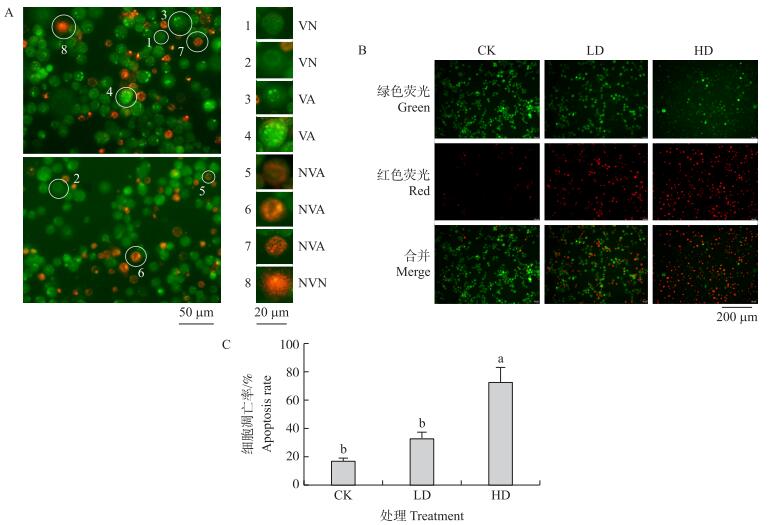
球孢白僵菌发酵液高、低剂量处理 Sf9 细胞后,用 Annexin V-FITC/PI 染色,通过流式细胞仪可检测到 细胞正常率、早期凋亡率、晚期凋亡率和坏死率。如图 3 所示,细胞团随着处理浓度的增加向右上角移动,即正常率逐渐减小,早期凋亡率和晚期凋亡率逐渐增大。CK、LD 和 HD 的凋亡率分别为(41.27±3.93)%、(47.33±0.68)%和(71.73±2.76)%。CK 与 LD 处理没有显著差异,CK 与 HD 处理差异显著,LD 和 HD 处 理间差异显著。
|
图 3 Annexin V-FITC/PI 染色-流式细胞仪检测球孢白僵菌发酵液处理对 Sf9 细胞凋亡的影响 Fig. 3 Effects of the fermentation filtrate of B. bassiana on Sf9 apoptosis determined by Annexin V-FITC/PI method A. 球孢白僵菌发酵液产物处理 Sf9 细胞 24 h 后,通过 Annexin V-FITC/PI 染色-流式细胞仪检测的细胞凋亡率(计数 10 000 个细胞,第 1 象限代表碎片细胞率,第 2 象限代表晚凋细胞率,第 3 象限代表正常细胞率,第 4 象限代表早凋细胞率);B. 对 A 中检测的数据进行 统计分析。 A. Apoptosis detection by Annexin V-FITC/PI method of Sf9 in 24 hours after treatments by the fermentation filtrate of B. bassiana,with LD and HD of 0.48 and 1.92 mg·mL-1(In each treatment,10 000 cells were counted. In each picture,first quadrant represents rate of the cells with disorganized membrane,second quadrant represents late apoptosis rate of the cells,third quadrant represents living rate of the cells and fourth quadrant represents early apoptosis rate of the cells);B. The statistic analysis of Fig. 3-A. |
通过 CCK-8 的细胞活力测定方法,发现球孢白僵菌发酵液处理 Sf9 细胞后,细胞表面皱缩,染色质浓 缩,最终留下细胞印迹,其增殖抑制中浓度为 0.907 mg·mL-1,表现出很强的增殖抑制活性。同时,AO/ EB 染色和 Annexin V-FITC/PI 染色-细胞流式仪测定均检测到球孢白僵菌发酵液对 Sf9 细胞的凋亡诱导效 果,说明球孢白僵菌发酵液中存在有效的杀虫成分,对昆虫细胞表现出增殖抑制和诱导凋亡的作用。已有 研究表明,球孢白僵菌发酵液对昆虫幼虫具有明显毒性,处理草地贪夜蛾细胞后发现细胞中同工酶数量减 少,细胞代谢紊乱,其中分泌到发酵液中的毒素是昆虫致死的主要原因[15-16] 。其他杀虫真菌发酵液也表 现出一定的细胞毒性,平沙绿僵菌发酵液可引起细胞皱缩、起泡和出芽,产生大小不等的凋亡小体[17] ;金 龟子绿僵菌代谢产物中主要毒力因子是环缩肽类物质,导致鳞翅目昆虫血细胞出现细胞膜向内凹陷、收 缩,细胞核偏移,细胞质外泄,细胞内形成空泡,细胞聚集成团的现象明显,细胞表面有瘤状凸起[18] 。
在球孢白僵菌发酵液诱导 Sf9 细胞凋亡的检测试验中,利用 AO/ EB 染色和 Annexin V-FITC/PI 染色- 细胞流式仪测定 2 种方法,各有利弊。AO/ EB 染色试验中,CK、低剂量处理和高剂量处理显示较好的剂 量效应,但该方法需要肉眼辨别细胞凋亡水平和计数,可能存在一定的误判。Annexin V-FITC/PI 染色-细 胞流式仪测定准确性较高,但是 CK 的本底凋亡水平过高,导致剂量效应不明显,尤其是低剂量处理与 CK 之间的差异,有可能由于 CK 本底过高而不易显现。因此,在细胞凋亡检测中,结合 2 种法、相互验证,可 以得到更为可靠的结果。同时,2 种凋亡检测方法均发现高剂量处理结果显著高于 CK,检测到的平均凋 亡率均在 70%以上,这主要是因为高剂量处理后晚期凋亡细胞增加,AO/ EB 容易识别,而且 Annexin V-FITC/PI 染色-细胞流式仪检测准确性更高,2 种方法表现出更好的一致性。
| [1] |
贾兴娜, 钟春燕, 聂金泉, 等. 生物农药在水稻病虫害防治上的应用现状和研究进展[J]. 现代农业科技, 2016(14): 129-131. Jia X N, Zhong C Y, Nie J Q, et al. Application situation and research progress of biological pesticides on the control of rice pests and diseases[J]. Modern Agricultural Science and Technology, 2016(14): 129-131 (in Chinese with English abstract). DOI:10.3969/j.issn.1007-5739.2016.14.076 |
| [2] |
张化霜. 微生物农药研究进展[J]. 农药科学与管理, 2011, 32(11): 22-25. Zhang H S. Research advance of microbial pesticides[J]. Pesticide Science and Administration, 2011, 32(11): 22-25 (in Chinese with English abstract). DOI:10.3969/j.issn.1002-5480.2011.11.012 |
| [3] |
周传恩. 我国杀虫微生物的应用研究进展及发展前景[J]. 农药, 2001, 40(7): 8-10. Zhou C E. A progress and development foresight of pesticidal microorganism in China[J]. Pesticides, 2001, 40(7): 8-10 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-0413.2001.07.002 |
| [4] |
张永军, 王中康, 殷幼平, 等. 球孢白僵菌的生物学特性及对小麦蚜虫的毒力[J]. 西南农业大学学报, 2001, 23(2): 144-146. Zhang Y J, Wang Z K, Yin Y P, et al. Biological characteristics of three isolates of Beauveria bassiana and their virulance against wheat aphids[J]. Journal of Southwest Agricultural University, 2001, 23(2): 144-146 (in Chinese with English abstract). DOI:10.3969/j.issn.1673-9868.2001.02.015 |
| [5] |
黄定高. 微生物农药的开发和应用前景[J]. 现代商贸工业, 2010, 22(13): 348-349. Huang D G. Development and foresight of microbial pesticides[J]. Modern Business Trade Industry, 2010, 22(13): 348-349 (in Chinese). DOI:10.3969/j.issn.1672-3198.2010.13.227 |
| [6] |
叶斌. 绿僵菌培养及防治马尾松毛虫的研究[D]. 福州:福建农林大学,2005. |
| [7] |
肖筠, 黄世群, 丁佶, 等. 微生物杀虫剂- - -苏云金杆菌(Bt)[J]. 四川农业科技, 2008(4): 44-45. Xiao J, Huang S Q, Ding J, et al. Microbial pesticide:Bacillus thuringiensis(Bt)[J]. Sichuan Agricultural Science and Technology, 2008(4): 44-45 (in Chinese). DOI:10.3969/j.issn.1004-1028.2008.04.030 |
| [8] |
武艺, 黄秀梨, 邓继先. 球孢白僵菌毒素对昆虫体外培养细胞胞内同功酶和代谢水平的影响[J]. 北京师范大学学报(自然科学版), 1997, 33(1): 117-121. Wu Y, Huang X L, Deng J X. The effect of Beauveria bassiana to theultrastructure and the total of protein[J]. Journal of Beijing Normal University (Natural Science Edition), 1997, 33(1): 117-121 (in Chinese with English abstract). |
| [9] |
胡维娜, 何广位, 李福霞, 等. 绿僵菌素 A 对家蚕 cecropin B 和 gloverin 4 基因表达的影响[J]. 环境昆虫学报, 2016, 38(5): 984-989. Hu W N, He G W, Li F X, et al. Effect of destruxin A on expression of cecropin B and gloverin 4 genes of silkworm[J]. Journal of Environmental Entomology, 2016, 38(5): 984-989 (in Chinese with English abstract). |
| [10] |
Wang Y C, Yu N, Chu F H, et al. Sublethal effects of Beauveria bassiana sensu lato isolate NJBb2101 on biological fitness and insecticide sensi- tivity of parental and offspring generations of brown planthopper,Nilaparvata lugens[J]. Biological Control, 2018, 121: 44-49. DOI:10.1016/j.biocontrol.2018.02.007 |
| [11] |
熊建文, 肖化, 张镇西. MTT 法和 CCK-8 法检测细胞活性之测试条件比较[J]. 激光生物学报, 2007, 16(5): 559-562. Xiong J W, Xiao H, Zhang Z X. An experimental research on different detection conditions between MTT and CCK-8[J]. Acta Laser Biology Sinica, 2007, 16(5): 559-562 (in Chinese with English abstract). DOI:10.3969/j.issn.1007-7146.2007.05.008 |
| [12] |
陈丽娟, 盛瑞兰, 汪承亚, 等. AO/ EB 荧光染色法测定阿糖胞苷诱导 HL-60 细胞凋亡[J]. 中华血液学杂志, 1998, 19(1): 41-42. Chen L J, Sheng R L, Wang C Y, et al. Detection of cytarabine inducing cell apoptosis by AO/ EB fluorescence staining[J]. Chinese Journal of Hematology, 1998, 19(1): 41-42 (in Chinese). DOI:10.3760/j:issn:0253-2727.1998.01.016 |
| [13] |
孙婷. Annexin V/ PI 双染法和 MTT 法评价无镍奥氏体不锈钢对人牙龈成纤维细胞的影响[J]. 沈阳:中国医科大学, 2012. Sun T. The evaluation on the influence of nickel-free austenitic stainless steel to human gingival fibroblast by using Annexin V/ PI double-staining method and MTT assay[J]. Shenyang:China Medical University, 2012 (in Chinese with English abstract). |
| [14] |
傅文宇,李敏伟,陈加平,等. 用流式细胞仪 PI、Annexin V 双染色法检测微囊藻毒素 LR 诱导的大鼠肾细胞凋亡[C] / / 第二届全国环境 与职业医学研究生学术研讨会论文集,2003:18-20. Fu W Y,Li M W,Chen J P,et al. Flow cytometric detection of apoptosis of renal cells of mice induced by microcystin-LR using PI and Annexin V staining[C]. Proceeding of the 2nd Symposium on Envionmental and Occupational Medicine for Postgraduates,2003:18-20(in Chinese with English abstract). http://www.wanfangdata.com.cn/details/detail.do?_type=conference&id=6685721 |
| [15] |
武艺, 黄秀梨, 洪泂, 等. 球孢白僵菌毒素的分离、毒力检测及结构鉴定[J]. 微生物学报, 1998, 38(6): 468-474. Wu Y, Huang X L, Hong J, et al. Isolation,detection toxicity and structure of toxin from Beauveria bassiana[J]. Acta Microbiologica Sinica, 1998, 38(6): 468-474 (in Chinese with English abstract). |
| [16] |
Genthner F J, Cripe G M, Crosby D J. Effect of Beauveria bassiana and its toxins on Mysidopsis bahia(Mysidacea)[J]. Archives of Environmental Contamination and Toxicology, 1994, 26(1): 90-94. DOI:10.1007/BF00212798 |
| [17] |
Johnstone R W, Ruefli A A, Lowe S W. Apoptosis:a link between cancer genetics and chemotherapy[J]. Cell, 2002, 108(2): 153-164. DOI:10.1016/S0092-8674(02)00625-6 |
| [18] |
范继巧. 绿僵菌素对家蚕血细胞及血淋巴蛋白质组的影响[D]. 广州:华南农业大学,2012. Fan J Q. Destruxin-A effects on the hemoeytes and haemolymphic proteome of Bombyx mori[D]. Guangzhou:South China Agricultural University, 2012(in Chinese with English abstract). http://d.old.wanfangdata.com.cn/Thesis/Y2245278 |




