文章信息
- 周敏, 程华, 张子昕, 邢晓娟, 蒋甲福, 陈发棣
- ZHOU Min, CHENG Hua, ZHANG Zixin, XING Xiaojuan, JIANG Jiafu, CHEN Fadi
- 菊花CmETR2基因的克隆及功能分析
- Cloning and functional analysis of CmETR2 gene in chrysanthemum
- 南京农业大学学报, 2020, 43(3): 431-437
- Journal of Nanjing Agricultural University, 2020, 43(3): 431-437.
- http://dx.doi.org/10.7685/jnau.201907045
-
文章历史
- 收稿日期: 2019-07-23
菊花(Chrysanthemum morifolium )是我国的十大传统名花和世界四大切花之一,在国内外花卉市场中占有十分重要的地位,具有极高的观赏与经济价值。由于菊花大多为秋菊品种;因此需要通过花期调控来实现菊花的周年生产[1]。植物开花受多种因素的影响;如植物本身的遗传特性、环境因素、营养物质以及激素等[2]。在模式植物拟南芥中,有6条开花路径;包括光周期路径(photoperiod pathway)、自主路径(autonomous pathway)、春化路径(vernalization pathway)、赤霉素路径(GA pathway)、环境温度路径(ambient temperature pathway)和年龄路径(age pathway)。在激素影响植物开花进程方面,有研究表明:在拟南芥中赤霉素可以促进开花影响因子SOC1(SUPPRESSOR OF OVEREXPRESSION OF CONSTANS 1)、FT(FLOWERING LOCUS T)和LFY(LEAFY)的表达,进而促进拟南芥花期提前[3-4];外源乙烯能抑制拟南芥和黄瓜等植物雄蕊花丝伸长[5];叶面喷洒乙烯利药液,使有些植物提早开花;抑制节间伸长,起到矮化植株协调开花整齐的作用[6];而6 ~ 60 mg· L-1乙烯利则抑制菊花花芽形成;还可显著推迟瓜叶菊开花期[7];喷施一定浓度的乙烯利溶液;菊花品种'金陵红玫'柳芽数量明显减少;植株节数增多且节间长度减小;同时可延长国庆小菊花芽分化的时间;从而推迟花期[8]。
在模式植物拟南芥中,乙烯信号转导通路的最上游由1个多基因家族编码的5个受体所组成:ETR1 (ethylene recptor 1)、ETR2(ethylene recptor 2)、ERS1(ethylene response sensor 1)、ERS2(ethylene response sensor 2)和EIN4(ethylene insensitive 4)。乙烯受体是乙烯信号转导过程中信号传递的关键因子,也是乙烯应答的必要蛋白。通过调控乙烯受体基因的表达水平可直接影响乙烯信号转导,延缓或中断植物成熟等生理变化,进而调节植物果实成熟和衰老进程,对鲜切花品质提高及产业发展意义非凡[9]。
本研究通过基因克隆获得CmETR2基因,分析其表达模式,构建基因超表达载体转入拟南芥中,观察其超表达植株中拟南芥的表型,旨在为阐明乙烯调控菊花开花作用机制提供理论基础。
1 材料与方法 1.1 供试材料供试菊花品种'神马'取自南京农业大学中国菊花种质资源保存中心。在菊花营养生长和生殖生长期,分别取植株的根、茎、从上往下数第3片完全展开叶、管状花、舌状花、花苞等样品;取样后迅速液氮保存。3株为1个重复。在长日照条件下的菊花扦插苗生长到10~12片叶时,喷施50 mg·L-1乙烯利。在处理后0、3、6、9、12、24、48和96 h取各组织样品,用液氮速冻。
1.2 CmETR2基因克隆与序列分析使用RNA快速提取试剂盒(北京华越洋)提取RNA,经检验合格后用反转录试剂盒(TaKaRa)合成cDNA,-20 ℃保存备用。采用Primer Premier 5.0软件设计正、反向引物CmETR2-F和CmETR2-R(表 1)。以RNA反转录获得的cDNA为模板,使用高保真酶进行PCR扩增,获得目的基因条带。
| 引物Primer | 序列Sequence(5′→3′) |
| CmEF1α-F/ R | TTTTGGTATCTGGTCCTGGAG/CCATTCAAGCGACAGACTCA |
| AtActin-F/R | GGTAACATTGTGCTCAGTGGTGG/AACGACCTTAATCTTCATGCTGC |
| CmETR2-F/R | AGAGTTGATATGTGGGTGCAATAGTCA/CTTGCACCATCTTCTTGGATCAAATA |
| qCmETR2-F/R | TGATGTAAACCGTGCTGTAACCCGT/TCTAAACCATCTAAATCAGG |
| qAtGI-F/R | CTGAGAAGCGACTTTTAGACGATG/GGTTGTAATGAGTCAAAATGCGAA |
| qAtSPL3-F | AGCTCCTCATGTTCGGATCTCTGG/AACTCACTGAGCGCGTGAAACCTG |
| qAtFD-F/R | CAAACTCTAATCTTCATACCCACC/ACGCTTATGTCTTCTATTCCCT |
| qAtTFL-F | TTGTGTTTGTTCTGTTCAGGC/CGGTTTCTCTTTGTGCGTTA |
| qAtFLC-F/R | TCCGTCGCTCTTCTCGTCGTCT/ATGAGTTCGGTCTTCTTGGCTC |
下载不同物种中与CmETR2基因编码的同源性较高的蛋白序列,进行多序列比对。采用BLAST对CmETR2基因序列进行同源性分析,采用软件DNAMAN 6.0和MEGA 7.0进行多序列比对和进化树构建,Bootstrap检测值为1 000次。
1.4 组织定量分析对菊花根、茎、叶、花苞、舌状花和管状花等样品提取RNA并反转录获得cDNA。根据克隆的CmETR2全长序列,采用Primer Premier 5.0软件设计组织定量引物qCmETR2-F和qCmETR2-R (表 1)。通过RT-qPCR分析CmETR2在菊花不同组织中的表达量。反应体系参照SYBR Premix Ex TaqTM(TaKaRa)说明书。PCR程序:95 ℃ 2 min;95 ℃ 15 s;55 ℃ 15 s;72 ℃ 20 s;40个循环,并加入熔解曲线分析程序。每个样品3次重复。内参基因为菊花CmEF1α,采用2-ΔΔCT计算基因相对表达量。
1.5 CmETR2 蛋白的亚细胞定位 1.5.1 载体构建将CmETR2基因的ORF产物和植物表达载体pORE-1X35S-R4(含GFP标签)同时用XhoⅠ和BamHⅠ(TaKaRa)进行双酶切, 酶切后的产物经琼脂糖凝胶电泳检测, 切胶纯化并回收。将回收的CmETR2片段与双酶切后的pORE-1X35S-R4载体片段用SolutionⅠ(TaKaRa)16 ℃过夜连接;转化大肠杆菌感受态DH5α后涂布于LB / Kan固体培养基(37 ℃, 过夜培养), 挑单克隆进行菌液检测, 挑选阳性菌液送公司测序。将测序正确的菌液提取质粒, 获得pORE-1X35S-R4-CmETR2表达载体。将pORE-1X35S- R4-CmETR2转化农杆菌感受态细胞EHA105, 用于后续的亚细胞定位试验。
1.5.2 烟草表皮细胞瞬时表达将1.5.1节中获得的pORE-1X35S-R4-CmETR2载体、定位基因(35S∷ D53-RFP)及pORE-1X35S-R4空载农杆菌菌株划线于含有卡那霉素和利福平的YEB平板上, 于28 ℃倒置培养2~3 d;挑取单克隆在含有卡那霉素和利福平的YEB液体培养基中过夜培养至菌液D600为0.8 ~ 1.0, 然后用侵染缓冲液(10 mmol·L-1 MES、100 μmol·L-1 AS、50 mmol·L-1 MgCl2)重悬, 用紫外分光光度仪测定D600值。按公式混合菌液:Vconstruct =n×Vfinal×0.5 / D600, 其中:n为叶片数量, Vfinal为2 mL。按计算好的体积充分混合菌液, 室温下5 000 r·min-1离心15 min, 弃上清液;用2 mL侵染缓冲液悬浮菌液, 室温黑暗静置3 h, 注射长势好、叶龄3周左右的本氏烟草叶片并做好标记, 暗培养12 ~16 h后转至光照/黑暗时间为16 h / 8 h条件下培养48 h;选取注射区域的叶片在激光共聚焦显微镜(LSM780, ZEISS)下观察GFP的荧光信号并拍照。
1.6 拟南芥转基因株系利用农杆菌蘸花法将pORE-1X35S-R4-CmETR2转入野生型拟南芥中。在1 / 2 MS+50 mg·L-1卡那霉素培养基中筛选阳性苗, T1代通过基因特异性引物和载体引物鉴定得到6株阳性苗。收取T1、T2和T3代种子, 并将获得的T3代纯合拟南芥种子与野生型同时播种。统计长日照条件(光照/黑暗时间为16 h/ 8 h, 相对湿度45%, 温度22 ℃, 光照强度约160 μmol·m-2·s-1)下各株系的莲座叶片数和开花时间。移栽2周后, 取叶片并提取RNA, 用基因特异引物(表 1)对阳性株系OX-63、OX-64、OX-65的表达情况进行半定量检测。
为了观察超表达植株对乙烯的敏感程度, 将T3代种子播种在MS培养基和含有10 μmol·L-1 ACC (1-氨基环丙烷-1-羧酸酯)MS培养基中, 暗培养3 d, 观察下胚轴的表型。对拟南芥超表达植株T3代与野生型植株提取RNA, 用特异引物(表 1)检测CmETR2超表达植株中5个开花相关基因(AtGI、AtFD、AtFLC、AtFLC和AtSPL3)的表达情况。
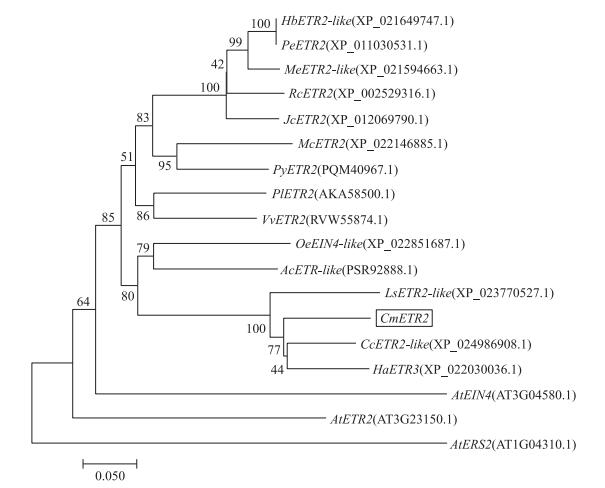
2 结果与分析 2.1 菊花CmETR2基因的克隆及进化树分析以菊花'神马'cDNA为模板, 克隆获得CmETR2基因全长序列(图 1), 开放阅读框(ORF)为2 292 bp, 编码氨基酸763个。将菊花ETR2蛋白与向日葵、莴苣、刺苞菜蓟等植物的蛋白进行多重序列比对, 结果(图 2)显示:CmETR2与向日葵ETR3以及刺菜蓟的ETR2-like亲缘关系较近, 同源性较高。

|
图 1 CmETR2基因的PCR产物 Fig. 1 The PCR product of CmETR2 gene M. Marker;1. CmETR2基因片段The fragment of CmETR2 gene. |
|
图 2 不同物种ETR2的系统进化树分析 Fig. 2 Phylogenetic analysis of ETR2 among different species Hb:橡胶树Hevea brasiliensis;Pe:胡杨Populus euphratica;Me:木薯Manihot esculenta;Rc:蓖麻Ricinus communis;Jc:麻风树Jatropha curcas;Mc:苦瓜Momordica charantia;Py:日本樱花Prunus yedoensis;Pl:芍药Paeonia lactiflora;Vv:葡萄Vitis vinifera;Oe:洋橄榄树Olea europaea;Ac:狝猴桃Actinidia chinensis;Ls:莴苣Lactuca sativa;Cm:菊花Chrysanthemum morifolium;Cc:刺菜蓟Cynara cardunculus;Ha:向日葵Helianthus annuus;At:拟南芥Arabidopsis thaliana. |
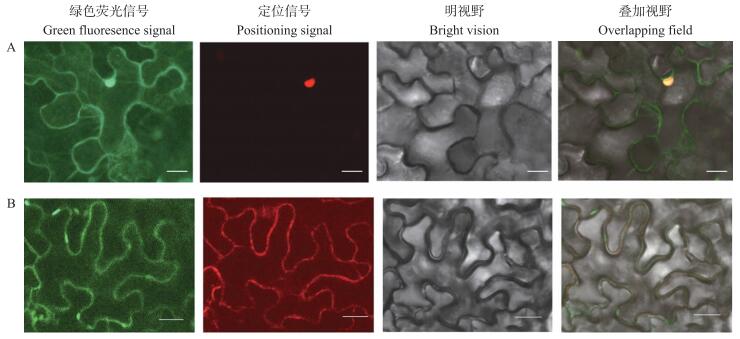
由图 3可见:阳性对照35S∷GFP的绿色荧光信号在整个烟草细胞内都可见, 包括细胞膜和细胞核;而融合蛋白绿色荧光信号只在膜中出现信号, 与定位信号产生的红色荧光重叠呈现出橙色荧光, 这说明CmETR2定位在细胞膜上。
|
图 3 CmETR2在烟草中的亚细胞定位 Fig. 3 The subcellular localization of CmETR2 in tobacco cells A. pORE-1X35S-R4;B. pORE-1X35S-R4-CmETR2. Bar= 20 μm. |
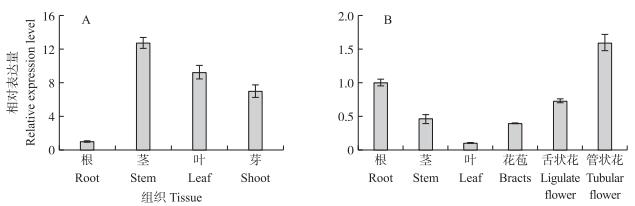
由图 4可见:CmETR2在菊花的根、茎、叶、芽和花中均有表达, 且表达量有明显差异。在菊花的营养生长期, CmETR2在茎和叶中的表达量较高;在生殖生长期, 该基因在管状花和根中的表达量较高, 其次是舌状花和茎, 而在叶中表达量最低。
|
图 4 CmETR2在菊花不同组织中的表达量 Fig. 4 The expression level of CmETR2 in different tissues of chrysanthemum A.营养生长期Vegetative growth stage;B.生殖生长期Reproductive growth satge. |
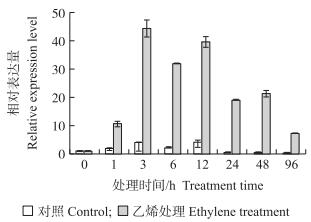
由图 5可见:外源乙烯处理3 h后, CmETR2基因的表达上调, 是对照组的20倍左右。随乙烯处理时间的延长, CmETR2的表达水平总体呈下降趋势, 在96 h降到最低水平。
|
图 5 外源乙烯处理后CmETR2基因的表达量 Fig. 5 The expression level of CmETR2 gene after exogenous ethylene treatment |
用基因特异引物和载体通用引物成功鉴定出6株阳性苗, 获得CmETR2超表达植株。由图 6-A可见:在超表达植株中均检测到CmETR2的表达, 而野生型植株中没有, 且CmETR2基因在超表达植株中的表达量差异不大。选择T3代植株OX-64和OX-65作为超表达的单拷贝纯合株系, 表型观察发现, CmETR2超表达植株表现出明显的晚花表型, 比野生型拟南芥晚开花3 d左右;超表达植株的莲座叶为15片左右, 而野生型的莲座叶为12片左右, 进一步证明转基因株系为晚花表型(图 6-B,C)。乙烯处理后, CmETR2超表达植株表现出明显的"三重反应", 即转基因株系的根变短、变粗以及顶端钩弯曲(图 6-D)。
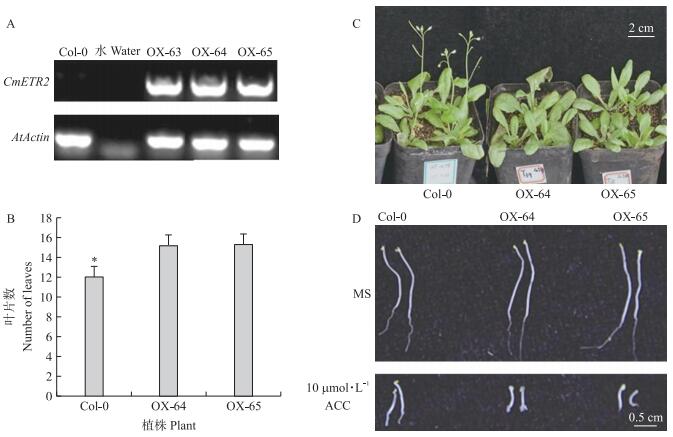
|
图 6 CmETR2超表达植株表型 Fig. 6 Phenotypes of CmETR2 overexpression plants A.半定量验证Semi-quantitative validation;B.野生型和超表达植株初花时的叶片数(* P<0.05) Leaf number of wild-type and overexpression plants at initial flowering;C.野生型和超表达植株的开花表型Flowering phenotypes of wild-type and overexpression plants;D. 1-氨基环丙烷-1-羧酸酯(ACC)处理三重反应对比Comparison of triple response after 1-aminocyclopropane-1-carboxylate(ACC)treatment. Col-0:野生型Wild type;OX-63、OX-64、OX-65:超表达植株Overexpression plants.下同。The same as follows. |
由图 7可见:与野生型相比, CmETR2超表达植株OX-64、OX-65中对开花具有促进作用的基因GI、SPL3和FD表达量明显下调, 而开花抑制因子FLC、TFL的表达显著上调。这表明超表达CmETR2使植株出现晚花表型, 可能是由开花促进基因下调以及开花抑制基因上调引起的。
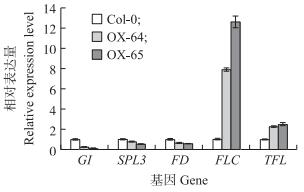
|
图 7 CmETR2超表达植株中开花调控基因的表达量 Fig. 7 The expression level of flowering regulated genes in CmETR2 overexpression plants GI: GIGANTEA; SPL3: SQUAMOSA PROMOTER-BINDING-LIKE 3;FD:FLOWERING LOCUS D; FLC:FLOWEING LOCUS C; TFL:TERMINAL FLOWER. |
本研究从菊花品种'神马'中克隆获得CmETR2基因全长序列, 通过对CmETR2基因表达特征分析和转拟南芥的功能验证, 证明菊花CmETR2基因具有延迟植物开花的功能。乙烯调节开花的作用是被子植物生殖过程中最重要的发育事件之一, 乙烯促进一些植物开花, 但却延迟另一些植物开花。例如, 在菠萝中乙烯可以促进开花, 而在拟南芥和牵牛中乙烯延迟开花[10]。ETR2属于乙烯受体亚家族Ⅱ(ERS2、EIN4、ETR2), 关于ETR2的研究十分广泛。ETR2在转基因水稻中的过表达降低乙烯敏感性, 延缓花的成花转变。然而ETR2干扰(RNAi)植株和ETR2T-DNA插入突变体表现出较强的乙烯敏感性和早花[11]。研究表明ETR2可能通过调控下游基因而延缓开花, 引起茎中淀粉积累[11]。在本研究中, CmETR2超表达植株都表现出晚花的表型, 说明CmETR2基因参与调控植物开花, 这与朱英秀[5]的结果一致。
为深入研究CmETR2基因在促进拟南芥开花方面的分子机制, 本试验检测了CmETR2超表达植株中开花相关基因的表达情况, 结果表明, CmETR2超表达植株中GI、SPL3、FD基因的表达量显著下调, 而FLC、TFL基因的表达量显著上调, 开花延迟, 表现出晚花的表型。乙烯抑制拟南芥成花是因为乙烯的出现会降低GA的活性, 导致DELLA蛋白的积累, 从而抑制下游开花整合子的表达[12]。在拟南芥的开花路径中, GI-CO-FT蛋白的调控模式起到关键的作用, 长日照条件下促进植物开花[13]。有研究表明, SPL基因受miR156剪切下调表达, 并能将年龄信号和其他开花途径整合促进植物开花[14]。年龄路径中的SPL转录因子能促进植物开花[15]。组成型表达SPL3导致植物早花[16], 同时SPL3 / 4 / 5将发育老化和光周期信号整合到拟南芥开花的FT-FD模块中[17]。在长日照条件下, 烟草中的FT-FD模块促进开花[18]。FLC基因主要在春化和自主路径中发挥作用, 是开花抑制基因, 使植株表现出晚花的表型[16]。CmTFL基因通过抑制AtFT、AtLFY、AtAP1的上调来负抑制开花[19]。花分生组织基因(LFY)通过反馈调节来促进TFL1蛋白向顶端分生组织的运动, 这种新的反馈信号机制能够确保花序结构的正常发育, 进而促进植物开花[20]。综上, 在CmETR2超表达植株中促进开花的基因表达量下调, 抑制开花的基因表达量上调, 与CmETR2超表达植株开花时间结果相符。该研究不仅丰富了植物乙烯受体调控花期的理论基础, 也为培育不同花期的菊花提供了基因资源, 具有重要的理论意义。
| [1] |
王恒.蔗糖诱导CmETR2调控夏菊开花的分子机理研究[D].南京: 南京农业大学, 2017. Wang H. Functional analysis of flowering regulation through sucrose and sucrose-induced CmETR2 in Chrysanthemum[ D]. Nanjing:Nanjing Agricultural University, 2017(in Chinese with English abstract). |
| [2] |
刘畅宇, 陈勋, 龙雨青, 等. 乙烯生物合成及信号转导途径中介导花衰老相关基因的研究进展[J]. 生物技术通报, 2019, 35(3): 171-182. Liu C Y, Chen X, Long Y Q, et al. Research advances in genes involved in ethylene biosynthesis and signal transduction during flower senescence[J]. Biotechnology Bulletin, 2019, 35(3): 171-182 (in Chinese with English abstract). |
| [3] |
van de Poel B, Smet D, van der Straeten D. Ethylene and hormonal cross talk in vegetative growth and development[J]. Plant Physiology, 2015, 169(9): 61-72. |
| [4] |
杨建霞, 范小峰, 蔺亚亚, 等. 赤霉素和乙烯利对拟南芥花期的影响[J]. 林业科技通讯, 2015(12): 50-52. Yang J X, Fan X F, Lin Y Y, et al. Effects of gibberellin and ethephon on the flowering time of Arabidopsis[J]. Forest Science and Technology, 2015(12): 50-52 (in Chinese). |
| [5] |
朱英秀. 体外施加乙烯对拟南芥雄蕊发育的影响[J]. 上海:上海师范大学, 2017. Zhu Y X. Effects of exogenous ethylene treatment on stamens development in Arabidopsis thaliana[J]. Shanghai:Shanghai Normal University, 2017 (in Chinese with English abstract). |
| [6] |
辛海波. 植物生长调节剂在园艺生产中的应用[J]. 农业开发与装备, 2016(10): 32-33. Xin H B. Application of plant growth regulators in horticultural production[J]. Agricultural Development & Equipments, 2016(10): 32-33 (in Chinese). DOI:10.3969/j.issn.1673-9205.2016.10.029 |
| [7] |
陈香玲, 卢美英. 乙烯利在植物成花方面的应用及研究进展[J]. 广西农业科学, 2005, 36(2): 110-112. Chen X L, Lu M Y. Progress of studies on application of ethrel in plant flower-formation regulation[J]. Guangxi Agricnltural Sciences, 2005, 36(2): 110-112 (in Chinese with English abstract). |
| [8] |
刘小旋. 国庆小菊花芽分化调控的初步研究[J]. 南京:南京农业大学, 2016. Liu X X. A preliminary study on the regulation of flower bud differentiation in guoqing chrysanthemum with small inflorescences[J]. Nanjing: Nanjing Agricultural University, 2016 (in Chinese with English abstract). |
| [9] |
李丽, 孙健, 易萍, 等. 芒果乙烯受体ETR1和ERS1基因的克隆及序列分析[J]. 南方农业学报, 2018, 49(6): 1053-1060. Li L, Sun J, Yi P, et al. Cloning and sequence analysis of ethylene receptor ETR1 and ERS1 genes from mango(Mangnifera indica L.)[J]. Journal of Southern Agriculture, 2018, 49(6): 1053-1060 (in Chinese with English abstract). DOI:10.3969/j.issn.2095-1191.2018.06.02 |
| [10] |
Kulikowska-Gulewska H, Majewska M, Kopcewicz J. Gibberellins in the control of photoperiodic flower transition in Pharbitis nil[J]. Physiologia Plantarum, 2000, 108(2): 202-207. DOI:10.1034/j.1399-3054.2000.108002202.x |
| [11] |
Wuriyanghan H, Zhang B, Cao W H, et al. The ethylene receptor ETR2 delays floral transition and affects starch accumulation in rice[J]. The Plant Cell, 2009, 21(5): 1473-1494. DOI:10.1105/tpc.108.065391 |
| [12] |
Achard P, Baghour M, Chapple A, et al. The plant stress hormone ethylene controls floral transition via DELLA-dependent regulation of floral meristem-identity genes[J]. Proc Natl Acad Sci USA, 2007, 104(15): 6484-6489. |
| [13] |
Fornara F, de Montaigu A, Sánchez-Villarreal A, et al. The GI-CDF module of Arabidopsis affects freezing tolerance and growth as well as flowering[J]. The Plant Journal, 2015, 81(5): 695-706. |
| [14] |
Jung J H, Yun J, Pil J S, et al. The SOC1-SPL module integrates photoperiod and gibberellic acid signals to control flowering time in Arabidopsis[J]. The Plant Journal, 2012, 69(4): 577-588. DOI:10.1111/j.1365-313X.2011.04813.x |
| [15] |
Fornara F, de Montaigu A, Coupland G. SnapShot:control of flowering in Arabidopsis[J]. Cell, 2010, 141(3): 550. DOI:10.1016/j.cell.2010.04.024 |
| [16] |
Cardon G H, H, hmann S, Nettesheim K, et al. Functional analysis of the Arabidopsis thaliana SBP-box gene SPL3:a novel gene involved in the floral transition[J]. The Plant Journal, 1997, 12(2): 367-377. DOI:10.1046/j.1365-313X.1997.12020367.x |
| [17] |
Jung J H, Lee H J, Ryu J Y, et al. SPL3/ 4 / 5 integrate developmental aging and photoperiodic signals into the FT-FD module in Arabidopsis flowering[J]. Molecular Plant, 2016, 9(12): 1647-1659. DOI:10.1016/j.molp.2016.10.014 |
| [18] |
Beinecke F A, Grundmann L, Wiedmann D R, et al. The FT/ FD-dependent initiation of flowering under long-day conditions in the day-neutral species Nicotiana tabacum originates from the facultative short-day ancestor Nicotiana tomentosiformis[J]. The Plant Journal, 2018, 96(2): 329-342. DOI:10.1111/tpj.14033 |
| [19] |
Choi K, Kim J, Hwang H J, et al. The FRIGIDA complex activates transcription of FLC, a strong flowering repressor in Arabidopsis, by recruiting chromatin modification factors[J]. The Plant Cell, 2011, 23(1): 289-303. DOI:10.1105/tpc.110.075911 |
| [20] |
Conti L, Bradley D. TERMINAL FLOWER1 is a mobile signal controlling Arabidopsis architecture[J]. The Plant Cell, 2007, 19(3): 767-778. DOI:10.1105/tpc.106.049767 |




