文章信息
- 李沛曈, 迟天华, 刘颖鑫, 范宏虹, 王海滨, 管志勇, 房伟民, 陈发棣, 张飞
- LI Peitong, CHI Tianhua, LIU Yingxin, FAN Honghong, WANG Haibin, GUAN Zhiyong, FANG Weimin, CHEN Fadi, ZHANG Fei
- 异色菊×菊花脑种间杂交F1代SSR遗传多态性分析、耐旱性鉴定及关联分析
- Genetic polymorphism analysis, evaluation of drought tolerance and association analysis using SSR markers in the interspecific Chrysanthemum dichrum×C.nankingense F1 hybrids
- 南京农业大学学报, 2020, 43(2): 238-246
- Journal of Nanjing Agricultural University, 2020, 43(2): 238-246.
- http://dx.doi.org/10.7685/jnau.201905042
-
文章历史
- 收稿日期: 2019-05-16
干旱是影响植物生长发育和产量的重要非生物逆境因子, 随着温室气体排放导致的全球变暖, 干旱持续期和发生地域也将进一步延长或扩大[1-2]。
菊花(Chrysanthemum morifolium)是我国传统名花和世界重要切花之一, 具有很高的观赏和经济价值。干旱缺水的环境条件常常导致菊花观赏品质和产量降低, 并且在切花菊上表现尤为明显[3-4]。研究表明, 受到干旱胁迫时菊花叶片微结构[5]和生理指标[6]均会发生明显变化。Li等[7]评价了切花菊品种资源的耐旱性, 并通过关联分析挖掘了部分耐旱性分子标记。另外, 有关菊花耐旱性相关基因的研究也取得了良好进展[8-10]。我国有丰富的菊花近缘野生种属植物, 且具有较强的抗逆性。这些近缘野生资源的挖掘和有效利用将有助于抗逆性状的遗传机制研究和优异基因挖掘, 为栽培品种的抗逆性改良奠定基础。Sun等[11]将耐旱性较强的野菊与耐旱性较差的观赏菊杂交, 证明远缘杂交可以获得强耐旱性的后代群体。虽然关于菊花耐旱性研究已有相关报道, 但是菊花耐旱育种进展仍比较滞后。
本研究拟通过盆栽模拟干旱处理和隶属函数法评价菊花二倍体近缘种异色菊(强抗旱)、菊花脑(低抗旱)及其种间F1杂交群体耐旱性的遗传变异, 并利用SSR分子标记分析该种间F1群体的遗传多态性, 以期挖掘优异耐旱育种中间材料, 为菊花耐旱性连锁作图和遗传改良提供参考依据。
1 材料与方法 1.1 试验材料供试材料为菊花二倍体近缘种异色菊(Chrysanthemum dichrum)和菊花脑(C.nankingense), 保存于南京农业大学中国菊花种质资源保存中心。2015年秋, 以异色菊为母本、菊花脑为父本, 采用人工辅助授粉方式进行杂交, 次年3月穴盘播种, 共获得87个株系的F1代分离群体。2016年5月, 将杂交亲本及其F1代进行扦插, 生根后定植于南京农业大学湖熟花卉基地, 常规大田管理。
1.2 耐旱性鉴定2017年6月, 将亲本和87个杂交株系的插穗扦插于口径6 cm、高度11 cm的穴盘中, 基质为蛭石和营养土(体积比3:1), 插穗生根后长至10叶龄时停止浇水进行自然干旱处理, 对照处理为正常浇水。干旱处理20 d后调查植株萎蔫情况, 包括萎蔫指数(WI)、叶片相对含水量(RWC)、株高(PH)、根长(RL)、地下部鲜质量(RFW)、地下部干质量(RDW)、地上部鲜质量(SFW)、地上部干质量(SDW)、鲜质量根冠比(FRSR)和干质量根冠比(DRSR)共10个抗旱相关性状。试验采用完全随机区组设计, 干旱处理共2个重复, 每个重复6株幼苗。
1.2.1 萎焉指数采用6级标准观察记录萎蔫情况。1级:植株挺直, 叶片自然伸展, 基本没有出现萎蔫; 2级:植株基本挺直, 植株叶片的1/4下垂; 3级:植株叶片的1/2萎蔫; 4级:植株叶片的3/4下垂; 5级:植株顶端萎蔫弯曲, 所有叶片皱缩萎蔫; 6级:植株干枯, 叶片发黄。
1.2.2 叶片相对含水量对照和处理的幼苗, 每株采取2片成熟、无病虫害的叶片, 首先用天平测其鲜质量, 然后将叶片用纸包好放入有水的穴盘孔中, 浸泡一夜, 次日将叶片用纸吸干水分测量其饱和质量; 最后将叶片置于80 ℃烘箱内48 h, 测其干质量。相对含水量(RWC)=(mf-md)/(mt-md)× 100%。式中:mf为叶片鲜质量; md为叶片干质量; mt为叶片充分吸水12 h后的饱和质量。叶片均为植株上部第3~4片完全叶。
1.2.3 干旱胁迫指数采用王艳慧等[12]的方法, 各指标均采用胁迫指数的方法表示, 单项指标的胁迫指数=处理测定值/对照测定值×100%。
1.2.4 隶属函数法采用隶属函数法求出每个指标的隶属函数值。计算公式为:若该指标数据与抗旱性是正相关关系, 则Xi=(X-Xmin)/(Xmax-Xmin); 若该指标数据与抗旱性是负相关关系, 则Xi=1-(X-Xmin)/(Xmax-Xmin)。式中:X为某个基因型(株系)某个指标的测定值; Xmin和Xmax为所有株系该指标的最小值和最大值。通过主成分分析筛选耐旱相关指标, 并对各材料所有耐旱相关指标的平均隶属函数值进行聚类分析。
1.2.5 相关性分析利用SPSS 20.0分析耐旱相关指标间的Pearson相关性。
1.3 基因组DNA提取及检测采取新鲜嫩叶, 采用Porebski等[13]的方法提取基因组DNA。用核酸仪检测DNA的浓度和纯度, 采用8 g·L-1琼脂糖凝胶电泳检测DNA质量。读取样品浓度后用ddH2O稀释至50 ng·μL-1, -20 ℃保存备用。
1.4 SSR分子标记EST-SSR引物设计采用Wang等[14]的方法, 并由上海捷瑞生物工程有限公司合成。先选取异色菊和菊花脑2个亲本进行第1轮引物筛选, 再从杂交后代中随机选取4个株系连同亲本完成第2轮引物筛选, 最后利用筛选出的33对引物(表 1)对亲本及其87株杂交后代进行全基因组分子扫描。SSR-PCR体系为:10×PCR Buffer 2.5 μL, Mg2+ 1.50 mmol·L-1, dNTPs 0.20 mmol·L-1, 正、反向引物各4 μL, Taq DNA聚合酶1.0 U, 模板DNA 35 ng。所用试剂均购自宝生物工程(大连)有限公司。
| 引物序号Primer code | 正向引物Forward primer(5′→3′) | 反向引物Reverse primer(5′→3′) | 重复碱基Repeat motif |
| 8 | CGTCACCCTTGGCTGTTAAT | GGTTGAAAGCAAATAGGGCA | TGA |
| 17 | TCATCTCTCAACCCACTATACCAA | GTTTCTGTGGTGGTGGTGGT | AC |
| 18 | TATCCCACTATGCCCACCAC | CACGAATTGGGTCTTTCTGG | CAC |
| 23 | CAATCTCATCATCCCCATCC | GTGGCGTGTTGTAGGTGTTG | CAA |
| 32 | TAACTACGCCGTTGACCCTT | CGGCCTCTGAGTCGTAGAAG | AAG |
| 34 | CCTAGTATCAAAGCTGCGAACA | CAATCGCGTTATCGTGTACC | AGATGG |
| 37 | CCACCACCTTCCTTCTTTGA | ATGGAAGTGCCCATGAGTTC | AC |
| 50 | TGTGGTCCCAATGAAAGTGA | CTCCATCAAATGGCGAAAAG | CCT |
| 53 | TCGAAGACAATCAGCACCTG | TAAGTGTTCTTCCAGCGCCT | ATG |
| 76 | TACACCACCTGCCTACCCTC | GATGTTACACGGCGAGACCT | AAGA |
| 88 | AAGGTTACATCGCTCCATCG | CACGAGTGTAGTCTTTCCACAA | TAT |
| 99 | ACGTTAGACCCGCGTTAAAA | CGTTTCAAAAGGCGTACAAA | TAATGG |
| 104 | AGACGAGAGGAGGGGATTGT | TCTTCGAAACCTCAGCCTGT | AAC |
| 123 | ATTTCCCATTGGTTCCTTCC | GGTTTTTGGGTGCAAAAGAA | GAAAGA |
| 130 | TTGATATGGAGGTTGGAGTGG | GGACGATTTAGTTCCGGTGA | TAA |
| 140 | TCCCTTCTCTATCTCCTCCTCC | GCAGGATGCATATGTGTTGG | ACC |
| 149 | CCTAGTATCAAAGCTGCGAACA | CAATCGCGTTATCGTGTACC | ATC |
| 155 | ACCTGTTTAGAAAACCGGGG | ATTTTGAATCGTGTCCGCTC | CTC |
| 162 | GCACCTCCACCACTACCACT | GTCCAGATCTACTCGGCCTG | CT |
| 166 | CATGTCACTTCCACGTCACC | TTCTTTTCTGCCTTTGGTGC | CA |
| 170 | GCCTTGAGGTGGTTGTTCTG | GGCAAGTCCGCGTAGTAGAA | TTGATT |
| 179 | GGTTCTTTGGATGGGAATGA | TCAAGACTCCCCCTCACATC | AATGGG |
| 180 | GGTTTTTGGATTGGCGACTA | AACTTGGCGTGTTTGATTCC | ACGT |
| 185 | GTTCAGCATCCTAGCCAAGC | CCACGATACCCCATGCTTAC | CA |
| 187 | TAGGCGAACGAGTGTCAAGA | GCCATCAGTCTCTCCCTCAG | CA |
| 193 | AACCATTTCCTTCACCCCTC | TTTCGAACTTTGCAGTCGTG | AT |
| 200 | CCCAGAGAAGCGTGAGATTT | TCCCCTGCTACTACCACCAC | GGT |
| 205 | TGTCGATCATCCCAAGTTTC | TTTAAGCCCTGGTACATCGG | CAA |
| 206 | TCCTGCTTTACCCACCATTT | GGTTGGTTACAATTCCGGTG | AACA |
| 212 | GGAAGAGGAGGAAGAGGACG | CGTTTAGGGCTGCTTCTTTG | AAGAGG |
| 214 | TGTCAAGCACAAATCGAGGA | GTTGGCAACCGAAATTCAAC | GA |
| 231 | TATAGGGGCCCCATCTTTTC | CACATGGAAAAAGAGCAGCA | CT |
| 234 | AAAACAAGGGAGAAGTGGGG | GCCGCCAATTCAAGATTTTA | TG |
根据SSR-PCR扩增产物的电泳结果, 在100~750 bp某个相同迁移率位置上有DNA条带的记为“1”, 没有DNA条带的记为“0”, 因不同原因造成带型不清或数据缺失的记为N(在后续软件分析中根据不同软件的录入数据要求转换成相应的记录形式)。
1.5 关联分析利用多位点关联分析软件包mrMLM[15-16]中的FASTmrEMMA、FASTmrMLM、ISIS EM-BLASSO、mrMLM、pKWmEB和pLARmEB 6种模型, 对耐旱相关性状进行关联检测。若阈值LOD>2.5则认为该标记位点与耐旱性有显著关联, 并计算该标记位点的表型解释率和表型效应值。
2 结果与分析 2.1 异色菊×菊花脑种间杂交F1代形态指标的干旱胁迫指数由表 2可知:各性状的干旱胁迫指数差异较大, 变异系数为10.99%~59.84%, 其中根长和株高的干旱胁迫指数变异系数较小, 分别为10.99%和18.99%;其他性状干旱胁迫指数变异系数较大, 为23.19%~59.84%。各性状的干旱胁迫指数呈连续性分布, 其中地上部干质量、地下部干质量、萎蔫指数和株高近似正态分布, 其他性状呈偏态分布(表 2, 图 1)。
| 指标 Index |
最小值 Minimum |
最大值 Maximum |
平均值 Mean |
标准差 SD |
变异系数/% CV |
偏度 Skewness |
峰度 Kurtosis |
正态性检验 P-value |
| SDW | 0.31 | 0.99 | 0.69 | 0.16 | 23.19 | -0.07 | -0.57 | 0.20 |
| RDW | 0.07 | 1.62 | 0.83 | 0.28 | 33.73 | 0.36 | 0.18 | 0.20 |
| SRW | 0.04 | 1.26 | 0.48 | 0.20 | 41.67 | 1.19 | 2.13 | 0.01 |
| RFW | 0.02 | 1.36 | 0.46 | 0.22 | 47.83 | 1.50 | 3.50 | 0.01 |
| RL | 0.61 | 1.17 | 0.91 | 0.10 | 10.99 | 0.12 | 0.62 | 0.16 |
| WI | 0.16 | 1.00 | 0.60 | 0.21 | 35.00 | -0.21 | -0.75 | 0.20 |
| PH | 0.34 | 1.09 | 0.79 | 0.15 | 18.99 | -0.55 | 0.55 | 0.20 |
| RWC | 0.01 | 2.04 | 0.54 | 0.31 | 57.41 | 1.38 | 4.76 | 0.00 |
| DRSR | 0.11 | 6.84 | 1.22 | 0.73 | 59.84 | 5.35 | 40.22 | 0.00 |
| FRSR | 0.01 | 2.46 | 0.99 | 0.37 | 37.37 | 0.78 | 3.44 | 0.17 |
| 注:1)SDW:地上部干质量(g)Shoot dry weight; RDW:地下部干质量(g)Root dry weight; SRW:地上部鲜质量(g)Shoot fresh weight; RFW:地下部鲜质量(g)Root fresh weight; RL:根长(cm)Root length; WI:萎蔫指数Wilting index; PH:株高(cm)Plant height; RWC:叶片相对含水量Relative water content; DRSR:干质量根冠比Dry root-shoot ratio; FRSR:鲜质量根冠比Fresh root-shoot ratio. 2)P-value>0.05视为符合正态分布。P-value>0.05 indicates a normal distribution.下同。The same as follows. | ||||||||
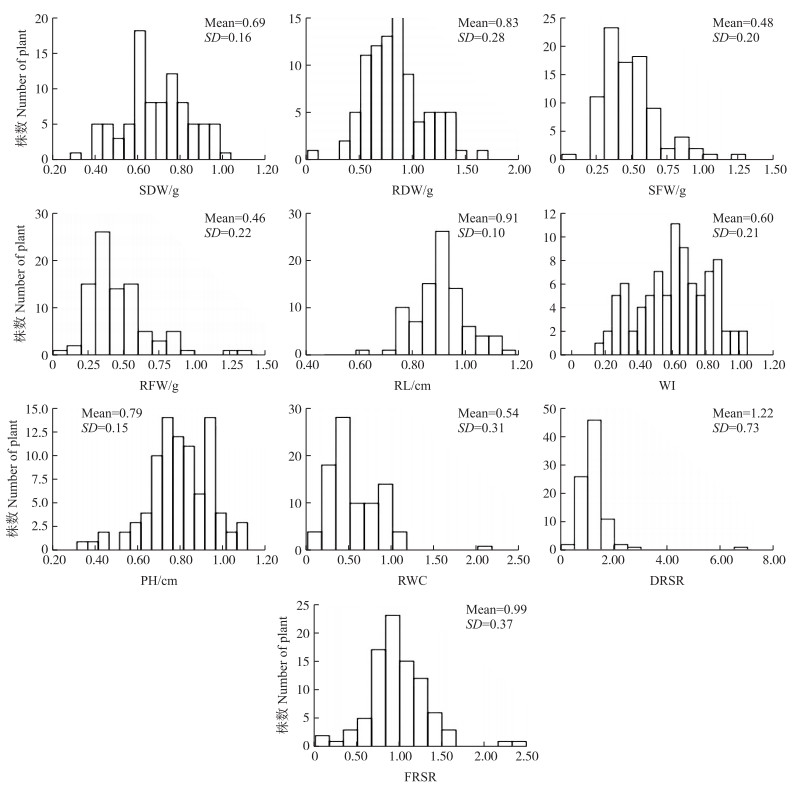
|
图 1 异色菊×菊花脑种间F1代群体形态指标干旱胁迫指数的频次分布 Fig. 1 Frequency of drought stress indices of morphological indicators ofthe interspecific C.dichrum×C.nankingense F1 hybrids |
相关性分析结果表明, 不同抗旱指标之间存在相关性(表 3)。其中9对抗旱指标间存在极显著相关性(P < 0.01)。例如, 地上部干质量与地下部干质量、地上部鲜质量、地下部鲜质量极显著正相关; 地下部干质量与地上部鲜质量、地下部鲜质量极显著正相关; 地上部鲜质量与地下部鲜质量极显著正相关。
| 指标Index | SDW | RDW | SFW | RFW | RL | WI | PH | RWC | DRSR |
| RDW | 0.466** | ||||||||
| SFW | 0.404** | 0.419** | |||||||
| RFW | 0.383** | 0.445** | 0.643** | ||||||
| RL | 0.013 | 0.054 | 0.038 | 0.134 | |||||
| WI | 0.180 | 0.014 | 0.179 | 0.204 | -0.001 | ||||
| PH | 0.207 | 0.234* | 0.268* | 0.208 | -0.116 | -0.020 | |||
| RWC | 0.127 | 0.148 | 0.268* | 0.359** | 0.118 | 0.499** | 0.117 | ||
| DRSR | -0.213* | 0.124 | -0.103 | 0.028 | 0.202 | 0.072 | -0.022 | 0.184 | |
| FRSR | -0.006 | 0.113 | -0.077 | 0.559** | 0.143 | -0.049 | -0.066 | 0.106 | 0.156 |
| Note:*P < 0.05, ** P < 0.01. | |||||||||
根据主成分分析方差大于1的原则, 筛选4个主成分为抗旱性评价的综合指标, 4个主成分的累计贡献率为67.57%(表 4)。由表 4和表 5可知:第1主成分解释了28.49%的表型变异, 其中负载量大于0.6的因子为地下部干质量(0.67)、地上部鲜质量(0.76)和地下部鲜质量(0.85);第2主成分解释了15.95%的表型变异, 其中负载量大于0.6的因子为干质量根冠比(0.65)和鲜质量根冠比(0.60);第3主成分的贡献率为12.96%, 其负载量较大的因子是萎焉指数(0.76);第4主成分的贡献率为10.17%, 其负载量较大的因子是干质量根冠比(0.60)。
| 主成分 Principal component |
方差 Variance |
贡献率/% Contribution rate |
累计贡献率/% Cumulative contributive rate |
| 1 | 2.85 | 28.49 | 28.49 |
| 2 | 1.60 | 15.95 | 44.44 |
| 3 | 1.30 | 12.96 | 57.40 |
| 4 | 1.01 | 10.17 | 67.57 |
| 指标 Index |
第1主成分 The first principal component |
第2主成分 The second principal component |
第3主成分 The third principal component |
第4主成分 The fourth principal component |
| RL | 0.14 | 0.50 | -0.19 | 0.26 |
| PH | 0.38 | -0.37 | -0.03 | 0.44 |
| SDW | 0.64 | -0.39 | -0.03 | -0.09 |
| RDW | 0.67 | -0.14 | -0.25 | 0.32 |
| SFW | 0.76 | -0.28 | 0.00 | 0.04 |
| RFW | 0.85 | 0.18 | -0.26 | -0.25 |
| WI | 0.38 | 0.19 | 0.76 | -0.22 |
| DRSR | 0.04 | 0.65 | 0.06 | 0.60 |
| FRSR | 0.29 | 0.60 | -0.50 | -0.42 |
| RWC | 0.55 | 0.37 | 0.54 | 0.01 |
根据主成分分析筛选出的抗旱指标, 得到平均隶属函数值的变异范围为0.20~0.65, 变异系数为25.64%(图 2)。基于耐旱平均隶属函数值的聚类分析将异色菊、菊花脑及其杂交后代聚为4大类(表 6):第Ⅰ类为不抗旱, 共14个株系, 平均隶属函数值为0.27;第Ⅱ类为低抗旱, 共43个株系, 平均隶属函数值为0.36;第Ⅲ类为抗旱, 共24个株系, 平均隶属函数值为0.46;第Ⅳ类为强抗旱, 共8个株系, 平均隶属函数值为0.61;异色菊抗旱性隶属函数值为0.62, 表现为强耐旱, 菊花脑抗旱性隶属函数值为0.39, 表现为低抗旱。抗旱性最强的为57号株系, 平均隶属函数值为0.65, 抗旱性最差为60号株系, 平均隶属函数值为0.20。
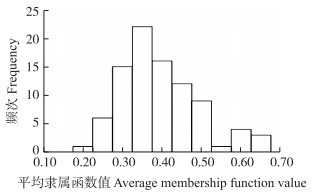
|
图 2 菊花脑、异色菊及其F1代群体耐旱性平均隶属函数值的频次分布 Fig. 2 Frequency distribution of the average membership function value for drought tolerance ofC.dichrum, C.nankingense and their interspecific F1 hybrids |
| 类型 Type |
亲本及F1代编号 Code of parents and the F1 hybrids |
份数 Number |
变异幅度 Range |
均值 Average |
| 不抗旱 No drought tolerance |
60、11、230、210、139、160、242、207、105、88、197、31、39、151 | 14 | 0.20~0.30 | 0.27 |
| 低抗旱 Low drought tolerance |
126、79、162、10、5、190、145、41、184、36、154、166、220、234、131、14、21、19、206、202、136、250、178、123、30、198、180、171、107、137、111、158、29、244、140、176、菊花脑C.dichrum、191、94、147、164、224、218 | 43 | 0.31~0.41 | 0.36 |
| 抗旱 Moderate drought tolerance |
149、175、56、46、238、117、236、214、148、192、228、246、200、18、174、194、208、144、130、129、113、170、15、109 | 24 | 0.41~0.52 | 0.46 |
| 强抗旱 Strong drought tolerance |
195、108、248、146、异色菊C.nankingense、227、75、57 | 8 | 0.55~0.65 | 0.61 |
33对SSR引物组合在异色菊、菊花脑及其87个杂交后代中共扩增得到198条带, 其中多态性条带170条, 多态性比率为85.8%, 平均每对引物扩增出5条多态性条带。相似系数为0.45~0.86, 平均值为0.7。说明供试亲本及其杂种在DNA水平上存在一定的遗传差异。
2.5 耐旱相关性状的多位点关联分析利用mrMLM界面包中的6种模型分别对相关耐旱性状进行关联分析, 结果(表 7)显示:当阈值LOD>2.5时, 共检测到4个SSR位点与3个数量性状(地上部干质量、地下部鲜质量和萎焉指数)显著关联。从地上部干质量性状看, 5种模型共关联到2个位点, 其中mrMLM和pLARmEB模型均检测到SSR-23-208位点, 其余模型则检测到SSR-8-329位点。对于地下部鲜质量, FASTmrMLM、FASTmrEMMA、pLARmEB和pKWmEB这4种模型具有较强的一致性, 均只检测到SSR-166-469位点。pKWmEB模型在萎蔫指数性状上检测到了1个显著位点SSR-179-355。4个关联位点的表型变异解释率为4.03%~15.11%。
| 性状Trait | 模型Model | 标记Marker | LOD | ai | r2 |
| SDW | mrMLM | SSR-23-208 | 2.55 | 0.080 | 11.83 |
| FASTmrMLM | SSR-8-329 | 2.69 | 0.052 | 4.03 | |
| pLARmEB | SSR-8-329 | 3.24 | 0.053 | 4.18 | |
| pLARmEB | SSR-23-208 | 2.59 | 0.051 | 4.82 | |
| pKWmEB | SSR-8-329 | 2.69 | 0.052 | 11.32 | |
| ISIS EM-BLASSO | SSR-8-329 | 2.69 | 0.052 | 4.12 | |
| RFW | FASTmrMLM | SSR-166-469 | 3.08 | 0.050 | 8.96 |
| FASTmrEMMA | SSR-166-469 | 3.08 | 0.097 | 7.98 | |
| pLARmEB | SSR-166-469 | 5.49 | 0.055 | 10.82 | |
| pKWmEB | SSR-166-469 | 3.97 | 0.049 | 15.11 | |
| WI | pKWmEB | SSR-179-355 | 2.97 | -0.049 | 7.69 |
| 注:LOD:阈值Threshold; ai:QTN效应QTN effect; r2:表型变异解释率Explained phenotypic variation. | |||||
干旱是影响菊花生长最重要的非生物逆境之一。减少干旱对菊花生产造成的损失, 最有效的途径是选育和推广耐旱品种, 因此, 充分发掘其耐旱种质、选育耐旱优良品种是目前国内外菊花育种的重要目标。近年来, 国内外学者以不同作物为研究对象, 从不同角度提出了更加全面的耐旱性鉴定方法, 普遍认为采用多指标多方法相结合的方式评价植物耐旱性更科学、客观, 各指标权重和综合评价是耐旱评价的关键。王宝祥等[17]以91份国内外水稻资源为材料, 采用水作和旱作2种栽培模式考察不同水稻资源抽穗期和成熟期耐旱性差异, 并根据各项指标胁迫系数的隶属函数值将供试品种分为3类:强耐旱、耐旱和敏感; 洪双等[18]利用隶属函数值法评价了107份甘蓝型油菜微核心种质耐旱性, 并筛选出2份高耐旱种质; 孙静[19]和翟丽丽等[20]通过盆栽模拟自然干旱的方法, 利用根冠比、株高、叶绿素相对含量以及地上部和地下部生物量等相关性状的胁迫指数和隶属函数法评价了菊花品种的抗旱性, 发现不同品种的抗旱性差异较大。本试验通过对抗旱性有关的10个指标进行主成分分析, 筛选出地上部干质量、地下部干质量、地上部鲜质量、地下部鲜质量、萎焉指数和干质量根冠比等指标与抗旱性密切相关, 基于平均隶属函数值的聚类分析将异色菊×菊花脑种间杂交F1代群体抗旱性分为不抗旱、低抗旱、抗旱和强抗旱4类。
种间远缘杂交是实现优良农艺性状从一个物种向另一个物种转移的有效途径, 也是作物遗传改良的重要途径[21]。Li等[22]通过远缘杂交成功将野生小麦具有的强适应型和抗条锈病特性导入栽培小麦中。Chen等[23]利用远缘杂交成功开发新的耐盐水稻Spartina种质。在菊花栽培品种的遗传改良研究中, 通过远缘杂交把野生种质资源特有的优良性状进行遗传重组, 育成系列高抗(耐)性菊花新品种, 在抗蚜虫性、花期及株型等育种方面取得了突破性进展[24]。本研究通过将强抗旱的异色菊和低抗旱的菊花脑进行种间远缘杂交, 87个杂交后代发生广泛的性状分离, 鉴定获得7个强抗旱株系和24个抗旱株系。这些强抗旱和抗旱F1株系可作为优异耐旱育种中间材料用于后期菊花耐旱性改良。
分子标记已成为作物育种的重要辅助选择手段, 被广泛应用于作物群体遗传连锁图谱的构建、品种鉴定、基因定位和遗传多样性分析中[25]。黄金凤等[26]通过SSR标记分析‘寒富’ב岳帅’杂交后代的遗传多样性, 20条SSR引物共扩增出54条带, 其中多态性条带49条, 多态性比率为90.7%, 表明杂交组合发生基因分离重组; 李玮瑜等[27]通过SSR标记探讨了亲本及后代群体间的遗传特性和亲缘关系; 杨旭等[28]利用SSR分子标记技术成功鉴别野生茄和栽培茄杂交后代。本研究中, 利用33对SSR引物组合在异色菊、菊花脑及其87个杂交F1代株系中共扩增得到170多态性条带, 多态性比率为85.8%, 说明该种间杂交群体的遗传多样性水平较高。
本研究中, 通过mrMLM软件中6种多位点关联分析方法共检测到4个SSR标记与地上部干质量、地上部鲜质量和萎蔫指数等耐旱相关性状显著关联。耐旱关联标记较少的原因主要是由于多态性SSR分子标记数据样本偏小, 而且多位点关联分析进行多基因背景控制, 降低了假阳性。在今后研究中, 将进一步通过基于高通量SNP分子标记的多位点关联分析挖掘耐旱性相关的优异等位变异。
| [1] |
Lobell D B, Burke M B, Tebaldi C, et al. Prioritizing climate change adaptation needs for food security in 2030[J]. Science, 2008, 319(5863): 607-610. DOI:10.1126/science.1152339 |
| [2] |
Millet E J, Welcker C, Kruijer W, et al. Genome-wide analysis of yield in Europe:allelic effects vary with drought and heat scenarios[J]. Plant Physiology, 2016, 172: 749-764. |
| [3] |
Liu Q, Xu K, Zhong M, et al. Overexpression of a novel chrysanthemum Cys2/His2-type zinc finger protein gene DgZFP3 confers drought tolerance in tobacco[J]. Biotechnology Letters, 2013, 35(11): 1953-1959. DOI:10.1007/s10529-013-1289-0 |
| [4] |
Yang Y, Ma C, Xu Y, et al. A zinc finger protein regulates flowering time and abiotic stress tolerance in chrysanthemum by modulating gibberellin biosynthesis[J]. The Plant Cell, 2014, 26(5): 2038-2054. DOI:10.1105/tpc.114.124867 |
| [5] |
刘长命, 赵颖. 干旱胁迫对药用菊花叶片微结构和叶绿素的影响[J]. 科技广场, 2017(11): 26-29. Liu C M, Zhao Y. Effects of drought stress on leaf microstructure and chlorophyll of medicinal chrysanthemum[J]. Science Mosaic, 2017(11): 26-29 (in Chinese with English abstract). |
| [6] |
杨若鹏, 张祖芸. 干旱胁迫对菊花生理指标的影响[J]. 红河学院学报, 2017, 15(2): 126-128. Yang R P, Zhang Z Y. Effects of drought stress on physiological and biochemical indexes of chrysanthemum[J]. Journal of Honghe University, 2017, 15(2): 126-128 (in Chinese with English abstract). |
| [7] |
Li P, Su J, Guan Z, et al. Association analysis of drought tolerance in cut chrysanthemum(Chrysanthemum morifolium Ramat.) at seedling stage[J]. 3 Biotech, 2018, 8: 226. |
| [8] |
Zhao Q, Zhong M, He L, et al. Overexpression of a chrysanthemum transcription factor gene DgNAC1 improves drought tolerance in chrysanthemum[J]. Plant Cell, Tissue and Organ Culture(PCTOC), 2018, 135(1): 119-132. |
| [9] |
Nie J, Wen C, Xi L, et al. The AP2/ERF transcription factor CmERF053 of chrysanthemum positively regulates shoot branching, lateral root, and drought tolerance[J]. Plant Cell Reports, 2018, 37(7): 1049-1060. DOI:10.1007/s00299-018-2290-9 |
| [10] |
Gao W, He M, Liu J, et al. Overexpression of Chrysanthemum lavandulifolium ClCBF1 in Chrysanthemum morifolium 'White Snow' improves the level of salinity and drought tolerance[J]. Plant Physiology and Biochemistry, 2018, 124: 50-58. DOI:10.1016/j.plaphy.2018.01.004 |
| [11] |
Sun C Q, Chen F D, Teng N J, et al. Interspecific hybrids between Chrysanthemum grandiflorum(Ramat.) Kitamura and C.indicum(L.) Des Moul. and their drought tolerance evaluation[J]. Euphytica, 2010, 174(1): 51-60. DOI:10.1007/s10681-009-0117-z |
| [12] |
王艳慧, 高洪文, 王赞, 等. 胶质苜蓿种质资源苗期抗旱性综合评价[J]. 植物遗传资源学报, 2009, 10(3): 443-447. Wang Y H, Gao H W, Wang Z, et al. Study and evaluation of drought resistance capacity of Medicago glutinosa germplasm resources at seedling stage[J]. Journal of Plant Genetic Resources, 2009, 10(3): 443-447 (in Chinese with English abstract). |
| [13] |
Porebski S, Bailey L G, Baum B R. Modification of a CTAB DNA extraction protocol for plants containing high polysaccharide and polyphenol components[J]. Plant Molecular Biology Reporter, 1997, 15(1): 8-15. DOI:10.1007/BF02772108 |
| [14] |
Wang H, Jiang J, Chen S, et al. Next-generation sequencing of the Chrysanthemum nankingense(Asteraceae) transcriptome permits large-scale unigene assembly and SSR marker discovery[J]. PLoS One, 2013, 8(4): e62293. DOI:10.1371/journal.pone.0062293 |
| [15] |
Wang S B, Feng J Y, Ren W L, et al. Improving power and accuracy of genome-wide association studies via a multi-locus mixed linear model methodology[J]. Scientific Reports, 2016, 6(1): 19444. DOI:10.1038/srep19444 |
| [16] |
冯建英, 温阳俊, 张瑾, 等. 植物关联分析方法的研究进展[J]. 作物学报, 2016, 42(7): 945-956. Feng J Y, Wen Y J, Zhang J, et al. Advances on methodologies for genome-wide association studies in plants[J]. Acta Agronomica Sinica, 2016, 42(7): 945-956 (in Chinese with English abstract). |
| [17] |
王宝祥, 余剑锋, 徐波, 等. 水稻种质资源耐旱性鉴定与评价[J]. 北方农业学报, 2018, 46(5): 1-8. Wang B X, Yu J F, Xu B, et al. Identification and evaluation of drought tolerance for rice germplasm resources[J]. Journal of Northern Agriculture, 2018, 46(5): 1-8 (in Chinese with English abstract). DOI:10.3969/j.issn.2096-1197.2018.05.01 |
| [18] |
洪双, 李浩, 许鲲, 等. 甘蓝型油菜微核心种质耐旱鉴定与评价指标筛选[J]. 中国油料作物学报, 2018, 40(2): 209-217. Hong S, Li H, Xu K, et al. Identification of a mini-core collection of Brassica napus accessions for drought tolerance and selection of evaluation indices[J]. Chinese Journal of Oil Crop Sciences, 2018, 40(2): 209-217 (in Chinese with English abstract). |
| [19] |
孙静.切花菊抗旱性评价及抗旱机理研究[D].南京: 南京农业大学, 2012. Sun J. Drought tolerance evaluation and mechanisms involved in drought tolerance of cut chrysanthemum[D]. Nanjing: Nanjing Agricultural University, 2012(in Chinese with English abstract). |
| [20] |
翟丽丽, 房伟民, 陈发棣, 等. 国庆小菊观赏性和耐旱、涝性的综合评价[J]. 中国农业科学, 2012, 45(4): 734-742. Zhai L L, Fang W M, Chen F D, et al. Comprehensive appraisal of the ornamental value and drought and flooding resistance of Guoqing chrysanthemum with small inflorescences[J]. Scientia Agricultura Sinica, 2012, 45(4): 734-742 (in Chinese with English abstract). DOI:10.3864/j.issn.0578-1752.2012.04.014 |
| [21] |
蔡小彦, 王玉红, 许艳超, 等. 棉花种间远缘杂交及F1真假杂种的SSR鉴定方法研究[J]. 中国棉花, 2018, 45(11): 6-9, 44. Cai X Y, Wang Y H, Xu Y C, et al. Identification of cotton interspecific hybrids with SSR markers[J]. China Cotton, 2018, 45(11): 6-9, 44 (in Chinese). |
| [22] |
Li D, Long D, Li T, et al. Cytogenetics and stripe rust resistance of wheat-Thinopyrum elongatum hybrid derivatives[J]. Molecular Cytogenetics, 2018, 11(1): 16. DOI:10.1186/s13039-018-0366-4 |
| [23] |
Chen Q, Chen B, Lu H, et al. Innovation on distant hybridization of saline-tolerant mud flat Spartina and rice germplasm[J]. Asian Agricultural Research, 2016, 8(11): 87-91, 94. |
| [24] |
陈发棣, 陈素梅, 房伟民, 等. 菊花优异种质资源挖掘与种质创新研究[J]. 中国科学基金, 2016, 30(2): 112-115. Chen F D, Chen S M, Fang W M, et al. Study on excavation and germplasm innovation of excellent germplasm resources of chrysanthemum[J]. Bulletin of National Natural Science Foundation of China, 2016, 30(2): 112-115 (in Chinese with English abstract). |
| [25] |
时颖, 杨学东, 龙显静, 等. 优质速生抗虫紫花苜蓿多元杂交后代的ISSR分析[J]. 贵州畜牧兽医, 2018, 42(5): 27-32. Shi Y, Yang X D, Long X J, et al. ISSR analysis of hybrid progeny of good quality, fast-growing and insect-resistant Medicago multiple parents cross[J]. Guizhou Journal of Animal Husbandry and Veterinary Medicine, 2018, 42(5): 27-32 (in Chinese with English abstract). DOI:10.3969/j.issn.1007-1474.2018.05.008 |
| [26] |
黄金凤, 吕天星, 王冬梅, 等. '寒富'×'岳帅'苹果杂交后代遗传多样性的SSR分析[J]. 分子植物育种, 2015, 13(5): 1040-1044. Huang J F, Lü T X, Wang D M, et al. Genetic diversity of hybrid progenies derived from apple cross of 'Hanfu'×'Yueshuai' analyzed by SSR[J]. Molecular Plant Breeding, 2015, 13(5): 1040-1044 (in Chinese with English abstract). DOI:10.13271/j.mpb.013.001040 |
| [27] |
李玮瑜, 孙毅, 李贵全, 等. 晋大62×诱处4号杂交后代群体遗传多样性分析[J]. 山西农业大学学报(自然科学版), 2009, 29(1): 16-18, 49. Li W Y, Sun Y, Li G Q, et al. Analysis on genetic diversity for crossbred of soybean Jinda62×Mutagenic Treatment No.4(MT4)[J]. Journal of Shanxi Agricultural University(Natural Science Edition), 2009, 29(1): 16-18, 49 (in Chinese with English abstract). DOI:10.3969/j.issn.1671-8151.2009.01.005 |
| [28] |
杨旭, 刘飞, 霍秋月, 等. SSR分子标记鉴定栽培茄与野生茄杂种F1研究[J]. 东北农业大学学报, 2017, 48(10): 20-27. Yang X, Liu F, Huo Q Y, et al. Identification of interspecific F1 hybrid between Solanum melongena and wild relatives by using SSR molecular marker technology[J]. Journal of Northeast Agricultural University, 2017, 48(10): 20-27 (in Chinese with English abstract). DOI:10.3969/j.issn.1005-9369.2017.10.003 |




