文章信息
- 王敏, 王玮, 吕青骎, 徐幸莲, 周光宏, 李春保
- WANG Min, WANG Wei, LÜ Qingqin, XU Xinglian, ZHOU Guanghong, LI Chunbao
- 间接竞争ELISA方法快速检测猪肉组织中的氯丙嗪
- Rapid detection of chlorpromazine in pork tissue by indirect competitive ELISA
- 南京农业大学学报, 2020, 43(1): 172-177
- Journal of Nanjing Agricultural University, 2020, 43(1): 172-177.
- http://dx.doi.org/10.7685/jnau.201812051
-
文章历史
- 收稿日期: 2018-12-29
兽药残留作为动物性食品中最重要的污染源之一, 与动物性食品安全息息相关。氯丙嗪(CPZ)属于一种典型的吩噻嗪类抗精神病药物, 主要应用于治疗精神疾病[1-3], 因其较强的镇静和止吐作用也被用于兽医临床[4-5]。农场动物的饲料中添加CPZ可起到镇静催眠、增重催肥、缩短出栏时间的作用, 同时可降低动物的应激反应和维持生命体征的稳定, 减少动物长途运输过程中的失重和死亡率, 防止肉品质降低[6-7]。但是CPZ残留于动物产品中, 会导致食用者发生黄疸病、白细胞减少症和粒细胞缺乏症等不良反应, 对人类健康产生不利影响[8-11]。欧洲药品评估局和联合国粮农组织/世界卫生组织食品添加剂联合专家委员会在1991年建议CPZ不得用于食用性动物中。欧盟早在1997年颁布的法令(EC)NO.17/97就已明令禁止在饲料中添加CPZ。日本也明确规定CPZ不得在动物源食品中检出。2002年, 我国《动物性食品中兽药最高残留限量》(农业部第235号公告)附录3规定, CPZ药物允许用作治疗, 但不得在动物性食品中检出。可是仍有不法商贩为谋求利益, 在食用动物饲料中非法添加CPZ, 因此, 亟需建立一种简单、快速、有效的CPZ残留检测方法。
目前, 相比其他抗精神病药物, CPZ的残留检测方法仍处于初步应用阶段[12], 其检测方法主要分为2大类。一类为仪器法, 如液相微萃取-液相色谱法[13]、液相色谱-库伦检测法[14]、高效液相色谱法[15]、液相色谱-质谱法[16]、气相色谱-质谱法等[17]。这些方法需要在专业实验室内进行, 且样品前处理繁琐, 检测时间长, 仪器设备昂贵, 需要专业人员操作, 一次只能分析少量样品, 因此这类方法不适合筛选测试。另一类是以抗体、抗原的特异性反应为基本原理建立起来的免疫学快速分析方法, 此类方法具有速度快、方便快捷、高灵敏度和低检测限等优点。酶联免疫吸附法(ELISA)是目前应用最多且最经典的免疫学方法, 特别适用于分析检测大量样品, 由于特异性强, 灵敏度高, 操作简单, 使得该技术在药物残留检测领域得到广泛应用[18-20]。本研究旨在建立一种简便、快速、准确检测猪肉中CPZ的间接竞争ELISA方法, 为畜禽肉中CPZ快速检测提供试验基础, 并应用于动物源食品药物残留的检测。
1 材料与方法 1.1 材料和试剂生鲜猪肉购于南京某超市, 经超高效液相色谱-串联质谱(UPLC-MS/MS)分析为CPZ阴性样品。
盐酸氯丙嗪(CPZ)、盐酸异丙嗪(PMZ)、盐酸硫利哒嗪(TDZ)、乙酰丙嗪马来酸盐(APZ)、奋乃静(PCZ)、氟哌啶醇(Hal)和盐酸氟奋乃静(FPZ)均购于德国Dr. Ehrenstorfer公司; 氯丙嗪-牛血清蛋白完全抗原(CPZ-BSA)、鼠抗CPZ单克隆抗体, 均由本中心的实验室自制; 辣根过氧化物酶(HRP)标记羊抗鼠免疫球蛋白(IgG)、四甲基联苯胺(TMB)显色液和终止液均购于美国Cell Signaling Technology公司; 其他试剂均为国产分析纯。
1.2 鼠抗CPZ单克隆抗体的鉴定纯度鉴定:利用SDS-PAGE电泳检测纯化后的鼠抗CPZ单克隆抗体, 然后进行蛋白质条带灰度扫描, 并用Quantity One 4.6凝胶分析软件进行纯度鉴定。
交叉性测定:采用间接竞争ELISA法。将PMZ、TDZ、APZ、PCZ、HAL和FPZ分别包被在酶标板上, 将鼠抗CPZ单克隆抗体作为一抗, 分别以PBS缓冲液(0.01 mol·L-1, pH7.4)和CPZ标准品作为阴性对照和阳性对照, 用HRP标记羊抗鼠IgG为二抗, 室温孵育1 h, 洗涤后用TMB试剂显色, 于酶标仪(美国Bio-Tek公司)450 nm处测定吸光值, 计算交叉反应率(CR)。CR=IC50(CPZ)/IC50(结构类似物)×100%, 其中IC50为半抑制浓度。
1.3 间接竞争ELISA方法的建立1) 抗原包被:在96孔板中每孔加入100 μL稀释好的CPZ-BSA完全抗原, 37 ℃包被2 h后, 弃包被液, PBST(含0.05% Tween-20的PBS缓冲液)洗涤3次, 拍干。2)封闭:每孔加入封闭液(1% BSA)200 μL, 37 ℃孵育2 h后, 弃封闭液, PBST洗涤3次, 拍干。3)竞争结合:先将不同浓度的CPZ标准品溶液依次加入酶标板中, 每孔100 μL, 再加入鼠抗CPZ单克隆抗体, 每孔100 μL, 37 ℃孵育1 h后弃溶液, PBST洗涤3次, 拍干。4)加酶标二抗:每孔加入100 μL稀释至工作浓度的HRP标记羊抗鼠IgG, 37 ℃孵育1 h后弃溶液, PBST洗涤3次, 拍干。5)显色:加入TMB试剂, 每孔100 μL, 室温避光显色15 min; 加终止液(2 mol·L-1 H2SO4溶液), 每孔50 μL, 室温反应5 min, 用酶标仪测定各孔的D450值。
1.4 间接竞争ELISA方法检测条件的优化1) 最佳抗原包被稀释倍数和抗体稀释浓度的确定:采用棋盘滴定法。抗原包被稀释倍数分别为1 : 250、1 : 500、1 : 1 000、1 : 2 000、1 : 5 000、1 : 10 000、1 : 20 000, 抗体稀释浓度分别为10.00、5.00、2.00、1.00、0.50、0.25、0.125和0 μg·mL-1。按照1.2节的步骤操作后测定吸光值, 以D450值为1.0左右时对应的抗原包被稀释倍数和抗体稀释浓度为最佳工作条件。
2) 酶标二抗稀释倍数的确定:在确定的最佳抗原包被稀释倍数和抗体稀释浓度基础上, 将HRP标记羊抗鼠IgG以1 : 500、1 : 1 000、1 : 2 000、1 : 4 000的稀释倍数进行对比试验, 选择D450值在1.0左右的酶标二抗稀释倍数为最佳稀释倍数。
1.5 标准曲线的制作及线性范围的确定将CPZ标准品稀释成10倍系列浓度梯度(0~1 000 ng·mL-1), 在上述最佳条件下, 进行间接竞争ELISA方法测定, 并制作标准曲线。以lgX为横坐标(X为竞争抗原浓度), 以各浓度孔的D450值为纵坐标绘制标准曲线。选择标准曲线呈明显相关的区段, 以lgX为横坐标, 以抑制率为纵坐标绘制标准曲线计算IC50并确定线性范围。抑制率=D/D0×100%, 其中D为加CPZ时的吸光值, D0为空白孔的吸光值。
1.6 方法评价1) 灵敏度测定:灵敏度以检测限(limit of detection, LOD)表示, 按1.2节的检测步骤, 于96孔ELISA酶标板随机选择10个孔进行零标准品测试, 计算D450值的平均值(D0)和标准差(SD)。按照公式LOD=D0+3SD计算, 在标准曲线上算出对应的CPZ质量浓度为此方法的检测下限, 即灵敏度。2)精密度测定:以孔间变异系数及板间变异系数表示该方法的精确度。选择低、中、高3种浓度(1.25、5.00、20.00 ng·mL-1)的CPZ标准品溶液, 同一样品测定2个批次, 每个批次重复测定32次, 计算批内和批间变异系数(CV)。CV=标准差(SD)/平均值(x)×100%。3)准确度测定:以加标回收率来表示该方法的准确度。将不同浓度(1.0、2.0、5.0、10.0 ng·mL-1)的CPZ标准品溶液添加至阴性猪肉糜中, 作为待测样品, 参照1.2节方法检测待测样品中CPZ浓度, 并根据公式计算回收率。回收率=测量质量浓度/实际质量浓度×100%, 以阴性猪肉糜作为空白对照。
2 结果与分析 2.1 鼠抗CPZ单克隆抗体的纯度鉴定将纯化后的鼠抗CPZ单克隆抗体进行SDS-PAGE电泳, 结果(图 1)显示, 纯化后的抗体纯度较高, 能达到95%以上。纯化的CPZ单克隆抗体有2个条带, 一条是蛋白质相对分子质量约为25×103的轻链, 另一条是相对分子质量约为55×103的重链。

|
图 1 氯丙嗪(CPZ)单克隆抗体SDS-PAGE电泳图 Fig. 1 Analysis of chlorpromazine(CPZ)monoclonal antibody by SDS-PAGE 1.蛋白质相对分子质量标准Protein molecular weight marker; 2.鼠抗CPZ单克隆抗体Mouse anti-CPZ monoclonal antibody. |
通过间接竞争ELISA方法, 检测鼠抗CPZ单克隆抗体与6种其他结构类似物的交叉反应情况。结果(表 1)显示, 该抗体仅与奋乃静有轻微交叉反应, 交叉反应率为5.74%, 与其他5种结构类似物的交叉反应率均小于0.77%, 说明检测中不容易出现交叉反应。
| 反应标准品 Reaction standard |
半抑制浓度(IC50)/(ng·mL-1)
Half maximal inhibitory concentration |
交叉反应率/%
Cross reaction rate |
| 氯丙嗪Chlorpromazine | 15.38 | 100.00 |
| 奋乃静Prochlorperazine | 267.90 | 5.74 |
| 乙酰丙嗪马来酸盐Acepromazine maleate salt | >2 000 | < 0.77 |
| 盐酸硫利达嗪Thioridazine hydrochloride | >2 000 | < 0.77 |
| 盐酸异丙嗪Promethazine hydrochloride | >2 000 | < 0.77 |
| 氟哌啶醇Haloperidol | >2 000 | < 0.77 |
| 盐酸氟奋乃静Fluphenazine hydrochlorid | >2 000 | < 0.77 |
由表 2可知:当抗原包被稀释倍数和抗体稀释浓度增大时, 吸光值表现为降低趋势。确定抗原包被(CPZ-BSA)的最佳稀释倍数为1 : 10 000, 对应的抗体最佳稀释浓度为1 μg·mL-1。
| 抗体稀释浓度/(μg·mL-1)
Antibody dilution concentration |
抗原稀释倍数Dilution multiple of antigen coating | ||||||
| 1:250 | 1:500 | 1:1 000 | 1:2 000 | 1:5 000 | 1:10 000 | 1:20 000 | |
| 10.00 | 2.865 | 2.658 | 2.557 | 2.086 | 1.797 | 1.528 | 1.142 |
| 5.00 | 2.871 | 2.615 | 2.643 | 1.924 | 1.610 | 1.421 | 1.103 |
| 2.00 | 2.832 | 2.703 | 2.615 | 2.039 | 1.762 | 1.201 | 1.146 |
| 1.00 | 2.890 | 2.681 | 2.586 | 1.818 | 1.294 | 1.026 | 1.115 |
| 0.50 | 2.853 | 2.626 | 2.541 | 1.976 | 1.352 | 1.218 | 0.911 |
| 0.25 | 2.831 | 2.607 | 2.624 | 2.031 | 1.225 | 0.865 | 0.649 |
| 0.125 | 2.847 | 2.631 | 2.645 | 1.502 | 1.143 | 0.774 | 0.485 |
| 0 | 0.106 | 0.076 | 0.059 | 0.044 | 0.027 | 0.015 | 0.011 |
当HRP标记羊抗鼠IgG进行不同稀释倍数稀释时, 随着酶标二抗稀释倍数的增加, D450值由1.647逐渐减小至0.425。当酶标二抗以1 : 1 000稀释时, D450值为1.012, 即为酶标二抗的最佳稀释倍数。
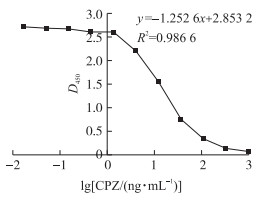
2.4 间接竞争ELISA标准曲线及线性范围的确定由图 2可见:当竞争抗原CPZ的浓度为1.37~111.11 ng·mL-1时, 标准曲线中呈良好的线性关系, IC50为15.38 ng·mL-1。
|
图 2 CPZ间接竞争ELISA标准曲线 Fig. 2 Standard curve of indirect competitive ELISA for CPZ |
由表 3可见: D0为0.994, SD为0.002, 计算得出LOD为0.51 ng·mL-1, 即灵敏度为0.51 ng·mL-1。
| 指标 Index |
CPZ零标准品CPZ zero standard | D0 | SD | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |||
| D450 | 0.992 | 0.994 | 0.996 | 0.993 | 0.999 | 0.992 | 0.997 | 0.991 | 0.994 | 0.995 | 0.994 | 0.002 |
由表 4可计算得出:间接竞争ELISA方法第1批次批内CV平均为6.58%, 第2批次批内CV平均为7.35%, 总的批内CV平均为6.97%, 总的批间CV平均为7.01%。本检测方法批内与批间的变异系数均小于10%, 说明该方法精密度较高, 重复性较好。
| ρ(CPZ)/(ng·mL-1) | 第1批(n=32)The first group | 第2批(n=32)The second group | |||||
| 平均值/(ng·mL-1) Mean value |
标准差 SD |
变异系数/% CV |
平均值/(ng·mL-1) Mean value |
标准差SD | 变异系数/% CV |
||
| 20.00 | 19.07 | 1.31 | 6.89 | 19.53 | 1.36 | 6.98 | |
| 5.00 | 5.35 | 0.41 | 7.61 | 5.35 | 0.37 | 6.91 | |
| 1.25 | 1.22 | 0.06 | 5.24 | 1.20 | 0.10 | 8.17 | |
由表 5可见:添加CPZ的质量浓度为1.0~10.0 ng·mL-1时, 回收率为96.90%~118.79%, 说明该方法的准度高, 稳定性好。随样品中CPZ质量浓度的增加, 回收率变异系数减小, 精确度提高, 表明本试验的间接竞争ELISA方法能够满足检测要求。
| 加标质量浓度/(ng·mL-1) Added concentration |
检出值/(ng·mL-1) Founded concentration |
回收率/% Recovery |
变异系数/% CV |
| 1.0 | 1.19 | 118.79 | 8.86 |
| 2.0 | 2.04 | 102.01 | 8.89 |
| 5.0 | 5.22 | 104.34 | 8.11 |
| 10.0 | 9.69 | 96.90 | 7.22 |
目前, 对CPZ残留的检测主要集中在食用性动物领域, 其中猪肉最为广泛。因此, 各国针对CPZ残留制定了相应的标准, 尽管我国食品安全抽检从未放松对CPZ的监测, 但近年来在猪肉中检测出CPZ残留的现象仍屡禁不止[21]。ELISA方法现已成为兽药残留最理想的检测技术之一, 而建立高灵敏ELISA方法的关键在于制备出高效价、高特异性的CPZ单克隆抗体。本研究在已制备的CPZ-BSA和鼠抗CPZ单克隆抗体的基础上, 鉴定抗体纯度能达到95%以上, 即可去除微量杂蛋白的干扰, 使ELISA方法的定量结果更准确。且与盐酸异丙嗪等6种CPZ结构类似物均无明显交叉反应, 说明制备的鼠抗CPZ单克隆抗体的特异性良好。
ELISA方法的检测效果除受抗体特异性影响外, 还受酶标板吸附性能、抗原和抗体的工作浓度等因素的影响, 其中抗体浓度升高会提高测量信号值, 同时会降低方法的检测限, 而包被抗原浓度降低会提高相应浓度竞争物的抑制率, 从而影响结果的准确性[22]。因此, 本研究在制备好抗体的基础上, 采用棋盘滴定法, 确定了抗原包被的最佳稀释倍数为1 : 10 000, 鼠抗CPZ单克隆抗体质量浓度为1 μg·mL-1, 酶标二抗的最佳稀释倍数为1 : 1 000。拟合线性回归方程为y=-1.252 6x+2.853 2(R2=0.986 6), 其检测的线性范围为1.37~111.11 ng·mL-1, 最低检测限为0.51 ng·mL-1, 总的批内CV为6.97%, 总的批间CV为7.01%, 回收率为96.90~118.79%。该方法的检测限远低于文献[23]的50 ng·mL-1, 且基本达到现行有效检测方法[24]中的0.50 ng·mL-1。表明该方法特异性强、灵敏度高、检测限低、稳定性好、重现性好, 且线性范围较宽, 可满足猪肉样本的快速定量检测需求, 而且此方法前处理过程简单, 操作简便, 可同时检测多个样品, 无需昂贵的设备仪器。因此, 本方法的建立有助于解决猪肉中痕量CPZ残留现场快速定量检测的技术难题, 同时也为开展其他药物残留检测技术研究提供新的技术思路。
| [1] |
Thornley B, Adams C E, Awad A G. Chlorpromazine versus placebo for the treatment of schizophrenia:a systematic review[J]. Schizophrenia Research, 1998, 29(1/2): 155. |
| [2] |
Rijcken C A W, Monster T B M, Brouwers J R B J, et al. Chlorpromazine equivalents versus defined daily doses:how to compare antipsychotic drug doses?[J]. Journal of Clinical Psychopharmacology, 2003, 23(6): 657-659. DOI:10.1097/01.jcp.0000096247.29231.3a |
| [3] |
Cooper J, Delahaut P, Fodey T L, et al. Development of a rapid screening test for veterinary sedatives and the beta-blocker carazolol in porcine kidney by ELISA[J]. The Analyst, 2004, 129(2): 169-174. |
| [4] |
Song S Q, Shi X Z, Li R X, et al. Extraction of chlorpromazine with a new molecularly imprinted polymer from pig urine[J]. Process Biochemistry, 2008, 43(11): 1209-1214. DOI:10.1016/j.procbio.2008.06.015 |
| [5] |
刘建静, 杨曙明. 氯丙嗪残留检测技术研究进展[J]. 中国畜牧兽医, 2008, 35(10): 141-144. Liu J J, Yang S M. Development of detect of chlorpromazine residues[J]. China Animal Husbandry and Veterinary Medicine, 2008, 35(10): 141-144 (in Chinese with English abstract). |
| [6] |
Amaral L, Viveiros M, Molnar J. Antimicrobial activity of Phenothiazines[J]. In Vivo, 2004, 18(6): 725-731. |
| [7] |
路平, 曲志娜, 谭维泉, 等. 气相色谱-质谱法测定猪肝中氯丙嗪残留的研究[J]. 中国动物检疫, 2006, 23(7): 30-31. Lu P, Qu Z N, Tan W Q, et al. Determination of pig liver by gas chromatography-mass spectrometry study on chlorpromazine residues[J]. Chinese Journal of Animal Quarantine, 2006, 23(7): 30-31 (in Chinese with English abstract). DOI:10.3969/j.issn.1005-944X.2006.07.016 |
| [8] |
李婷, 周启星. 氯丙嗪生态毒理效应与人体健康影响研究与展望[J]. 生态学杂志, 2006, 25(12): 1554-1558. Li T, Zhou Q X. Ecotoxicological effect of chlorpromazine and its influence on human health[J]. Chinese Journal of Ecology, 2006, 25(12): 1554-1558 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-4890.2006.12.022 |
| [9] |
孔红英. 吩噻嗪类抗精神病药物对神经系统的副作用分析及处理[J]. 中国中医药咨讯, 2011(10): 230. Kong H Y. Analysis and treatment of side effects of phenothiazine antipsychotics on nervous system[J]. Journal of China Traditional Chinese Medicine Information, 2011(10): 230 (in Chinese). |
| [10] |
Ito Y, Sato S, Son M, et al. Bioelectric toxicity caused by chlorpromazine in human lung epithelial cells[J]. Toxicology and Applied Pharmacology, 2002, 183(3): 198-206. DOI:10.1006/taap.2002.9486 |
| [11] |
Frötschl R, Weickardt S, Staszewski S, et al. Effects of chlorpromazine with and without UV irradiation on gene expression of HepG2 cells[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2005, 575(1/2): 47-60. |
| [12] |
冯锐, 梁祈, 詹若挺. 猪肉中氯丙嗪残留量测定国家标准方法的优化[J]. 医学信息, 2015, 28(9): 124. Feng R, Liang Q, Zhan R T. Optimization of national standard method for determination of chlorpromazine residues in pork[J]. Medical Information, 2015, 28(9): 124 (in Chinese). |
| [13] |
Cruz-Vera M, Lucena R, Cárdenas S, et al. Determination of phenothiazine derivatives in human urine by using ionic liquid-based dynamic liquid-phase microextraction coupled with liquid chromatography[J]. Journal of Chromatography B, 2009, 877(1/2): 37-42. |
| [14] |
Saracino M A, Amore M, Baioni E, et al. Determination of selected phenothiazines in human plasma by solid-phase extraction and liquid chromatography with coulometric detection[J]. Analytica Chimica Acta, 2008, 624(2): 308-316. DOI:10.1016/j.aca.2008.06.040 |
| [15] |
Asghari A, Fahimi E, Bazregar M, et al. Rapid determination of some psychotropic drugs in complex matrices by tandem dispersive liquid-liquid microextraction followed by high performance liquid chromatography[J]. Journal of Chromatography B, 2017, 1052: 51-59. DOI:10.1016/j.jchromb.2017.03.012 |
| [16] |
Zhang L, Huang W, Jiang X H. Determination of chlorpromazine in porcine muscle using high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chinese Pharmaceutical Sciences, 2015, 24(10): 690-694. |
| [17] |
单美娜, 徐晓枫, 蒲云霞, 等. 气相色谱质谱法测定猪肉中氯丙嗪残留[J]. 中国食品卫生杂志, 2013, 25(5): 438-440. Shan M N, Xu X F, Pu Y X, et al. Determination of chlorpromazine in pork by gas chromatography-mass spectrometry[J]. Chinese Journal of Food Hygiene, 2013, 25(5): 438-440 (in Chinese with English abstract). |
| [18] |
Liu J W, Lu C C, Liu B H, et al. Development of novel monoclonal antibodies-based ultrasensitive enzyme-linked immunosorbent assay and rapid immunochromatographic strip for aflatoxin B1 detection[J]. Food Control, 2016, 59: 700-707. DOI:10.1016/j.foodcont.2015.06.038 |
| [19] |
Mandli J, El Fatimi I, Seddaoui N, et al. Enzyme immunoassay(ELISA/immunosensor) for a sensitive detection of pork adulteration in meat[J]. Food Chemistry, 2018, 255: 380-389. DOI:10.1016/j.foodchem.2018.01.184 |
| [20] |
Kong D Z, Wu X L, Li Y, et al. Ultrasensitive and eco-friendly immunoassays based monoclonal antibody for detection of deoxynivalenol in cereal and feed samples[J]. Food Chemistry, 2019, 270: 130-137. DOI:10.1016/j.foodchem.2018.07.075 |
| [21] |
阮光锋. 猪肉中有安眠药?[J]. 健康博览, 2017(7): 62. Ruan G F. Are there sleeping pills in pork?[J]. Health Review, 2017(7): 62 (in Chinese). DOI:10.3969/j.issn.1006-415X.2017.07.046 |
| [22] |
李树莹, 唐云飞, 盛建武, 等. 恩诺沙星完全抗原的合成及间接竞争ELISA方法的建立[J]. 环境科学学报, 2017, 37(8): 2904-2910. Li S Y, Tang Y F, Sheng J W, et al. Preparation of complete antigen and development of an indirect competitive ELISA for the detection of enrofloxacin in water samples[J]. Acta Scientiae Circumstantiae, 2017, 37(8): 2904-2910 (in Chinese with English abstract). |
| [23] |
安徽省质量技术监督局.动物组织中氯丙嗪的残留测定——酶联免疫吸附法: DB34T 1373-2011[S].合肥: 安徽省质量技术监督局, 2011. Anhui Provincial Bureau of Quality and Technical Supervision. Determination of chlorpromazine in animal tissue: enzyme linked immunosorbent assay: DB34T 1373-2011[S]. Hefei: Anhui Provincial Bureau of Quality and Technical Supervision, 2011(in Chinese). |
| [24] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.猪肾和肌肉组织中乙酰丙嗪、氯丙嗪、氟哌啶醇、丙酰二甲氨基丙吩噻嗪、甲苯噻嗪、阿扎哌隆、阿扎哌醇、咔唑心安残留量的测定液相色谱-串联质谱法: GB/T 20763-2006[S].北京: 中国标准出版社, 2006. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. Method for determination of acetopromaizine, chlorpromazine, haloperidol, propionylpromazine, xylazine, azaperone, azaperol and carazolol residues in porcine kidney and muscle tissues: LC-MS-MS method: GB/T 20763-2006[S]. Beijing: Standards Press of China, 2006(in Chinese). |




