文章信息
- 张夏薇, 慕春龙, 朱伟云
- ZHANG Xiawei, MU Chunlong, ZHU Weiyun
- 不同浓度硫化氢对肠上皮细胞炎症、线粒体功能和氧化应激的影响
- Effects of different concentrations of hydrogen sulfide on inflammation, mitochondrial function and oxidative stress of intestinal epithelial cells
- 南京农业大学学报, 2020, 43(1): 157-163
- Journal of Nanjing Agricultural University, 2020, 43(1): 157-163.
- http://dx.doi.org/10.7685/jnau.201902004
-
文章历史
- 收稿日期: 2019-02-17
肠道健康对动物机体整体代谢和健康至关重要。肠道微生物及其代谢产物对调节宿主肠道健康具有十分重要的意义。硫化氢(H2S)作为常见的肠道菌群代谢产物, 能够对肠道上皮细胞产生直接影响, 也可以通过外周血液循环输送到全身的组织和器官, 从而发挥其生理调节功能。H2S作为有毒气体被人们所熟知, 但近年来的研究表明, H2S是继一氧化氮和一氧化碳之后的第三个新型气体信号分子[1], 具有调节神经、炎症反应、血管舒张、氧化应激和凋亡等多种生理作用[2]。
高浓度H2S参与调节肠道黏膜炎症[3]和结肠癌血管生成[4]等过程。因此, 肠道对H2S的代谢能力也就显得尤为重要。肠道菌群产生的H2S主要在肠上皮细胞线粒体中进行氧化代谢, 通过硫醌氧化还原酶(sulfide quinone oxidoreductase, SQR)、硫代硫酸盐硫转移酶(thiosulfate sulfur transferase, TST)、硫双加氧酶(sulfur dioxygenase, ETHE1)和亚硫酸氧化酶(sulfite oxidase, SUOX)的作用[5], 将H2S转化为硫代硫酸盐或硫酸盐, 最后通过门静脉系统进入肝脏和其他器官, 避免H2S过度积累达到毒害水平。研究表明, ETHE1缺陷的儿童易患乙基丙二酸脑病(ethylmalonic encephalopathy, EE), 并伴随腹泻发生[5]。患有炎症性肠病(inflammatory bowel disease, IBD)的患者其肠黏膜的H2S代谢能力受损[6], 这说明肠黏膜H2S代谢紊乱可能与IBD的发病机制有关。因此, 研究肠上皮细胞的H2S代谢过程具有重要的临床意义。
肠上皮位于机体与其肠腔内环境的交界处, 因此容易受到腔内物质如H2S所致的氧化损伤。肠道内有毒物质的积累导致的氧化应激, 会损伤线粒体和细胞功能[7]。本实验室之前的研究表明, 给大鼠饲喂高蛋白日粮后其肠道内硫化物浓度升高, 通过对结肠黏膜进行转录组分析, 发现高蛋白日粮上调参与调节谷胱甘肽代谢、抗原呈递和肿瘤坏死因子α(TNF-α)介导的信号传导等过程相关基因的表达, 下调参与固有免疫和氧化磷酸化调节的基因表达[8], 但这些炎症、氧化应激反应和线粒体功能方面的变化是否是由肠道内硫化物浓度升高导致的还不清楚。因此, 本试验采用人结肠癌细胞系Caco-2, 研究不同浓度H2S对肠上皮细胞炎症、氧化应激和线粒体硫化物代谢过程的影响, 旨在揭示H2S影响肠道健康的潜在机制。
1 材料与方法 1.1 试验试剂胎牛血清购自Sigma公司, 硫氢化钠(NaHS)购自Sigma Aldrich公司, CCK-8试剂盒、还原型谷胱甘肽测试盒(GSH)、超氧化物歧化酶测试盒(SOD)和丙二醛测试盒(MDA)均购自南京建成生物工程研究所, 谷胱甘肽过氧化物酶检测试剂盒(GPx)和BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所, Bradford试剂盒购自北京索莱宝科技有限公司, RNApure超纯总RNA快速提取试剂盒购自北京艾德莱生物科技有限公司, PrimeScriptTM RT Master Mix和SYBR Premix Ex Taq购自TaKaRa公司。
1.2 细胞培养和处理采用人源结肠癌上皮细胞系Caco-2进行体外细胞试验, 在培养瓶中进行培养, 细胞每2 d传1代, 细胞传10~20代后接种于6孔细胞培养板中, 细胞培养液采用添加了100 U·mL-1青霉素、100 μg·mL-1链霉素和10%胎牛血清的DMEM/F12培养基, 细胞培养在充满5% CO2的37 ℃恒温培养箱中。
本试验以Caco-2细胞为模型, 共分为4个组, 分别为对照组和低(0.1 mmol·L-1)、中(1 mmol·L-1)、高(2 mmol·L-1)浓度NaHS处理组, 每组6个重复。将Caco-2细胞接种于6孔细胞培养板中, 待细胞生长至约90%融合时弃培养液, 用PBS清洗1次, 更换为用不含血清的基础培养基配制的0.1、1和2 mmol·L-1 NaHS溶液, 每孔加入2 mL。处理24 h后测定细胞活力、mRNA相对表达水平和各个氧化应激指标。
1.3 细胞活力检测采用CCK-8试剂盒测定细胞活力。在96孔板每孔中加入100 μL(约3×104个细胞)的细胞悬液, 培养24 h后进行处理, 最后每孔加入10 μL CCK-8溶液, 置于37 ℃恒温培养箱中染色2 h, 测量A450值。
1.4 肠上皮细胞炎性相关基因和线粒体硫化物代谢酶基因的实时荧光定量PCR(RT-qPCR)检测采用RNApure超纯总RNA快速提取试剂盒提取Caco-2细胞的总RNA。以1 μg总RNA为模板, 利用PrimeScriptTM RT Master Mix反转录(RT)合成单链cDNA。之后, 以cDNA为模板, 使用SYBR Premix Ex Taq和StepOne Real-Time PCR system(Applied Biosystems, Life Technologies)进行qPCR。引物序列如表 1所示。qPCR程序:95 ℃预变性30 s; 95 ℃ 10 s, 60 ℃ 30 s, 循环40次; 95 ℃ 15 s, 60 ℃ 60 s, 95 ℃ 15 s。最后, 以β-actin为内参基因, 采用2-ΔΔCT法对样品基因的相对表达水平进行计算。
| 基因 Gene |
引物对序列 Primer pairs sequence(5'→3') |
片段长度/bp Fragment length |
GenBank序列号 Accession No. |
| β-actin | CTCCTTAATGTCACGCAGGATTTC/GTGGGGCGCCCCAGGCACCA | 540 | NM_001101.5 |
| SQR | GGTTTCGCTCATCCCAAAATAGG/GCTCCAGCACACTTCACTG | 134 | NM_021199.4 |
| TST | TGCTGGAGAACCTTGAATCTAAGA/GCCCGAGTCCAGTCCTACTG | 107 | NM_003312.6 |
| ETHE1 | CCAGGCTGTGTCACCTTCGT/CAACAGGGCATCTCCAGTGAA | 63 | NM_014297.5 |
| SUOX | CCGACGCTCTGAGATGACTC/GGGATGGATGCTCCATAGGC | 204 | NM_001032386.2 |
| TNF-α | TTGTAGCAAACCCTCAAGCTGA/AGATGAGGTACAGGCCCTCTGA | 129 | NM_000594.4 |
| IL-6 | GTGAAAGCAGCAAAGAGGCACT/ACCAGGCAAGTCTCCTCATTGA | 106 | NM_000600.5 |
| TGF-β | GGGACTATCCACCTGCAAGA/CCTCCTTGGCGTAGTAGTCG | 239 | LT739506.1 |
| 注: SQR:硫醌氧化还原酶基因Sulfide quinone oxidoreductase gene; TST:硫代硫酸盐硫转移酶基因Thiosulfate sulfur transferase gene; ETHE 1 :硫双加氧酶基因Sulfur dioxygenase gene; SUOX:亚硫酸氧化酶基因Sulfite oxidase gene; TNF-α:肿瘤坏死因子α基因Tumor necrosis factor-α gene; IL-6 :白介素-6基因Interleukin 6 gene; TGF-β:转化生长因子β基因Transforming growth factor-β gene。 | |||
首先采用反复冻融法令细胞破碎, 然后采用还原型GSH测试盒测定细胞内的GSH含量:测量A405值后与标准浓度GSH溶液进行对比计算样品中GSH的含量。
1.5.2 超氧化物歧化酶(SOD)活性检测首先使用细胞裂解液裂解细胞, 然后采用SOD测试盒测定细胞内的SOD活性:先测量A450值, 计算出SOD抑制率, 再根据样品蛋白浓度进一步计算出SOD活性。
1.5.3 谷胱甘肽过氧化物酶(GPx)活性检测首先使用细胞裂解液裂解细胞, 然后采用GPx检测试剂盒测定细胞内的GPx活性:测量340 nm处吸光值计算出检测体系中GPx活性, 再根据样品蛋白浓度最终计算出样品中GPx活性。
1.6 丙二醛(MDA)含量检测首先使用细胞裂解液裂解细胞, 然后采用MDA测试盒测定细胞内的MDA含量:先测量A530值, 计算出检测体系中MDA含量, 再根据样品蛋白浓度最终计算出样品的MDA含量。
1.7 数据统计分析采用SPSS 20.0软件对试验数据进行统计学分析。采用单因素方差分析法(ANOVA)进行分组方差分析比较, 再通过Duncan ’ s法进行多重比较检验。数据均表示为均值±标准误(x+SE)。
2 结果与分析 2.1 不同浓度NaHS处理对肠上皮细胞活力的影响由图 1可见:与对照组相比, 0.1和1 mmol·L-1 NaHS处理显著增加细胞活力(P < 0.05), 而2 mmol·L-1 NaHS处理有增加细胞活力的趋势, 但差异不显著(P>0.05)。结果表明, 0.1和1 mmol·L-1 NaHS处理增加肠上皮细胞活力, 且细胞活力的增加量与NaHS浓度呈反比。2 mmol·L-1 NaHS处理对肠上皮细胞活力无显著影响。

|
图 1 不同浓度NaHS处理对Caco-2细胞活力的影响 Fig. 1 Effects of different concentrations of NaHS on the viability of Caco-2 cells 不同字母表示差异显著(P < 0.05)。下同。Different letters indicate significant difference at 0.05 level. The same as follows. |
如图 2所示:与对照组相比, 2 mmol·L-1 NaHS处理显著上调TNF-α基因表达水平(P < 0.05), 而0.1和1 mmol·L-1 NaHS处理对TNF-α表达水平的影响没有显著差异(P>0.05);0.1、1和2 mmol·L-1 NaHS处理没有显著影响IL-6基因表达水平(P>0.05)。NaHS处理对TNF-α和IL-6基因表达的影响均呈现剂量依赖性的上升趋势。与对照组相比, 0.1和2 mmol·L-1 NaHS处理有上调TGF-β基因表达水平的趋势, 但并不显著(P>0.05)。表明, 2 mmol·L-1 NaHS处理的显著促进肠上皮细胞炎症发生。
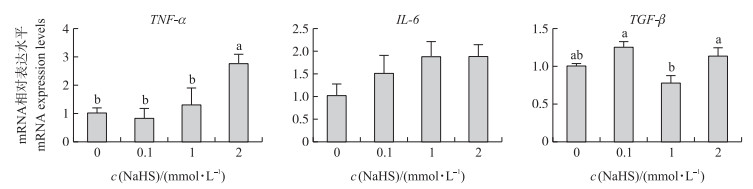
|
图 2 不同浓度NaHS对Caco-2细胞炎症基因表达水平的影响 Fig. 2 Effects of different concentrations of NaHS on inflammatory gene expression level of Caco-2 cells |
如图 3所示:与对照组相比, 0.1 mmol·L-1 NaHS处理显著上调TST、ETHE1和SUOX等硫化物代谢酶基因表达水平(P < 0.05), 1 mmol·L-1 NaHS处理没有引起硫化物代谢酶基因的变化(P>0.05), 2 mmol·L-1 NaHS处理有下调SQR基因表达水平的趋势, 但并不显著(P>0.05)。表明, 0.1 mmol·L-1 NaHS处理促进肠上皮细胞线粒体的硫化物代谢过程, 1和2 mmol·L-1 NaHS处理对硫化物代谢过程的影响并不明显。
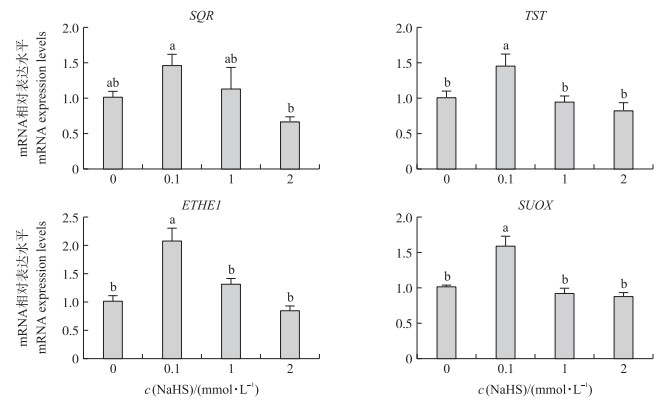
|
图 3 不同浓度NaHS对Caco-2细胞硫化物代谢基因表达水平的影响 Fig. 3 Effects of different concentrations of NaHS on sulfide metabolism gene expression levels of Caco-2 cells |
如图 4所示:与对照组相比, 0.1 mmol·L-1 NaHS处理显著提高细胞内MDA含量(P < 0.05), 但没有引起SOD、GPx活性和GSH含量等方面的显著变化(P>0.05);1 mmol·L-1 NaHS处理显著减弱SOD活性(P < 0.05), 但没有引起MDA、GSH含量和GPx活性的显著变化(P>0.05);2 mmol·L-1 NaHS处理显著提高MDA、GSH含量和GPx活性(P < 0.05), 显著减弱SOD活性(P < 0.05)。表明, 0.1、1和2 mmol·L-1 NaHS处理均增加细胞的氧化应激程度, 其中2 mmol·L-1 NaHS处理表现最为强烈。
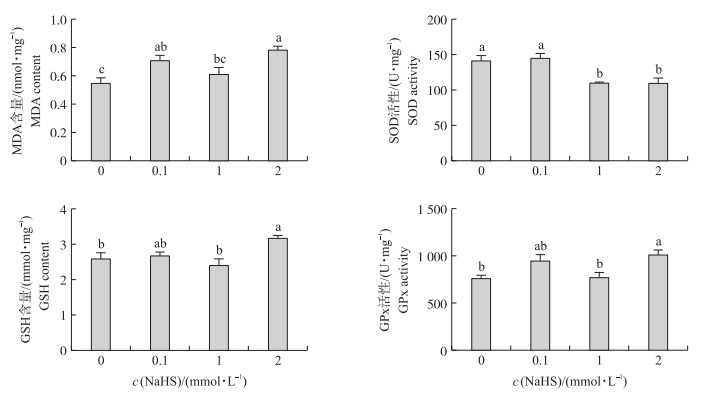
|
图 4 不同浓度NaHS对Caco-2细胞氧化应激的影响 Fig. 4 Effects of different concentrations of NaHS on oxidative stress of Caco-2 cells |
已有研究表明, H2S可以促进肿瘤细胞增殖[4], 外源添加NaHS(0.2~5 mmol·L-1)促进IEC-18细胞的增殖[9]。本研究表明, 外源添加NaHS增加Caco-2细胞活力, 促进细胞增殖, 并且在一定范围内, 细胞活力增加量与H2S浓度呈反比。研究表明, NaHS可以促进角质细胞的增殖和分化, 且增殖程度呈现剂量依赖性特征[10]。这与本研究结果不同, 可能是由于来源于不同器官和组织的细胞生长特性具有差异导致。
3.2 H2S对肠上皮细胞炎症状态的影响不同浓度H2S对细胞炎症状态的作用不同。有研究表明, 20 μmol·L-1 NaHS处理可以缓解葡聚糖硫酸钠(DSS)引起的Caco-2细胞的炎症反应, 其机制可能与NF-κB信号通路有关[11]。内源性H2S参与DSS诱导的炎症反应, 10~200 μmol·L-1 GYY4137(H2S供体)可以减轻炎症和肠道功能障碍[12]。然而, 对大鼠模型研究发现, 高蛋白日粮可显著提高大肠中H2S浓度, 1.5 mmol·L-1 NaHS处理抑制结肠线粒体耗氧量, 激发炎症反应[13]。临床试验也表明, 肠道高浓度硫化物与溃疡性结肠炎发病有关, 肠道硫还原菌种类也更丰富[14]。本试验结果支持高浓度硫化物促进炎症发展这一现象, 在Caco-2细胞中, 2 mmol·L-1 NaHS处理显著上调TNF-α基因表达水平, 说明高浓度H2S加剧结肠炎症反应, 参与调节肠道免疫。
3.3 H2S对肠上皮细胞线粒体H2S代谢能力的影响SQR、TST和ETHE1基因表达水平是影响结肠上皮细胞硫化物代谢的主要因素[15]。研究发现小鼠结肠肌细胞中有SQR基因的表达, 但未检测到TST和ETHE1, 对SQR进行药物阻断会导致周围组织中H2S水平的升高[16]。本研究发现, 2 mmol·L-1 NaHS处理下调SQR基因表达水平, 但并未影响其他硫化物代谢酶的基因表达, 说明SQR可能是H2S代谢途径中的关键酶。已有研究发现, 与饲喂普通日粮的大鼠相比, 饲喂高蛋白日粮的大鼠肠道内硫化物含量显著增加, 同时SQR基因表达水平也显著上调[13], 与本试验0.1 mmol·L-1 NaHS处理显著上调硫化物代谢基因表达水平的结果相符。在健康的结肠上皮中, SQR和TST的表达量很高, H2S迅速降解[17]。患结肠炎的大鼠, 其结肠黏膜溃疡部位H2S的浓度显著升高, H2S代谢能力明显降低, 与该部位的SQR表达水平明显下降有关[18]。本试验中2 mmol·L-1 NaHS处理下调SQR基因表达水平, 可能是由于H2S浓度过高, 超过了肠上皮细胞及线粒体对其的氧化代谢能力, 对线粒体乃至肠道产生损伤, 从而抑制线粒体对H2S的代谢能力, 但其中机制有待进一步研究。
3.4 H2S对肠上皮细胞氧化应激状态的影响本研究发现, 2 mmol·L-1 NaHS处理显著提高MDA、GSH含量和GPx活性, 显著减弱SOD活性, 这些结果均说明2 mmol·L-1 NaHS处理增强细胞的氧化应激水平。SOD、GSH和GPx都具有抗氧化能力, 其中SOD和GPx属于抗氧化酶, GSH属于非酶类抗氧化物[19], 可直接清除线粒体产生的自由基和活性氧[20], 也可以通过辅助GPx间接清除活性氧[21], GSH和GPx共同参与谷胱甘肽代谢过程。MDA是自由基与脂质发生过氧化反应的终产物, 影响线粒体呼吸链复合物及线粒体内关键酶活性, 具有细胞毒性, 是衡量细胞氧化应激水平的直接指标。综合分析这些结果, 说明0.1、1和2 mmol·L-1 NaHS处理均可以提高细胞氧化应激水平, 其中2 mmol·L-1 NaHS处理表现最为强烈, 显著上调谷胱甘肽代谢过程。
本研究中NaHS浓度的选择基于健康人的粪样硫化物浓度范围(0.3~3.4 mmol·L-1), 对于食用高蛋白饮食的成年人, 粪样中的硫化物浓度可达3.4 mmol·L-1[22]。同时, 有研究表明100 μmol·L-1 GYY4137能改善DSS诱导的炎症反应和肠道紊乱情况[12]。1 mmol·L-1 NaHS处理会抑制HT-29细胞的细胞色素C氧化酶的活性[23]。0.5~2 mmol·L-1 NaHS处理显著抑制十二指肠纵行肌肌条运动, 且呈剂量依赖性趋势, 但当NaHS的浓度低到100 μmol·L-1时对肌肉肌条的运动已没有影响[24], 但该浓度范围内的NaHS对肠上皮细胞及其线粒体功能的作用还不清楚。长期食用高蛋白饮食, 除了其产生的H2S直接作用危害肠道外, 还会增加肠道内N-亚硝基化合物、苯乙酸和支链脂肪酸的浓度, 降低丁酸和抗氧化酚酸的浓度, 提高肠道内pH值[25], 这些均可能影响H2S对肠道的调节作用, 从而影响整个机体的免疫和代谢机能。
综上所述, 低浓度H2S能增强肠上皮细胞活力, 提高线粒体硫化物代谢能力和氧化应激水平; 而高浓度H2S上调促炎症因子的表达, 影响细胞免疫应答, 同时诱导肠上皮细胞氧化应激, 对肠道健康造成不利影响。
| [1] |
Wang R. Physiological implications of hydrogen sulfide:a whiff exploration that blossomed[J]. Physiological Reviews, 2012, 92(2): 791-896. DOI:10.1152/physrev.00017.2011 |
| [2] |
Kabil O, Motl N, Banerjee R. H2S and its role in redox signaling[J]. Biochimica et Biophysica Acta-Proteins and Proteomics, 2014, 1844(8): 1355-1366. DOI:10.1016/j.bbapap.2014.01.002 |
| [3] |
Coffey J C, Rowan F, Burke J, et al. Pathogenesis of and unifying hypothesis for idiopathic pouchitis[J]. American Journal of Gastroenterology, 2009, 104(4): 1013-1023. DOI:10.1038/ajg.2008.127 |
| [4] |
Szabo C, Coletta C, Chao C, et al. Tumor-derived hydrogen sulfide, produced by cystathionine-beta-synthase, stimulates bioenergetics, cell proliferation, and angiogenesis in colon cancer[J]. Proc Natl Acad Sci USA, 2013, 110(30): 12474-12479. DOI:10.1073/pnas.1306241110 |
| [5] |
Di Meo I, Lamperti C, Tiranti V. Mitochondrial diseases caused by toxic compound accumulation:from etiopathology to therapeutic approaches[J]. EMBO Molecular Medicine, 2015, 7(10): 1257-1266. DOI:10.15252/emmm.201505040 |
| [6] |
Arijs I, Vanhove W, Rutgeerts P, et al. Decreased mucosal sulfide detoxification capacity in patients with Crohn's disease[J]. Inflammatory Bowel Diseases, 2013, 19(5): 70-72. DOI:10.1097/MIB.0b013e31827e790e |
| [7] |
Zhang J H. Autophagy and mitophagy in cellular damage control[J]. Redox Biology, 2013, 1(1): 19-23. DOI:10.1016/j.redox.2012.11.008 |
| [8] |
Mu C L, Yang Y X, Luo Z, et al. The colonic microbiome and epithelial transcriptome are altered in rats fed a high-protein diet compared with a normal-protein diet[J]. The Journal of Nutrition, 2016, 146(3): 474-483. DOI:10.3945/jn.115.223990 |
| [9] |
Deplancke B, Gaskins H R. Hydrogen sulfide induces serum-independent cell cycle entry in nontransformed rat intestinal epithelial cells[J]. FASEB Journal, 2003, 17(8): 1310-1312. |
| [10] |
Xie X, Dai H, Zhuang B Y, et al. Exogenous hydrogen sulfide promotes cell proliferation and differentiation by modulating autophagy in human keratinocytes[J]. Biochemical and Biophysical Research Communications, 2016, 472(3): 437-443. DOI:10.1016/j.bbrc.2016.01.047 |
| [11] |
Chen X, Liu X S. Hydrogen sulfide from a NaHS source attenuates dextran sulfate sodium(DSS)-induced inflammation via inhibiting nuclear factor-kappa B[J]. Journal of Zhejiang University-Science B, 2016, 17(3): 209-217. DOI:10.1631/jzus.B1500248 |
| [12] |
Zhao H Y, Yan R, Zhou X G, et al. Hydrogen sulfide improves colonic barrier integrity in DSS-induced inflammation in Caco-2 cells and mice[J]. International Immunopharmacology, 2016, 39: 121-127. DOI:10.1016/j.intimp.2016.07.020 |
| [13] |
Beaumont M, Andriamihaja M, Lan A, et al. Detrimental effects for colonocytes of an increased exposure to luminal hydrogen sulfide:the adaptive response[J]. Free Radical Biology & Medicine, 2016, 93: 155-164. |
| [14] |
Carbonero F, Benefiel A C, Gaskins H R. Contributions of the microbial hydrogen economy to colonic homeostasis[J]. Nature Reviews Gastroenterology & Hepatology, 2012, 9(9): 504-518. |
| [15] |
Mimoun S, Andriamihaja M, Chaumontet C, et al. Detoxification of H2S by differentiated colonic epithelial cells:implication of the sulfide oxidizing unit and of the cell respiratory capacity[J]. Antioxidants & Redox Signaling, 2012, 17(1): 1-10. |
| [16] |
Linden D R, Furne J, Stoltz G J, et al. Sulfide quinone reductase contributes to hydrogen sulfide metabolism in murine peripheral tissues but not in the CNS[J]. British Journal of Pharmacology, 2012, 165(7): 2178-2190. DOI:10.1111/j.1476-5381.2011.01681.x |
| [17] |
Lagoutte E, Mimoun S, Andriamihaja M, et al. Oxidation of hydrogen sulfide remains a priority in mammalian cells and causes reverse electron transfer in colonocytes[J]. Biochimica et Biophysica Acta, 2010, 1797(8): 1500-1511. DOI:10.1016/j.bbabio.2010.04.004 |
| [18] |
Flannigan K L, Ferraz J G P, Wang R, et al. Enhanced synthesis and diminished degradation of hydrogen sulfide in experimental colitis:a site-specific, pro-resolution mechanism[J]. PLoS One, 2013, 8(8): e71962. DOI:10.1371/journal.pone.0071962 |
| [19] |
Evans P, Halliwell B. Free radicals and hearing:cause, consequence, and criteria[J]. Annals New York Academy of Sciences, 1999, 88: 419-440. |
| [20] |
Wu G, Fang Y Z, Yang S, et al. Glutathione metabolism and its implications for health[J]. The Journal of Nutrition, 2004, 134(3): 489-492. DOI:10.1093/jn/134.3.489 |
| [21] |
Han C, Kim M J, Ding D, et al. GSR is not essential for the maintenance of antioxidant defenses in mouse cochlea:possible role of the thioredoxin system as a functional backup for GSR[J]. PLoS One, 2017, 12(7): e0180817. DOI:10.1371/journal.pone.0180817 |
| [22] |
Magee E A, Richardson C J, Hughes R, et al. Contribution of dietary protein to sulfide production in the large intestine:an in vitro and a controlled feeding study in humans[J]. American Journal of Clinical Nutrition, 2000, 72(6): 1488-1494. DOI:10.1093/ajcn/72.6.1488 |
| [23] |
Leschelle X, Goubern M, Andriamihaja M, et al. Adaptative metabolic response of human colonic epithelial cells to the adverse effects of the luminal compound sulfide[J]. Biochimica et Biophysica Acta General Subjects, 2005, 1725(2): 201-212. DOI:10.1016/j.bbagen.2005.06.002 |
| [24] |
Wen L, Jing L, Liping G, et al. Hydrogen sulfide modulates duodenal motility in male rats via activating TRPV1 and KATP channels[J]. British Journal of Pharmacology, 2014, 171(6): 1534-1550. DOI:10.1111/bph.12562 |
| [25] |
Russell W R, Gratz S W, Duncan S H, et al. High-protein, reduced-carbohydrate weight-loss diets promote metabolite profiles likely to be detrimental to colonic health[J]. American Journal of Clinical Nutrition, 2011, 93(5): 1062-1072. DOI:10.3945/ajcn.110.002188 |




