文章信息
- 纪海静, 蒋临正, 常伟伟, 杨彩霞, 陈坤琳, 王慧利, 仲跻峰, 徐银学, 邢光东
- JI Haijing, JIANG Linzheng, CHANG Weiwei, YANG Caixia, CHEN Kunlin, WANG Huili, ZHONG Jifeng, XU Yinxue, XING Guangdong
- 乳腺炎奶牛乳腺上皮细胞的程序性坏死研究
- Necroptosis of mammary epithelial cells in bovine mammary glands with mastitis
- 南京农业大学学报, 2020, 43(1): 151-156
- Journal of Nanjing Agricultural University, 2020, 43(1): 151-156.
- http://dx.doi.org/10.7685/jnau.201901011
-
文章历史
- 收稿日期: 2019-01-04
2. 江苏省农业科学院畜牧研究所, 江苏 南京 210014;
3. 江苏优源奶业产业研究院有限公司, 江苏 南京 211100
2. Institute of Animal Science, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;
3. Institute of Jiangsu Youyuan Dairy Industry Co., Ltd., Nanjing 211100, China
奶牛乳腺炎是乳腺组织受到病原微生物侵染而诱发的一种乳腺疾病[1-2], 当大肠杆菌、金黄色葡萄球菌等细菌侵染奶牛乳腺组织并引发乳腺炎时, 乳腺组织中的细胞发生凋亡; 同时乳腺上皮细胞中的炎性相关因子白介素1β(interleukin-1β, IL-1β)、白介素6(interleukin-6, IL-6)和肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)等表达上升[3-6]。
细胞坏死一直被误认为是不受调控的细胞偶然死亡事件, 但近年来研究表明, 细胞程序性死亡是凋亡被抑制情况下的一种细胞坏死方式[7-8]。发生程序性死亡时, 细胞肿胀, 继而膜破裂并释放细胞内容物, 引发局部炎性反应。细胞程序性坏死过程中, 受体相互作用蛋白(receptor-interacting protein1/3, RIPK1/3)磷酸化后形成坏死复合物(necrosome)并招募混合谱系激酶结构域样蛋白(mixed lineage kinase domain-like protein, MLKL), MLKL被坏死复合物磷酸化后, 转移到细胞膜上激活离子通道, 促进细胞坏死[9-10]。
细胞程序性坏死由RIPK1-RIPK3-MLKL信号通路激活并能引发组织的局部炎症, 在小鼠炎性疾病模型中已得到了很好的研究和诠释[11-12], 而在奶牛乳腺炎中还没有相关的研究报道。本研究通过细胞程序性坏死通路中的关键蛋白MLKL免疫荧光定位, 并结合程序性坏死相关因子的检测, 探究乳腺炎奶牛乳腺组织中是否存在细胞程序性坏死。
1 材料与方法 1.1 试验材料 1.1.1 试验样品的采集健康及患乳腺炎奶牛来自于南京优然牧业有限责任公司。奶牛屠宰后, 将乳腺剖开, 根据腺泡形态、颜色及纤维化程度等特征, 分别采集健康和乳腺炎乳区的组织。采集的乳腺组织置4%(体积分数)多聚甲醛中固定, 剪成1 cm3左右小块放入1.5 mL冻存管液氮中保存, 带回实验室放入-80 ℃冰箱中备用。
1.1.2 主要仪器与试剂YD-6D生物组织包埋机、YD-A生物组织摊片机(金华市益迪医疗设备有限公司); 石蜡切片机(Leica RM2245);烘片机(Leica HI1220);光学显微镜(Nikon YS100);实时荧光定量PCR(RT-qPCR)仪(ABI StepOnePlus TM); 酶标仪(Thermo 1510)。
苏木精、伊红(谷歌生物); RNA提取试剂盒(百泰克生物技术有限公司); 反转录、RT-qPCR试剂盒(诺唯赞生物科技有限公司); 合成引物(上海捷瑞生物工程有限公司); PAGE胶(金斯瑞生物科技有限公司); MLKL单克隆抗体(Abgent); Phospho-MLKL单克隆抗体(Cell Signaling Technology); GAPDH、HRP-羊抗兔抗体(南京迅贝生物科技有限公司); RIPKA裂解液、蛋白酶抑制剂、磷酸酶抑制剂(博士德生物); BCA蛋白浓度测定试剂盒(康为世纪生物科技有限公司); 牛血清白蛋白(索莱宝生物科技有限公司); ECL化学发光试剂盒(GE Healthcare)。
1.2 试验方法 1.2.1 HE染色观察乳腺组织形态4%多聚甲醛固定的健康和乳腺炎乳腺组织, 经不同浓度乙醇进行梯度脱水后, 于二甲苯中透蜡, 最后进行石蜡块包埋并切成厚度为5 μm的石蜡切片。切片经展片和烘片后, 进行苏木精-伊红(HE)染色, 并在显微镜下观察组织形态。
1.2.2 RT-qPCR检测炎性因子及程序性坏死相关因子mRNA表达从冻存的乳腺组织中提取组织总RNA, 反转录为cDNA。RT-qPCR检测目的基因TNF-α、IL-1β、IL-6、Caspase8、MLKL、RIPK1和RIPK3的mRNA表达, 内参基因为GAPDH。引物序列见表 1。
| 基因名称 Gene name |
登录号 Accession No. |
引物对序列 Primer pairs sequence(5'→3') |
扩增片段长度/bp Fragment length |
| GAPDH | NM_001034034.2 | ATCAAGTGGGGTGATGCTGG/TACTTCTCGTGGTTCACGCC | 167 |
| TNF-α | NM_173966 | CTTCTGCCTGCTGCACTTCG/GAGTTGATGTCGGCTACAACG | 156 |
| IL-1β | NM_174093.1 | GGCCAAAGTCCCTGACCTCT/CTGCCACCATCACCACATTC | 167 |
| IL-6 | NM_173923.2 | GGAGGAAAAGGACGGATGCT/GGTCAGTGTTTGTGGCTGGA | 227 |
| Caspase8 | XM_005202615 | CTGAGAGAAGAGGCCCGTGA/CCCGGCTTAGGAACTTGAGG | 173 |
| MLKL | XM_024978879 | CACCATTCGGAAACACCC/CGGCAGAACTGACCCTCT | 166 |
| RIPK1 | XM_024983424.1 | GCAATAGCTCCAAGCAGGTC/TGTGCAGCAGGAAGTCATTC | 148 |
| RIPK3 | XM_024997365.1 | CCAGAGAGAGCAGGTTCCAC/AATCAGGCGGTTGTTGTTTC | 219 |
冰上称取-80 ℃保存的健康和患乳腺炎的乳腺组织各500 mg, 放入提前按比例加入磷酸酶和磷脂酶抑制剂的500 μL裂解液。匀浆1~2 min后冰上裂解30 min, 4 ℃、12 000 r·min-1离心10 min。吸取上清液并按照BCA试剂盒测定浓度, 加入裂解液和上样缓冲液将蛋白调整为均一浓度, 95 ℃煮沸10 min变性, 取样进行120 g·L-1 SDS-PAGE电泳, 切胶然后将蛋白转移至PVDF膜上, 50 g·L-1脱脂奶粉室温封闭2 h后, 4 ℃孵育加一抗过夜, TBST洗涤后加辣根过氧化物酶标记的羊抗兔/鼠抗二抗(50 g·L-1脱脂奶粉1 : 5 000稀释), 室温孵育2 h。TBST洗涤3次后加ECL试剂显影发光。Western blot结果用软件Image J进行灰度分析。
1.3 数据分析用Excel 2010分析数据, 数据均采用平均值±标准差(x±SD)表示。数据结果用软件SPSS 20.0进行独立样本t测验。
2 结果与分析 2.1 奶牛乳腺组织学观察奶牛乳腺组织石蜡切片HE染色(图 1)表明:健康奶牛乳腺组织中腺泡圆润、充盈, 没有组织间增生和炎性发生; 临床乳腺炎奶牛乳腺组织中, 乳腺腺泡明显萎缩, 萎缩后的乳腺腺泡大多缺乏圆润形态, 且腔内混有脱落的组织或炎性细胞等。
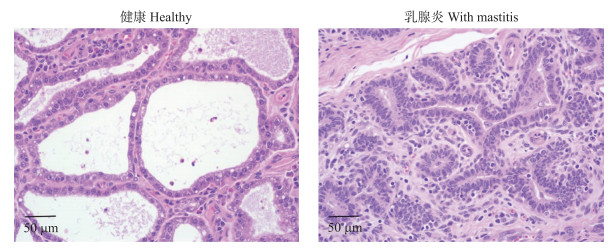
|
图 1 奶牛乳腺组织HE染色观察(×400) Fig. 1 Paraffin sections of stained by HE from bovine mammary glands(×400) |
健康和乳腺炎奶牛乳腺组织中炎性因子基因IL-1β、IL-6和TNF-α mRNA表达量的RT-qPCR检测结果(图 2)表明:乳腺炎乳腺组织中IL-1β、IL-6和TNF-α mRNA表达量较健康乳腺组织中的表达量均极显著升高(P < 0.001)。
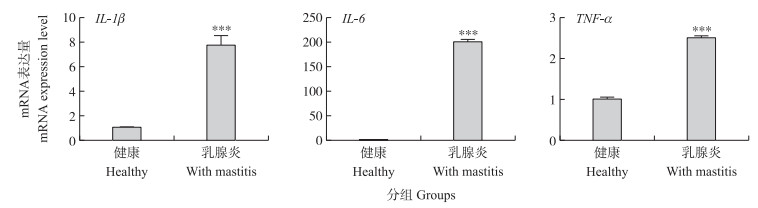
|
图 2 奶牛乳腺组织中IL-1β、IL-6和TNF-α mRNA的相对表达量 Fig. 2 Expression level of IL-1β, IL-6 and TNF-α mRNA in bovine mammary glands *P < 0.05, **P < 0.01, ***P < 0.001. The same as follows. |
对健康和乳腺炎奶牛乳腺组织中程序性坏死相关基因RIPKK3、RIPKK1、MLKL和Caspase8 mRNA表达量进行RT-qPCR检测, 结果(图 3)表明:Caspase8在乳腺炎乳腺组织中表达量极显著下降(P < 0.001), RIPK1表达量极显著升高(P < 0.001), RIPK3的表达量显著升高(P < 0.01), 而MLKL在2组奶牛乳腺组织中的表达量差异不显著(P>0.05)。
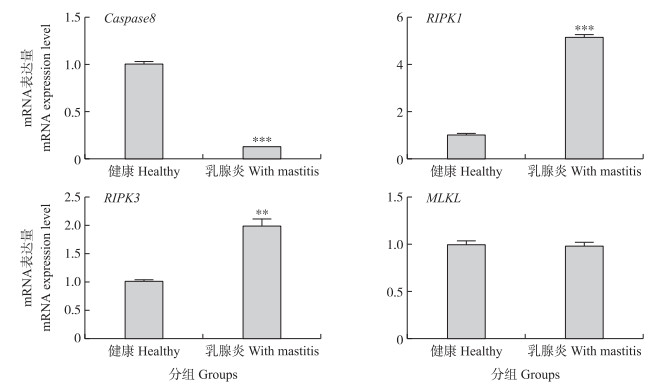
|
图 3 乳腺组织中Caspase8、RIPK1、RIPK3和MLKL mRNA的相对表达量 Fig. 3 Expression level of Caspase8, RIPK1, RIPK3 and MLKL mRNA in bovine mammary glands |
乳腺组织中MLKL和p-MLKL的Western blot检测结果(图 4)表明:MLKL在健康与乳腺炎奶牛乳腺组织中的表达量无显著差异(P>0.05), 该结果与MLKL mRNA表达结果(图 3)一致; 而p-MLKL蛋白的表达量则差异显著(P < 0.05), 即乳腺炎乳腺组织中的表达量显著高于健康乳腺组织。
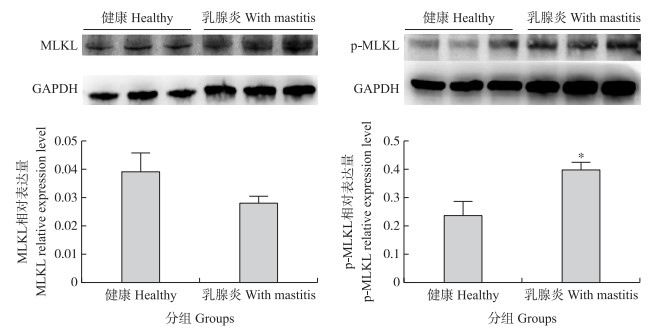
|
图 4 奶牛乳腺组织中MLKL和p-MLKL蛋白的相对表达量 Fig. 4 Expression level of MLKL and p-MLKL protein in bovine mammary glands |
乳腺炎分为隐性乳腺炎及临床乳腺炎, 其中临床乳腺炎表现为红肿、结块和发硬等[13]。本研究通过HE染色健康及临床乳腺炎乳腺组织, 发现乳腺炎乳区乳腺组织中, 腺泡室失去原有形态, 腺泡明显萎缩, 中间夹杂有脱落的上皮组织并且间质细胞有明显的增生现象, 这与余盼等[14]的结果一致。
研究表明, 细胞程序性坏死能够引起机体产生局部炎症[15-16], 而MLKL是细胞程序性坏死RIPK1/RIPK3复合物中的RIPK3亚基的磷酸化底物[8-9, 17]。MLKL主要分布在细胞质、线粒体相关膜部位和细胞质膜等部位, 当被RIPK3重招募、磷酸化并形成多聚体后, 转移到细胞膜并激活离子通道, 促进细胞的坏死[18-20]。
奶牛乳腺受细菌侵染后, 最早产生的炎性细胞因子是TNF-α, TNF-α进一步刺激机体并产生IL-6和IL-1β等其他炎性因子, 扩大其对机体的致炎性作用, 从而对机体造成严重性损伤[21]。本研究RT-qPCR结果表明, 乳腺炎乳腺组织中TNF-α、IL-6和IL-1β mRNA表达量极显著升高, 说明乳腺组织中乳腺炎的发生, 能够显著促进炎性因子的表达。
乳腺上皮细胞受细菌刺激引起细胞外TNF激活与释放, TNF作用于肿瘤坏死因子受体1(tumor necrosis receptor 1, TNFR1), TNFR1和胞质中的RIPK1组成早期复合物, 激活炎症通路。当Caspase8活性受抑制时, 去泛素化的RIPK1招募RIPK3后, RIPK1和RIPK3相互磷酸化并形成坏死复合物(necrosome), 坏死复合物招募MLKL, 同时MLKL被RIPK3磷酸化, MLKL磷酸化后由单体转变为有活性的寡聚体, MLKL寡聚体能破坏细胞器膜和质膜的完整性, 进而激发细胞坏死进程[22-28]。本研究中的实时荧光定量结果表明, 乳腺炎乳腺组织中Caspase8 mRNA表达量极显著下降, RIPK1和RIPK3 mRNA表达量极显著上升, 而MLKL表达量没有显著变化, 说明细胞程序性坏死可能对奶牛乳腺炎的发生具有重要的作用。
细胞程序性坏死通路中, MLKL磷酸化后激活坏死通路, 致使细胞发生程序性坏死[29-31], 因此p-MLKL在细胞程序性坏死过程中作用至关重要。Western blot结果表明, 乳腺炎乳腺组织中, p-MLKL表达量显著升高, 与组织中的mRNA定量结果一致。
本研究通过炎性细胞因子(TNF-α、IL-1β、IL-6)和程序性坏死相关因子基因(Caspase8、RIPK1和RIPK3)mRNA表达量以及MLKL和p-MLKL蛋白表达量检测及差异分析, 说明乳腺炎乳腺组织中存在细胞程序性坏死。
| [1] |
张瑜, 朱俊平, 王晓艺. 奶牛乳房炎治疗技术的研究进展[J]. 湖北畜牧兽医, 2016, 37(12): 11-13. Zhang Y, Zhu J P, Wang X Y. Progress in the research of cow mastitis treatment technology[J]. Hubei Journal of Animal and Veterinary Sciences, 2016, 37(12): 11-13 (in Chinese). DOI:10.3969/j.issn.1007-273X.2016.12.005 |
| [2] |
张娜. 奶牛乳房炎的病因与综合防治措施[J]. 农业工程技术, 2016(11): 59. Zhang N. The cause of dairy cow mastitis and comprehensive prevention and control measures[J]. Agricultural Engineering Technology, 2016(11): 59 (in Chinese). |
| [3] |
Zhao X, Lacasse P. Mammary tissue damage during bovine mastitis:causes and control[J]. Journal of Animal Science, 2008, 86(13): 57-65. |
| [4] |
Long E, Capuco A V, Wood D L, et al. Escherichia coli induces apoptosis and proliferation of mammary cells[J]. Cell Death Differ, 2001, 8(8): 808-816. DOI:10.1038/sj.cdd.4400878 |
| [5] |
Bannerman D D, Paape M J, Lee J W, et al. Escherichia coli and Staphylococcus aureus elicit differential innate immune responses following intramammary infection[J]. Clin Diagn Lab Immunol, 2004, 11(3): 463-472. |
| [6] |
Rainard P, Riollet C. Innate immunity of the bovine mammary gland[J]. Veterinary Research, 2015, 37(3): 369-400. |
| [7] |
王芳, 贾勇生, 佟仲生. 混合系激酶区域样蛋白的研究进展[J]. 生理科学进展, 2015, 46(4): 265-268. Wang F, Jia Y S, Tong Z S. Research progress in mixed lineage kinase komain-like[J]. Progress in Physiological Sciences, 2015, 46(4): 265-268 (in Chinese with English abstract). |
| [8] |
Sun L, Wang H, Wang Z, et al. Mixed lineage kinase domain-like protein mediates necrosis signaling downstream of RIPKK3 kinase[J]. Cell, 2012, 148(1/2): 213-227. |
| [9] |
Zhao J, Jitkaew S, Cai Z, et al. Mixed lineage kinase domain-like is a key receptor interacting protein 3 downstream component of TNF-induced necrosis[J]. Proc Natl Acad Sci USA, 2012, 109(14): 5322-5327. DOI:10.1073/pnas.1200012109 |
| [10] |
Oerlemans M I, Liu J, Arslan F, et al. Inhibition of RIPK1-dependent necrosis prevents adverse cardiac remodeling after myocardial ischemia-reperfusion in vivo[J]. Basic Res Cardiol, 2012, 107(4): 270. DOI:10.1007/s00395-012-0270-8 |
| [11] |
Mareninova O A, Sung K F, Hong P, et al. Cell death in pancreatitis:caspases protect from necrotizing pancreatitis[J]. J Biol Chem, 2006, 281(6): 3370-3381. DOI:10.1074/jbc.M511276200 |
| [12] |
Wu W, Liu P, Li J. Necroptosis:an emerging form of programmed cell death[J]. Crit Rev Oncol Hematol, 2012, 82(3): 249-258. DOI:10.1016/j.critrevonc.2011.08.004 |
| [13] |
Alain K, Karrow N A, Thibault C, et al. Osteopontin:an early innate immune marker of Escherichia coli mastitis harbors genetic polymorphisms with possible links with resistance to mastitis[J]. BMC Genomics, 2009, 10: 444. DOI:10.1186/1471-2164-10-444 |
| [14] |
余盼, 孙宇, 李莲, 等. 乳房炎奶牛乳腺组织中TLR4/p38的表达差异分析[J]. 南京农业大学学报, 2015, 38(6): 967-972. Yu P, Sun Y, Li L, et al. Alteredexpressions of TLR4/p38 singaling pathway in mammary tissue of Chinese Holstein cows with mastitis[J]. Journal of Nanjing Agricultural University, 2015, 38(6): 967-972 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2015.06.014 |
| [15] |
Degterev A, Huang Z, Boyce M, et al. Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury[J]. Nat Chem Biol, 2005, 1(2): 112-118. DOI:10.1038/nchembio711 |
| [16] |
Cho Y S, Challa S, Moquin D, et al. Phosphorylation-driven assembly of the RIPKK1-RIPKK3 complex regulates programmed necrosis and virus-induced inflammation[J]. Cell, 2009, 137(6): 1112-1123. DOI:10.1016/j.cell.2009.05.037 |
| [17] |
Declercq W, Vanden B T, Vandenabeele P. RIPK kinases at the crossroads of cell death and survival[J]. Cell, 2009, 138(2): 229-232. DOI:10.1016/j.cell.2009.07.006 |
| [18] |
Chen X, Li W, Ren J, et al. Translocation of mixed lineage kinase domain-like protein to plasma membrane leads to necrotic cell death[J]. Cell Res, 2014, 24(1): 105-121. DOI:10.1038/cr.2013.171 |
| [19] |
Cai Z, Jitkaew S, Zhao J, et al. Plasma membrane translocation of trimerized MLKL protein is required for TNF-induced necroptosis[J]. Nat Cell Biol, 2014, 16(1): 55-65. DOI:10.1038/ncb2883 |
| [20] |
Wang H, Sun L, Su L, et al. Mixed lineage kinase domain-like protein MLKL causes necrotic membrane disruption upon phosphorylation by RIPKK3[J]. Mol Cell, 2014, 54(1): 133-146. DOI:10.1016/j.molcel.2014.03.003 |
| [21] |
Liu M, Song S, Li H, et al. The protective effect of caffeic acid against inflammation injury of primary bovine mammary epithelial cells induced by lipopolysaccharide[J]. J Dairy Sci, 2014, 97(5): 2856-2865. DOI:10.3168/jds.2013-7600 |
| [22] |
Linkermann A, Green D R. Necroptosis[J]. N Engl J Med, 2014, 370: 455-465. DOI:10.1056/NEJMra1310050 |
| [23] |
Han J, Zhong C Q, Zhang D W. Programmed necrosis:backup to and competitor with apoptosis in the immune system[J]. Nat Immunol, 2011, 12: 1143-1149. DOI:10.1038/ni.2159 |
| [24] |
Pasparakis M, Vandenabeele P. Necroptosis and its role in inflammation[J]. Nature, 2015, 517(7534): 311-320. DOI:10.1038/nature14191 |
| [25] |
Orozco S, Yatim N, Werner M R, et al. RIPKK1 both positively and negatively regulates RIPKK3 oligomerization and necroptosis[J]. Cell Death Differ, 2014, 21: 1511-1521. DOI:10.1038/cdd.2014.76 |
| [26] |
Murphy J M, Czabotar P E, Hildebrand J M, et al. The pseudokinase MLKL mediates necroptosis via a molecular switch mechanism[J]. Immunity, 2013, 39: 443-453. DOI:10.1016/j.immuni.2013.06.018 |
| [27] |
Vandenabeele P, Galluzzi L, van den Berghe T, et al. Molecular mechanisms of necroptosis:an ordered cellular explosion[J]. Nat Rev Mol Cell Biol, 2010, 11(10): 700-714. DOI:10.1038/nrm2970 |
| [28] |
Wu X N, Yang Z H, Wang X K. Distinct roles of RIPKK1-RIPKK3 hetero-and RIPKK1-RIPKK3 homo-interaction in mediating necroptosis[J]. Cell Death Differ, 2014, 21: 1709-1720. DOI:10.1038/cdd.2014.77 |
| [29] |
姚志兰, 崔平福, 宗佳丽, 等. 奶牛泌乳启动调控激素的研究进展[J]. 畜牧与兽医, 2018, 50(8): 129-132. Yao Z L, Cui P F, Zong J L, et al. A review of research on hormones regulating initiation of lactating in dairy cow[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(8): 129-132 (in Chinese with English abstract). |
| [30] |
He S, Wang L, Miao L, et al. Receptor interacting protein kinase-3 determines cellular necrotic response to TNF-alpha[J]. Cell, 2009, 137(6): 1100-1111. DOI:10.1016/j.cell.2009.05.021 |
| [31] |
Degterev A, Hitomi J, Germscheid M, et al. Identification of RIPKK1 kinase as aspecific cellular target of necrostatins[J]. Nat Chem Biol, 2008, 4(5): 313-321. DOI:10.1038/nchembio.83 |




