文章信息
- 杨方晓, 李莲, 赵若含, 王根林
- YANG Fangxiao, LI Lian, ZHAO Ruohan, WANG Genlin
- 褪黑素对HT-2毒素诱导的牛卵巢颗粒细胞内质网应激与自噬的影响
- Effects of melatonin on endoplasmic reticulum stress and autophagy in bovine ovarian granulosa cells induced by HT-2 toxin
- 南京农业大学学报, 2020, 43(1): 143-150
- Journal of Nanjing Agricultural University, 2020, 43(1): 143-150.
- http://dx.doi.org/10.7685/jnau.201812028
-
文章历史
- 收稿日期: 2018-12-18
卵巢颗粒细胞为卵母细胞提供营养, 促进卵母细胞发育, 颗粒细胞的损伤可以影响其对卵母细胞的营养供应并破坏卵母细胞-颗粒细胞的连接, 导致卵母细胞的降解和死亡[1]。T-2是由镰刀菌产生的霉菌毒素, 是食品和动物饲料中常见的污染物[2]。T-2毒素在体内和体外的主要代谢产物为HT-2。通常HT-2会对家畜和人类造成严重的健康问题, 特别是在生殖健康方面, HT-2可以透过胎盘屏障对胎儿造成伤害[3]。体内研究显示, HT-2毒素可通过影响细胞凋亡、自噬、氧化应激和表观遗传修饰来降低小鼠卵母细胞成熟能力[4]。T-2和HT-2毒素联合IGF-I可以改变猪卵巢颗粒细胞的孕酮分泌, 还可能影响卵巢中类固醇生成的过程[5]。T-2毒素对早期胚胎发育有害, 导致胚泡比例下降, 胚胎发育迟缓, 染色质损伤率增加[6]。体外试验显示, T-2毒素造成小鼠睾丸间质细胞[7]和大鼠卵巢颗粒细胞[8]发生凋亡和氧化应激。
褪黑素(N-乙酰-5-甲氧色胺)已被证明对细胞氧化和炎症损伤具有广泛的保护作用, 褪黑素及其代谢产物能清除自由基并减少ROS的产生[9]。在霉菌毒素相关研究中, 褪黑素可改善呕吐毒素对小鼠卵母细胞成熟和早期胚胎卵裂的不利影响[10]。因此, 褪黑素可能是预防或治疗真菌毒素引起的生殖障碍的潜在药物。目前, 关于HT-2毒素在牛卵巢颗粒细胞的作用仍不清楚, 褪黑素对其的作用机制也不明确。本研究以牛卵巢颗粒细胞为试验材料, 分析HT-2毒素对牛卵巢颗粒细胞内质网应激和自噬的影响以及褪黑素在上述过程中的作用, 探索霉菌毒素对动物繁殖性能的作用机制, 为生产中防治霉菌毒素对奶牛繁殖功能的影响提供依据。
1 材料与方法 1.1 试剂HT-2毒素(#34136)和褪黑素(Mel, #M5250)购自Sigma-Aldrich公司; 胎牛血清(FBS)、DMEM/F12培养基购自福麦斯生物技术有限公司; CCK-8试剂盒购自南京建成生物研究所; BCA试剂盒购自碧云天生物技术研究所; Trizol试剂购自Invitrogen公司; PrimeScriptTM RT Master Mix、SYBR Premix Ex Taq Ⅱ购于TaKaRa公司。促卵泡激素受体(FSHR)、葡萄糖调节蛋白GRP78(11587-AP)和增强子结合蛋白同源蛋白CHOP(15204-AP)抗体购自武汉Proteintech公司; GAPDH(#5174)购自CST公司; LC3-Ⅱ(AB100-2220)和P62(H00000644-M01)抗体购于NOVUS公司。
1.2 卵巢颗粒细胞培养和处理奶牛卵巢采自南京市浦口区家虎牛羊屠宰场, 装入加有链霉素和青霉素的PBS中, 于30 ℃、4 h内运回试验室。PBS清洗2次后, 从卵巢表面2~6 mm的卵泡中抽取卵泡液, 用DMEM洗涤离心(900 r·min-1、6 min)2次, 接种在培养板上, 置于二氧化碳培养箱内, 37 ℃、5% CO2、饱和湿度培养。12 h待细胞贴壁后, 轻轻更换培养基以除去死细胞, 每24 h换液1次, 待细胞长至80%~90%汇合时, 进行细胞消化传代培养[11]。然后将细胞分为对照组和处理组。在HT-2毒素对细胞影响的试验中, 分别以0.5、25、50、75和100 nmol·L-1 HT-2毒素处理细胞24 h, 再根据对细胞增殖影响的结果选择50 nmol·L-1 HT-2用于后续的褪黑素挽救试验。在褪黑素对HT-2毒素诱导的细胞挽救试验中, 分别以0、0.01、0.1、1、10、100、1 000 μmol·L-1褪黑素处理细胞12 h, 再用50 nmol·L-1 HT-2毒素处理24 h。使用二甲亚砜(DMSO)溶解褪黑素, 再用水定容。在挽救试验中设加入DMSO的为阴性对照组。
1.3 免疫荧光法鉴定牛卵巢颗粒细胞将牛卵巢颗粒细胞接种于细胞爬片, 待细胞长到70~80%汇合时, 吸出培养基, PBS洗涤3次(每次3 min), 每孔加1 mL 4%多聚甲醛固定细胞1 h, PBS洗涤后, 用0.5% Triton-X100处理10 min, PBS洗涤2次, 20 g·L-1 BSA封闭1 h。对照组不加入FSHR抗体, 试验组加入稀释好的FSHR兔多克隆抗体(1 : 500), 4 ℃孵育过夜, PBS洗涤; 加二抗羊抗兔IgG(1:500)室温孵育1 h, PBS洗涤3次; 加入Hoechst 33342染核10 min, PBS洗涤3次后, 用DAPI染液的封片剂进行封片, 置于激光共聚焦显微镜下观察染色情况并拍照[12]。
1.4 CCK-8检测细胞增殖状况细胞处理结束后, 吸出培养基, PBS洗涤3次(每次3 min), 每孔加入100 μL CCK-8溶剂, 放入细胞培养箱37 ℃孵育5 h, 测量吸光值A450。每个样品重复5次, 取平均值。
1.5 应激和自噬相关基因的RT-qPCR测定收集细胞, 按Trizol试剂盒说明书提取细胞总RNA。取1 000 ng总RNA用TaKaRa的试剂盒反转录成cDNA, -80 ℃保存备用。按照SYBR qPCR试剂盒检测mRNA的表达水平。反应产物经熔解曲线检测特异性。用2-ΔΔCT计算各基因相对表达量[13]。引物序列见表 1。
| 基因Gene | 基因登录号GenBank ID | 引物对序列Prime pairs sequences(5'→3') |
| Atg7 | NM_001142967.1 | CAAGAGAGACCGGGATGA/GCTCAGAACCGGTGGGATGA |
| CHOP | NM_001078163.1 | TGAAAGGAAAGTGGCACAGC/ACTGTTCATGCTTGGTGCAG |
| p62 | NM_176641.1 | CTCCGGAAGCTGAAACATGG/ACTGGGATCTTCCGATGGAC |
| GRP78 | AJ586431.1 | TCACCTCCAATCCGGAGAAC/CTTTGTTTGCCCACCTCCAA |
| β-actin | X00182.1 | CATGCCATCCTCCGTCTGGA/CTCTCGGCTGTGGTGGTGAA |
| 注: Atg7 :自噬相关基因7 Autophagy-related gene 7;CHOP:C/EBP同源蛋白基因C/EBP-homologous protein gene; p62 :选择性自噬接头蛋白p62基因Selective adaptor protein autophagy of p62 gene; GRP78 :葡萄糖调节蛋白78基因Glucose-regulated protein 78 gene; β-actin:β-肌动蛋白基因β-actin gene. | ||
收集细胞, 加入含PMSF的裂解液, 冰上裂解30 min, 每5 min摇匀1次。用刮刀收集细胞后, 15 000 r·min-1离心15 min, 收集上清液, BCA试剂盒检测蛋白浓度。加入上样缓冲液, 100 ℃变性10 min, 用预制胶电泳分离, 电泳结束后湿转法转移到硝酸纤维膜上, 用50 g·L-1脱脂牛奶室温封闭1 h。分别加单克隆抗体(GAPDH、GRP78、CHOP、LC3B、P62)4 ℃过夜孵育。加二抗(HRP标记的羊抗兔IgG)孵育1 h, 用化学发光法显示结果, 用Image J进行条带的灰度分析[13]。
1.7 统计分析用GraphPad 6.0软件(GraphPad software Inc., USA)进行方差分析(ANOVA), 用t测验分析各组间的差异显著性。试验重复3次, 所有数据均表示为x±SE。
2 结果与分析 2.1 牛卵巢颗粒细胞的鉴定FSHR只存在于卵巢颗粒细胞, 绿色荧光表明该细胞为FSHR阳性细胞。由图 1结果可知:95%以上的细胞为牛卵巢颗粒细胞, 且生长状态良好, 可用于后续试验。
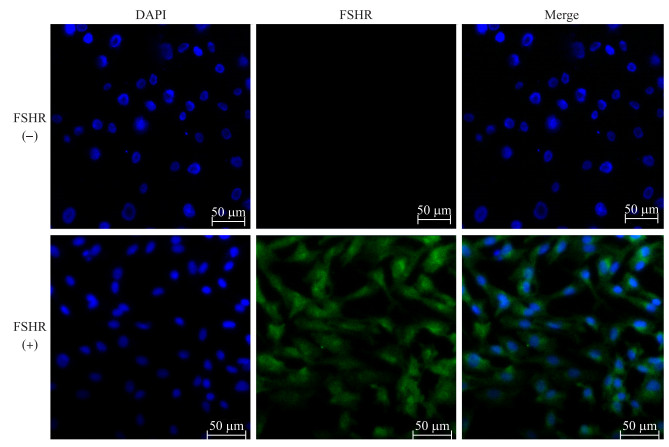
|
图 1 FSHR免疫荧光染色鉴定牛卵巢颗粒细胞 Fig. 1 Identification of bovine granulosa cells by FSHR immunofluorescence |
牛卵巢颗粒细胞经不同浓度(0、5、25、50、75和100 nmol·L-1)HT-2毒素处理24 h, 结果如图 2所示:随HT-2毒素浓度增加, 细胞活力呈浓度依赖性降低, 50 nmol·L-1 HT-2毒素处理24 h, 细胞活力约为50%。后期进行褪黑素挽救试验时, 选择50 nmol·L-1 HT-2处理细胞。牛卵巢颗粒细胞分别经(0、0.01、0.1、1、10、100、1 000 μmol·L-1)褪黑素预处理12 h, 再用50 nmol·L-1 HT-2处理细胞24 h, 结果如图 3所示:当褪黑素浓度为10 μmol·L-1时, 细胞增殖显著增加(P < 0.05), 当褪黑素浓度为100 μmol·L-1时, 细胞增殖极显著增加(P < 0.01)。因此, 选择100 μmol·L-1褪黑素进行后续试验。
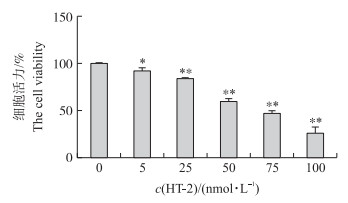
|
图 2 HT-2毒素对牛卵巢颗粒细胞增殖的影响 Fig. 2 The effect of HT-2 toxin on the proliferation of bovine ovary granulocytes *P < 0.05, **P < 0.01, ***P < 0.001. The same as follows. |

|
图 3 不同浓度褪黑素(Mel)预处理对50 nmol·L-1 HT-2诱导细胞增殖减少的影响 Fig. 3 The effect of different concentrations of melatonin (Mel)pretreatment on 50 nmol·L-1 HT-2-induced cell proliferation reduction Ctrl:空白对照, 不加HT-2和Mel Without any treatment |
通过RT-qPCR和Western blot检测细胞内质网应激相关基因CHOP和GRP78 mRNA和蛋白的表达, 进一步检测HT-2对卵巢颗粒细胞的作用。从图 4可知:与对照组相比, HT-2处理组CHOP和GRP78 mRNA表达显著上调, 且呈浓度依赖性。HT-2处理导致CHOP和GRP78蛋白表达上调(P < 0.01)。结果进一步表明HT-2毒素通过调控内质网应激相关基因mRNA和蛋白的表达, 来促进牛卵巢颗粒细胞发生内质网应激反应。

|
图 4 HT-2毒素对内质网应激相关基因CHOP和GRP78 mRNA(A、B)及其蛋白(C、D)表达水平的影响 Fig. 4 Effects of HT-2 toxin on the expression level of endoplasmic reticulum stress-related genes CHOP and GRP78 (A, B)and their proteins(C, D) |
采用RT-qPCR检测细胞内自噬相关基因Atg7和p62 mRNA的表达。如图 5-A和5-B所示:与对照组相比, HT-2毒素处理组Atg7 mRNA表达呈浓度依赖性升高, 而p62 mRNA的表达则相应降低。Western blot检测自噬相关蛋白LC3-Ⅱ和P62的变化情况(图 5-C)。HT-2毒素诱导细胞发生浓度依赖性自噬(图 5-D)。从免疫荧光染色结果(图 6)可见:HT-2诱导细胞发生自噬, 红色为LC3-Ⅱ阳性, 细胞呈浓度依赖性自噬。HT-2可能是通过上调LC3- Ⅱ基因表达, 同时下调p62基因的表达来促进牛卵巢颗粒细胞发生自噬。

|
图 5 HT-2毒素对自噬激相关基因mRNA(A、B)和蛋白(C、D)表达的影响 Fig. 5 Effects of HT-2 toxin on the expression of autophagy-related genes(A, B)and proteins(C, D) |

|
图 6 HT-2毒素对牛卵巢颗粒细胞LC3-Ⅱ免疫荧光的影响 Fig. 6 Effect of HT-2 toxin on LC3-Ⅱ immunofluorescence in bovine ovarian granulosa cells |
如图 7-A所示:褪黑素预处理极显著抑制HT-2毒素引起的CHOP mRNA表达升高(P < 0.01);图 7-B显示:褪黑素预处理极显著下调HT-2毒素诱导的GRP78 mRNA表达升高(P < 0.01), 与Western blot检测蛋白表达趋势一致。褪黑素预处理显著逆转HT-2毒素引起的CHOP蛋白表达上调(图 7-C、D), 显著抑制HT-2毒素诱导的GRP78蛋白表达升高(P < 0.05)。
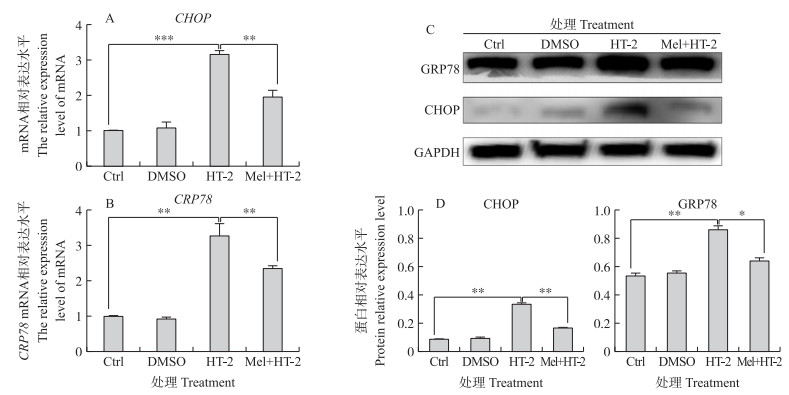
|
图 7 褪黑素处理对HT-2毒素诱导的细胞内质网应激相关基因(A、B)和蛋白(C、D)的影响 Fig. 7 Effect of melatonin treatment on endoplasmic reticulum stress-related genes(A, B) and proteins(C, D)induced by HT-2 toxin Ctrl:对照组Control group; DMSO:二甲基亚砜处理DMSO treatment; HT-2:50 nmol·L-1 HT-2, 24 h; Mel+HT-2:100 μmol·L-1 Mel, 12 h, 50 nmol·L-1 HT-2, 24 h。图 8同此The same as in the Fig. 8. |
如图 8-A、B所示:褪黑素极显著抑制了HT-2毒素诱导的Atg7 mRNA表达的上调(P < 0.01), 褪黑素极显著减轻了HT-2毒素引起的p62 mRNA和蛋白表达下调(P < 0.01)。Western blot检测结果(如图 8-C、D)显示:褪黑素处理显著降低HT-2毒素诱导的LC3-Ⅱ蛋白表达上调(P < 0.05)。

|
图 8 褪黑素对HT-2毒素诱导细胞自噬的影响 Fig. 8 Effect of melatonin on autophagy induced by HT-2 toxin |
霉菌毒素HT-2会对动物健康造成不良影响, HT-2毒素与生殖疾病之间存在关联, 但HT-2毒素在卵巢颗粒细胞的作用机制尚未阐明。本试验中, 我们发现HT-2毒素通过引起内质网应激和自噬发挥毒性, 进一步发现褪黑素能够有效缓解HT-2毒素诱导的内质网应激和自噬。
HT-2毒素以剂量依赖性方式抑制细胞活力。内质网是一种控制蛋白质生物合成和运输并维持细胞稳态的重要细胞器, 细胞发生氧化应激会引起内质网稳态被破坏, 引发未折叠蛋白反应来维持细胞存活和重建体内平衡[14]。为了进一步阐明HT-2毒素在内质网应激中的作用, 我们检测了内质网应激标记蛋白——增强子结合蛋白同源蛋白CHOP和葡萄糖调节蛋白GRP78。未折叠反应蛋白(UPR)是内质网应激过程中的主要保护和补偿蛋白。CHOP在ER应激诱导的细胞凋亡中发挥收敛作用, 并控制一组参与凋亡的应激诱导基因的表达。GRP78是UPR的中枢调节因子, 被广泛用作ER应激标记物[15]。通过RT-qPCR和Westein blot检测发现HT-2毒素诱导CHOP和GRP78表达呈浓度依赖性, 说明HT-2毒素暴露导致牛卵巢颗粒细胞发生内质网应激。有研究表明内质网应激可能是一种新型的自噬诱导剂[16]。当细胞长期暴露于不利条件下, UPR的保护机制可能无法维持内质网的功能改变, 随后导致自噬依赖性细胞死亡[17]。自噬是真核生物中通过自噬体形成和溶酶体降解来降解和再循环细胞质组分的复杂分解代谢过程[18]。几乎所有受损的细胞膜都是选择性自噬的基质, 而过度的自噬对细胞生存不利。HT-2毒素会引起颗粒细胞内质网应激, 为了揭示过度的内质网应激是否导致细胞发生自噬依赖性死亡, 我们对自噬关键基因和蛋白进行测定, 发现HT-2毒素诱导自噬关键基因LC3- Ⅱ和Atg7表达呈剂量依赖性上调。p62水平与自噬激活相关基因Atg7呈负相关, 这是自噬体与溶酶体融合的必要条件。RT-qPCR和Western blot结果显示P62表达随HT-2毒素浓度增加而下调。这与Zhu等[4]研究证明HT-2毒素诱导卵母细胞发生过度自噬的结果一致。从癌细胞自噬相关研究中发现内质网应激通过转录激活因子和CHOP导致LC3B和自噬相关蛋白的转录上调[19]。我们的研究表明HT-2毒素可能诱导细胞发生内质网应激而促进自噬发生。
褪黑素被证明是一种存在于卵巢的抗氧化剂, 有助于提高卵母细胞质量[20], 提高受精成功率和妊娠成功率[21]。研究发现, 褪黑素能够显著降低缺血过程中的内质网应激, 抑制未折叠蛋白活化[22]。褪黑素还能够保护大鼠生殖系统免受霉菌毒素伤害[23-24]。褪黑素在大鼠中也显示出了对霉菌毒素的抗性, 改善了脱氧雪腐镰刀菌烯醇对小鼠卵母细胞成熟和早期胚胎分裂的不利影响[10]。为了检测褪黑素是否能够缓解HT-2毒素诱导的细胞内质网应激和自噬, 本研究中通过CCK-8测定发现100 μmol·L-1褪黑素预处理对HT-2毒素抑制的细胞增殖具有显著缓解作用, 于是选择100 μmol·L-1进行后续试验。褪黑素通过降低CHOP、GRP78表达来缓解内质网应激。内质网应激的异常激活涉及许多疾病的发病机制, 内质网应激也导致自噬[22], 而褪黑素可以通过抑制卵巢的颗粒细胞自体吞噬来发挥保护作用[23]。过度的自噬会对细胞造成损伤, 一定浓度的褪黑素对HT-2毒素诱导的牛卵巢颗粒细胞过度自噬具有抑制作用, 并逆转HT-2毒素引起的LC3-Ⅱ表达上调, 从而减轻过度自噬对细胞的负面作用。
综上所述, HT-2毒素具有抑制牛卵巢颗粒细胞增殖, 诱导细胞发生内质网应激和自噬的作用, 而褪黑素可以改善HT-2毒素引起的内质网应激和自噬作用。
| [1] |
Zhang T, He W H, Feng L L, et al. Effect of doxorubicin-induced ovarian toxicity on mouse ovarian granulosa cells[J]. Regul Toxicol Pharmacol, 2017, 86: 1-10. |
| [2] |
Karacaoglu E, Selmanoglu G. T-2 toxin induces cytotoxicity and disrupts tight junction barrier in SerW3 cells[J]. Environ Toxicol Pharmacol, 2017, 56: 259-267. DOI:10.1016/j.etap.2017.10.005 |
| [3] |
Wang X, Wang W, Cheng G, et al. High risk of embryo-fetal toxicity:placental transfer of T-2 toxin and its major metabolite HT-2 toxin in BeWo cells[J]. Toxicol Sci, 2014, 137(1): 168-178. DOI:10.1093/toxsci/kft233 |
| [4] |
Zhu C C, Zhang Y, Duan X, et al. Toxic effects of HT-2 toxin on mouse oocytes and its possible mechanisms[J]. Arch Toxicol, 2016, 90(6): 1495-1505. DOI:10.1007/s00204-015-1560-3 |
| [5] |
Maruniakova N, Kadasi A, Sirotkin A V, et al. T-2 toxin and its metabolite HT-2 toxin combined with insulin-like growth factor-Ⅰmodify progesterone secretion by porcine ovarian granulosa cells[J]. J Environ Sci Health A, 2014, 49(4): 404-409. DOI:10.1080/10934529.2014.854650 |
| [6] |
Somoskoi B, Kovacs M, Cseh S. Effects of T-2 mycotoxin on in vitro development and chromatin status of mouse embryos in preimplantation stages[J]. ToxicolaInd Health, 2016, 32(7): 1260-1265. |
| [7] |
Zhang Y F, Yang J Y, Li Y K, et al. Toxicity and oxidative stress induced by T-2 toxin in cultured mouse Leydig cells[J]. Toxicol Mech Methods, 2017, 27(2): 100-106. DOI:10.1080/15376516.2016.1258747 |
| [8] |
Wu J, Tu D, Yuan L Y, et al. T-2 toxin exposure induces apoptosis in rat ovarian granulosa cells through oxidative stress[J]. Environ Toxicol Pharmacol, 2013, 36(2): 493-500. DOI:10.1016/j.etap.2013.03.017 |
| [9] |
Zhang H M, Zhang Y. Melatonin:a well-documented antioxidant with conditional pro-oxidant actions[J]. J Pineal Res, 2014, 57(2): 131-146. DOI:10.1111/jpi.12162 |
| [10] |
Lan M, Han J, Pan M H, et al. Melatonin protects against defects induced by deoxynivalenol during mouse oocyte maturation[J]. J Pineal Res, 2018, 65(1): e12477. DOI:10.1111/jpi.12477 |
| [11] |
Yao W, Pan Z, Du X, et al. miR-181b-induced SMAD7 downregulation controls granulosa cell apoptosis through TGF-beta signaling by interacting with the TGFBR1 promoter[J]. J Cell Physiol, 2018, 233(9): 6807-6821. DOI:10.1002/jcp.26431 |
| [12] |
Burry R W. Controls for immunocytochemistry:an update[J]. J Histochem Cytochem, 2011, 59(1): 6-12. DOI:10.1369/jhc.2010.956920 |
| [13] |
Chen K L, Li L, Yang F X, et al. SIRT7 depletion inhibits cell proliferation, migration, and increases drug sensitivity by activating p38MAPK in breast cancer cells[J]. J Cell Physiol, 2018, 233(9): 6767-6778. DOI:10.1002/jcp.26398 |
| [14] |
Szpigel A, Hainault I, Carlier A, et al. Lipid environment induces ER stress, TXNIP expression and inflammation in immune cells of individuals with type 2 diabetes[J]. Diabetologia, 2018, 61(2): 399-412. DOI:10.1007/s00125-017-4462-5 |
| [15] |
Lin P, Chen F, Sun J, et al. Mycotoxin zearalenone induces apoptosis in mouse Leydig cells via an endoplasmic reticulum stress-dependent signalling pathway[J]. Reprod Toxicol, 2015, 52: 71-77. DOI:10.1016/j.reprotox.2015.02.007 |
| [16] |
Zeng M, Sang W, Chen S, et al. 4-PBA inhibits LPS-induced inflammation through regulating ER stress and autophagy in acute lung injury models[J]. Toxicol Lett, 2017, 271: 26-37. DOI:10.1016/j.toxlet.2017.02.023 |
| [17] |
Hsu H C, Li S J, Chen C Y, et al. Eicosapentaenoic acid protects cardiomyoblasts from lipotoxicity in an autophagy-dependent manner[J]. Cell Biol Toxicol, 2018, 34(3): 177-189. DOI:10.1007/s10565-017-9406-9 |
| [18] |
Li Y, Zhang Z, He C, et al. Melatonin protects porcine oocyte in vitro maturation from heat stress[J]. J Pineal Res, 2015, 59(3): 365-375. DOI:10.1111/jpi.12268 |
| [19] |
Acuna-Castroviejo D, Escames G, Venegas C, et al. Extrapineal melatonin:sources, regulation, and potential functions[J]. Cell Mol Life Sci, 2014, 71(16): 2997-3025. DOI:10.1007/s00018-014-1579-2 |
| [20] |
Carloni S, Albertini M C, Galluzzi L, et al. Melatonin reduces endoplasmic reticulum stress and preserves sirtuin 1 expression in neuronal cells of newborn rats after hypoxia-ischemia[J]. J Pineal Res, 2014, 57(2): 192-199. DOI:10.1111/jpi.12156 |
| [21] |
Malekinejad H, Mirzakhani N, Razi M, et al. Protective effects of melatonin and Glycyrrhiza glabra extract on ochratoxin A-induced damages on testes in mature rats[J]. Hum Exp Toxicol, 2011, 30(2): 110-123. DOI:10.1177/0960327110368416 |
| [22] |
Fernandez A, Ordonez R, Reiter R J, et al. Melatonin and endoplasmic reticulum stress:relation to autophagy and apoptosis[J]. J Pineal Res, 2015, 59(3): 292-307. DOI:10.1111/jpi.12264 |
| [23] |
Shen M, Cao Y, Jiang Y, et al. Melatonin protects mouse granulosa cells against oxidative damage by inhibiting FOXO1-mediated autophagy:implication of an antioxidation-independent mechanism[J]. Redox Biol, 2018, 18: 138-157. DOI:10.1016/j.redox.2018.07.004 |
| [24] |
司梦雪, 王冰洁, 冯楠楠, 等. 自噬在玉米赤霉烯酮诱导TM4细胞凋亡中的作用[J]. 畜牧与兽医, 2018, 50(8): 104-109. Si M X, Wang B J, Feng N N, et al. Effect of autophagy on apoptosis induced by zearalenone in TM4 cells[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(8): 104-109 (in Chinese with English abstract). |




