文章信息
- 安雪姣, 赵生国, 潘章源, 张仁森, 田志龙, 马琳, 蔡原, 储明星
- AN Xuejiao, ZHAO Shengguo, PAN Zhangyuan, ZHANG Rensen, TIAN Zhilong, MA Lin, CAI Yuan, CHU Mingxing
- 绵羊DIO2基因组织表达及其多态性与产羔数关联分析
- Tissue expression and polymorphism of sheep DIO2 gene and their association with litter size
- 南京农业大学学报, 2020, 43(1): 134-142
- Journal of Nanjing Agricultural University, 2020, 43(1): 134-142.
- http://dx.doi.org/10.7685/jnau.201811020
-
文章历史
- 收稿日期: 2018-11-13
2. 甘肃农业大学动物科学技术学院, 甘肃 兰州 730070;
3. 临沂大学农林科学学院, 山东 临沂 276005
2. College of Animal Science and Technology, Gansu Agricultural University, Lanzhou 730070, China;
3. College of Agricultural and Forestry Science, Linyi University, Linyi 276005, China
甲状腺激素(TH)通过甲状腺激素脱碘酶(DIO)调控动物机体内的代谢平衡, 并在动物的季节性繁殖中起着重要作用[1]。甲状腺激素脱碘酶属于硒蛋白家族, 根据其特征主要分为:1~3型脱碘酶(DIO1—DIO3)3类[2]。其中DIO1主要存在于动物机体的内质网和线粒体膜上, DIO2主要分布于垂体、肝脏、肾脏、甲状腺等组织中[3], DIO3主要分布于垂体、胎盘、棕色脂肪(BAT)等组织中[4]。由于组织分布及酶活性的不同, 这3种脱碘酶在机体内的生理作用也不同[5]。DIO2、DIO3的主要功能是调控甲状腺激素(T2、T3、T4、rT3)的动态平衡, 其中DIO2催化T3转变成T4, DIO3则将T3、T4转变成T2和rT3[6]。T3、T4在机体内的含量变化与动物繁殖状态的季节性变换显著相关[7]。DIO2在机体下丘脑-垂体轴促甲状腺激素(TSH)分泌的负反馈调节中起重要作用, 其中TSH与下丘脑基底部(MBH)的促甲状腺激素受体(TSHR)结合介导了DIO2的升高, 使T4转化为T3, 导致促性腺激素(GnRH)的释放产生差异, 影响垂体激素的分泌, 从而调控性腺的生理活动[8]。研究发现, 季节性繁殖动物黑线仓鼠在长光照时DIO2基因的表达量显著高于短光照, 由于DIO2基因表达量增加, 机体内T3浓度升高, 同时高浓度T3又会导致GnRH分泌减少, 终止繁殖状态, 启动休情期[9-10]。
本研究以常年发情的小尾寒羊和季节性发情的草地型藏羊为试验动物, 分别采集其下丘脑-垂体-卵巢这一生殖轴上的10种组织, 检测DIO2基因在这2个绵羊品种组织中的表达差异, 并对重测序筛选出的DIO2基因g.88484594T>C和g.88484603G>C位点在小尾寒羊、湖羊、苏尼特羊、滩羊、策勒黑羊、草地型藏羊等6个绵羊品种中的多态性进行研究, 探讨DIO2基因在绵羊季节性繁殖中的作用, 以及DIO2基因多态性与小尾寒羊产羔数的关系, 为进一步开展绵羊季节性繁殖研究和分子标记辅助育种提供参考依据。
1 材料与方法 1.1 试验材料 1.1.1 试验样品采集及处理基因表达试验:随机选择生长状况良好、年龄相同(2~3岁)、体况一致的西藏当雄县的草地型藏羊和山东省郓城县的小尾寒羊经产空怀母羊各3只。屠宰后迅速采集大脑、小脑、下丘脑、垂体、卵巢、子宫、输卵管、肾脏、甲状腺、肾上腺共10种组织新鲜样品, 装入2 mL冻存管, 液氮中冷冻后, 转移到-80 ℃冰箱保存备用。
多态性分析试验:21只苏尼特羊血液样本采自内蒙古巴彦淖尔市乌拉特中旗民羊牧业有限责任公司, 22只滩羊血液样本采自宁夏盐池县宁夏朔牧盐池滩羊繁育有限公司, 161只草地型藏羊血液样本采自西藏当雄县, 101只湖羊血液样本采自江苏省徐州申宁羊业有限公司, 52只策勒黑羊血液样本采自新疆和田市策勒县, 380只小尾寒羊血液样品采自山东省郓城县诚联小尾寒羊种羊场。采用颈静脉采血, 柠檬酸葡萄糖抗凝, -20 ℃保存。同时记录小尾寒羊产羔季节、胎次与产羔数。
1.1.2 主要试剂总RNA提取试剂盒购于天根生化科技有限公司(北京), 反转录试剂盒和荧光定量染料、Premix ExTaq Ⅱ等均购于TaKaRa公司(大连)。Taq PCR Master Mix购于拓英坊科技有限公司(北京), 分型试剂和仪器均来自康普森生物技术有限公司(北京)。
1.2 组织总RNA的提取和引物设计利用Trizol(Invitrogen, 美国)和动物组织总RNA提取试剂盒提取各组织总RNA。采用NanoDrop 2000检测RNA的浓度及纯度(A260/A280值为1.8~2.1), 用10 g · L-1的琼脂糖凝胶电泳检测RNA完整性, 置于-80 ℃冷冻备用。参照GenBank公布的绵羊DIO2基因mRNA序列(GenBank ID:XM_015097211.1), 使用Primer Premier 5.0软件进行跨外显子设计引物, 以β-actin(GenBank ID:NM_001009784)作为内参基因。引物由北京天一辉远生物科技有限公司合成。引物信息见表 1。
| 基因名称 Gene name |
引物对序列 Primer pairs sequences(5′→3′) |
退火温度/℃
Annealing temperature |
产物长度/bp Product length |
| DIO2 | GAAGGAATGCGCTGCATCTG/GGGAATTGGGGGCATCTTCA | 60 | 82 |
| β-actin | CCAACCGTGAGAAGATGACC/CCCAGGGCGTACAGGGACAG | 62 | 97 |
使用cDNA快速合成试剂盒反转录合成cDNA, 反应总体系为20 μL, 包括RT enzyme MixⅠ1.0 μL、Oligo dT primer 1.0 μL、Radom 6 miers 1.0 μL, RNA 1 μg, 5×PrimeScript Buffer 4.0 μL。反应条件:37 ℃ 15 min, 85 ℃ 5 s。全程操作在冰上进行。反转录产物用无RNA酶ddH2O 5倍稀释后, 以持家基因β-actin为对照进行PCR检测, 质量合格后-20 ℃保存。
参照本课题组前期设置的qPCR体系和程序[11-12], 绘制目的基因及持家基因的标准曲线, 检测引物的扩增效率, 并确保其在95%~105%区间进行反应以检测目的基因的相对表达量。qPCR检测利用Roche Light CyclerⓇ480Ⅱ型荧光定量PCR仪, 以β-actin为内参基因, 每个样品重复检测3次。采用2-ΔΔCT法[13-14]计算目的基因相对表达量, 用SPSS 19.0统计软件对数据进行单因素方差分析。数据结果均用平均值±标准误(x±SE)表示。
1.4 基因分型及数据分析采用Sequenom MassARRAYⓇSNP技术[15]对DIO2基因g.88484594T>C和g.88484603G>C位点进行基因型检测。分型样品为DNA, 每个样品需要量为20 μL, DNA含量为40~80 ng · μL-1。参考本课题组田志龙等[16]的分析方法用Excel 2016软件统计绵羊DIO2基因2个SNP的基因型频率、等位基因频率、多态信息含量(PIC)、杂合度(He)和有效等位基因数(Ne), 然后进行Hardy-Weinberg平衡检验。用SPSS 19.0软件中一般线性模型对小尾寒羊基因型与前2胎产羔表型数据进行关联分析, 用独立样本t测验对小尾寒羊基因型与第3胎产羔数进行关联分析, 结果用x±SE表示。
1.5 生物信息学分析使用ExPASy、RNAFOLD、PSIPRED软件对g.88484603G>C位点突变前、后氨基酸理化性质和mRNA二级结构及蛋白质的二级结构进行初步预测, SPDBV软件对突变前、后蛋白质进行同源建模。
2 结果与分析 2.1 总RNA提取与cDNA合成提取小尾寒羊和草地型藏羊各组织的总RNA, 用10 g·L-1琼脂糖凝胶电泳检测, 发现28 S和18 S条带清晰可见, 且二者均无降解和拖带现象(图 1)。经反转录合成的cDNA以β-actin为对照进行PCR扩增, 产物干净单一(图略), 可用于后续的qPCR试验。
|
图 1 RNA质量的电泳检测 Fig. 1 Electrophoresis of the RNA quality M. DNA marker; 1~10.大脑、小脑、下丘脑、垂体、卵巢、子宫、输卵管、甲状腺、肾上腺和肾脏Brain, cerebellum, hypothalamus, pituitary, ovary, uterus, oviduct, thyroid, adrenal glands and kidney. |
使用荧光定量PCR技术对草地型藏羊和小尾寒羊10种组织DIO2基因的表达水平进行了研究。结果显示(图 2):DIO2基因在2个绵羊品种的10种组织中均有一定表达, 其中在垂体的表达量显著高于其他组织(P < 0.05), 在小脑、肾脏和肾上腺中表达量很低。DIO2基因在草地型藏羊垂体、子宫、输卵管、下丘脑和卵巢组织中的表达量显著高于小尾寒羊(P < 0.05), 其余组织则差异不显著(P>0.05)。
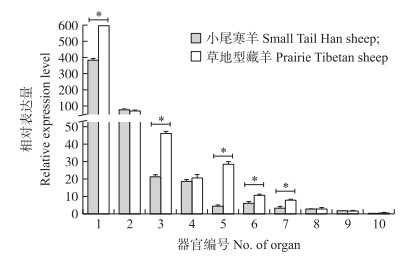
|
图 2 DIO2基因在小尾寒羊和草地型藏羊各组织间的表达 Fig. 2 Expression of DIO2 gene in tissues between Small Tail Han sheep and Prairie Tibetan sheep 1.垂体Pituitary; 2.大脑Brain; 3.子宫Uterus; 4.甲状腺Thyroid; 5.输卵管Oviduct; 6.下丘脑Hypothalamus; 7.卵巢Ovary; 8.小脑Cerebellum; 9.肾上腺Adrenal glands; 10.肾脏Kidney. |
通过基因分型发现:DIO2基因g.88484594T>C位点在常年发情的绵羊中存在3种基因型, 分别是CC、CT和TT, 而在季节性发情的绵羊中只存在2种基因型CC和TT; g.88484603G>C位点在常年发情和季节性发情绵羊品种中均存在3种基因型, 分别是CC、GC和GG(图 3)。

|
图 3 DIO2基因2个位点的分型结果 Fig. 3 Genotyping result of two SNP in DIO2 gene |
由表 2可知:绵羊DIO2基因g.88484594T>C位点基因型频率在季节性发情、常年发情绵羊品种间差异不显著(P>0.05), 而等位基因频率二者之间差异显著(P < 0.05), 且在常年发情和季节性发情品种中, T均是优势等位基因; g.88484603G>C位点基因型频率和等位基因频率在季节性发情、常年发情绵羊品种间差异都达到极显著水平(P < 0.01), 且在季节性发情和常年发情绵羊品种中G均是优势等位基因。
| 位点 Loci |
基因型 Genotype |
基因型频率Genotype frequency | P值P-value | 等位基因Allele | 基因型频率Genotype frequency | P值P-value | |||
| 常年发情羊 Year-round estrous sheep |
季节性发情羊 Seasonal estrous sheep |
常年发情羊 Year-round estrous sheep |
季节性发情羊 Seasonal estrous sheep |
||||||
| g.88484594T>C | CC | 0.18(87) | 0.12(24) | 0.09 | C | 0.18 | 0.12 | 0.01 | |
| CT | 0.00(2) | 0.00(0) | T | 0.82 | 0.88 | ||||
| TT | 0.82(400) | 0.88(180) | |||||||
| g.88484603G>C | CC | 0.25(143) | 0.12(24) | 1.17E-05 | C | 0.48 | 0.34 | ||
| GC | 0.46(256) | 0.45(93) | G | 0.52 | 0.66 | 8.69E-07 | |||
| GG | 0.29(162) | 0.43(89) | |||||||
从表 3可知:绵羊DIO2基因g.88484594T>C位点在小尾寒羊、苏尼特羊、湖羊和草地型藏羊4个群体中均表现为低度多态(PIC < 0.25), 滩羊和策勒黑羊中表现为中度多态(0.25 < PIC < 0.5), 卡方适合性检验结果表明, 该位点在这6个群体中均处于哈代温伯格不平衡状态(P < 0.05);g.88484603G>C位点在这6个绵羊群体中均表现为中度多态(0.25 < PIC < 0.5), 卡方适合性检验结果表明, 该位点在这6个绵羊品种中均处于哈代温伯格平衡状态(P>0.05)。
| 位点 Loci |
品种 Breed |
基因型频率 Genotype frequency |
基因频率 Allele frequency |
多态信息含量 Polymorphism information content(PIC) |
杂合度 Heterozygosity(He) |
有效等位基因数 Effective number of allele(Ne) |
P值 P-value |
||||
| CC | CT | TT | C | T | |||||||
| g.88484594T>C | 小尾寒羊 Small Tail Han sheep |
0.12 | 0.00 | 0.88 | 0.12 | 0.88 | 0.18 | 0.20 | 1.26 | 9.26E-56 | |
| 滩羊 Tan sheep |
0.23 | 0.00 | 0.77 | 0.23 | 0.77 | 0.29 | 0.35 | 1.54 | 9.44E-14 | ||
| 苏尼特羊 Sunite sheep |
0.14 | 0.00 | 0.86 | 0.14 | 0.86 | 0.21 | 0.24 | 1.32 | 1.6E-40 | ||
| 策勒黑羊 Cele Black sheep |
0.33 | 0.00 | 0.67 | 0.33 | 0.67 | 0.34 | 0.44 | 1.79 | 1.26E-05 | ||
| 湖羊 Hu sheep |
0.11 | 0.00 | 0.89 | 0.11 | 0.89 | 0.18 | 0.20 | 1.25 | 1.21E-66 | ||
| 草地型藏羊 Prairie Tibetan sheep |
0.09 | 0.00 | 0.91 | 0.09 | 0.91 | 0.16 | 0.17 | 1.20 | 3.5E-100 | ||
| CC | GC | GG | C | G | |||||||
| g.88484603G>C | 小尾寒羊 Small Tail Han sheep |
0.15 | 0.59 | 0.26 | 0.44 | 0.56 | 0.37 | 0.49 | 1.98 | 0.30 | |
| 滩羊 Tan sheep |
0.22 | 0.64 | 0.14 | 0.55 | 0.45 | 0.37 | 0.50 | 1.98 | 0.18 | ||
| 苏尼特羊 Sunite sheep |
0.14 | 0.38 | 0.48 | 0.33 | 0.67 | 0.35 | 0.44 | 1.80 | 0.51 | ||
| 策勒黑羊 Cele Black sheep |
0.33 | 0.52 | 0.15 | 0.59 | 0.41 | 0.37 | 0.49 | 1.94 | 0.61 | ||
| 湖羊 Hu sheep |
0.12 | 0.43 | 0.45 | 0.34 | 0.66 | 0.35 | 0.45 | 1.82 | 0.59 | ||
| 草地型藏羊 Prairie Tibetan sheep |
0.10 | 0.43 | 0.47 | 0.32 | 0.68 | 0.34 | 0.43 | 1.76 | 0.95 | ||
| 注:P>0.05表示位点在该品种中处于哈代温伯格平衡状态。 Note:P>0.05 indicates the locus was in Hardy-Weinberg equilibrium. |
|||||||||||
为了进一步探讨g.88484603G>C位点突变对DIO2基因结构的影响, 使用NCBI提供的ORF Finder程序对绵羊DIO2基因突变前、后的序列进行氨基酸预测。结果发现:绵羊DIO2基因g.88484603G>C位点位于该基因第二外显子上, 并且该突变导致DIO2蛋白第99位氨基酸由丙氨酸(Ala)变为甘氨酸(Gly)。用ExPASy在线软件对突变前、后氨基酸理化性质进行初步预测, 结果显示, 野生型的分子质量为29 695.08 u, 突变型的分子质量为29 681.05 u, 分子质量略微降低。野生型的不稳定指数为50.43, 突变型的不稳定指数为50.11, 不稳定指数降低, 突变后更加稳定。
2.4.1 DIO2基因g.88484603G>C位点突变前、后mRNA二级结构预测使用RNAFOLD软件对g.88484603G>C突变前、后的mRNA二级结构进行预测, 发现当g.88484603G>C位点发生突变后, mRNA的结构发生了改变, 而且其最小结构自由能降低, 由原来的-552.13 kJ·mol-1变为-547.36 kJ·mol-1(图 4)。

|
图 4 g.88484603G>C位点不同基因型的mRNA二级结构 Fig. 4 The mRNA secondary structure prediction of different genotypes of g.88484603G>C locus a、b分别代表野生型和突变型。下同。 a and b represent the wild type and the mutation type, respectively. The same below. |
根据绵羊DIO2基因的CDS序列推导氨基酸序列, 使用PSIPRED软件对该突变位点前、后DIO2蛋白质的二级结构进行初步预测, 结果显示, 野生型和突变型氨基酸二级结构没有发生大的变化(图 5)。
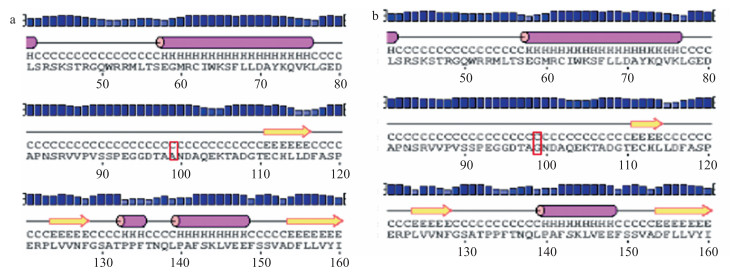
|
图 5 DIO2蛋白二级结构预测 Fig. 5 The secondary structure prediction of DIO2 protein 图中H、C和E分别代表α-螺旋、无规则卷曲和延伸链。 H, C and E mean alpha helix, random coil, extended strand, respectively. The same as below. |
使用SPDBV软件对该基因的蛋白进行同源建模, 结果如图 6所示:DIO2基因g.88484603G>C位点氨基酸的改变可能使蛋白的活性位点和空间结构改变, 进而影响酶活性。
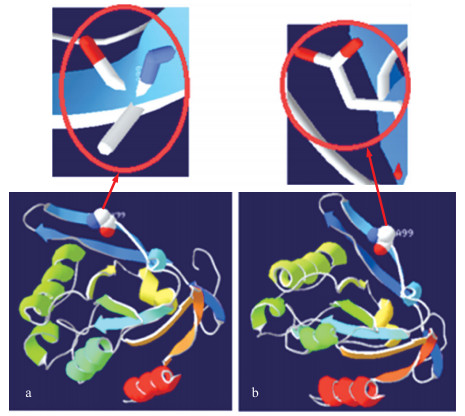
|
图 6 DIO2蛋白三级结构的预测 Fig. 6 The tertiary structure prediction of DIO2 protein |
由表 4可知:DIO2基因2个SNP位点多态性与小尾寒羊前3胎产羔数均无显著相关(P>0.05)。
| 位点 Loci |
基因型 Genotype |
第1胎样本数 Number of the first parity |
第1胎产羔数 Litter size of the first parity |
第2胎样本数 Number of the second parity |
第2胎产羔数 Litter size of the second parity |
第3胎样本数 Number of the third parity |
第3胎产羔数 Litter size of the third parity |
| TT | 2 | 3.00±0.00 | 2 | 3.00±0.00 | 1 | 3.00 | |
| g.88484594T>C | CT | 240 | 2.10±0.05 | 228 | 2.26±0.06 | 86 | 2.86±0.10 |
| CC | 81 | 2.27±0.09 | 77 | 2.45±0.10 | 35 | 2.77±0.18 | |
| GG | 92 | 2.02±0.09 | 85 | 2.22±0.10 | 33 | 3.03±0.19 | |
| g.88484603G>C | GC | 162 | 2.19±0.07 | 156 | 2.29±0.07 | 61 | 2.74±0.14 |
| CC | 95 | 2.23±0.09 | 91 | 2.43±0.10 | 39 | 2.77±0.17 |
DIO2基因是动物机体TSH/DIO系统发挥作用的主要基因, 该系统通过TSH与其受体TSHR结合, 调节DIO2基因的表达, 从而调节T3、T4浓度来控制动物的季节性繁殖[17]。研究发现DIO2基因在大鼠、小鼠、绵羊、蟾蜍、人等的下丘脑、垂体、大脑、小脑、甲状腺、睾丸、腹部脂肪等多个组织中均有一定的表达, 但在垂体、大脑、下丘脑中的表达量较高[18-22]。本研究中DIO2基因在小尾寒羊和藏羊垂体的表达量显著高于其他组织(P < 0.05), 因此推测DIO2基因主要在绵羊垂体部位发挥作用。研究发现, DIO2基因在辽宁绒山羊(季节性发情)子宫的表达量显著高于济宁青山羊(常年发情)(P < 0.05)[23], 长光照时索厄岛绵羊、鹌鹑和叙利亚仓鼠下丘脑中DIO2基因表达量上升, T3浓度增加, 短光照时表达量降低, T3浓度下降[24-26]。这些都与本研究DIO2基因在草地型藏羊下丘脑、垂体、卵巢、子宫和输卵管组织中的表达量显著高于小尾寒羊(P < 0.05)的结果一致。说明在夏季长光照时, 外界光照刺激绵羊松果体分泌褪黑素, 褪黑素与褪黑素受体结合促使季节性发情的草地型藏羊垂体结节部的DIO2基因表达量上升[27-28], 高浓度DIO2导致T3浓度升高, 草地型藏羊进入休情状态, 而小尾寒羊中DIO2浓度较低, 在夏季长光照下依旧可以发情[29]。
3.2 DIO2基因多态性与动物繁殖之间的关系目前, 关于DIO2基因多态性的研究主要集中于人。研究发现, DIO2基因rs225014位点突变导致其第92个氨基酸由苏氨酸变为丙氨酸, 该突变可能会影响DIO2蛋白活性进而限制局部组织T3的生成[30]; rs12885300位点突变使DIO2蛋白第3个氨基酸由甘氨酸变为天冬氨酸, 导致游离甲状腺素对TSH的负反馈减弱[31]。王喜英[32]在人的DIO2基因上发现7个SNP位点, 其中有2个可能与秦巴山区人群精神发育迟滞易感性相关。本研究在小尾寒羊DIO2基因上检测到了2个SNP位点, 这2个位点多态性与小尾寒羊前3胎产羔数均无显著相关(P>0.05), 表明该基因可能不是影响小尾寒羊产羔性状的候选基因。但g.88484603G>C位点在不同繁殖特性(季节性发情和常年发情)绵羊群体的基因型频率和等位基因频率均达到极显著差异(P < 0.01), 预测该位点的等位基因与季节性发情有一定的相关性, 表明该位点C等位基因对绵羊常年发情更有利, 该位点可以作为影响绵羊季节性发情的候选多态位点进行更为深入的研究。对该位点进行生物信息学分析, 发现该位点的错义突变导致编码的氨基酸由丙氨酸变成甘氨酸, 突变前、后氨基酸的性质由非极性氨基酸变为极性不带电的氨基酸, 这种改变可能引起蛋白性质的改变。对突变前、后的氨基酸理化性质及mRNA和蛋白结构进行了预测, 发现该点的突变导致氨基酸的不稳定指数由50.43变为50.11, mRNA的最小结构自由能由-552.13 kJ·mol-1变为-547.36 kJ·mol-1, 自由能和不稳定指数均降低, 表明突变后稳定性增强。但是从蛋白二级结构来看, 该位点的突变并没有引起该蛋白的二级结构发生变化, 主要原因可能是由于突变前、后氨基酸在二级结构中都形成无规则卷曲链。DIO2基因编码Ⅱ型脱碘酶, 从蛋白三级结构来看, 氨基酸的突变可能导致该酶的作用位点发生改变, 从而影响酶活性, 进而影响酶的作用效率, 但其具体的影响机制还有待进一步证实。
综合本试验结果, DIO2基因在草地型藏羊下丘脑、垂体、卵巢、子宫和输卵管组织中的表达量显著高于小尾寒羊。绵羊DIO2基因g.88484603G>C位点与绵羊季节性发情显著相关, 可作为常年发情绵羊选育的辅助标记。
| [1] |
Goldsmith A R, Nicholls T J. Thyroidectomy prevents the development of photorefractoriness and the associated rise in plasma prolactin in starlings[J]. General & Comparative Endocrinology, 1984, 54(2): 256-263. |
| [2] |
Croteau W, Davey J C, Galton V A, et al. Cloning of the Mammalian type Ⅱ iodothyronine deiodinase. A selenoprotein differentially expressed and regulated in human and rat brain and other tissues[J]. Journal of Clinical Investigation, 1996, 98(2): 405-417. DOI:10.1172/JCI118806 |
| [3] |
Becker K B, Schneider M J, Davey J C, et al. The type Ⅲ 5-deiodinase in Rana catesbeiana tadpoles is encoded by a thyroid hormone-responsive gene[J]. Endocrinology, 1995, 136(10): 4424-4431. DOI:10.1210/endo.136.10.7664662 |
| [4] |
Arthur J R, Beckett G J. Roles of selenium in type I iodothyronine 5'-deiodinase and in thyroid hormone and iodine metabolism[M]//Burk F R. Selenium in Biology and Human Health. New York: Spring, 1994: 93-115.
|
| [5] |
徐佼, 陈斌, 计成. DIO2及UGT1A1基因多态性与左甲状腺素剂量关系的研究进展[J]. 中国临床药理学与治疗学, 2015, 20(4): 476-480. Xu J, Chen B, Ji C. Advances in the relationship between DIO2 and UGT1A1 gene polymorphisms and levothyroxine dose[J]. Chinese Clinical Pharmacology and Therapeutics, 2015, 20(4): 476-480 (in Chinese with English abstract). |
| [6] |
Bianco A C, Salvatore D, Gereben B, et al. Biochemistry, cellular and molecular biology, and physiological roles of the iodothyronine selenodeiodinases[J]. Endocrine Reviews, 2002, 23(1): 38-89. DOI:10.1210/edrv.23.1.0455 |
| [7] |
Majumdar G, Trivedi A K, Gupta N J, et al. Circadian synchronization determines critical day length for seasonal responses[J]. Physiology & Behavior, 2015, 147: 282-290. |
| [8] |
Drigo R A, Fonseca T L, Werneckdecastro J P, et al. Role of the type 2 iodothyronine deiodinase(D2) in the control of thyroid hormone signaling[J]. Biochimica et Biophysica Acta, 2013, 1830(7): 3956-3964. DOI:10.1016/j.bbagen.2012.08.019 |
| [9] |
丁吉顺. Dio2/Dio3系统对黑线仓鼠繁殖的调控机制[D].曲阜: 曲阜师范大学, 2015. Ding J S. Regulation mechanism of Dio2/Dio3 system on black line hamster reproduction[D]. Qufu: Qufu Normal University, 2015(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10446-1015407952.htm |
| [10] |
Adib A, Freret S, Touze J L, et al. Progesterone improves the maturation of male-induced preovulatory follicles in anoestrous ewes[J]. Reproduction, 2014, 148(4): 403. DOI:10.1530/REP-14-0263 |
| [11] |
李晓雨, 贺小云, 刘秋月, 等. TAC1和PRLR基因在绵羊不同繁殖状态下的表达模式分析[J]. 畜牧兽医学报, 2018, 49(2): 253-262. Li X Y, He X Y, Liu Q Y, et al. Analysis of expression patterns of TAC1 and PRLR genes in different breeding conditions of sheep[J]. Chinese Journal of Animal and Veterinary Sciences, 2018, 49(2): 253-262 (in Chinese with English abstract). |
| [12] |
周梅, 曹晓涵, 贺小云, 等. 绵羊FGF7基因组织表达及其多态性与产羔数之间的关系[J]. 畜牧兽医学报, 2018, 49(3): 525-533. Zhou M, Cao X H, He X Y, et al. Relationship between tissue expression of FGF7 gene and polymorphism and litter size in sheep[J]. Chinese Journal of Animal and Veterinary Sciences, 2018, 49(3): 525-533 (in Chinese with English abstract). |
| [13] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [14] |
Schmittgen T D, Livak K J. Analyzing real-time PCR data by the comparative GT method[J]. Nature Protocols, 2008, 3(6): 1101-1108. DOI:10.1038/nprot.2008.73 |
| [15] |
马晓萌, 轩俊丽, 王慧华, 等. TXNRD1基因多态性与乌珠穆沁绵羊生长性状的关联分析[J]. 畜牧兽医学报, 2016, 47(5): 909-921. Ma X M, Xuan J L, Wang H H, et al. Association analysis of TXNRD1 gene polymorphism with growth traits of Wuzhumuqin sheep[J]. Chinese Journal of Animal and Veterinary Sciences, 2016, 47(5): 909-921 (in Chinese with English abstract). |
| [16] |
田志龙, 刘秋月, 王翔宇, 等. 绵羊BMP15基因多态性及其与产羔数的关联分析[J]. 中国畜牧杂志, 2018, 54(7): 23-26. Tian Z L, Liu Q Y, Wang X Y, et al. Polymorphism of BMP15 gene in sheep and its association with litter size[J]. Chinese Journal of Animal Science, 2018, 54(7): 23-26 (in Chinese with English abstract). |
| [17] |
田占伟.利用营养水平诱导新疆哈萨克绵羊产后发情激素变化规律及部分相关基因表达研究[D].石河子: 石河子大学, 2015. Tian Z W. Using nutrient levels to induce postpartum estrus hormone changes and expression of some related genes in Xinjiang Kazakh sheep[D]. Shihezi: Shihezi University, 2015(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10759-1015993388.htm |
| [18] |
Tavolaro F M, Thomson L M, Ross A W, et al. Photoperiodic effects on seasonal physiology, reproductive status and hypothalamic gene expression in young male F344 rats[J]. Journal of Neuroendocrinology, 2015, 27(2): 79-87. DOI:10.1111/jne.12241 |
| [19] |
Romano R M, Gomes S N, Cardoso N C, et al. New insights for male infertility revealed by alterations in spermatic function and differential testicular expression of thyroid-related genes[J]. Endocrine, 2017, 55(2): 607-617. DOI:10.1007/s12020-016-0952-3 |
| [20] |
de Miera C S, Monecke S, Bartzen-Sprauer J, et al. A circannual clock drives expression of genes central for seasonal reproduction[J]. Current Biology, 2014, 24(13): 1500-1506. DOI:10.1016/j.cub.2014.05.024 |
| [21] |
Torriani M, Srinivasa S, Fitch K V, et al. Dysfunctional subcutaneous fat with reduced dicer and brown adipose tissue gene expression in HIV-infected patients[J]. Journal of Clinical Endocrinology & Metabolism, 2016, 101(3): 1225-1234. |
| [22] |
刘静.中华大蟾蜍胚胎发育中脱碘酶基因DIO2、DIO3表达特性的研究[D].西安: 陕西师范大学, 2013. Liu J. Study on the expression characteristics of deiodinase genes DIO2 and DIO3 in embryonic development of Chinese giant salamander[D]. Xi'an: Shaanxi Normal University, 2013(in Chinese with English abstract). |
| [23] |
黄冬维, 狄冉, 胡文萍, 等. 山羊繁殖季节性相关基因DIO2与DIO3的表达分析[J]. 农业生物技术学报, 2016, 24(10): 1536-1543. Huang D W, Di R, Hu W P, et al. Expression analysis of seasonal related genes DIO2 and DIO3 in goat breeding[J]. Journal of Agricultural Biotechnology, 2016, 24(10): 1536-1543 (in Chinese with English abstract). |
| [24] |
Yasuo S, Watanabe M, Nakao N, et al. The reciprocal switching of two thyroid hormone-activating and-inactivating enzyme genes is involved in the photoperiodic gonadal response of Japanese quail[J]. Endocrinology, 2005, 146(6): 2551-2554. DOI:10.1210/en.2005-0057 |
| [25] |
Revel F G, Saboureau M, Pévet P, et al. Melatonin regulates type 2 deiodinase gene expression in the Syrian hamster[J]. Endocrinology, 2006, 147(10): 4680-4687. DOI:10.1210/en.2006-0606 |
| [26] |
Sáenz D M C, Hanon E A, Dardente H, et al. Circannual variation in thyroid hormone deiodinases in a short-day breeder[J]. Journal of Neuroendocrinology, 2013, 25(4): 412-421. DOI:10.1111/jne.12013 |
| [27] |
Henningsen J B, François G, Valérie S. RFRP neurons-the doorway to understanding seasonal reproduction in mammals[J]. Frontiers in Endocrinology, 2016, 7(9): 36. |
| [28] |
朱兰, 兰蓉, 邵庆勇, 等. 云南黑山羊新品种和龙陵黄山羊高繁基因的研究[J]. 畜牧与兽医, 2018, 50(2): 1-6. Zhu L, Lan R, Shao Q Y, et al. Study on candidate proliferative genes in new-breed Yunnan black goats and Longling goats[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(2): 1-6 (in Chinese with English abstract). |
| [29] |
夏青, 刘秋月, 王翔宇, 等. 绵羊季节性繁殖分子机制及休情季节诱导绵羊发情配种技术[J]. 遗传, 2018, 40(5): 369-377. Xia Q, Liu Q Y, Wang X Y, et al. Molecular mechanism of seasonal reproduction of sheep and induction of estrus breeding in sheep during the resting season[J]. Genetics, 2018, 40(5): 369-377 (in Chinese with English abstract). |
| [30] |
Bianco A C, Casula S. Thyroid hormone replacement therapy:three 'simple' questions, complex answers[J]. European Thyroid Journal, 2012, 1(2): 88-98. DOI:10.1159/000339447 |
| [31] |
Hoftijzer H C, Heemstra K A, Visser T J, et al. The type 2 deiodinase ORFa-Gly3Asp polymorphism(rs12885300) influences the set point of the hypothalamus-pituitary-thyroid axis in patients treated for differentiated thyroid carcinoma[J]. The Journal of Clinical Endocrinology & Metabolism, 2011, 96(9): 1527-1533. |
| [32] |
王喜英.基于家系的DIO2基因多态性与秦巴山区人群精神发育迟滞的关联研究[D].西安: 西北大学, 2010. Wang X Y. Association between DIO2 gene polymorphism based on family and mental retardation in Qinba mountain area[D]. Xi'an: Northwest University, 2010(in Chinese with English abstract). |




