文章信息
- 孙玲伟, 王智博, 安世钰, 张国敏, 樊懿萱, 王锋
- SUN Lingwei, WANG Zhibo, AN Shiyu, ZHANG Guomin, FAN Yixuan, WANG Feng
- RP-Arg和NCG对营养限饲湖羊胎盘发育的影响
- Effects of dietary RP-Arg and NCG supplementation on development of maternal and fetal placenta in nutrient restriction Hu sheep during pregnancy
- 南京农业大学学报, 2020, 43(1): 125-133
- Journal of Nanjing Agricultural University, 2020, 43(1): 125-133.
- http://dx.doi.org/10.7685/jnau.201811004
-
文章历史
- 收稿日期: 2018-11-03
2. 上海市农业科学院畜牧兽医研究所, 上海 201106
2. Institute of Animal Science and Veterinary Medicine, Shanghai Academy of Agricultural Sciences, Shanghai 201106, China
湖羊具有性成熟早、繁殖力强和肉质鲜嫩等特点, 是我国宝贵的肉毛兼用型绵羊品种之一。目前, 随着湖羊饲养规模的扩大和饲养方式的不断转变, 多种饲养问题也陆续出现, 由于其多胎特性, 易造成妊娠期湖羊营养的摄取不足, 进而可能导致胎儿宫内生长迟缓(intrauterine growth retardation, IUGR)[1]。绵羊胎盘分为肉阜(caruncle)和子叶(cotyledon)两部分, 是妊娠期母体-胎盘-胎儿之间营养物质和气体交换的重要组织器官[2]。研究表明胎盘组织结构异常是引发胎儿IUGR的重要因素, 主要包括胎盘绒毛数量和面积、血流量、血管形成等的减少或血管结构出现变化等[3]。血管内皮生长因子(vascular endothelial growth factor, VEGF)家族在血管生长中具有重要作用, 主要影响血管生长、发育和通透性[4]。此外, 胎盘组织中细胞生长也受营养条件和细胞内外环境影响。雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)通路已经被证明能够调节胎盘组织中蛋白质的合成和细胞生长[5]。
精氨酸(arginine, Arg)是机体内合成蛋白质、一氧化氮(nitric oxide, NO)和多胺等多种物质的前体, 能够调控胎盘的营养运输, 对胎盘和胎儿的发育具有重要调节作用[6]。胎儿IUGR证实与Arg的缺乏具有一定相关性, 多项研究也表明通过对妊娠期猪、羊和人补充Arg能够改善胎儿IUGR并促进胎儿生长[7]。由于Arg在瘤胃内易降解, 且生产中饲喂过瘤胃精氨酸(rumen-protected arginine, RP-Arg)价格相对较高, N-氨甲酰谷氨酸(N-carbamylglutamate, NCG)可以增强内源性Arg的产生, 且瘤胃降解率低, 价格低于RP-Arg。目前, RP-Arg和NCG对缓解妊娠期湖羊营养不良造成的胎儿IUGR研究较少, 对胎盘和胎儿发育的机制也未见深入研究。基于此, 本试验拟通过对妊娠期营养限饲湖羊饲喂RP-Arg和NCG, 分析对胎盘生长血管生成因子的变化和mTOR通路中关键靶蛋白表达的变化, 从而系统阐释RP-Arg和NCG对胎盘发育的调控机制, 为肉羊生产中胎儿IUGR防治提供一定的理论依据。
1 材料与方法 1.1 试验动物及设计饲养试验于江苏省泰州市海伦湖羊厂进行, 为期5个月。选取约18.50月龄和体质量约40.10 kg的经产湖羊48只, 体况评分为2.55±0.18(满分为5分)。对所有羊驱虫、健胃后, 进行同期发情和人工授精, 单栏饲喂, 自由采食、饮水直至妊娠35 d。在妊娠35 d时, 对妊娠母羊进行B超检测, 选取怀有双胎的妊娠湖羊32只。采用单因素试验设计, 试验羊每组8只, 随机分为4组:对照组(CG组), 100%NRC, 100%维持需要日粮营养水平; 限饲组(RG组), 50% NRC; RP-Arg添加组(ARG组), 50% NRC日粮基础上添加20 g · d-1 RP-Arg; NCG添加组(NCG组, 50% NRC日粮基础上添加5 g · d-1 NCG。试验期分为2个阶段(0~90 d和91~110 d)。各阶段日粮组分及其营养水平参照表 1。在妊娠110 d时, 对所有试验羊屠宰, 分离并称胎儿、总胎盘、胎盘子叶和肉阜组织质量, 采集脐静脉血液样品装入10 mL肝素钠管, 4 ℃条件下12 000 r · min-1离心10 min, 分离上清液后分装密封, 存于-80 ℃低温冰箱保存。
| 日粮组成 Feed composition |
试验期Test period | |
| 0~90 d | 91~110 d | |
| 精饲料组成Concentrated feed composition | ||
| 羊草Chinese wild rye | 50.00 | 45.00 |
| 玉米Corn | 35.12 | 31.32 |
| 豆粕Soybean meal | 12.00 | 20.00 |
| CaHPO4 | 1.67 | 2.34 |
| CaCO3 | 0.41 | 0.54 |
| 食盐Salt | 0.50 | 0.50 |
| 预混料① Premix | 0.30 | 0.30 |
| 合计Total | 100.00 | 100.00 |
| 日粮营养组成② Nutritional composition | ||
| 干物质Dry matter | 90.23 | 90.36 |
| 粗灰分Ash | 7.23 | 7.14 |
| 总能③ Gross energy(MJ·kg-1) | 17.63 | 18.49 |
| 粗蛋白Crude protein | 9.98 | 13.59 |
| 粗脂肪Ether extract | 4.21 | 4.59 |
| 中性洗涤纤维Neutral detergent fiber | 37.12 | 32.57 |
| 酸性洗涤纤维Acid detergent fiber | 20.98 | 18.93 |
| 钙Calcium | 0.57 | 0.81 |
| 磷Phosphorus | 0.45 | 0.69 |
| 注: ①预混料为每千克日粮提供维生素A 30 000 IU, 维生素D 10 000 IU, 维生素E 100 mg, 铁90 mg, 铜12.5 mg, 锰50 mg, 锌100 mg, 硒0.3 mg, 碘0.8 mg, 钴0.5 mg; ②营养水平均为实测值; ③总能单位是MJ · kg-1, 为计算值。 Note: ①The premix provided the following nutrients per kg of the diet:30 000 IU vitamin A(VA), 10 000 IU VD, 100 mg VE, 90 mg Fe, 12.5 mg Cu, 50 mg Mn, 100 mg Zn, 0.3 mg Se, 0.8 mg I, and 0.5 mg Co; ②Nutrient levels are measured value; ③The unit of gross energy is MJ · kg-1. |
||
测定4组样品中脐静脉血浆样品中一氧化氮(NO)、葡萄糖(glucose, Glu)、游离脂肪酸(nonesterified fatty acid, NEFA)、甘油三酯(triglyceride, TG)和甘油(glycerol)浓度以及一氧化氮合酶(nitric oxide synthase, NOS)活性, 所用试剂盒均购自建成生物公司(南京)。所有试剂盒的批内和批间变异系数均低于10%。每个样品设定3个生物学重复。
1.2.2 总RNA提取及cDNA合成利用Trizol试剂盒(Invitrogen, 美国)提取子叶和肉阜组织中总RNA, 然后利用NanoDrop2000(Thermo Scientific, 美国)测定其浓度并用甲醛变性琼脂糖凝胶电泳检验其质量。对提取的RNA样品按照PrimeScriptTM反转录试剂盒(TaKaRa, 中国)说明书, 分两步法由RNA反转录(RT)为cDNA, 反应总体积为20 μL。
1.2.3 胎盘组织生长相关基因的引物设计及实时荧光定量PCR检测登录NCBI网站(http://www.ncbi.nlm.nih.gov/), 查找胎盘发育相关生长因子基因序列信息, 应用Primer Premier 5.0软件设计相应引物, 采用NCBI Primer-BLAST进行引物特异性检测。引物序列由上海Invitrogen生物技术有限公司合成(引物信息见表 2)。
| 基因名称 Genes |
登录号 GenBank No. |
引物对序列 Primer pairs sequences(5'→3') |
产物长度/bp Product length |
| GAPDH | NM_001034034.1 | F:GTCAAGGCAGAGAACGGGAA/R:GGTTCACGCCCATCACAAAC | 119 |
| VEGF-A | NM 214084.1 | F:CAACGACGAAGGTCTGGAGTG/R:GCCTCGCTCTATCTTTCTTTGG | 155 |
| VEGFR-1 | X51602 | F:GGAGGGTTCTGACGGTAATA/R:CTCAACAGAAAT GGAAGTGG | 272 |
| VEGFR-2 | AF513909.1 | F:GGGACCTGACCGACTACC/R:GACAGCGAGGCAGGATGG | 198 |
| PLGF1 | AY943279.1 | F:TGTCCTTCTGAGTCGCTGTAGT/R:GCATAGTGATGTTGGCTGTCTT | 84 |
| Ang-1 | AY881028 | F:CACGTGGAACAGGATTTCTC/R:CTAGCTTGTAGGTTGATAATG | 304 |
| Ang-2 | AY881029 | F:ACACCTAAGAGACTGGGAAG/R:ATTCAGGTTGGAAGGACCAC | 250 |
| Tie-2 | AY881030 | F:CAGTTTACCAGGTGGACATC/R:ACATTTTGGAAGGCTTGGGC | 247 |
| mTOR | XM_012186862.2 | F:CTGGGAATGTTGGTGTCCTT/R:TGATTGTGCTCTGGATGGAG | 153 |
| p70S6K | AY396564.1 | F:CAGAGCGGAATATTCTGGAG/R:CATAAATAGTTCTCCTCCACTGAG | 188 |
| 4EBP1 | NM_004095.3 | F:GAAGTTCCTGATGGAGTGTCG/R:TGATTCTGCCTGGCTTCC | 123 |
利用StepOne-Plus荧光定量PCR仪(Applied Biosystems, 美国)进行实时荧光定量PCR(qPCR)。PCR反应体系(20 μL):SYBRⓇ Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)(2×)10 μL, 上游和下游引物各0.8 μL, ROX Reference Dye(50×)0.4 μL, cDNA 2.0 μg, 补加超纯水至20 μL。PCR程序:95 ℃预变性10 min; 95 ℃ 15 s、60 ℃ 30 s、72 ℃ 30 s, 共40个循环; 最后72 ℃延伸10 min。以GAPDH基因作为本试验的内参基因。本试验中所有检测样品重复检测3次以上, 采用相对定量法分析PCR结果, 应用2-ΔΔCT法计算相关基因的相对表达量。
1.2.4 胎盘mTOR通路中关键因子的水平检测用RIPA裂解液提取冷冻的子叶和肉阜组织中总蛋白, 应用BCA法检测蛋白浓度, 以备后续进行Western blot检测。利用十二烷基硫酸钠-聚丙烯酰胺凝胶电(SDS-PAGE)对蛋白样品进行分离。4组样品分离后, 置2 mL含有5% BSA的TBST溶液中, 室温孵育2 h, 分别再加入2 mL 1 : 1 000稀释的抗体, 4 ℃孵育过夜, 用TBST洗膜3次(每次10 min)。抗体4EBP1、p-4EBP1(Thr37/46)和p-p70S6K(Thr389)购自CST公司, p70S6K购自Abcam公司, β-actin(SC-47778)购自Santa Cruz公司。之后, 加入二抗(1 : 4 000, HPR标记的羊抗兔IgG)室温孵育1 h, 加入ECL显影液, 放射自显影。使用Image J生物软件分析目的蛋白与β-actin(内参)的条带灰度值, 计算目的蛋白Fold change值。
1.3 数据的统计分析所有试验数据结果使用SPSS 17.0(SPSS Inc. USA)进行统计分析, 4组间胎儿和胎盘组织质量、脐静脉血浆中代谢物浓度、胎盘中相关因子mRNA和蛋白表达量应用单因素方差分析方法检验其差异显著性, 用平均数±标准误(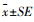
由表 3可见:与CG组相比, RG、ARG和NCG组胎儿体质量显著降低(P < 0.05);而ARG和NCG组胎儿体质量显著高于RG组(P < 0.05)。RG组胎儿体质量/胎盘质量比值显著低于其他3组(P < 0.05);ARG和NCG组胎儿体质量/胎盘质量的比值虽然低于CG组(P < 0.05), 但高于RG组(P < 0.05)。4组间胎盘质量、肉阜质量和子叶质量差异不显著(P>0.05), RG组中胎盘质量、肉阜质量和子叶质量相较于其他3组出现下降趋势。ARG和NCG组间胎儿体质量以及胎儿体质量/胎盘质量比值差异不显著(P>0.05)。
| 项目Item | 分组Groups | |||
| CG | RG | ARG | NCG | |
| 胎儿数No. of fetuses | 16 | 16 | 16 | 16 |
| 胎儿体质量/kg Fetal weight | 1.88±0.32a | 1.40±0.24c | 1.66±0.17b | 1.68±0.31b |
| 胎盘质量/kg Placentome weight | 0.56±0.14a | 0.55±0.11a | 0.57±0.10a | 0.57±0.08a |
| 胎儿体质量/胎盘质量Fetuses weight/Placentome weight | 3.34±0.56a | 2.56±0.87c | 2.92±1.02b | 2.94±1.21b |
| 肉阜质量/kg Caruncular weight | 0.09±0.02a | 0.08±0.03a | 0.09±0.01a | 0.09±0.01a |
| 子叶质量/kg Cotyledonary weight | 0.32±0.04a | 0.29±0.03a | 0.30±0.02a | 0.30±0.02a |
| 注: 1)CG组:100%NRC推荐量; RG组:50%NRC限饲组; ARG组:50%NRC限饲+20 g · d-1的RP-Arg; NCG组:50%NRC限饲+5 g · d-1的NCG; 2)同行间肩头字母不同表示组间差异显著(P < 0.05)。下表同。 Note: 1)CG:Control group, fed 100% NRC requirements. RG:Nutrient-restricted group, fed 50% NRC requirements. ARG:Rumen protected-arginine group, fed 50% NRC requirements supplemented with 20 g · d-1 RP-Arg. NCG:N-carbamylglutamate group, fed 50% NRC requirements supplemented with 5 g · d-1 NCG. 2)Date with different letters means significant difference between the treatments(P < 0.05). The same as below. |
||||
由表 4可见:4组间胎儿脐静脉血浆中NOS和NEFA浓度差异不显著(P>0.05)。相对于CG组, RG组胎儿脐静脉血浆中Glu浓度显著低于其他3组(P < 0.05);ARG组和NCG组Glu浓度显著高于RG组(P < 0.05), 但显著低于CG组(P < 0.05)。RG组胎儿脐静脉血浆中Glycerol和TG浓度显著高于CG、ARG组和NCG组(P < 0.05)。RG组胎儿脐静脉血浆中NO浓度显著低于CG、ARG组和NCG组(P < 0.05)。ARG组和NCG组间胎儿脐静脉血浆中上述代谢物浓度差异不显著(P>0.05)。
| 指标Item | 分组Groups | |||
| CG | RG | ARG | NCG | |
| 一氧化氮Nitric oxide(NO) | 112.34±15.23a | 102.90±13.25b | 113.55±12.87a | 124.63±15.87a |
| 一氧化氮合酶Nitric oxide synthase(NOS) | 11.42±1.09a | 13.69±2.37a | 12.38±3.66a | 11.28±1.11a |
| 葡萄糖Glucose(Glu) | 115.75±17.57a | 73.32±19.87c | 94.74±14.56b | 101.21±19.85b |
| 游离脂肪酸Nonesterified fatty acid(NEFA) | 88.53±2.30a | 85.77±4.47a | 89.02±3.45a | 87.64±3.19a |
| 甘油Glycerol | 146.12±6.67b | 161.24±7.86a | 149.65±8.94b | 149.21±8.60b |
| 甘油三酯Triglyceride(TG) | 167.43±8.02b | 184.36±10.05a | 168.48±12.17b | 169.57±9.93b |
从图 1可见:4组肉阜组织中(图 1-A), RG组VEGFR- 2 mRNA表达量显著高于CG、ARG和NCG组(P < 0.05), 但其他3组间差异不显著(P>0.05)。CG组肉阜中PLGF 1 mRNA表达量显著低于其他3组(P < 0.05), NCG组PLGF 1 mRNA表达量显著低于RG和ARG组(P < 0.05), 但RG组和ARG组差异不显著(P>0.05)。CG、ARG和NCG组肉阜中Tie- 2 mRNA表达量显著高于RG组(P < 0.05), 但其他3组间差异不显著(P>0.05)。

|
图 1 妊娠110 d时RP-Arg和NCG对限饲湖羊胎盘肉阜(A)和子叶(B)组织中血管生长基因mRNA表达的影响 Fig. 1 Effects of dietary RP-Arg and NCG supplementation on mRNA expression of angiogenic factors in caruncle(A)and cotyledon(B)in nutrient restricted Hu sheep on 110 days of pregnancy 不同组间字母不同表示组间差异显著(P < 0.05)。下表同。 Different groups with different letters means significant difference between the treatments(P < 0.05). The same as below. |
4组子叶组织中(图 1-B), 仅VEGFR- 2和Tie-2 mRNA表达量差异显著(P < 0.05)。RG组VEGFR- 2 mRNA表达量显著高于CG、ARG和NCG组(P < 0.05), ARG组和NCG组中VEGFR- 2 mRNA表达量显著高于CG组(P < 0.05)。CG和NCG组Tie- 2 mRNA表达量显著高于RG组, 而RG组和NCG组间表达量差异不显著(P>0.05)。
2.4 RP-Arg和NCG对营养限饲湖羊胎盘中mTOR通路中关键因子的mRNA和蛋白表达水平的影响由图 2可见:不同组肉阜组织和子叶组织中mTOR基因的mRNA表达量差异不显著(P>0.05)。RG组肉阜组织中p70S6K mRNA表达量显著高于其他3组(P < 0.05), ARG和NCG组p 70S6 K mRNA表达量显著高于CG组(P < 0.05)。CG组肉阜组织中4EBP1 mRNA表达量显著低于CG、ARG和NCG组(P < 0.05), 但其余3组间差异不显著(P>0.05)。RG和ARG组子叶组织中p 70S6 K mRNA表达量显著高于CG和NCG组(P < 0.05), 而CG与NCG组、RG和ARG组间差异不显著(P>0.05)。RG组子叶组织中4EBP1 mRNA表达量显著高于CG、ARG和NCG组(P < 0.05), 而ARG和NCG组mRNA表达量显著低于RG组(P < 0.05)。

|
图 2 妊娠110 d时RP-Arg和NCG对限饲湖羊胎盘肉阜和子叶组织中mTOR通路关键因子mRNA表达的影响 Fig. 2 Effects of dietary RP-Arg and NCG supplementation on mRNA expression of mTOR pathway in caruncle and cotyledon in nutrient restricted Hu sheep on 110 days of pregnancy |
Western blot分析结果显示(图 3):CG和ARG组肉阜组织中p70S6K蛋白表达量显著高于RG和NCG组(P < 0.05), 而CG和ARG组, RG和NCG组间p70S6K蛋白表达量差异不显著(P>0.05)。CG组肉阜组织中p-p70S6K蛋白表达量显著高于其他3组(P < 0.05), ARG组显著高于RG组(P < 0.05)。CG组肉阜组织中4EBP1蛋白表达量显著低于其他组(P < 0.05), 而RG和ARG组蛋白表达量显著高于NCG组(P < 0.05)。RG组肉阜组织中p-4EBP1蛋白表达量显著低于其他3组(P < 0.05), 而3组间差异不显著(P>0.05)。RG组子叶组织中p70S6K蛋白表达量显著低于CG和NCG组(P < 0.05), 而CG和ARG组、ARG和NCG组间蛋白表达量差异不显著(P>0.05)。CG组子叶组织中p-p70S6K蛋白表达量显著高于其他3组(P < 0.05), 而RG组蛋白表达量显著低于ARG和NCG组(P < 0.05)。子叶组织中4EBP1蛋白表达量差异不显著(P>0.05)。RG组子叶组织p-4EBP1蛋白表达量显著高于其他3组(P < 0.05), 而3组间差异不显著(P>0.05)。

|
图 3 妊娠110 d时RP-Arg和NCG对限饲湖羊胎盘肉阜和子叶组织中mTOR通路中关键蛋白表达的影响 Fig. 3 Effects of dietary RP-Arg and NCG supplementation on proteins expressions of mTOR pathway in caruncle and cotyledon in nutrient restricted Hu sheep on 110 days of pregnancy |
胎盘是母体和胎儿进行物质交换的组织器官。此外, 胎盘产生的多种蛋白质和激素对于维持妊娠以及胎儿的营养发育和免疫保护等具有重要作用。研究证明胎盘功能不全, 易引起胎儿IUGR[8]。VEGF家族中多个因子及其受体均能调控胎盘中血管的发育, 通过调节胎盘功能而参与胎儿IUGR的调控[9]。此外, mTOR信号通路主要调控氨基酸等营养物质的摄取, 该通路中下游关键靶蛋白p70S6K和4EBP1的表达及磷酸化水平也能够调控胎盘组织中蛋白质的合成和细胞生长。
3.1 营养限饲后补充RP-Arg和NCG对胎盘发育的影响胎儿生长发育与胎盘组织密切相关, 胎盘生长发育受阻或功能损伤也是胎儿发生IUGR的重要原因之一。妊娠期母体的营养代谢发生改变时, 胎儿和胎盘的生长发育均可能受到影响。此外, 胎儿的生长发育受胎盘中营养物质的传输量以及胎盘血流速度等多方面的影响, 因此提高胎盘血流以及母体对胎儿的营养物质传输是缓解哺乳动物IURG的主要方法。母体日粮中补充RP-Arg和NCG显著提高胎儿体质量, 说明Arg能够提高母体营养物质转化胎儿的吸收利用率。胎盘体视学观察结果显示, IUGR胎盘的质量、体积、绒毛表面积和绒毛毛细血管表面积均小于正常组[9]。然而, 本试验中4组间总胎盘质量差异不显著, 以往研究也表明母羊日粮营养水平以及Arg添加不影响胎盘质量[10]。分析该结果, 可能是妊娠期营养不足的母羊, 将大量营养物质输入到胎盘和胎儿组织中, 以促进妊娠进程。以往研究发现, 计算胎儿体质量/胎盘质量的比值能够用于评估胎盘效率, 在人类和哺乳动物妊娠中胎儿体质量/胎盘质量的比值与胎儿的营养水平呈正相关[11]。本试验中营养限饲母羊的胎儿体质量/胎盘质量的比值显著低于其他组, 但限饲母羊日粮中补充RP-Arg和NCG能够显著提高胎儿体质量/胎盘质量的比值, 表明Arg的补充能够促进胎盘效率, 提高胎儿体质量。
3.2 营养限饲后补充RP-Arg和NCG对胎儿脐静脉血中代谢物浓度的影响以往研究表明胎儿脐静脉血可作为评估母体-胎儿以及胎盘-胎儿间营养物质供应的重要检测指标之一[12]。NO和NOS是机体内由Arg促进生成, 具有调节血管舒张力和增加血管通透性的功能。本试验中仅RG组胎儿脐静脉血中NO含量降低, 而ARG与NCG相较于CG差异不显著, 说明母体营养限饲可能降低母-胎血液循环中NO含量, 但RP-Arg和NCG的补充能提高静脉血中NO含量, 该结果与以往的研究一致[13]。虽然NEFA能够参与胎儿脂肪合成, 促进葡萄糖和脂肪在胎儿体内的沉积, 但在本研究中母体的营养限饲及添加Arg未影响胎儿脐静脉血中NEFA含量。葡萄糖通过糖酵解和三羧酸循环过程为胎盘和胎儿提供能量, 并激活子宫内mTOR信号通路, 促进胎盘和胎儿的生长发育[14]。也有研究报道称胎猪脐静脉血浆中葡萄糖的缺乏是导致胎猪体质量降低的主要原因[15]。本试验中胎儿脐静脉血中Glycerol和TG含量在母体营养限饲时显著降低。Glycerol是TG的水解产物, 反映机体内TG含量的变化。TG的主要功能是供给胎儿热能, 保证脑和肌肉等多个组织器官的正常发育, 以及出生后的存活能力。以往研究证明母体血脂的改变会影响胎儿脐带血中血脂的水平, 而胎儿脂质代谢的改变与胎儿IUGR相关[16]。此外, Glycerol也可以直接参与糖酵解, 或通过糖异生转为葡萄糖, 为细胞代谢提供能量。
3.3 营养限饲后补充RP-Arg和NCG对胎盘组织中相关生长因子的影响VEGF家族主要包括VEGFA和PLGF1, 并通过结合细胞表面的VEGFR-1、VEGFR-2、Tie-1和Tie-2等受体, 对胎盘血管生长发育具有重要作用[17]。其中, VEGFR-1促进血管内皮细胞的分化和发育, 而VEGFR-2则诱导内皮细胞增殖和迁移[18]。本试验肉阜和子叶组织中VEGFA和VEGFR- 1 mRNA表达量在不同组间差异不显著, 然而母体营养限饲显著增加肉阜和子叶中VEGFR- 2 mRNA表达量。在缺氧导致胎儿IUGR的研究中发现, 胎盘中VEGFA mRNA表达量不变, 但VEGFR- 1和VEGFR-2 mRNA表达量显著增加[19]。在绵羊胎盘中VEGFR-2是调节胎盘发育的主要受体, 而VEGFR-1仅在妊娠中后期表达[20]。本试验中, 母羊营养限饲增加肉阜和子叶中VEGFR- 2 mRNA表达量, 可能是为了缓解母体的营养限饲, 促进胎盘中血管的发育以及增加胎盘的血流量。Ang-1和Ang-2通过二者共同的受体Tie-2调节, 增强胎盘中VEGF的血管生成[21]。此外, Ang-1与VEGF协同发挥作用, 促进血管发育系统的成熟和稳定, 而Ang-2调节分支血管形成过程中的不稳定[22]。本试验中Ang- 1和Tie-2 mRNA表达量在组间差异不显著, 但营养限饲组中肉阜和子叶中Tie- 2 mRNA表达量显著下降。以往IUGR研究中证明绵羊肉阜和子叶中Ang- 2和Tie-2 mRNA表达量下降, 将影响VEGFA和PLGF的表达[23]。妊娠期限饲母羊通过补充RP-Arg和NCG改善胎盘中血管发育相关因子的变化, 从而调控胎盘的生长发育。
3.4 营养限饲后补充RP-Arg和NCG对胎盘中mTOR通路关键因子的影响胎盘组织中细胞生长也受营养条件和细胞内外环境影响。mTOR通路又称为哺乳动物体内的"营养传感器", 在该通路中mTOR可以接受上游氨基酸和腺苷单磷酸活化蛋白激酶传递的信号, 并将其整合后传递到mTOR通路中下游靶蛋白p70S6K和4EBP1[24]。这些蛋白进一步激活调节目标基因的转录, 从而合成蛋白质, 以及调控细胞生长[25]。因此, 本试验中, 通过检测mTOR通路的关键蛋白p70S6K和4EBP1的表达量, 探究母体营养因素对胎盘中蛋白质的合成以及细胞生长的影响。虽然在试验中IUGR胎儿骨骼肌中未发现4EBP1的表达量与对照组胎儿中表达量的显著差异, 但在引发胎儿IUGR的胎盘组织中发现p70S6K和4EBP1的表达量差异显著[26]。本试验中肉阜和子叶中mTOR mRNA表达量在组间差异不显著, 但p 70S6K和4EBP1 mRNA和蛋白及其磷酸化水平表达量差异显著, 说明在母体营养限饲时, 胎盘组织中mTOR通路中下游靶蛋白p70S6K和4EBP1被激活, 相互配合以促进细胞生长增殖。当胎儿出现IUGR时, 胎盘组织中p70S6K总蛋白和磷酸化水平下调[24], 这与本试验的结果相似。此外, 4EBP1蛋白受已经被证明的5个磷酸化位点调控(即Thr37、Thr46、Thr70、Ser64和Ser82)[27], 本试验中仅检测Thr37/46位点的4EBP1磷酸化蛋白水平。
综上所述, 母羊妊娠期营养限饲会降低胎儿体质量/胎盘质量比值, 改变胎儿脐静脉血中代谢物的变化, 以及胎盘组织中相关血管生长因子以及mTOR通路中关键因子的表达变化。日粮中补充适量的RP-Arg和NCG通过调节子叶和肉阜中血管生长相关因子以及mTOR通路中关键因子的表达, 促进胎盘的生长发育, 从而缓解营养限饲母体和胎儿的影响。添加20 g · d-1RP-Arg和5 g · d-1NCG对胎盘发育基影响不显著, 然而NCG的价格相对RP-Arg较为低廉, 因此建议在妊娠期母羊的日粮中添加NCG, 不仅能缓解因母体因素造成的胎儿IUGR, 也能一定程度上对母羊进行营养补充。
| [1] |
Arroyo J, Winn V. Vasculogenesis and angiogenesis in the IUGR placenta[J]. Seminars in Perinatology, 2008, 32(3): 172-177. DOI:10.1053/j.semperi.2008.02.006 |
| [2] |
Hafez S A, Borowicz P P, Reynolds L P, et al. Maternal and fetal microvasculature in sheep placenta at several stages of gestation[J]. Journal of Anatomy, 2010, 216(3): 292-300. DOI:10.1111/j.1469-7580.2009.01184.x |
| [3] |
Li Y, Lorca, Ramón A, Su E J. Molecular and cellular underpinnings of normal and abnormal human placental blood flow[J]. Journal of Molecular Endocrinology, 2017, JME-17-0139. |
| [4] |
Regnault T R, Orbus R J, de Vrijer B, et al. Placental expression of VEGF, PIGF and their receptors in a model of placental insufficiency-intrauterine growth restriction(PI-IUGR)[J]. Placenta, 2002, 23(2/3): 132-144. |
| [5] |
Baluk P, Falcón B L, Hashizume H, et al. Cellular actions of angiogenesis inhibitors on blood vessels[J]. Experimental Dermatology, 2007, 16(10): 869-872. DOI:10.1111/j.1600-0625.2007.00607_6.x |
| [6] |
Zhang H, Sun L W, Wang Z Y, et al. N-carbamylglutamate and L-arginine improved maternal and placental development in underfed ewes[J]. Reproduction, 2016, 151(6): 623-635. DOI:10.1530/REP-16-0067 |
| [7] |
Wu G, Bazer F W, Datta S, et al. Proline metabolism in the conceptus:implications for fetal growth and development[J]. Amino Acids, 2008, 35(4): 691-702. DOI:10.1007/s00726-008-0052-7 |
| [8] |
Godfrey K M, Lillycrop K A, Burdge G C, et al. Epigenetic mechanisms and the mismatch concept of the developmental origins of health and disease[J]. Pediatric Research, 2007, 61(5): 5-10. DOI:10.1203/01.pdr.0000267659.76350.c5 |
| [9] |
David A L. Maternal uterine artery VEGF gene therapy for treatment of intrauterine growth restriction[J]. Placenta, 2017, 59(Suppl 1): S44-S50. |
| [10] |
Vonnahme K A, Hess B W, Hansen T R, et al. Maternal undernutrition from early-to mid-gestation leads to growth retardation, cardiac ventricular hypertrophy, and increased liver weight in the fetal sheep[J]. Biology of Reproduction, 2003, 69(1): 133-140. DOI:10.1095/biolreprod.102.012120 |
| [11] |
Pardi G, Marconi A M, Cetin I. Placental-fetal interrelationship in IUGR fetuses:a review[J]. Placenta, 2002, 23(Suppls A): S136-S141. |
| [12] |
Daffos F, Capella-Pavlovsky M, Forestier F. Fetal blood sampling via the umbilical cord using a needle guided by ultrasound report of 66 cases[J]. Prenatal Diagnosis, 1983, 3(4): 271-277. DOI:10.1002/pd.1970030402 |
| [13] |
Arroyo J A, Anthony R V, Parker T A, et al. ERK and AKT activation at mid-gestation and near-term in an ovine model of intrauterine growth restriction[J]. Systems Biology in Reproductive Medicine, 2010, 56(1): 62-73. DOI:10.3109/19396360903469307 |
| [14] |
Gao H J, Wu G Y, Spencer T E, et al. Select nutrients in the ovine uterine lumen. Ⅱ. Glucose transporters in the uterus and peri-implantation conceptuses[J]. Biology of Reproduction, 2009, 80(1): 94. DOI:10.1095/biolreprod.108.071654 |
| [15] |
林刚.宫内生长受限猪胎盘磷酸戊糖途径受损及其营养调控的研究[D].北京: 中国农业大学, 2014. Lin G. Impaired placental pentose phosphate pathway of IUGR fetal pig and its nutritional regulation[D]. Beijing: China Agricultural University, 2014. |
| [16] |
Pecks U, Brieger M, Schiessl B, et al. Maternal and fetal cord blood lipids in intrauterine growth restriction[J]. Journal of Perinatal Medicine, 2012, 40(3): 287. |
| [17] |
Dai J, Rabie A B. VEGF:an essential mediator of both angiogenesis and endochondral ossification[J]. Journal of Dental Research, 2007, 86(10): 937-950. DOI:10.1177/154405910708601006 |
| [18] |
Mac G F, Popel A S. Model of competitive binding of vascular endothelial growth factor and placental growth factor to VEGF receptors on endothelial cells[J]. American Journal of Physiology Heart & Circulatory Physiology, 2004, 286(1): H153-H164. |
| [19] |
Regnault T R, de Vrijer B, Galan H L, et al. The relationship between transplacental O2 diffusion and placental expression of PlGF, VEGF and their receptors in a placental insufficiency model of fetal growth restriction[J]. Journal of Physiology, 2003, 550(2): 641-656. DOI:10.1113/jphysiol.2003.039511 |
| [20] |
Bogic L V, Brace R A, Cheung C Y. Developmental expression of vascular endothelial growth factor(VEGF) receptors and VEGF binding in ovine placenta and fetal membranes[J]. Placenta, 2001, 22(4): 265. DOI:10.1053/plac.2001.0627 |
| [21] |
Schiessl B, Innes B A, Bulmer J N, et al. Localization of angiogenic growth factors and their receptors in the human placental bed throughout normal humanpregnancy[J]. Placenta, 2008, 30(1): 79-87. |
| [22] |
Babischkin J S, Suresch D L, Pepe G J, et al. Differential expression of placental villous angiopoietin-1 and-2 during early, mid and late baboon pregnancy[J]. Placenta, 2007, 28(2/3): 212-218. |
| [23] |
Hagen A S, Orbus R J, Wilkening R B, et al. Placental expression of angiopoietin-1, angiopoietin-2 and tie-2 during placental development in an ovine model of placental insufficiency-fetal growth restriction[J]. Pediatric Research, 2005, 58(6): 1228-1232. DOI:10.1203/01.pdr.0000185266.23265.87 |
| [24] |
Kim D H, Sarbassov D D, Ali S M, et al. mTOR interacts with raptor to form a nutrient-sensitive complex that signals to the cell growth machinery[J]. Cell, 2002, 110(2): 163. DOI:10.1016/S0092-8674(02)00808-5 |
| [25] |
Kimball R L, Wayment M, Merrill D, et al. Hypoxia reduces placental mTOR activation in a hypoxia-induced model of intrauterine growth restriction(IUGR)[J]. Physiological Reports, 2015, 3(12): e12651. DOI:10.14814/phy2.12651 |
| [26] |
Roos S, Powell T L, Jansson T. Placental mTOR links maternal nutrient availability to fetal growth[J]. Biochemical Society Transactions, 2009, 37(1): 295-298. DOI:10.1042/BST0370295 |
| [27] |
Gingras A, Gygi S P, Raught B, et al. Regulation of 4E-BP1 phosphorylation:a novel two-step mechanism[J]. Genes & Development, 1999, 13(11): 1422-1437. |




