文章信息
- 孙晓轲, 储稳, 徐立新, 宋小凯, 李祥瑞, 严若峰
- SUN Xiaoke, CHU Wen, XU Lixin, SONG Xiaokai, LI Xiangrui, YAN Ruofeng
- 旋毛虫反式-2-烯酰辅酶A还原酶1对大鼠免疫功能的影响
- Effects of Trichinella spiralis trans-2-enoyl coenzyme A reductase 1 on immune functions of rat
- 南京农业大学学报, 2020, 43(1): 116-124
- Journal of Nanjing Agricultural University, 2020, 43(1): 116-124.
- http://dx.doi.org/10.7685/jnau.201901028
-
文章历史
- 收稿日期: 2019-01-14
旋毛虫(Trichinella spiralis)是一种重要的人兽共患病病原, 能感染人、其他哺乳动物、鸟类、爬行动物等100多种宿主[1], 在世界范围内造成重大的公共卫生安全隐患[2]。
反式-2-烯酰辅酶A还原酶(trans-2-enoyl-CoA reductases, TER)是一类以还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NADH)为辅酶, 在所有生物中普遍存在[3], 能够催化烯酰辅酶A生成酰基辅酶A的氧化还原酶, 但其在分子水平的生物学功能和催化机制并不清楚[4]。本实验室前期通过蛋白组学研究发现旋毛虫反式-2-烯酰辅酶A还原酶1(trans-2-enoyl coenzyme A reductase 1, TER1, Uniprot蛋白登录号:E5S3Z9)为旋毛虫差异性表达蛋白, 其在雌、雄虫体内的表达量差异显著, 雌虫TER1表达量仅为雄虫的55%。
目前, TER被用于疏通大肠杆菌异源丁醇合成途径的限速步骤, 已经被应用于化学、生物催化和工业生物技术等方面[3], 但对其研究主要在细菌上, 对其在寄生虫上的研究较少。而旋毛虫的TER1是否也有相应的酶功能, 是否对宿主免疫系统产生一定影响等问题尚不清楚。本试验拟通过基因重组表达旋毛虫的TER1, 研究其对大鼠免疫系统的影响, 以进一步了解旋毛虫与宿主间的相互作用。
1 材料与方法 1.1 试验材料 1.1.1 试验动物、虫种、菌种和质粒试验动物为健康SD大鼠和健康ICR小鼠, 购自扬州大学实验动物中心; 旋毛虫虫种为中国河南猪旋毛虫分离株, 国际编号ISS534, 由本课题组传代并保存于ICR小鼠体内; 大肠杆菌DH5α、BL21菌种及pET-32a(+)载体均由南京农业大学兽医寄生虫病学实验室保存。
1.1.2 工具酶和主要试剂DL2000、DL5000 DNA标准品、T4DNA连接酶、限制性内切酶EcoRⅠ、XhoⅠ、2×PhantaⓇ Master Mix、pMD19-T(+)载体均购自宝生物(TaKaRa)工程(大连)有限公司; 反转录试剂盒购于南京诺唯赞生物科技有限公司; RNA提取试剂盒、质粒提取试剂盒、琼脂糖凝胶回收试剂盒购于OMEGA公司; 蛋白定量分析试剂盒购于Thermo公司; 弗式完全佐剂、弗氏不完全佐剂、FITC-dextran购于Sigma公司; Cy3标记的山羊抗大鼠IgG(H+L)、DAPI细胞核染液、抗荧光淬灭封片液、Cell Counting Kit-8(CCK-8)试剂盒、总一氧化氮(NO)检测试剂盒和细胞凋亡试剂盒均购于碧云天生物技术有限公司; MillcellⓇ Hanging Cell Culture Inserts迁移小室购自Merck-Millipore公司; 大鼠外周血淋巴细胞分离液购自北京索莱宝科技有限公司; RPMI 1640和DMEM细胞培养液、胎牛血清(FBS)和青、链霉素均购于Gibco公司; 细胞因子试剂盒购于上海恒远生物科技有限公司; 其余试剂均为国产分析纯。
1.2 TER1 基因的克隆与表达 1.2.1 RT-PCR反应胃蛋白酶消化法收取旋毛虫肌幼虫, 参照RNA提取试剂盒说明书提取旋毛虫肌幼虫的总RNA。根据旋毛虫TER 1基因序列(GenBank登录号:Tsp_03549), 利用Primer Premier 5.0软件设计上/下游引物(P1/P2):5'-CCG GAATTC ATGCATCCAGAATTAATTCGCCATCT-3', 5'-CCG CTCGAG AGATTCGAAAACTAGCAGTTGTTTTCTCG-3', 下划线分别表示EcoRⅠ和XhoⅠ酶切位点, 引物由上海生工生物工程有限公司合成。以提取的旋毛虫肌幼虫总RNA为模板, 应用反转录试剂盒合成第1链cDNA, 再以cDNA为模板进行PCR反应。反应体系(50 μL):Master Mix 25 μL、引物各2 μL、模板cDNA 4 μL、ddH2O 17 μL。反应条件:94 ℃ 5 min; 94 ℃ 35 s, 55 ℃ 35 s, 72 ℃ 90 s, 35个循环; 72 ℃ 10 min。10 g · L-1琼脂糖凝胶电泳检验PCR产物。
1.2.2 TER 1基因的克隆、表达与重组蛋白的纯化扩大PCR反应体系至200 μL, 回收PCR产物, 连接到pMD19-T(+)载体上。将连接产物转化至大肠杆菌DH5α感受态细胞中, 12 h后随机挑取单克隆, 经双酶切鉴定和测序选取阳性克隆, 命名为pMD19-T(+)/TER 1。应用DNAstar软件分析其ORF的基本信息, 利用在线软件预测其表达蛋白中有无跨膜区(http://www.cbs.dtu.dk/services/TMHMM/)以及N端信号肽(http://www.cbs.dtu.dk/services/SignalP/)。对重组质粒pMD19-T(+)/TER 1和表达载体pET-32a(+)使用EcoRⅠ和XhoⅠ进行双酶切, 然后分别回收目的基因片段和载体片段, 用T4DNA连接酶连接, 将连接产物转化至大肠杆菌BL21感受态细胞中。随机挑取单菌落, 提取质粒进行双酶切鉴定, 阳性质粒命名为pET-32a(+)/TER 1。将阳性克隆接种于含50 μg · mL-1氨苄抗生素的LB液体培养基中, 37 ℃振荡培养至菌液A600值为0.4~0.6时, 加入IPTG至终浓度为1 mmol · L-1, 继续培养5 h后, 离心收集菌体沉淀, 超声破碎, 将上清液和包涵体进行SDS-PAGE, 确定重组蛋白的分布情况。使用His蛋白纯化柱对重组蛋白进行纯化, 经SDS-PAGE检测后, 将纯化后的重组蛋白rTER1放入含梯度浓度(6、4、2和0 mol · L-1)尿素的复性缓冲液中透析复性, PEG20000浓缩后, 使用BCA蛋白测定试剂盒测定蛋白浓度, 经过滤除菌后分装, 置于-70 ℃冻存。
1.2.3 重组蛋白抗血清的制备选用雌性标重SD大鼠, 首次免疫用300 μg rTER1与等体积的弗氏完全佐剂乳化后背部皮下多点注射; 2周后取等量rTER1与等体积的弗氏不完全佐剂乳化, 以相同方式免疫大鼠; 三免和四免方法与二免相同, 均间隔1周。四免1周后大鼠眼眶采血, 分离血清, -20 ℃保存备用。
1.2.4 重组蛋白酶活性分析参照文献[3]对rTER1进行酶性活测定。标准反应混合物中含有磷酸钾缓冲液(pH6.2)、0.4 mmol · L-1NADH、0.5 mmol · L-1巴豆酰辅酶A和不同质量(1、2、4、8、16、32 μg)的rTER1。反应混合物在加入底物之前, 在30 ℃环境中孵育10 min, 加入底物开始反应至15 min后, 测定A340。另设pET-32a空载体诱导表达蛋白代替rTER1, 作为对照组, 每个样品3个重复。
1.2.5 重组蛋白的Western blot分析以感染旋毛虫的小鼠血清作为一抗, 健康小鼠的血清作为阴性对照, 对rTER1进行Western blot分析。取适量rTER1进行SDS-PAGE, 电泳结束后, 将凝胶上的蛋白转印到PVDF膜上, 以TBST配制的5%脱脂奶4 ℃过夜封闭膜上的非特异性结合位点。将膜浸没在含一抗(1 : 100稀释)的5%脱脂奶中37 ℃孵育2 h, TBST清洗3次后, 将膜浸没在HRP标记的山羊抗小鼠IgG(二抗, 1 : 5 000稀释)中37 ℃作用2 h, TBST清洗5次, 每次5 min, 加入DAB显色后拍照。
1.3 重组蛋白与大鼠PBMC的结合及对细胞免疫功能的影响 1.3.1 大鼠PBMC的分离与培养无菌采集SD大鼠眼眶抗凝血, 参照大鼠外周血淋巴细胞分离液说明书, 通过标准的Ficoll-hypaque(GE Healthcare, USA)梯度离心法分离获得SD大鼠外周血单个核细胞(PBMC)。用台盼蓝染色法检测细胞活力, 确定细胞活力均在95%以上。将细胞重悬于含10%灭活胎牛血清、1%双抗的RPMI 1640培养液中, 调整细胞浓度至1×106 mL-1, 在37 ℃, 含5% CO2的细胞培养箱中培养。
1.3.2 重组蛋白与大鼠PBMC结合的免疫荧光鉴定取12孔细胞培养板, 每孔加入PBMC悬液1 mL, 加入终浓度为10 μg · mL-1的rTER1, 以相同体积的PBS作为对照, 37 ℃、5% CO2的细胞培养箱中培养1 h, 离心收集细胞。用PBS洗涤3次, 再用400 μL PBS重悬, 滴加到防脱载玻片上, 室温放置15 min。用4%多聚甲醛室温固定30 min, PBS洗涤3次, 每次5 min, 用含5% BSA的PBS 37 ℃封闭30 min。移除封闭液, 滴加含有大鼠抗rTER1血清(1 : 100稀释)的封闭液4 ℃过夜, PBS洗涤3次, 滴加Cy3标记的山羊抗大鼠IgG(1 : 500稀释), 37 ℃避光孵育1 h, PBS洗涤3次后用DAPI室温复染5 min, PBS洗涤3次后滴加荧光淬灭封片液, 盖上盖玻片, 激光共聚焦显微镜观察rTER1与大鼠PBMC的结合情况[5]。
1.3.3 重组蛋白对大鼠PBMC增殖的影响取96孔板, 每孔接种细胞悬液100 μL, 再向每孔加入终浓度为10 μg · mL-1的ConA(阳性对照)和10、20、40 μg · mL-1的rTER1, 同时设pET-32a空载体诱导表达蛋白对照和PBS空白对照。于37 ℃、5% CO2的细胞培养箱中培养48 h后, 每孔加入10 μL CCK-8溶液, 继续在细胞培养箱内避光孵育4 h, 然后用酶标仪测定A450的吸光值。按照如下公式计算增殖指数[6]:细胞增殖指数=试验组A450/对照组A450。
1.3.4 重组蛋白对大鼠PBMC迁移的影响取24孔板, 每孔接种细胞悬液1 mL, 再加入不同浓度的rTER1(10、20、40 μg · mL-1), 同时设pET-32a空载体蛋白对照和PBS空白对照, 放入细胞培养箱培养24 h, 计数细胞; 将迁移小室嵌入24孔板细胞培养板, 并在迁移小室的下室加入500 μL含10%灭活胎牛血清的1640培养基, 上室加入200 μL经过计数的细胞混合物, 然后置于37 ℃、5% CO2的细胞培养箱培养2 h, 收集并计数迁移至下室中的细胞, 计算迁移细胞占总上样细胞的百分比。
1.3.5 重组蛋白对大鼠PBMC分泌NO的影响用含10%胎牛血清、1%双抗的DMEM培养基重新调整PBMC浓度至1×106 mL-1。取24孔板, 每孔加入细胞悬液1 mL以及相应浓度的rTER1, 并设置pET-32a空载体诱导表达蛋白对照和PBS空白对照, 于细胞培养箱培养24 h后, 离心取细胞上清液, 按照总NO检测说明书(碧云天公司)进行测定。
1.3.6 重组蛋白对大鼠PBMC吞噬功能的影响取24孔细胞培养板, 每孔加入1 mL PBMC, 分别加入不同浓度的rTER1, 并设置pET-32a空载体诱导表达蛋白对照和PBS空白对照, 置于37 ℃、5% CO2的细胞培养箱培养。48 h后收取细胞, 用100 μL预冷的PBS洗涤2次后将细胞重悬, 再与等体积的FITC-dextran(1 mg · mL-1, 相对分子质量40 000)混匀后分别置于4 ℃、37 ℃避光孵育1 h, 用含2% FBS的预冷PBS洗涤3次, 用500 μL含2%多聚甲醛的预冷PBS重悬细胞, 流式细胞术测定平均荧光强度(MFI), 检测rTER1对PBMC吞噬功能的影响[7]。细胞吞噬指数(PI)=MFI试验组/MFI细胞对照组[6]。
1.3.7 重组蛋白对大鼠PBMC凋亡的影响用不同浓度rTER1(10、20和40 μg · mL-1), pET-32a空载体诱导表达蛋白(10 μg · mL-1)以及PBS培养PBMC 24 h。用不含Ca2+/Mg2+的PBS(pH7.4)洗涤2次, 重悬PBMC于结合缓冲液中, 在室温黑暗环境中将膜联蛋白V-FITC加入细胞悬浮液中, 染色15 min后加入碘化丙啶, 通过流式细胞仪(BD Biosciences, USA)分析。
1.4 重组蛋白对大鼠体内细胞因子分泌的影响将30只250 g左右的SD大鼠随机均分成3组。第1组腹腔注射0.3 mg rTER1, 第2组腹腔注射0.3 mg pET-32a空载体诱导表达蛋白, 第3组注射0.5 mL PBS。分别于注射前(0 d), 注射后1、2、3、4、5和6 d采集血清。用ELISA试剂盒检测血清中IL-4、IL-9、IL-17、TGF-β和IFN-γ的水平。
1.5 数据的统计分析使用GraphPad Premier 6.0软件包进行分析, 组间比较采用单因素方差分析(One-way ANOVA)。数据均表示为平均值±标准差(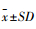
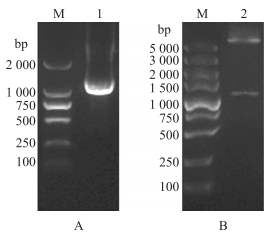
PCR产物经琼脂糖凝胶电泳后, 在1 000~2 000 bp处有一条带与TER1预期大小一致(图 1)。
|
图 1 旋毛虫TER 1基因的克隆与鉴定 Fig. 1 Cloning and identification of Trichinella spiralis TER 1 gene A. PCR产物琼脂糖凝胶电泳; B.重组质粒pET-32a(+)/TER 1双酶切鉴定; M. DNA标准品; 1. PCR扩增产物; 2.重组质粒经EcoRⅠ和XhoⅠ的双酶切。 A. Agarose gel electrophoresis of PCR products; B. Identification of recombinant plasmid pET-32a(+)/TER 1 by restriction enzyme digestion; M. DNA marker; 1. Products of PCR; 2. Recombinant plasmid digested by EcoRⅠand XhoⅠ. |
利用DNAstar软件分析TER 1基因的ORF, 其基因长度为1 083 bp, 编码含360个氨基酸组成的蛋白质, 理论等电点为9.46, 相对分子质量39.858×103, 无信号肽(图 2-A), 无跨膜区(图 2-B)。将该ORF在NCBI网站进行BLAST对比分析, 发现与GenBank中旋毛虫TER 1基因(Tsp_03549)的相似度为100%。在NCBI的Conserved Domain在线蛋白数据库检索, 结果表明:旋毛虫TER1在进化过程中十分保守, 包含2-烯酰基硫酯还原酶结构域(2-enoyl thioester reductase, ETR), 具有非常保守的烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADP)结合位点。

|
图 2 旋毛虫TER1氨基酸序列分析 Fig. 2 Analysis of T.spiralis TER1 amino acid sequence A. N端信号肽预测; B.跨膜蛋白预测。 A. N-terminal signal peptide prediction; B. Membrane protein prediction. |
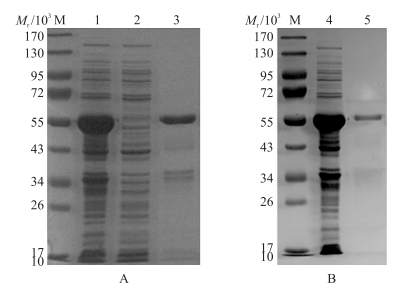
原核表达质粒pET-32a(+)/TER 1经EcoRⅠ和XhoⅠ双酶切鉴定后, 得到长度大于5 000 bp的载体片段和1 000~1 500 bp的目的片段, 与预期相符(图 1-B), 表明原核表达质粒构建成功。SDS-PAGE分析结果显示:重组质粒pET-32a(+)/TER 1成功在大肠杆菌中表达, 重组蛋白相对分子质量约为58×103, 诱导表达后的重组蛋白主要以包涵体形式存在(图 3-A), 经镍柱纯化后得到了较纯净的重组蛋白rTER1(图 3-B)。
|
图 3 rTER1表达(A)与纯化(B)的鉴定 Fig. 3 The expression(A)and purification(B)of rTER1 M.蛋白质相对分子质量标准品; 1.诱导5 h的细菌裂解产物; 2.表达产物上清液; 3.表达产物包涵体; 4.纯化前的包涵体蛋白; 5.纯化后的包涵体蛋白。 M. Protein molecular weight marker; 1. Bacterial lysate induced by IPTG for 5 h; 2. Supernatant of expression products; 3. Inclusion body of expression products; 4. Inclusion body without purification; 5. Purified protein from inclusion body. |
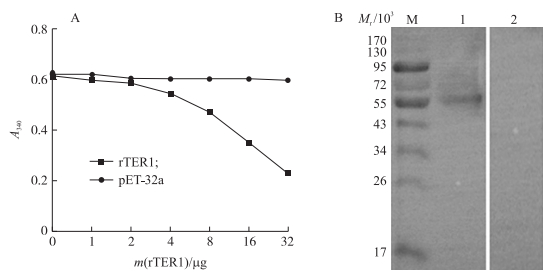
酶活性测定结果如图 4-A所示:A340值随rTER1量的增加而降低, 但pET-32a空载体诱导表达蛋白对照组的A340值无明显变化。
|
图 4 rTER1的酶活性(A)分析及Western blot(B)分析 Fig. 4 Activity analysis(A)and Western blot analysis(B) of rTER1 M.蛋白质相对分子质量标准品; 1.感染旋毛虫的小鼠血清; 2.健康小鼠的血清。 M. Protein molecular weight marker; 1. The serum of mice infected with T. spiralis was used as the primary antibody; 2. The primary antibody was the serum from healthy mice. |
Western blot分析结果显示:以感染旋毛虫的小鼠血清作为一抗时, 在相对分子质量(55~72)×103区域处有一条特异性条带, 而以健康小鼠血清为一抗的阴性对照没有条带出现(图 4-B)。
2.4 重组蛋白rTER1与大鼠PBMC结合的鉴定鉴定结果如图 5所示:rTER1组的细胞发出Cy3标记的红色荧光, DAPI复染的细胞核发出蓝色荧光; 而PBS对照组细胞核只有蓝色荧光, 没有观察到红色荧光。
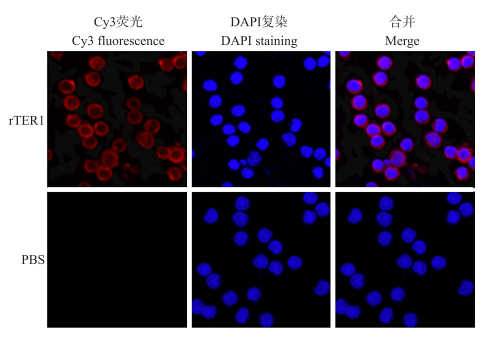
|
图 5 rTER1与大鼠PBMC结合的免疫荧光鉴定(×100) Fig. 5 Immunofluorescence identification of binding of rTER1 and rat PBMC |
如图 6-A所示:与PBS空白对照组和pET-32a空载体组相比, 10和20 μg · mL-1 rTER1能极显著促进大鼠PBMC增殖(P < 0.01), 而40 μg · mL-1 rTER1和ConA阳性对照组均极显著促进大鼠PBMC增殖(P < 0.001)。
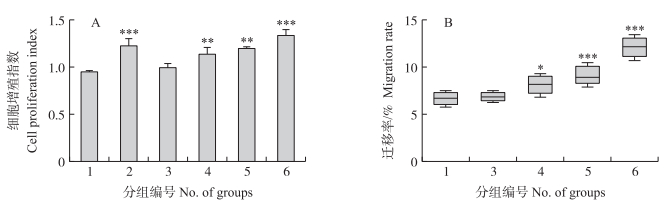
|
图 6 rTER1对大鼠PBMC增殖(A)与迁移(B)的影响 Fig. 6 Effect of rTER1 on rat PBMC proliferation(A)and migration(B) 1. PBS对照组; 2. ConA阳性对照组; 3. pET-32a空载体组; 4~6. 10、20和40 μg · mL-1 rTER1处理组。 1. PBS control group; 2. ConA positive control group; 3. pET-32a empty vector protein group; 4-6. rTER1 treatment groups with concentrations of 10, 20 and 40 μg · mL-1, respectively. *P < 0.05, * *P < 0.01, * * *P < 0.001. The same as follows. |
如图 6-B所示:与PBS空白对照组和pET-32a空载体组相比, 10 μg · mL-1 rTER1能显著促进PBMC迁移(P < 0.05), 20和40 μg · mL-1 rTER1促进作用极显著(P < 0.001)。
2.6 重组蛋白rTER1对大鼠PBMC分泌NO和吞噬功能的影响如图 7-A所示:rTER1组与PBS空白对照组、pET-32a空载体组相比, 10 μg · mL-1 rTER1能显著促进PBMC分泌NO(P < 0.01), 20和40 μg · mL-1 rTER1的促进作用极显著(P < 0.001)。
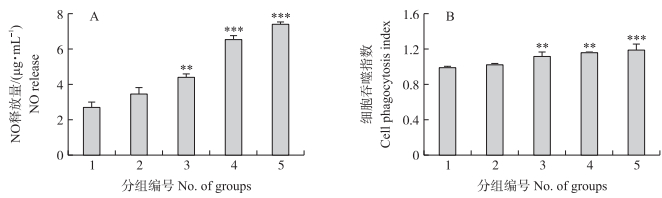
|
图 7 rTER1对大鼠PBMC分泌NO(A)和吞噬功能(B)的影响 Fig. 7 Effect of rTER1 on rat PBMC nitric oxide production(A)and phagocytosis(B) 1. PBS空白对照组; 2. pET-32a空载体组; 3~5.分别为10、20和40 μg · mL-1 rTER1处理组。 1. PBS blank control group; 2. pET-32a empty vector protein group; 3-5. rTER1 treatment groups with concentrations of 10, 20 and 40 μg · mL-1, respectively. |
与PBS空白对照组和pET-32a空载体诱导表达蛋白组相比, rTER1在质量浓度为10和20 μg · mL-1时, 均能显著促进大鼠PBMC的吞噬功能(P < 0.01), 而40 μg · mL-1时促进作用极显著(P < 0.001)(图 7-B)。
2.7 重组蛋白对大鼠PBMC凋亡的影响图 8-A为流式细胞术结果。统计各组细胞凋亡的比例(包括早期凋亡的Q3区和晚期凋亡的Q2区), 统计结果如图 8-B所示:PBS阴性对照组和pET-32a空载体诱导表达蛋白组之间无显著差异(P>0.05), 与这2组相比, rTER1质量浓度为10和20 μg · mL-1时, 大鼠PBMC细胞凋亡无显著差异(P>0.05), 当rTER1质量浓度为40 μg · mL-1时, 能够显著促进大鼠PBMC的凋亡(P < 0.05)。
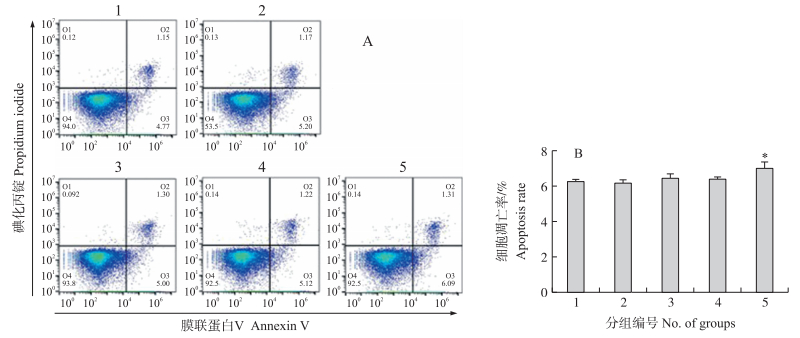
|
图 8 rTER1对大鼠PBMC凋亡的影响 Fig. 8 Effect of rTER1 on rat PBMC apoptosis 1. PBS空白对照组; 2. pET-32a空载体组; 3~5.浓度分别为10、20和40 μg · mL-1 rTER1处理组。 1. PBS blank control group; 2. pET-32a empty vector protein group; 3-5. rTER1 treatment groups with concentrations of 10, 20 and 40 μg · mL-1, respectively. |
如图 9所示:PBS和pET-32a组中各细胞因子的表达水平没有显著差异(P>0.05)。在注射rTER1后1~5 d, 大鼠体内IFN-γ水平均显著高于对照组(P < 0.05);IL-17水平在注射后1~4 d时极显著低于对照组(P < 0.01), 然后在5 d时恢复正常水平(P>0.05)。但是, 与对照组相比, 注射rTER1对IL-4、IL-9和TGF-β的分泌水平没有显著影响(P>0.05)。
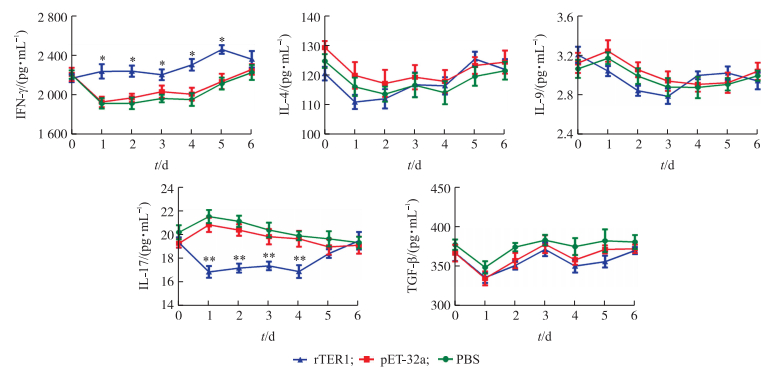
|
图 9 rTER1对大鼠体内细胞因子分泌水平的影响 Fig. 9 Effect of rTER1 on cytokine expression level in vivo |
目前, 对旋毛虫病的防治主要依赖于甲苯咪唑和阿苯达唑等化学药物, 然而效果并不理想, 因此开发预防旋毛虫感染的疫苗尤其重要[8]。虽然人们已经针对旋毛虫进行了许多疫苗方面的研究, 但是由于旋毛虫的生活史以及与宿主互作过程较为复杂[9], 目前仍然没有针对该寄生虫的可靠且广泛适用的疫苗[10]。因此寻找具有免疫保护效果的虫体特异性抗原是研制该寄生虫疫苗的关键[11], 探索抗原蛋白在旋毛虫入侵、感染过程中发挥的作用, 对筛选出抗旋毛虫疫苗候选分子具有重要意义。
笔者选取旋毛虫TER 1基因进行克隆表达, 序列分析发现其具有保守的ETR结构域和NADP结合位点, 属于中链还原酶/脱氢酶(medium chain dehydrogenase reductase, MDR)/锌依赖性醇脱氢酶样家族, 在脂肪酸和次级代谢物生物合成中必不可少[12]。TER1存在于线粒体中, 参与脂肪酸延伸反应的第4步还原反应, 产生用于鞘脂合成的长链脂肪酸, 以及通过鞘氨醇-1-磷酸(sphingosine-1-phosphate, S1P)代谢途径降解鞘脂中的鞘氨醇(sphingosine, SPH), 这些对线粒体功能至关重要[13]。
本试验所纯化的重组蛋白rTER1具有一定的酶活性, 但是由于缺少TER1阳性对照, 无法计算出重组蛋白的酶促动力学常数, 只对酶活性进行了定性。Western blot分析表明, rTER1具有良好的免疫反应原性, 免疫荧光试验证明其能与大鼠PBMC进行结合, 说明rTER1具有对免疫细胞功能进行调节的潜力[5], 而具体结合的细胞种类以及相应的细胞受体则需要进一步研究。
本研究体外试验选择了外周血单个核细胞, 其包括淋巴细胞、单核细胞和树突状细胞, 是免疫系统的重要组成部分[14]。通过测定部分免疫指标, 可以了解重组蛋白对其免疫功能的影响, 从而明确重组蛋白与宿主免疫系统的作用关系, 为寻找具有高效免疫保护作用的疫苗候选抗原奠定基础。细胞增殖和迁移是与免疫反应密切相关且必不可少的过程, 是细胞有效参与宿主防御, 抵御病原体侵袭的重要表现[15]。NO是一种普遍存在的信号分子, 由参与免疫反应的各种类型的细胞所释放, 特别是IFN-γ激活的单核巨噬细胞, 其具有多种免疫调节功能, 参与针对多种寄生虫的非特异性免疫防御, 在机体抵抗寄生虫感染过程中发挥重要作用[16]。细胞凋亡是一种可以在自然条件下发生的现象, 其受外源性(死亡受体)和内在(线粒体)两种主要途径调节, 被认为是由寄生分子和细胞机制诱导的宿主免疫应答的免疫调节[17]。本研究结果表明, rTER1能够显著促进细胞增殖和迁移, 有利于免疫细胞清除病原和有害物质; 能够显著促进大鼠PBMC的NO分泌和吞噬功能, 加强机体的防御能力。一定浓度的rTER1能够促进大鼠PBMC的凋亡, 对清除衰老损伤细胞和维持机体内环境的稳态有可能具有着重要作用, 但诱导细胞凋亡的信号传导途径和机制尚需进一步研究。
在抑制寄生虫感染的过程中, 1型(Th1)和2型(Th2)免疫反应和与细胞因子分泌相关的各种炎症反应起重要作用[18]。在旋毛虫入侵肠道阶段, 机体的免疫反应是Th1/Th2混合, 其中初始阶段以Th1型免疫应答为主; 在肌肉组织寄生阶段, Th2型免疫反应占优势; 在整个感染过程中Th1型和Th2型反应之间存在动态平衡关系[19]。本研究测定了分别由Th1、Th2、Th9、Th17和调节型T细胞(Treg)分泌的IFN-γ、IL-4、IL-9、IL-17和TGF-β的水平。IFN-γ主要与相关病原体的识别有关, 可调节免疫能力和应对其他细胞因子信号转导, 激活单核巨噬细胞[20]。然而, IFN-γ在旋毛虫感染过程中的具体作用还不清楚[21]。Th17主要通过IL-17(也称为组织的炎症因子)发挥作用。Th17细胞在寄生虫感染过程中迅速转化为Th2细胞, 是抵抗寄生虫感染的重要细胞因子[22]。从本研究发现, 在大鼠体内, rTER1能够促进IFN-γ分泌, 抑制IL-17的分泌, 推测其可能通过调节IFN-γ的分泌来发挥作用, 以增强机体的免疫能力; 而抑制IL-17分泌可能提示该蛋白分子能够抑制Th17细胞向Th2细胞的转化, 从而抑制机体的Th2型免疫反应; IL-4、IL-9和TGF-β的变化不显著。有研究表明, 寄生虫在感染中主动通过调整机体Th1、Th2和Th17的平衡, 使其逃避宿主的免疫杀伤, 同时又不使宿主产生特别严重的免疫抑制, 以此达到寄生的目的[23]。
本课题组高波等[24]研究发现, 捻转血矛线虫谷胱甘肽过氧化物酶重组蛋白HC29能有效提高山羊PBMC的多种免疫功能, 而免疫保护试验也表明其对山羊捻转血矛线虫具有部分保护作用[25], 说明对寄生虫重组蛋白功能的研究有助于寻找具有免疫保护效果的抗原。综合本研究结果, 认为TER1是旋毛虫生长发育过程中的重要分子, 可通过多种途径影响免疫系统功能的发挥, 具有作为疫苗候选抗原的潜力, 值得进一步研究。
致谢: 感谢南京农业大学动物医学院黄鑫、王强强在样品采集、数据分析过程中给予的帮助。
| [1] |
Murrell K D, Pozio E. Worldwide occurrence and impact of human trichinellosis, 1986-2009[J]. Emerging Infectious Diseases, 2011, 17: 2194-2202. DOI:10.3201/eid1712.110896 |
| [2] |
Pozio E. World distribution of Trichinella spp. infections in animals and humans[J]. Veterinary Parasitology, 2007, 149: 3-21. DOI:10.1016/j.vetpar.2007.07.002 |
| [3] |
Hu K, Zhao M, Zhang T L, et al. Structures of trans-2-enoyl-CoA reductases from Clostridium acetobutylicum and Treponema denticola:insights into the substrate specificity and the catalytic mechanism[J]. Biochemical Journal, 2013, 449: 79-89. DOI:10.1042/BJ20120871 |
| [4] |
胡宽.丙酮丁醇梭菌中反式-2-烯酰辅酶A还原酶的晶体结构和催化机制研究及一株抗CD25单链抗体的设计与改造[D].上海: 中国科学院上海生命科学研究院, 2012. Hu K. Study on crystal structure and catalytic mechanism of trans-2-enoyl CoA reductase from Clostridium acetobutylicum and design and affinity of an anti-CD25 single chain Fv[D]. Shanghai: Shanghai Institutes for Biological Sciences, CAS, 2012(in Chinese with English abstract). |
| [5] |
Wang W, Yuan C, Wang S, et al. Transcriptional and proteomic analysis reveal recombinant galectins of Haemonchus contortus down-regulated functions of goat PBMC and modulation of several signaling cascades in vitro[J]. Journal of Proteomics, 2014, 98: 123-137. DOI:10.1016/j.jprot.2013.12.017 |
| [6] |
Li Y, Yuan C, Wang L K, et al. Transmembrane protein 147(TMEM147):another partner protein of Haemonchus contortus galectin on the goat peripheral blood mononuclear cells(PBMC)[J]. Parasites & Vectors, 2016, 9: 355. |
| [7] |
Kim M Y, Kim J H, Cho J Y. Cytochalasin B modulates macrophage-mediated inflammatory responses[J]. Biomolecules & Therapeutics, 2014, 22: 295. |
| [8] |
Lei F, Liang S, Jing Y, et al. Heat shock protein 70 from Trichinella spiralis induces protective immunity in BALB/c mice by activating dendritic cells[J]. Vaccine, 2014, 32: 4412-4419. DOI:10.1016/j.vaccine.2014.06.055 |
| [9] |
Fu B Q, Liu M Y, Kapel C M O, et al. Molecular cloning of a cDNA encoding a putative cuticle collagen of Trichinella spiralis[J]. Veterinary Parasitology, 2005, 132: 31-35. DOI:10.1016/j.vetpar.2005.05.020 |
| [10] |
Bai X, Hu X, Liu X, et al. Current research of trichinellosis in China[J]. Front Microbiol, 2017, 8: 1472. DOI:10.3389/fmicb.2017.01472 |
| [11] |
吴绍强, 蒋金书, 刘群, 等. 鸡球虫疫苗研究进展[J]. 畜牧兽医学报, 2005, 36(1): 1-5. Wu S Q, Jiang J S, Liu Q, et al. Progress in the development of vaccines against avian coccidiosis[J]. Chinese Journal of Animal and Veterinary Science, 2005, 36(1): 1-5 (in Chinese with English abstract). DOI:10.3321/j.issn:0366-6964.2005.01.001 |
| [12] |
Rosenthal R G, Vögeli B, Quade N, et al. The use of ene adducts to study and engineer enoyl-thioester reductases[J]. Nature Chemical Biology, 2015, 11: 225-243. |
| [13] |
Takeshi W, Kensuke A, Akio K. Dual functions of the trans-2-enoyl-CoA reductase TER in the sphingosine 1-phosphate metabolic pathway and in fatty acid elongation[J]. Journal of Biological Chemistry, 2014, 289: 24736-24748. DOI:10.1074/jbc.M114.571869 |
| [14] |
吴玲燕, 王玉俭, 温玉玲, 等. 捻转血矛线虫NADH:泛醌氧化还原酶结构域包含蛋白基因的克隆表达及功能分析[J]. 畜牧兽医学报, 2017, 48(4): 722-730. Wu L Y, Wang Y J, Wen Y L, et al. Cloning, expression and function analysis of NADH:ubiquinone oxidoreductase domain containing protein in Haemonchus contortus[J]. Chinese Journal of Animal and Veterinary Science, 2017, 48(4): 722-730 (in Chinese with English abstract). |
| [15] |
Moll H. Dendritic cells and host resistance to infection[J]. Cellular Microbiology, 2010, 5: 493-500. |
| [16] |
Romain O, Philippe B. Induction, propagation, and activity of host nitric oxide:lessons from Leishmania infection[J]. Trends in Parasitology, 2015, 31: 653-664. DOI:10.1016/j.pt.2015.08.001 |
| [17] |
Katarzyna D S, Maria D. Apoptosis, a protective mechanism for pathogens and their hosts[J]. Wiadomoci Parazytologiczne, 2005, 51: 271-280. |
| [18] |
Shakya K P, Miller J E, Horohov D W. A Th2 type of immune response is associated with increased resistance to Haemonchus contortus in naturally infected Gulf Coast Native lambs[J]. Veterinary Parasitology, 2009, 163: 57-66. DOI:10.1016/j.vetpar.2009.03.052 |
| [19] |
Ishikawa N, Goyal P K, Mahida Y R, et al. Early cytokine responses during intestinal parasitic infections[J]. Immunology, 2010, 93: 257-263. |
| [20] |
Andrew C, Gaelle L F, John C, et al. The Th1 life cycle:molecular control of IFN-γ to IL-10 switching[J]. Trends in Immunology, 2011, 32: 278-286. DOI:10.1016/j.it.2011.03.010 |
| [21] |
Morales M A G, Raffaella M, Massimo S, et al. Increased CD8(+)-T-cell expression and a type 2 cytokine pattern during the muscular phase of Trichinella infection in humans[J]. Infection & Immunity, 2002, 70: 233-239. |
| [22] |
Marc P, Selina S, Stefanie W, et al. Rapid in vivo conversion of effector T cells into Th2 cells during helminth infection[J]. Journal of Immunology, 2012, 188: 615-623. DOI:10.4049/jimmunol.1101164 |
| [23] |
程云, 李建华, 彭景贤. 细胞因子与寄生虫感染关系研究进展[J]. 中国病原生物学杂志, 2010, 5(5): 381-384. Cheng Y, Li J H, Peng J X. Advances in research on the relationship between cytokines and parasite immunity[J]. Journal of Pathogen Biology, 2010, 5(5): 381-384 (in Chinese with English abstract). |
| [24] |
高波, 袁橙, 宋小凯, 等. 捻转血矛线虫谷胱甘肽过氧化物酶体外对山羊外周血单核细胞功能的影响[J]. 畜牧与兽医, 2014, 46(5): 19-23. Gao B, Yuan C, Song X K, et al. Effects of glutathione peroxidase in Haemonchus contortus on functions of peripheral blood mononuclear cellsfrom goats in vitro[J]. Animal Husbandry and Veterinary Medicine, 2014, 46(5): 19-23 (in Chinese with English abstract). |
| [25] |
Sun W, Song X K, Yan R F, et al. Vaccination of goats with a glutathione peroxidase DNA vaccine induced partial protection against Haemonchus contortus infection[J]. Veterinary Parasitology, 2011, 182: 239-247. DOI:10.1016/j.vetpar.2011.05.024 |




