文章信息
- 王娟芳, 戴建君, 姜敏, 任建鸾, 李德志, 张鹏, 孙建和, 汤芳
- WANG Juanfang, DAI Jianjun, JIANG Min, REN Jianluan, LI Dezhi, ZHANG Peng, SUN Jianhe, TANG Fang
- 禽致病性大肠杆菌O1、O2、O78血清型三重PCR检测方法的建立
- Triplex PCR to identify avian pathogenic Escherichia coli O1, O2 and O78 serotypes
- 南京农业大学学报, 2020, 43(1): 108-115
- Journal of Nanjing Agricultural University, 2020, 43(1): 108-115.
- http://dx.doi.org/10.7685/jnau.201811032
-
文章历史
- 收稿日期: 2018-11-28
2. 上海市兽医生物技术重点实验室, 上海 200240
2. Shanghai Key Laboratory of Veterinary Biotechnology, Shanghai 200240, China
禽致病性大肠杆菌(avian pathogenic Escherichia coli, APEC)是肠外致病性大肠杆菌(extraintestinal pathogenic Escherichia coli, ExPEC)中的一种, 可以引起鸡、火鸡及其他禽类的肠道外疾病, 通常伴有全身性感染和特征性纤维性病变, 如心包炎、肝周炎、气囊炎等, 甚至引起败血症而急性死亡[1-3]。由APEC引起的细菌感染是造成全球家禽养殖重大经济损失的重要原因[4-6]。
有试验证明APEC在大鼠上可引起与新生儿脑膜炎大肠杆菌(neonatal meningitis Escherichia coli, NMEC)感染类似的脑膜炎症状, 提示APEC具有人畜共患的风险[7]。越来越多的证据显示APEC对人类健康造成了潜在威胁[3, 8-12]。因此, 加强长期监测禽大肠杆菌病对养禽业和公共卫生都具有重要意义。
APEC的血清型众多, 目前报道的致病力较强的血清型主要有O1、O2和O78, 临床上发病率较高的禽大肠杆菌病也主要以这3种血清型为主[6, 13]。目前对APEC O1、O2和O78血清型菌株的检测报道较少, 且所用检测方法耗时长, 仪器设备较繁琐, 灵敏度低。因此本试验针对APEC的这3种血清型各设计1对特异性引物, 通过优化3种引物的比例、退火温度以及其他PCR反应条件, 以建立能够同时扩增APEC 3种主要血清型的三重PCR检测方法, 实现对APEC O1、O2和O78血清型的快速检测。
1 材料与方法 1.1 菌株O1血清型大肠杆菌CVCC249、O2血清型大肠杆菌CVCC251、O78血清型大肠杆菌CVCC1553均购自中国兽医微生物菌种保藏管理中心。金黄色葡萄球菌98064、金黄色葡萄球菌ATCC25923、肠炎沙门氏菌1806、鼠伤寒沙门氏菌ATCC14028和枯草芽胞杆菌0802由本实验室保存。
1.2 主要试剂和仪器细菌基因组DNA提取试剂盒(OMEGA公司); Taq试剂盒、DL1000 DNA Marker(TaKaRa公司); 胰蛋白胨、酵母提取物、麦康凯琼脂(英国Oxoid公司); GoldView核酸染料(北京鼎国昌盛生物技术有限公司); 大肠杆菌O抗原诊断血清(天津生物芯片技术有限公司)。PCR仪(德国Eppendorf公司); 电泳仪(北京市六一仪器厂); 凝胶成像系统(美国Bio-Rad公司); NanoDrop紫外可见分光光度计(美国Thermo Scientific公司)。
1.3 引物设计与合成将APEC O1、O2血清型的O抗原基因簇序列与大肠杆菌184种血清型的O抗原基因簇序列进行比对, 分别筛选出O1、O2的O抗原特异性基因序列, 根据特异性基因序列设计APEC O1、O2特异性引物(表 1)。将APEC O78血清型菌株CVCC1553进行全基因组测序, 并将其序列和NCBI中另一株禽致病性大肠杆菌O78血清型菌株(GenBank ID:CP004009.1)的全基因组序列与NCBI已公布的其他200多株大肠杆菌全基因组序列比较, 筛选出APEC O78特异性基因(GenBank ID:AGC87672.1), 根据该特异性基因设计O78血清型特异性引物(表 1)。引物由南京擎科生物科技有限公司合成。
| 细菌菌株 Bacteria strains |
引物对序列 Primer pairs sequences(5'→3') |
扩增片段长度/bp Fragment length |
| CVCC249(O1) | TTAGTAATTTCTGCGATTGG/TATAGCTTGCGTCAGTGGT | 261 |
| CVCC251(O2) | TGGGTGTTCCTGCTTGTTA/GCGTCCATACTCGCTGTTA | 665 |
| CVCC1553(O78) | CGGAAGATAATGAGTGGGT/GCAACATGGAGCTAATAAAA | 399 |
将禽致病性大肠杆菌CVCC249、CVCC251、CVCC1553分别按照1 : 100的比例转接至LB培养基中, 37 ℃、180 r · min-1培养4~6 h, 再根据细菌基因组DNA提取试剂盒说明书进行操作, 提取细菌基因组DNA作为模板, 储存于-20 ℃。
1.5 三重PCR反应及各条件优化设置三重PCR反应体系25 μL, 包括Taq酶(5 U · μL-1)0.4 μL, MgCl2(25 mmol · L-1)1.5 μL, dNTP Mixture(2.5 mmol · L-1)1.5 μL, 10×PCR Buffer(Mg2+ free)2.5 μL, APEC O1、O2和O78的DNA模板各1 μL, 引物(10 μmol · L-1)各0.5 μL, ddH2O补齐25 μL。PCR反应程序:94 ℃ 5 min; 94 ℃ 30 s, 53 ℃ 30 s, 72 ℃ 40 s, 35个循环; 72 ℃ 10 min。取PCR产物进行20 g ·L-1琼脂糖凝胶电泳。
1.5.1 退火温度、dNTP、MgCl2和Taq DNA酶量的优化将退火温度依次设置为47.0、47.3、48.1、49.4、51.1、52.7、54.3、55.9、57.6、58.9、59.7和60.0 ℃, 进行三重PCR反应, 根据结果筛选最佳退火温度; 将dNTP的加入量分别设置为0.5、1.0、1.3、1.5、2.0、2.5、3.0、3.5、4.0和4.5 μL, 进行三重PCR反应, 根据结果筛选dNTP的最适加入量; 将MgCl2的加入量分别设置为0.5、1.0、1.3、1.5、1.8、2.0、2.5、3.0、3.5和4.0 μL, 进行三重PCR反应, 根据结果筛选MgCl2的最适加入量; 将Taq酶的加入量分别设置为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9和1 μL, 进行三重PCR反应, 根据结果筛选Taq DNA酶的最适加入量。
1.5.2 引物加入量的优化为确定三重PCR体系中3对引物的加入量, 把3对引物作为3个因素, 采用正交设计L9(33)在0.5、1.0、1.5 μL 3个水平上进行试验。表 2中的加入量为单个引物的加入量。根据电泳检测结果, 确定3对引物的最佳加入量[14]。
| 编号Number | O1F/R | O2F/R | O78F/R |
| 1 | 0.5 | 0.5 | 0.5 |
| 2 | 0.5 | 1.0 | 1.0 |
| 3 | 0.5 | 1.5 | 1.5 |
| 4 | 1.0 | 0.5 | 1.0 |
| 5 | 1.0 | 1.0 | 1.5 |
| 6 | 1.0 | 1.5 | 0.5 |
| 7 | 1.5 | 0.5 | 1.5 |
| 8 | 1.5 | 1.0 | 1.5 |
| 9 | 1.5 | 1.5 | 1.0 |
为检测引物的特异性, 将三重PCR反应体系中的DNA模板以不同组合进行PCR, 包括3种血清型(O1+O2+O78)组合和2种血清型组合(O1+O2、O1+O78、O2+O78)。
另外, 选取本实验室保存的146株包含多种血清型的大肠杆菌菌株进行特异性检测, 以及用金黄色葡萄球菌98064、金黄色葡萄球菌ATCC25923、肠炎沙门氏菌1806、鼠伤寒沙门氏菌ATCC14028和枯草芽胞杆菌0802株进行特异性检测, 并用O1血清型大肠杆菌CVCC249、O2血清型大肠杆菌CVCC251、O78血清型大肠杆菌CVCC1553作为阳性对照。
1.7 三重PCR敏感性试验将提取的3种血清型菌株的DNA用紫外分光光度计进行浓度测定, 并调整浓度至100 ng · μL-1, 再进行以下浓度梯度稀释:5、1、0.5、0.2、0.1、0.05、0.02、0.01和0.001 ng · μL-1, 将上述不同浓度DNA分别作为模板进行PCR反应, 以超纯水作为阴性对照, 确定该三重PCR检测方法的敏感性。
1.8 临床模拟样品检测取18份新鲜鸡粪于18个1.5 mL EP管中, 取6份各添加1 mL O1血清型菌液(5×108CFU · mL-1), 取6份各添加1 mL O2血清型菌液(5×108 CFU · mL-1), 取6份各添加1 mL O78血清型菌液(5×108 CFU · mL-1), 制备出18份临床模拟样品。另外取1份新鲜鸡粪加入1 mL LB液体培养基, 作为阴性对照。将菌液和粪样混匀后2 000 r · min-1离心1 min, 将上层液体分别移入新1.5 mL EP管中, 5 000 r · min-1离心5 min, 弃上清液后, 加1 mL ddH2O重悬菌液沉淀, 再次离心并弃上清液, 如此洗菌3次。将沉淀重悬于200 μL ddH2O中, 于100 ℃煮沸10 min粗提DNA, 应用建立的禽致病性大肠杆菌O1、O2、O78三重PCR法对粗提的DNA样品进行检测。
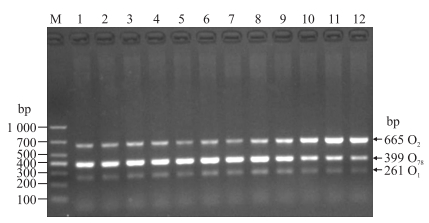
2 结果与分析 2.1 优化的反应参数 2.1.1 最佳退火温度将梯度PCR的扩增产物进行琼脂糖凝胶电泳, 结果显示, O1血清型在6~9泳道的温度时条带最亮, O2血清型在8~12泳道的温度时条带最亮, O78血清型在3~8泳道的温度时条带最亮(图 1)。故8泳道的温度为三重PCR电泳检测最佳结果, 即最佳退火温度为55.9 ℃。
|
图 1 退火温度的优化 Fig. 1 The optimization of annealing temperature M. Marker; 1-12. 47.0, 47.3, 48.1, 49.4, 51.1, 52.7, 54.3, 55.9, 57.6, 58.9, 59.7 and 60.0 ℃. |
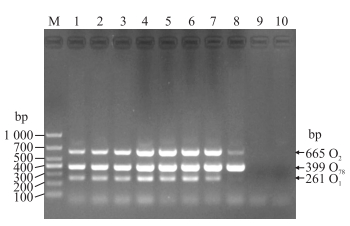
加入不同的dNTP量进行PCR扩增后, 电泳结果显示, 4泳道的电泳条带最亮(图 2), 即dNTP的最适加入量为1.5 μL。
|
图 2 dNTP最适加入量的优化 Fig. 2 The optimization of dNTP additive amount M. Marker; 1-10. 0.5, 1.0, 1.3, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0 and 4.5 μL. |
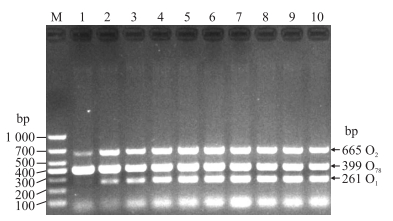
加入不同MgCl2量进行PCR扩增后, 电泳结果显示, 7泳道的电泳条带最亮(图 3), 即MgCl2的最适加入量为2.5 μL。
|
图 3 MgCl2最适加入量的优化 Fig. 3 The optimization of MgCl2 additive amount M. Marker; 1-10. 0.5, 1.0, 1.3, 1.5, 1.8, 2.0, 2.5, 3.0, 3.5 and 4.0 μL. |
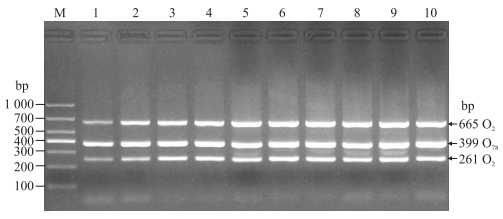
加入不同Taq DNA酶量进行PCR扩增后, 电泳结果显示, 6泳道的电泳条带最亮(图 4), 即Taq DNA酶的最适加入量为0.6 μL。
|
图 4 Taq DNA酶最适加入量的优化 Fig. 4 The optimization of Taq DNA polymerase additive amount M. Marker; 1-10. 0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9 and 1.0 μL. |
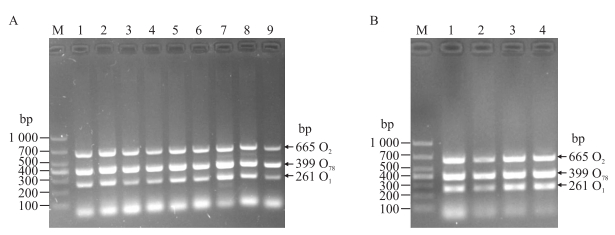
按照表 2的9个引物组合加入量进行PCR扩增后, 电泳结果显示, 7泳道(O1、O2、O78引物加入量分别为1.5、0.5、1.5 μL)的电泳条带最亮(图 5-A)。为减少引物二聚体的影响, 将3对引物的加入量等比例减少, O1、O2、O78的引物组合加入量(μL)分别为1.5、0.5、1.5, 1.2、0.4、1.2, 1.0、0.33、1.0和0.6、0.2、0.6。结果显示:4泳道条带最亮, 且引物二聚体最少(图 5-B), 即O1、O2、O78的最适加入量分别为0.6、0.2、0.6 μL。
|
图 5 引物最适加入量的优化 Fig. 5 The optimization of primers proportion A.引物加入量的正交优化结果Orthogonal optimization results of primers proportion:M. Marker; 1-9.同表 2 The same as Table 2 test number. B.引物等比例减少后的优化结果The optimization primers proportion proportionally reduced:M. Marker; 1-4. O1、O2、O78各引物组合加入量The addition amount of each primer(μL):1.5, 0.5, 1.5;1.2, 0.4, 1.2;1.0, 0.33, 1.0;0.6, 0.2, 0.6. |
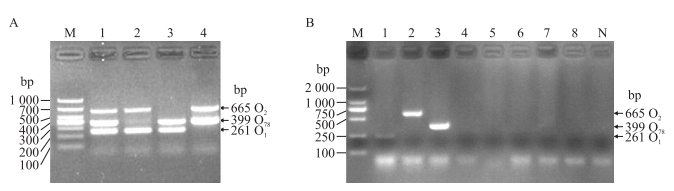
将DNA模板以不同组合方式进行三重PCR反应, 结果每个反应都能扩增出预期的目的片段, 且无非特异性扩增条带(图 6-A), 表明此3对引物在3种血清型之间无交叉反应。
|
图 6 三重PCR的特异性检测 Fig. 6 Specificity test of triple PCR A.大肠杆菌3种血清型之间的特异性检测:M. Marker; 1. O1+O2+O78; 2. O1+O2; 3. O1+O78; 4. O2+O78。B.非大肠杆菌菌株的特异性检测:M. Marker; 1. CVCC249;2. CVCC251;3. CVCC1553;4.金黄色葡萄球菌98064;5.金黄色葡萄球菌ATCC25923;6.肠炎沙门氏菌1806;7.鼠伤寒沙门氏菌ATCC14028;8.枯草芽孢杆菌0802;N.阴性对照。 A. Specific detection between three serotypes of APEC:M. Marker; 1. O1+O2+O78; 2. O1+O2; 3. O1+O78; 4. O2+O78. B. Specific detection of non-E.coli strains:M. Marker; 1. CVCC249;2. CVCC251;3. CVCC1553;4. Staphylococcus aureus 98064;5. Staphylococcus aureus ATCC25923;6. Salmonella enteritidis 1806;7.Salmonella typhimurium ATCC14028;8. Bacillus subtilis 0802;N. Negative control. |
用其他种属的细菌进行特异性试验, 结果(图 6-B)显示, 除阳性对照CVCC249、CVCC251、CVCC1553有相应的条带外, 金黄色葡萄球菌98064、金黄色葡萄球菌ATCC25923、肠炎沙门氏菌1806、鼠伤寒沙门氏菌ATCC14028和枯草芽胞杆菌0802株的检测结果都为阴性, 说明该三重PCR在不同细菌菌株之间无交叉反应, 特异性好。
特异性检测结果显示:在146株大肠杆菌中, 3株O1血清型菌株检测结果均为O1血清型阳性; 10株O2血清型菌株检测结果均为O2血清型阳性; 9株O78血清型菌株检测结果均为O78血清型阳性; 有1株O50血清型菌株检测结果为O2血清型阳性; 其余123株大肠杆菌菌株检测结果均为阴性, 准确率为99.32%(145/146)(图略)。
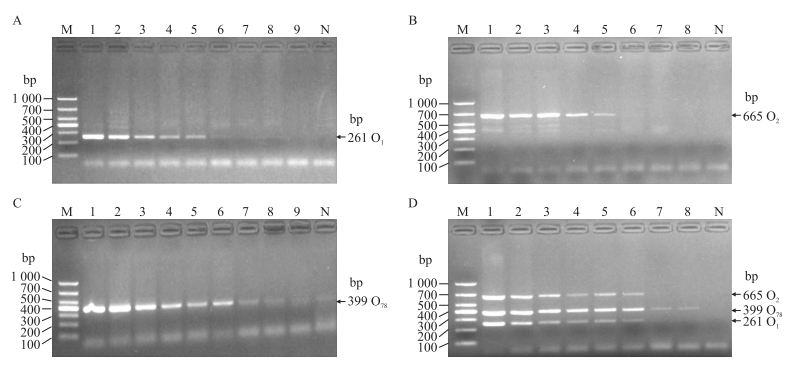
2.3 三重PCR敏感性检测敏感性结果显示:仅以O1血清型的DNA为模板时, 最低检测限为0.1 ng · μL-1(图 7-A); 仅以O2血清型的DNA为模板时, 最低检测限为0.1 ng · μL-1(图 7-B); 仅以O78血清型的DNA为模板时, 最低检测限为0.02 ng · μL-1(图 7-C); 当以O1、O2和O78混合DNA为模板时, 最低检测限为0.05 ng · μL-1(图 7-D)。
|
图 7 三重PCR的敏感性检测
Fig. 7 Sensitivity test of triple PCR
A—C.分别为以O1、O2、O78DNA为模板Taking O1, O2, O78 template respective; D.以O1+O2+O78混合DNA为模板Taking O1+O2+O78 mixed DNA as template. M. Marker; 1-9. 5、1、0.5、0.2、0.1、0.05、0.02、0.01 and 0.001 ng · μL-1of DNA; N.阴性对照Negative control. |
对18份临床模拟样品采用煮沸法粗提DNA, 其中O1、O2、O78血清型样品各6份, 应用建立的三重PCR法进行检测, 结果检测出6份O1血清型样品, 6份O2血清型样品, 5份O78血清型样品, 总检出率为94.4%(17/18)(表 3), 阴性对照未出现条带。
| 血清型Serotypes | 样品数Samples number | 阳性数Positive number | 检出率/% Positive rate | 总检出率/% Total positive rate |
| O1 | 6 | 6 | 100 | 94.4 |
| O2 | 6 | 6 | 100 | |
| O78 | 6 | 5 | 83.3 |
大肠杆菌O抗原血清型众多[15], 经典的血清型检测方法为血清凝集试验, 一次只能检测一种血清型, 费用高、操作繁琐、耗时长, 不能适应快速检测的需要; 并且特异性、敏感度均较低, 不同O血清群之间的交叉反应经常发生, 从而产生模棱两可的结果[16]。
其他方法如DNA微阵列、磁性微球悬浮列阵法和磁性微球免疫分析法等也已用于大肠杆菌的检测。DNA微阵列法已用于产肠毒素大肠杆菌O抗原血清型的分型。Wang等[17]使用DNA微阵列技术同时检测产肠毒素大肠杆菌菌株中19种最常见的O抗原血清型O6、O8、O11、O15、O25、O27、O78、O85、O114、O115、O126、O128、O139、O148、O149、O159、O166、O167和O173, 灵敏度为50 ng · μL-1。虽然该方法能一次性鉴定多种O抗原血清型, 适合大规模O抗原血清型鉴定, 但是灵敏度远低于本研究建立的三重PCR检测方法的灵敏度(0.05 ng · μL-1), 且需要特殊的仪器, 费用高。磁性微球悬浮列阵法和磁性微球免疫分析法都是使用Luminex技术, 是一种复合微球感应系统, 磁性微球悬浮列阵法已应用于产肠毒素性大肠杆菌O26、O45、O91、O103、O111、O113、O121、O128、O145和O157等10个血清型的鉴定[18]。磁性微球免疫分析法已应用于大肠杆菌O157血清型的鉴定[19]。此类方法虽然灵敏度高, 但是操作繁琐, 成本高, 不适合临床快速检测。
最近, PCR方法已被用作检测多种细菌菌株的快速分析技术[20-22]。Coimbra等[20]提出了一种rfb限制性片段长度多态性(rfb-RFLP)分析法来鉴定大肠杆菌血清型。此方法是控制大肠杆菌O抗原合成的基因在4.2~20 kb, 以gnd和galF基因为界, 称为rfb簇, 通过使用长程PCR扩增整个rfb基因簇, 然后用限制性内切酶对PCR产物进行酶切, 分析电泳条带大小, 进而确定血清型。但这种方法耗时长, 并且由于产生大量的频带, 难以解释[21]。所以Clermont等[21]将此方法进行改进, 用于基于rfb基因座的5'端部分的等位基因特异性PCR扩增, 用于测定与人败血症相关的大肠杆菌O1、O2、O4、O6、O7、O12、O15、O16、O18、O25、O75和O157共12种血清型, 但是不同血清型检测结果的特异性有差异, O12血清型的特异性检测结果最低, 为71%。
而多重PCR法是基于普通PCR法发展的, 能够同时检测多种目的基因, 提高检测效率。孙畅[23]用多重PCR法检测鸭禽致病性大肠杆菌的6个毒力基因, 灵敏度为0.1 ng · μL-1, 低于本试验建立的三重PCR方法的灵敏度, 且依靠毒力基因检测只能鉴别出是否为APEC, 不能精确到APEC血清型的鉴定。
本试验通过优化各反应条件, 建立了禽致病性大肠杆菌O1、O2和O78的三重PCR检测方法。在dNTP的优化试验中, 当dNTP浓度过高时, 反而出现了假阴性结果, 这可能是因为dNTP能够结合镁离子, 当dNTP浓度过高时, 反应体系中没有游离的镁离子, 而Taq DNA聚合酶发挥活性需要游离的镁离子, 故出现假阴性结果。
在特异性检测中, 对本实验室保存的146株大肠杆菌进行了检测, 除了1株O50血清型的大肠杆菌Q91检测结果为O2血清型假阳性结果外, 其他菌株的检测结果与本实验室的血清型凝集试验结果一致。出现这一假阳性结果的原因是O2和O50型的O抗原合成基因簇序列高度同源(>99%)[24-25], PCR方法无法鉴别。
在临床模拟样品检测中, 检出率为94.4%(17/18), 1份O78模拟样品的检测结果为阴性, 这可能是由于这份粪便样品含有足量的PCR抑制剂如复杂多糖、有机盐(如胆酸盐)等, 抑制了PCR反应, 故导致PCR出现假阴性结果。本试验所建立的三重PCR检测方法特异性好, O1、O2、O78 3种血清型之间无交叉反应; 用其他种属的细菌进行特异性检测也无条带产生, 表明该检测方法与其他种属细菌也无交叉反应; 灵敏度高, O1和O2血清型的检测限皆为0.1 ng · μL-1, O78血清型的检测限为0.02 ng · μL-1, 当同时检测O1、O2和O78血清型时最低能检测到0.05 ng · μL-1。该三重PCR检测方法快速、特异、敏感, 是禽致病性大肠杆菌流行菌株血清分型的有效便捷方法, 弥补了传统血清学测定的不足。因此, 该方法的建立有益于临床诊断与流行病学研究。
| [1] |
Wang S H, Niu C L, Shi Z Y, et al. Effects of ibeA deletion on virulence and biofilm formation of avian pathogenic Escherichia coli[J]. Infection and Immunity, 2011, 79(1): 279-287. DOI:10.1128/IAI.00821-10 |
| [2] |
Gibbs P S, Maurer J J, Nolan L K, et al. Prediction of chicken embryo lethality with the avian Escherichia coli traits complement resistance, colicin V production, and presence of the increased serum survival gene cluster(iss)[J]. Avian Diseases, 2003, 47: 370-379. DOI:10.1637/0005-2086(2003)047[0370:POCELW]2.0.CO;2 |
| [3] |
Guabiraba R, Schouler C. Avian colibacillosis:still many black holes[J]. FEMS Microbiology Letters, 2018, 362(15): fnv118. |
| [4] |
Zhuang Q Y, Wang S C, Li J P, et al. A clinical survey of common avian infectious diseases in China[J]. Avian Diseases, 2014, 58(2): 297-302. DOI:10.1637/10709-110113-ResNote.1 |
| [5] |
Melha M. Human and avian extraintestinal pathogenic Escherichia coli:infections, zoonotic risks, and antibiotic resistance trends[J]. Foodborne Pathogens Disease, 2013, 10(11): 916-932. DOI:10.1089/fpd.2013.1533 |
| [6] |
Ewers C, Janßen T, Kießling S, et al. Molecular epidemiology of avian pathogenic Escherichia coli(APEC) isolated from colisepticemia in poultry[J]. Veterinary Microbiology, 2004, 104(1): 91-101. |
| [7] |
Tivendale K A, Logue C M, Kariyawasam S, et al. Avian-pathogenic Escherichia coli strains are similar to neonatal meningitis E.coli strains and are able to cause meningitis in the rat model of human disease[J]. Infection and Immunity, 2010, 78: 3412-3419. DOI:10.1128/IAI.00347-10 |
| [8] |
Zhuge X K, Jiang J W, Pan Z H, et al. Comparative genomic analysis shows that avian pathogenic Escherichia coli isolate IMT5155(O2:K1:H5, ST Complex 95, ST140) shares close relationship with ST95 APEC O1:K1 and human ExPEC O18:K1 strains[J]. PLoS One, 2014, 9(11): e112048. DOI:10.1371/journal.pone.0112048 |
| [9] |
Wang S H, Dai J J, Meng Q M, et al. DotU expression is highly induced during in vivo infection and responsible for virulence and Hcp1 secretion in avian pathogenic Escherichia coli[J]. Frontiers in Microbiology, 2014, 5: 588. |
| [10] |
Ewers C, Li G, Wilking H, et al. Avian pathogenic, uropathogenic, and newborn meningitis-causing Escherichia coli:how closely related are they?[J]. International Journal of Medical Microbiology, 2007, 297(3): 163-176. DOI:10.1016/j.ijmm.2007.01.003 |
| [11] |
Mora A, Viso S, López C, et al. Poultry as reservoir for extraintestinal pathogenic Escherichia coli O45:K1:H7-B2-ST95 in humans[J]. Veterinary Microbiology, 2013, 167(3-4): 506-512. DOI:10.1016/j.vetmic.2013.08.007 |
| [12] |
Solà-Ginés M, Cameron-Veas K, Badiola I, et al. Diversity of multi-drug resistant avian pathogenic Escherichia coli(APEC) causing outbreaks of colibacillosis in broilers during 2012 in Spain[J]. PLoS One, 2015, 10(11): e0143191. DOI:10.1371/journal.pone.0143191 |
| [13] |
Ebrahimi-Nik H, Bassami M R, Mohri M, et al. Bacterial ghost of avian pathogenic E.coli(APEC) serotype O78:K80 as a homologous vaccine against avian colibacillosis[J]. PLoS One, 2018, 13(3): e0194888. DOI:10.1371/journal.pone.0194888 |
| [14] |
王如景, 王羽, 李英军, 等. 双正交优化多重PCR检测食源性致病菌的研究[J]. 食品科技, 2012, 37(8): 308-313. Wang R J, Wang Y, Li Y J, et al. Double orthogonal design to optimize multiplex PCR reaction system for detection of food-borne bacterial pathogens[J]. Food Science and Technology, 2012, 37(8): 308-313 (in Chinese with English abstract). |
| [15] |
DebRoy C, Fratamico P M, Yan X, et al. Comparison of O-antigen gene clusters of all O-serogroups of Escherichia coli and proposal for adopting a new nomenclature for O-typing[J]. PLoS One, 2016, 11(1): e0147434. DOI:10.1371/journal.pone.0147434 |
| [16] |
刘璨颖, 张济培, 王丙云. 大肠杆菌O-抗原血清型鉴定研究进展[J]. 中国人畜共患病学报, 2016, 32(10): 928-932. Liu C Y, Zhang J P, Wang B Y. Research progress on identification of Eschrichia coli O-antigen serogroups[J]. Chinese Journal of Zoonoses, 2016, 32(10): 928-932 (in Chinese with English abstract). |
| [17] |
Wang Q, Wang S, Beutin L, et al. Development of a DNA microarray for detection and serotyping of enterotoxigenic Escherichia coli[J]. Journal of Clinical Microbiology, 2010, 48(6): 2066-2074. DOI:10.1128/JCM.02014-09 |
| [18] |
Lin A, Nguyen L, Lee T, et al. Rapid O serogroup identification of the ten most clinically relevant STECs by Luminex microbead-based suspension array[J]. Journal of Microbiological Methods, 2011, 87(1): 105-110. DOI:10.1016/j.mimet.2011.07.019 |
| [19] |
Clotilde L M, Bernard C, Hartman G L, et al. Microbead-based immunoassay for simultaneous detection of Shiga toxins and isolation of Escherichia coli O157 in foods[J]. Journal of Food Protection, 2011, 74(3): 373-379. DOI:10.4315/0362-028X.JFP-10-344 |
| [20] |
Coimbra R S, Grimont F, Lenormand P, et al. Identification of Escherichia coli O-serogroups by restriction of the amplified O-antigen gene cluster(rfb-RFLP)[J]. Research in Microbiology, 2000, 151(8): 639-654. DOI:10.1016/S0923-2508(00)00134-0 |
| [21] |
Clermont O, Johnson J R, Menard M, et al. Determination of Escherichia coli O types by allele-specific polymerase chain reaction:application to the O types involved in human septicemia[J]. Diagnostic Microbiology and Infectious Disease, 2007, 57(2): 129-136. DOI:10.1016/j.diagmicrobio.2006.08.007 |
| [22] |
龙梦瑶, 蒋蔚, 陈永军, 等. 采用IMS-RT-PCR方法快速检测肉制品中大肠杆菌O157[J]. 畜牧与兽医, 2018, 50(3): 68-76. Long M Y, Jiang W, Chen Y J, et al. Rapid detection of Escherichia coli O157 in meat products by immunomagnetic beads and real-time PCR[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(3): 68-76 (in Chinese with English abstract). |
| [23] |
孙畅.鸭禽致病性大肠杆菌分离鉴定及多重PCR检测方法的建立[D].牡丹江: 牡丹江师范学院, 2017. Sun C. Isolation and identification of duck avian pathogenic Escherichia coli and establishment of multiplex PCR detection method[D]. Mudanjiang: Mudanjiang Normal University, 2017(in Chinese with English abstract). |
| [24] |
Iguchi A, Iyoda S, Kikuchi T, et al. A complete view of the genetic diversity of the Escherichia coli O-antigen biosynthesis gene cluster[J]. DNA Research, 2015, 22(1): 101-107. DOI:10.1093/dnares/dsu043 |
| [25] |
Delannoy S, Beutin L, Mariani-Kurkdjian P, et al. The Escherichia coli serogroup O1 and O2 lipopolysaccharides are encoded by multiple O-antigen gene clusters[J]. Frontiers in Cellular and Infection Microbiology, 2017, 7: 30. |




