文章信息
- 郜普源, 孟晓慧, 李托, 朱瀚, 黄启为, 刘东阳, 沈其荣
- GAO Puyuan, MENG Xiaohui, LI Tuo, ZHU Han, HUANG Qiwei, LIU Dongyang, SHEN Qirong
- 基于响应曲面法优化贵州木霉NJAU4742产胞外木聚糖酶的研究
- Study on conditions for xylanase production by Trichoderma guizhouense NJAU4742 through response surface methodology
- 南京农业大学学报, 2020, 43(1): 98-107
- Journal of Nanjing Agricultural University, 2020, 43(1): 98-107.
- http://dx.doi.org/10.7685/jnau.201904016
-
文章历史
- 收稿日期: 2019-04-10
农作物秸秆是由纤维素、半纤维素以及木质素通过生物化学过程而形成的具有高度稳定性的天然多聚物, 其中纤维素和半纤维素含量最丰富, 其分解过程比较复杂[1]。纤维素的分解主要通过纤维素内切酶(EG)、纤维素外切酶(CBHⅠ和CBH Ⅱ)以及β-葡萄糖苷酶相互作用而实现[2]。其中EG主要负责纤维素β-1, 4-糖苷键的水解, CBHⅠ和CBH Ⅱ分别负责纤维素的还原端和非还原端分解, 而β-葡萄糖苷酶能将纤维二糖及其他低分子纤维糊精分解为葡萄糖[3]。木聚糖是半纤维素的主要成分, 其主链是由木糖残基通过β-1, 4-糖苷键聚合而成的链状骨架, 并被不同的残基(阿拉伯糖残基、乙酰残基、葡萄糖醛酸残基、阿魏酸残基和p-香豆酸残基)修饰后形成大量的侧链分支[4-5]。木聚糖结构比较复杂, 需要多种酶系进行协同降解。内切木聚糖酶(XYN)主要负责木聚糖主链上的β-1, 4-糖苷键的水解生成木二糖, 并在木糖苷酶(β-XYL)作用下形成木糖[6]; 木聚糖侧链的水解主要通过乙酰木聚糖酯酶(AXE)、阿魏酸酯酶(FE)、α-阿拉伯呋喃糖酶(α-AF)、α-葡萄糖醛酸酶(α-GLU)等完成[7]。青霉、曲霉、木霉等丝状真菌能够分泌纤维素酶与半纤维素酶[8], 有效降解秸秆需要这些酶的共同参与, 而其分泌调控机制在不同培养条件下也存在显著的差异性。
贵州木霉NJAU4742是1株高效的生物有机肥功能菌, 但其生物有机肥的制备不能直接进行二次固体发酵(不耐高温), 只能以直接添加高密度木霉孢子的调配方式来实现。木霉固体菌种生产过程中存在很多技术瓶颈, 其中秸秆分解速率尤为关键, 直接影响菌丝生长及产孢。在预试验中, 我们比较分析了贵州木霉NJAU4742的内切葡聚糖酶、外切葡聚糖酶、β-葡萄糖苷酶和木聚糖酶酶活性, 发现菌株产木聚糖酶的能力显著高于其他纤维素酶, 所以选择对菌株产木聚糖酶的条件进行优化, 优化后对于提高菌株的降解能力更加有效。因此, 本试验以水稻秸秆为材料, 利用响应曲面法优化生物肥功能菌株贵州木霉NJAU4742产胞外木聚糖酶的参数, 旨在提高该功能菌对木质纤维素的分解能力, 为综合利用农业固体废弃物和开发优质的生物有机肥提供理论依据。
1 材料与方法 1.1 材料 1.1.1 样品采集本试验所用的水稻秸秆取自江苏省淮安市柴米河农业科技发展有限公司, 将新鲜采集的水稻秸秆用自来水清洗干净并风干后, 用医用剪刀将其剪成长度为2~3 cm的片段; 部分样品用球磨仪进行研磨, 并于干燥阴凉处保存备用。
1.1.2 菌株及发酵培养基菌株为本实验室分离筛选获得的植物有益菌贵州木霉NJAU4742, 该菌株的基因组信息已经注释完成并对外公布(http://bioinfo.njau.edu.cn/tgn4742/index.php)。为防止菌种退化, 将其接种于固体培养基上7 d后产孢子, 并用无菌水制备孢子悬液, 孢子悬浮于15%(体积分数)甘油水溶液后, 于-70 ℃保存。
Mandels盐溶液[9]:1.4 g · L-1(NH4)2SO4, 2.0 g · L-1KH2PO4, 0.3 g · L-1 CaCl2, 0.3 g · L-1MgSO4, 0.3 g · L-1尿素, 0.25 g · L-1酵母膏, 0.75 g · L-1蛋白胨, 5 mg · L-1 FeSO4 · 7H2O, 20 mg · L-1CoCl2, 1.6 mg · L-1 MnSO4和1.4 mg · L-1 ZnSO4。
PDA固体培养基:葡萄糖20 g, 马铃薯200 g, 琼脂20 g, 自来水1 L。
1.2 方法 1.2.1 接种与培养将保存于-70 ℃冰箱的原始菌株的孢子, 接种到含有50 mL固体PDA培养基的三角瓶中, 在28 ℃避光培养条件下培养7 d, 加入15 mL经高温灭菌的生理盐水, 120 r · min-1振荡培养30 min, 用2层无菌纱布过滤除去固形物(菌丝及孢子囊), 滤液即为菌株的孢子悬液。孢子悬液用血球计数板计数, 按照标准方法计算孢子悬液中的孢子浓度。
称取2 g干燥水稻秸秆样品于500 mL三角瓶中, 加入100 mL不同处理的盐溶液, 待培养基充分混匀后121 ℃高温灭菌30 min后备用。根据孢子悬液浓度, 按照不同处理接种相应的孢子; 接种完成后, 将三角瓶置于28 ℃、180 r · min-1条件下振荡培养。培养5 d后对不同处理取样, 并测定相关指标。
1.2.2 粗酶液制备及胞外蛋白含量测定培养完成以后, 取出培养物并用2层纱布过滤除去大颗粒的固形物和菌丝。将过滤后的上清液转移到50 mL离心管中, 12 000 r · min-1、4 ℃离心10 min, 所得上清液即为粗酶液。
BCA工作液的配制:根据标准品和样品数量, 试剂A与试剂B的体积比为50 : 1配制苹果绿的BCA工作溶液。
样品的测定分析:取经适当稀释的酶液10 μL加入到96孔板的样品孔位里, 每个样品测定4~5个平行, 向样品中加入200 μL BCA工作液(样品与工作液的体积比为1:20)并混匀, 37 ℃水浴反应30 min后冷却至室温, 在酶标仪(Spectra max M5, Molecular Devices)562 nm波长下测定吸光值。
标准曲线的绘制:分别将0、1、2、4、8、12、16和20 μL蛋白标准样品(1 mg · mL-1)加到96孔板的样品孔中, 加稀释液补足。然后各孔中加入200 μL配制好的BCA工作液, 在37 ℃水浴反应30 min后冷却至室温, 在酶标仪562 nm波长下测定吸光值, 根据测定值绘制标准曲线, 计算样品中的蛋白质含量。
1.2.3 粗酶液中木聚糖酶活性的测定根据Bailey等[10]的木聚糖酶测定方法:取稀释50倍后的粗酶液0.2 mL加入到1 mL 10 mg · mL-1的木聚糖中, 再加0.8 mL醋酸缓冲液, 同时以灭活的粗酶液(沸水浴20 min)为空白对照, 40 ℃水浴条件下反应30 min。取出后加入0.5 mL 0.3 mol · L-1 HCl终止反应, 用0.1 mL 2.5 mol · L-1的K2CO3中和, 再加入2 mL DNS沸水浴8 min后定容至25 mL。最后用酶标仪在520 nm处测定吸光值。根据标准曲线计算还原糖含量。在上述条件下每分钟分解木聚糖得到1 μmol还原糖所需的酶量定义为1个酶活性单位。
1.2.4 粗酶液的蛋白质电泳分析根据样品的蛋白浓度加入样品溶解液, 使混合液蛋白浓度为0.5~1.0 mg · mL-1。溶解后将其转移到带塞的小离心管中, 轻轻盖上盖子, 在100 ℃沸水浴中加热3 min, 取出冷却后加样。取25 μL上述混合液, 小心通过缓冲液将样品加到凝胶凹形样品槽底部。
菌株NJAU4742分泌的总蛋白凝胶电泳分析参照Laemmli等[11]的方法。PAGE胶制备好后, 将样品上到胶孔并开始电泳, 初始电流为10 mA, 待样品进入分离胶后, 将电流调至20~30 mA, 当溴酚蓝染料距硅胶框1 cm时, 停止电泳, 关闭电源。取下PAGE胶并标记, 然后加入染色液染色1~2 h, 再用脱色液脱色, 直至蛋白质条带清晰。
1.3 试验设计 1.3.1 液体发酵产酶的单因子试验以稻草秸秆为唯一碳源, 采用单因子试验法[12], 分别优化尿素含量(0.20、0.25、0.30、0.35和0.40 g · L-1)、硫酸铵含量(1.2、1.3、1.4、1.5和1.6 g · L-1)、氯化钙含量(0.2、0.3、0.4、0.5和0.6 g · L-1)、磷酸二氢钾含量(1.0、1.5、2.0、2.5和3.0 g · L-1)、初始pH值(2.0、3.0、4.0、5.0、6.0和7.0)、温度(23、26、28、30、35和40 ℃)、时间(4、5、6、7和8 d)以及接种量(1.0×105、1.0×106和1.0×107 CFU · mL-1), 并以木聚糖酶活性作为筛选指标。
1.3.2 液体发酵产酶主要影响因子的确定根据固体发酵特点以及单因子试验结果, 选择如下因子:尿素(X1)、硫酸铵(X2)、氯化钙(X3)、磷酸二氢钾(X4)、初始pH值(X5)、温度(X6)、时间(X7)以及接种量(X8)作为液体发酵产酶的重要因素。同时, 用Plackett-Burman试验来确定关键因素[13], 每个因素分别取2个水平, 按照因素的特点和单因素试验中的高水平和低水平值, 最终确定影响贵州木霉NJAU4742产木聚糖酶的主要因素(表 1)。
| 因子代号 Factor symbol |
因子 Factors |
水平Level | |
| -1 | +1 | ||
| X1 | 尿素含量/(g·L-1) Urea content | 0.2 | 0.4 |
| X2 | 硫酸铵含量/(g·L-1) (NH4)2SO4 content | 1.2 | 1.6 |
| X3 | 氯化钙含量/(g·L-1) CaCl2 content | 0.2 | 0.6 |
| X4 | 磷酸二氢钾含量/(g·L-1) KH2PO4 content | 1 | 3 |
| X5 | 初始pH值Initial pH value | 2.0 | 4.0 |
| X6 | θ/℃ | 26 | 30 |
| X7 | t/d | 6 | 8 |
| X8 | 接种量/(CFU·mL-1) Inoculation size | 105 | 107 |
基于Plackett-Burman试验结果, 确定影响菌株产胞外木聚糖酶的主要因素。再通过最陡爬坡试验, 确定不同重要因素水平对响应值的影响, 获得最终的取值区间。利用Design-Expert 10.0软件[14], 基于以上的结果进行Box-Behnken试验设计和数据分析[15], 并将尿素、氯化钙、磷酸二氢钾和初始pH值重新分配为A、B、C和D 4个不同试验组别。
2 结果与分析 2.1 影响菌株产胞外木聚糖酶的单因子试验通过单因子试验, 研究不同培养基成分对菌株贵州木霉产胞外木聚糖酶的影响(图 1)。尿素可以为菌株在分解秸秆过程中提供氮源, 尿素的添加量影响贵州木霉NJAU4742分泌胞外木聚糖酶, 0.25 g · L-1的添加量有利于菌株产胞外木聚糖酶。磷酸二氢钾和硫酸铵对贵州木霉NJAU4742分泌胞外木聚糖酶的影响不显著。氯化钙添加量对贵州木霉NJAU4742产胞外木聚糖酶影响较大, 在添加量为0.40 g · L-1时, 胞外木聚糖酶产量达到最大, 为15.69 U · mL-1。
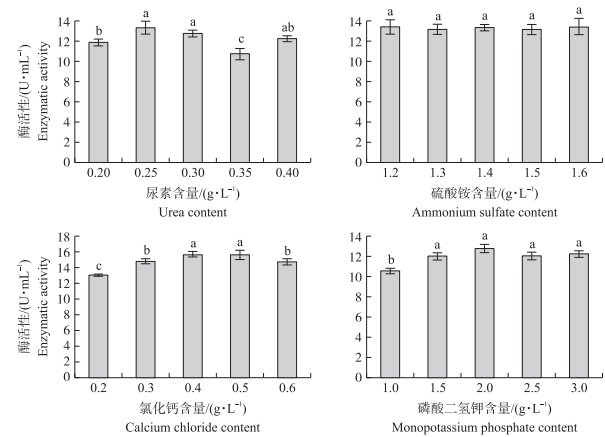
|
图 1 不同培养基成分对菌株产木聚糖酶的影响 Fig. 1 Effect of different componants in the medium on the production of xylanase |
采用单因子试验, 研究了不同培养条件对菌株产胞外木聚糖酶的影响(图 2), 结果表明:pH对菌株产胞外木聚糖酶的影响比较大, 在初始pH值3.0时木聚糖酶活性最大(13.51 U · mL-1); 温度为23~28 ℃时木聚糖酶活性逐渐增加, 28 ℃时达到最大值(11.78 U · mL-1), 随后木聚糖酶活性快速下降; 酶活性随培养时间的增加逐渐增加, 培养8 d时达到最大(12.11 U · mL-1); 接种孢子悬液(1.0×105CFU · mL-1)时, 菌株产胞外木聚糖酶的活性达到15.87 U · mL-1。
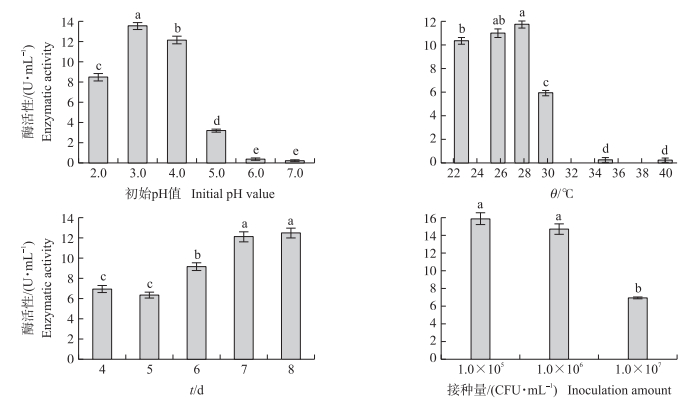
|
图 2 不同培养条件对菌株产木聚糖酶的影响 Fig. 2 Effect of different cultural conditions on the production of xylanase |
利用Minitab 15.0软件设计Plackett-Burman试验, 根据每个因子的不同水平, 总共设计12组不同水平的试验, 验证不同因子对贵州木霉产胞外木聚糖酶的影响, 试验的响应值为木聚糖酶活性(表 2)。根据不同组合进行试验, 获得对应试验号的胞外木聚糖酶活性, 其中酶活性较高的试验组为第1组、第10组和第11组, 其酶活性分别为14.31、14.35和14.07 U · mL-1, 并且3个处理没有显著差异。
| 运行编号 Run order |
因子代号Factor symbol | 木聚糖酶活性/(U·mL-1) Xylanase activity | |||||||||
| X1 | X2 | X3 | X4 | X5 | X6 | X7 | X8 | 测定值Measured value | 预测值Predicted value | ||
| 1 | -1 | 1 | -1 | -1 | 1 | -1 | 1 | 1 | 14.31a | 13.85ab | |
| 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 6.39f | 6.90d | |
| 3 | 1 | 1 | -1 | -1 | 1 | 1 | -1 | -1 | 6.66f | 6.66d | |
| 4 | 1 | -1 | -1 | -1 | -1 | -1 | 1 | 1 | 3.21g | 4.14e | |
| 5 | -1 | 1 | -1 | 1 | -1 | 1 | 1 | 1 | 11.99c | 12.45b | |
| 6 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | 13.73ab | 14.23ab | |
| 7 | -1 | 1 | 1 | -1 | -1 | 1 | -1 | 1 | 10.65d | 9.42c | |
| 8 | 1 | 1 | -1 | 1 | -1 | -1 | -1 | 1 | 6.72f | 6.52d | |
| 9 | -1 | -1 | 1 | 1 | -1 | -1 | 1 | -1 | 9.67e | 9.21c | |
| 10 | -1 | -1 | 1 | -1 | 1 | 1 | 1 | -1 | 14.35a | 14.61a | |
| 11 | -1 | 1 | 1 | 1 | 1 | -1 | -1 | -1 | 14.07a | 14.99a | |
| 12 | 1 | -1 | -1 | 1 | 1 | -1 | 1 | -1 | 12.94b | 11.71bc | |
利用Minitab 15.0软件, 预测不同因子对菌株产胞外木聚糖酶影响的线性模型(Y=66.4-42.1 X1-20.9 X2-23.2 X3+25.3 X4+24.5 X5+15.0 X6-15.9 X7+13.5 X8)。模型的预测结果(表 2)表明, 第10组和第11组试验中的预测结果最高, 2个处理没有显著差异, 线性模型预测结果与测定分析的结果一致。利用Minitab 15.0软件对上述12组试验数据进行方差分析。结果(表 3)表明:预测的线性模型具有显著性(P < 0.05), 而尿素对产酶影响具有极显著的效应(P < 0.01), 氯化钙、磷酸二氢钾和初始pH值对产酶的影响也显著。根据Plackett-Burman试验结果以及显著性方差分析结果得出, 在8个因素中, 尿素添加量对菌株产木聚糖酶的影响最大, 其次是氯化钙、磷酸二氢钾和初始pH值。因此, 选择这4个因子进行进一步优化。
| 因子代号 Factor symbol |
自由度 DF |
均方差 MSE |
F值 F-value |
P值 P-value |
| X1 | 1 | 108.04 | 53.92 | 0.005** |
| X2 | 1 | 17.74 | 8.85 | 0.059 |
| X3 | 1 | 24.06 | 12.01 | 0.040* |
| X4 | 1 | 21.63 | 10.80 | 0.046* |
| X5 | 1 | 39.18 | 19.55 | 0.021* |
| X6 | 1 | 5.37 | 2.68 | 0.200 |
| X7 | 1 | 16.19 | 8.08 | 0.066 |
| X8 | 1 | 10.37 | 5.17 | 0.107 |
| 模型Model | 8 | 19.28 | 9.62 | 0.045* |
| 残差Residual | 3 | 2.00 | ||
| 总和Total | 11 | |||
| Note:*P < 0.05;* *P < 0.01;R2=0.962 5, R2(adj)=0.862 5. | ||||
利用Design-Expert 10.0软件设计Box-Behnken试验。以4个因子为核心因子, 总共设计了29组试验, 其中有3个重复的中心点, 测定这些试验条件下的胞外木聚糖酶活性。由表 4可见, 第15号试验组的胞外木聚糖酶活性最大(20.68 U · mL-1)。根据试验结果, 预测不同因子对酶活性影响的模型。根据模型, 预测不同试验组合中的木聚糖酶活性, 预测结果表明, 14~16号试验组合中的木聚糖酶活性较大, 为20.30 U · mL-1, 与该试验组合测定的结果基本一致。将试验设计的测定结果与上述模型拟合出的结果进行线性回归分析。回归方程:酶活性=14.079 00+0.613 25A+0.128 17B+1.388 08C-0.038 000D+0.492 00AB+0.352 00AC-0.636 75AD-0.223 00BC-0.283 00BD-0.072 750CD-0.701 29A2-0.175 67B2-1.004 54C2-1.011 17D2。结果表明, 不同处理的预测结果与测定结果虽然有一点偏差, 但是都比较接近, 说明该预测模型比较准确。
| 运行排序 Run order |
标准排序 Stand order |
因子Factor | 木聚糖酶活性/(U·mL-1) Xylanase activity | |||||
| A | B | C | D | 测定结果Measurement results | 预测结果Forecast results | |||
| 1 | 7 | -1 | 0 | -1 | 0 | 16.42 | 16.25 | |
| 2 | 29 | -1 | 0 | 0 | -1 | 17.37 | 17.32 | |
| 3 | 28 | -1 | -1 | 0 | 0 | 17.87 | 18.16 | |
| 4 | 6 | -1 | 0 | 0 | 0 | 18.83 | 18.94 | |
| 5 | 19 | -1 | 1 | 0 | 0 | 17.86 | 17.53 | |
| 6 | 11 | -1 | 0 | 0 | 1 | 17.75 | 18.06 | |
| 7 | 16 | -1 | 0 | 1 | 0 | 17.57 | 17.40 | |
| 8 | 17 | 0 | 0 | -1 | -1 | 15.23 | 15.97 | |
| 9 | 21 | 0 | -1 | -1 | 0 | 17.86 | 17.11 | |
| 10 | 14 | 0 | 1 | -1 | 0 | 16.27 | 16.05 | |
| 11 | 10 | 0 | 0 | -1 | 1 | 16.43 | 16.88 | |
| 12 | 18 | 0 | -1 | 0 | -1 | 18.15 | 17.97 | |
| 13 | 3 | 0 | 1 | 0 | -1 | 17.26 | 17.18 | |
| 14 | 13 | 0 | 0 | 0 | 0 | 19.87 | 20.30 | |
| 15 | 4 | 0 | 0 | 0 | 0 | 20.68 | 20.30 | |
| 16 | 22 | 0 | 0 | 0 | 0 | 20.09 | 20.30 | |
| 17 | 8 | 0 | -1 | 0 | 1 | 19.22 | 18.96 | |
| 18 | 5 | 0 | 1 | 0 | 1 | 17.88 | 17.72 | |
| 19 | 27 | 0 | 0 | 1 | -1 | 17.75 | 17.14 | |
| 20 | 2 | 0 | -1 | 1 | 0 | 17.50 | 18.09 | |
| 21 | 12 | 0 | 1 | 1 | 0 | 16.02 | 17.13 | |
| 22 | 1 | 0 | 0 | 1 | 1 | 18.66 | 17.77 | |
| 23 | 26 | 1 | 0 | -1 | 0 | 15.15 | 15.10 | |
| 24 | 9 | 1 | 0 | 0 | -1 | 15.84 | 16.02 | |
| 25 | 24 | 1 | -1 | 0 | 0 | 16.97 | 17.27 | |
| 26 | 20 | 1 | 0 | 0 | 0 | 18.29 | 17.66 | |
| 27 | 25 | 1 | 1 | 0 | 0 | 16.19 | 15.87 | |
| 28 | 23 | 1 | 0 | 0 | 1 | 16.27 | 16.81 | |
| 29 | 15 | 1 | 0 | 1 | 0 | 16.03 | 16.00 | |
| 注:A:尿素Urea; B:CaCl2; C:KH2PO4; D:pH值pH value. | ||||||||
利用Design-Expert 10.0软件对Box-Behnken试验结果进行显著性方差分析, 结果(表 5)表明:该预测模型具有极显著水平(P < 0.01), 能够对菌株产木聚糖酶进行准确预测。另外, 因子A、A2、B2、C2和D2对菌株产木聚糖酶具有极显著影响, 而因子B、C对菌株产木聚糖酶具有显著影响。统计结果中失拟项没有显著性(P=0.309), 说明数据中没有异常点, 不需要引入更高次数的项。进一步说明该模型比较准确, 可以对贵州木霉产胞外木聚糖酶进行回归拟合与预测。
| 类别 Source |
预测系数 Expected coefficient |
总平方和 Sum of squares |
自由度 DF |
均方差 MSE |
F值 F-value |
P值 P-value |
| 模型Model | 20.30 | 49.54 | 14 | 3.54 | 8.43 | < 0.01** |
| A | -0.64 | 5.70 | 1 | 5.70 | 13.56 | < 0.01** |
| B | -0.51 | 3.09 | 1 | 3.09 | 7.36 | 0.02* |
| C | 0.51 | 3.17 | 1 | 3.17 | 7.55 | 0.02* |
| D | 0.38 | 1.77 | 1 | 1.77 | 4.22 | 0.06 |
| AB | -0.19 | 0.15 | 1 | 0.15 | 0.35 | 0.56 |
| AC | -0.07 | 0.02 | 1 | 0.02 | 0.04 | 0.84 |
| AD | 0.01 | 0.00 | 1 | 0.00 | 0.00 | 0.97 |
| BC | 0.03 | 0.00 | 1 | 0.00 | 0.01 | 0.93 |
| BD | -0.11 | 0.05 | 1 | 0.05 | 0.12 | 0.73 |
| CD | -0.07 | 0.02 | 1 | 0.02 | 0.05 | 0.83 |
| A2 | -2.00 | 21.36 | 1 | 21.36 | 50.87 | <0.01** |
| B2 | -1.09 | 6.95 | 1 | 6.95 | 16.55 | < 0.01** |
| C2 | -2.11 | 25.99 | 1 | 25.99 | 61.89 | < 0.01** |
| D2 | -1.25 | 9.06 | 1 | 9.06 | 21.58 | < 0.01** |
| 残差Residual | 5.88 | 14 | 0.42 | |||
| 失拟项Lake of fit | 5.53 | 12 | 0.46 | 2.63 | 0.309 | |
| 纯误差Pure error | 0.35 | 2 | 0.18 | |||
| 总离差Cor total | 55.42 | 28 | ||||
| Note:*P<0.05;* *P<0.01;R2=0.893 9, R2(adj)=0.787 8. | ||||||
利用Design-Expert 10.0软件分析二次回归模型的可信度, 结果表明二次回归方程的复相关系数为0.893 9, 而模型的校正相关系数(Adj R-squared)为0.787 8, 进一步说明该模型具有一定的可信度。根据设计的不同试验组, 利用Design-Expert 10.0软件分析获得了回归模型各因子效应图(图 3)。4个因子对于响应值R都有一定的影响, 其中A、B, A、C和A、D对R的关系都是非线性的, 因为表面图发生了显著的弯曲, 形成了典型的二次曲面。B、C, B、D和C、D对R的关系也是非线性的关系, 两者直接的效应曲面都和响应值R存在二次项, 而且从图中可以看出A、B、C和D各因子均存在极点, 说明该体系能进一步优化与分析。根据表 4和表 5分析结果, 响应曲面回归方程为:R=20.30-0.64A-0.51B+0.51C+0.38D-0.19AB-0.067AC+0.013AD+0.027BC-0.11BD-0.073CD-2.00A2-1.09B2-2.11C2-1.25D2。

|
图 3 不同因子对贵州木霉NJAU4742产胞外木聚糖酶的影响 Fig. 3 Effect of various parameters on the production of xylanase from T. guizhounense NJAU4742 |
根据图 3的三维响应曲面图及等高线图, 可以获得回归模型中存在的稳定点(最大值)。对上述的二次回归方程分别求一阶偏导并赋值为0后, 可以获得4个方程:
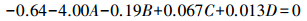
|
(1) |

|
(2) |

|
(3) |
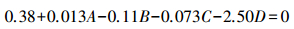
|
(4) |
通过解上述四元一次方程组, 获得上述模型的极值点为:A=-0.150, B=-0.226, C=0.119, D=0.160。经编码代换得到, 各因子最佳的最终添加量真实值为尿素(A)0.29 g · L-1, CaCl2(B)0.35 g · L-1, KH2PO4(C)2.12 g · L-1, 初始pH值(D)3.16。模型预测产量最大值为20.46 U · mL-1。利用响应曲面法优化获得的极值点结合单因子试验, 在该条件下实际测定贵州木霉NJAU4742胞外木聚糖酶活性为19.86 U · mL-1, 与模型预测的产酶最大值比较接近。因此, 本研究中的模型能够准确预测贵州木霉NJAU4742的胞外木聚糖酶活性。
2.6 贵州木霉NJAU4742优化前、后胞外蛋白的比较分析通过对培养基和培养条件的优化, 获得了贵州木霉NJAU4742产胞外木聚糖酶的最佳条件。在该条件下, 菌株胞外蛋白含量比原始培养条件培养提高1.50倍, 木聚糖酶活性提高1.25倍(等体积发酵液)。利用SDS-PAGE方法分析胞外蛋白的条带差异(图 4), 部分区域条带的蓝色深度显著增加, 尤其是Ⅰ[蛋白相对分子质量为(70~100)×103]和Ⅱ(蛋白相对分子质量为40×103)区域的蛋白, 说明经过培养基和培养条件的优化, 可以显著增加一些特定蛋白的分泌量。

|
图 4 优化前、后贵州木霉NJAU4742胞外蛋白的电泳分析 Fig. 4 Electrophoretic analysis of extracellular protein from T. guizhounense NJAU4742 before and after optimization M为标准蛋白。M is the standard protein. 1~3为优化前样品。1-3 indioate samples before optimization. 4~6为优化后样品。4-6 indicate samples after optimization. |
化肥、农药等化学品的过量施用, 导致土壤养分生物转化能力变弱, 作物产量对化肥养分的依赖性变强, 经济作物土传病害愈发严重, 影响了我国农业的可持续发展[16]。近年来, 贵州木霉因其显著的植物促生及土传病害防控效果, 越来越广泛地应用于农业生产上[17]。贵州木霉定殖于植物根部后能与植物形成共生体, 显著促进根际养分的转化并通过分泌次级代谢产物和植物生长调节剂来促进植物生长[18]。有效施用贵州木霉及其生物有机肥, 是减少我国农用化学品投入的重要途径之一。木霉生物有机肥的制备不像芽胞杆菌生物有机肥那样直接进行二次固体发酵, 只能以直接添加高密度木霉孢子的调配方式来实现。木霉固体菌种生产过程存在很多技术瓶颈, 其中秸秆分解速率尤为关键, 将直接影响菌株的菌丝生长及产孢。因此, 对于突破木霉生物有机肥的生产瓶颈, 提高其木质纤维素酶活性尤为重要。
植物木质纤维素是地球上最丰富、最廉价的可再生资源, 可以转化为能被人类使用的资源, 因此受到科学家越来越多的重视[19]。获取高效的纤维素和半纤维素酶已经成为微生物领域研究的热点, 特别是在生物燃料和生物有机肥领域[20]。半纤维素是秸秆中除纤维素外含量最多的成分, 广泛存在于玉米芯、甘蔗渣、米糠、秸秆及麸皮等农副产品中。由于其结构的特殊性, 半纤维素成为木质纤维素水解的天然屏障, 限制了木质纤维素与纤维素酶的接触面积, 从而降低了酶解作用。而木聚糖则是自然界中最丰富的半纤维素。木聚糖的基本单位是D-吡喃木糖, 它的主链是由木糖通过β-1, 4-糖苷键连接形成, 侧链是O-乙酰基、α-L-阿拉伯呋喃糖基、α-1, 2-葡萄糖醛酸或4-O-甲基葡萄糖醛酸。这些成分通过化学键互相交联, 形成复杂的结构[21]。狭义的木聚糖酶是指水解木聚糖主链的内切木聚糖酶, 但完全水解木聚糖需要内切-1, 4-β-木聚糖酶、β-木糖苷酶等多种酶的协同作用[22]。因此, 通过优化培养基成分以及培养条件提高功能菌分泌木聚糖酶非常有必要。本研究采用响应曲面法优化贵州木霉NJAU4742产木聚糖酶, 优化后胞外蛋白产量提高了1.5倍, 而木聚糖酶产量提高了1.25倍, 所以该方法对于优化菌株产酶是有效的。
优化丝状真菌产木聚糖酶也有相关研究, 陈瑶瑶等[23]采用单因子试验优化了黄曲霉产β-1, 4-木聚糖酶发酵的条件, 确定其产酶的最佳条件为:麸皮3.5%、磷酸氢二铵3.0%、吐温-60 1.0%、NaCl 0.5%、MgSO4 · 7H2O 0.05%和KH2PO4 0.075%。权淑静等[24]研究表明固体发酵条件下桔绿木霉产木聚糖酶的最适合的培养条件为:培养温度30 ℃、初始pH值6.0、培养时间72 h、接种量1.0×107 CFU · mL-1孢子悬液, 木聚糖酶活性可达391.5 U · g-1。本研究也是从培养基成分和培养条件出发, 通过响应曲面模型来优化菌株产木聚糖酶条件, 确定贵州木霉NJAU4742产胞外木聚糖酶的最佳条件为尿素添加量0.29 g · L-1、氯化钙添加量0.35 g · L-1、磷酸二氢钾添加量2.12 g · L-1、初始pH值3.16、培养温度28 ℃、培养时间7 d、孢子接种量1.0×105CFU · mL-1, 优化后胞外木聚糖酶活性达到19.86 U · mL-1。通过与其他菌株的优化条件及方法相比, 可以看出每个试验的培养基组分、培养条件差异比较大。这说明不同的菌株在产酶的过程中, 对于培养基、培养条件的需求不同, 所以最终选择的试验方法以及最终得到的结果差异也比较大。
| [1] |
Adebayo E, Martinez-Carrera D. Oyster mushrooms(Pleurotus) are useful for utilizing lignocellulosic biomass[J]. African Journal of Biotechnology, 2015, 14(1): 52-67. |
| [2] |
Sandgren M. Structural and functional studies of glycoside hydrolase family 12 enzymes from Trichoderma reesei and other cellulolytic microorga-nisms[D]. Ussuriysk: Acta Universitatis Upsaliensis, 2003.
|
| [3] |
Bergadi F, Laachari F, Sadiki M, et al. Determination of endoglucanase activity of paper decaying fungi from an old library at the ancient medina of Fez[J]. Microbiology, 2016, 85(1): 47-55. |
| [4] |
Kroukamp H, Haan R, Grange D C, et al. Strain breeding enhanced heterologous cellobiohydrolase secretion by Saccharomyces cerevisiae in a protein specific manner[J]. Biotechnology Journal, 2017, 12(10): 1700346. |
| [5] |
Li X, Xiao Y, Feng Y, et al. The spatial proximity effect of beta-glucosidase and cellulosomes on cellulose degradation[J]. Enzyme and Microbial Technology, 2018, 115: 52-61. |
| [6] |
Behnam S, Karimi K, Khanahmadi M, et al. Optimization of xylanase production by Mucor indicus, Mucor hiemalis, and Rhizopus oryzae through solid state fermentation[J]. Biological Journal of Microorganism, 2016, 4(16): 1-10. |
| [7] |
Long L, Tian D, Zhai R, et al. Thermostable xylanase-aided two-stage hydrolysis approach enhances sugar release of pretreated lignocellulosic biomass[J]. Bioresource Technology, 2018, 257: 334-338. |
| [8] |
Saha S, Kauffmann B, Ferrand Y, et al. Selective encapsulation of disaccharide xylobiose by an aromatic foldamer helical capsule[J]. Angewandte Chemie International Edition, 2018, 57(41): 13542-13546. |
| [9] |
Mandels M, Weber J. Enhanced cellulase production by a mutant of Trichoderma viride[J]. Applied Microbiology, 1971, 21(1): 152. |
| [10] |
Bailey M J, Biely P, Poutanen K. Interlaboratory testing of methods for assay of xylanase activity[J]. Journal of Biotechnology, 1992, 23: 257-270. |
| [11] |
Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685. |
| [12] |
Bakhtiari M R, Faezi M G, Fallahpour M, et al. Medium optimization by orthogonal array designs for urease production by Aspergillus niger PTCC5011[J]. Process Biochemistry, 2006, 41: 547-551. |
| [13] |
Dayana P S, Bakthavatsalam A K. Optimization of phenol degradation by the microalga Chlorella pyrenoidosa using Plackett-Burman design and response surface methodology[J]. Bioresource Technology, 2016, 207: 150-156. |
| [14] |
Visser J C, Dohmen W C, Hinrichs W L J. Quality by design approach for optimizing the formulation and physical properties of extemporaneously prepared orodispersible films[J]. International Journal of Pharmaceutics, 2015, 485: 70-76. |
| [15] |
Tak B, Tak B, Kim Y, et al. Optimization of color and COD removal from livestock wastewater by electrocoagulation process:application of Box-Behnken design(BBD)[J]. Journal of Industrial and Engineering Chemistry, 2015, 28: 307-315. |
| [16] |
Sun J, Zou L, Li W, et al. Rhizosphere soil properties and banana Fusarium wilt suppression influenced by combined chemical and organic fertilizations[J]. Agriculture, Ecosystems & Environment, 2018, 254: 60-68. |
| [17] |
Druzhinina I S, Chenthamara K, Zhang J, et al. Massive lateral transfer of genes encoding plant cell wall-degrading enzymes to the mycoparasitic fungus Trichoderma from its plant-associated hosts[J]. PLoS Genetics, 2018, 14(4): e1007322. |
| [18] |
Chun J, Yang H E, Kim D H. Identification of a novel partitivirus of Trichoderma harzianum NFCF319 and evidence for the related antifungal activity[J]. Frontiers in Plant Science, 2018, 9: 1699. |
| [19] |
Fraceto L F, Maruyama C R, Guilger M, et al. Trichoderma harzianum-based novel formulations:potential applications for management of Next-Gen agricultural challenges[J]. Journal of Chemical Technology & Biotechnology, 2018, 93: 2056-2063. |
| [20] |
Weselowski B, Nathoo N, Eastman A W, et al. Isolation, identification and characterization of Paenibacillus polymyxa CR1 with potentials for biopesticide, biofertilization, biomass degradation and biofuel production[J]. BMC Microbiology, 2016, 16(1): 244. |
| [21] |
Yu J, Paterson N, Blamey J. Cellulose, xylan and lignin interactions during pyrolysis of lignocellulosic biomass[J]. Fuel, 2017, 191: 140-149. |
| [22] |
Milessi T S, Kopp W, Rojas M J, et al. Immobilization and stabilization of an endoxylanase from Bacillus subtilis(XynA) for xylooligosaccharides(XOs) production[J]. Catalysis Today, 2016, 259: 130-139. |
| [23] |
陈瑶瑶, 陈洲, 刘璐, 等. 黄曲霉产β-1, 4-木聚糖酶发酵条件的优化及其酶学特性研究[J]. 食品工业科技, 2019, 40(7): 131-137. Chen Y Y, Chen Z, Liu L, et al. Optimization of fermentation conditions for β-1, 4-xylanase production by Aspergillus flavus and its enzymatic properties[J]. Science and Technology of Food Industry, 2019, 40(7): 131-137 (in Chinese with English abstract). |
| [24] |
权淑静, 张永战, 徐文涛, 等. 桔绿木霉产木聚糖酶固体发酵条件研究[J]. 河南科学, 2018, 36(2): 165-169. Quan S J, Zhang Y Z, Xu W T, et al. Culture condition for production of xylanase by Trichoderma citrinoviride under solid state fermentation[J]. Henan Science, 2018, 36(2): 165-169 (in Chinese with English abstract). |




