文章信息
- 马丽君, 黄金, 胡天翼, 黄小娜, 张克云
- MA Lijun, HUANG Jin, HU Tianyi, HUANG Xiaona, ZHANG Keyun
- 崇明拟异小杆线虫gsa-1基因的功能鉴定
- Functional identification of gsa-1 in Heterorhabditidoides chongmingensis
- 南京农业大学学报, 2020, 43(1): 89-97
- Journal of Nanjing Agricultural University, 2020, 43(1): 89-97.
- http://dx.doi.org/10.7685/jnau.201903023
-
文章历史
- 收稿日期: 2019-03-14
昆虫病原线虫(entomopathogenic nematode, EPN)是一种新型高效绿色无污染的生物防治因子[1]。EPN的生活方式具有高度特异性, 与其携带的共生菌互利共生。EPN的侵染期线虫(infected juvenile, IJ)可以附着在宿主昆虫的角质层上, 穿透各种自然孔进入昆虫的血淋巴中释放自身携带的共生菌[2]。共生菌在血淋巴中快速繁殖从而迅速杀死宿主[3-5]。EPN主要包括Heterorhabditis、Steinernematidae和Heterorhabditidoides属线虫, 在全球范围内分布极广, 生活在除南极洲以外的所有大陆。由于EPN具有惊人的物种多样性及生物地理学特征, 其基本适用于所有的气候和场所。迄今为止, EPN已被成功应用于世界各地以控制多种昆虫害虫[6], 其中S. scapterisci对蝼蛄有明显的控制效果, 现已被广泛应用于高尔夫球场、牧场及其他受蝼蛄侵害的禾本科植被[7]。目前, 在全球范围内EPN因被称为化学杀虫剂的环境安全替代品而备受关注。
许多寄生性线虫使用化感系统如化学感受和湿度感受等主动寻找宿主, 其中嗅觉是寻找宿主的关键因素[8-11]。许多寄生性线虫通过宿主产生的CO2和其他挥发性物质来寻找辨别宿主。已有研究表明EPN已经进化出专门的嗅觉系统, 有助于线虫选择宿主昆虫[6]。此外, 植物受到节肢动物啃咬攻击时叶子常常会释放出某些挥发性化合物, 这些化合物会吸引昆虫病原线虫[12]。有报道指出, 当线虫长时间暴露于某种挥发性物质中时, 会在一段时间内不再对该物质产生嗅觉趋化性反应, 该现象称为嗅觉适应性。线虫生活的环境复杂, 其中一些气味对线虫有天然的吸引作用但并不能为其提供营养。因此, 线虫必须通过适应某些吸引性气味来区分环境中的刺激, 以便于线虫寻找食物[13-14]。因此研究EPN的嗅觉趋化性和嗅觉适应性可以更好地帮助线虫缩短搜寻宿主的时间, 增强生物防治的效率。
崇明拟异小杆线虫(Heterorhabditidoides chongmingensis)DZ0503CMFT(DZ)是一种与嗜线虫沙雷氏菌(Serratia nematodephila)DZ0503SBS1T(S1)特异性共生的EPN[15-16]。本实验室前期研究发现DZ线虫与其自身共生菌S1及其非自身共生菌S.nematodiphila DR186(186)分别进行培养时, 线虫的体长、产卵量、雌虫比例、带菌率等均有明显差异[17]。本研究进一步发现其嗅觉趋化性和适应性也有显著差异, 但相关的调控机制尚不清楚。参与嗅觉调控的细胞内组分主要包括嗅觉受体、G蛋白和阳离子通道, 其中G蛋白由Gα、Gβ和Gγ 3个亚基组成[18-19]。Jansen等[20]研究表明部分Gα亚基对嗅觉有调控作用。本文选取化感神经元中广泛表达的G蛋白Gα亚基的基因gsa- 1, 研究其生物学功能, 进一步明确该基因对DZ线虫的嗅觉趋化性及适应性的影响。
1 材料与方法 1.1 试验材料 1.1.1 试验样品DZ线虫是南京农业大学生命科学学院动物生物学系发现鉴定并保存的小杆科EPN新属新种H. chongmingensis的模式品系DZ0503CMFT(DZ)。嗜线虫沙雷氏菌(S. nematodephila)DZ0503SBS1T(S1)是DZ线虫的共生菌模式菌株[15-16]。线虫由本实验室采用5龄大蜡螟(Galleria mellonella)老熟幼虫进行传代培养。S. nematodephila DR186(186)是本实验室从昆虫病原线虫如皋拟异小杆线虫H. rugaoensis中分离得到的共生菌[21]。DZ线虫与菌株S1及186分别组合构建的单菌线虫DZ/S1和DZ/186的数字基因表达谱(DGE)和表达谱文库(DEGs)由本实验室前期通过高通量测序技术完成[22]。HT115(DE3)菌株购自美国线虫遗传中心(Caenorhabditis Genetis Center, CGC), L4440质粒购自中国质粒载体菌株细胞株基因保藏中心-质粒科学实验室(Biovector Science Lab)。
1.1.2 试验试剂RNAiso Plus、Prime STAR Max DNA Polymerase、MiniBEST Agarose Gel DNA Extraction Kit、限制酶KpnⅠ、限制酶PstⅠ、MiniBEST Plasmid Purification Kit等购自TaKaRa大连公司; HiFiScript cDNA Synthesis Kit、UltraSYBR Mixture(Low ROX)等购自康维世纪生物公司。
1.2 基因克隆及氨基酸序列分析根据本实验室前期构建的DZ/S1和DZ/186的DGE文库[22], 选取化感神经元中广泛表达的G蛋白Gα亚基的基因gsa- 1作为研究对象。取DZ侵染期线虫约500条用RNAiso Plus提取其总RNA, 然后用HiFiScript cDNA合成试剂盒将其反转录为cDNA, 将其作为模板扩增gsa- 1全序列。运用Primer Premier 5.0设计gsa- 1全序列引物。F:5'-AAGAGCACAATCGTCAAG-3';R:5'-CAGACAACAACTTTATTT-3'。PCR反应体系(20 μL):模板cDNA 1 μL, 上、下游引物(10 μmol · L-1)各1 μL, 2×Prime STAR Max DNA Polymerase 10 μL, RNase-Free Water 7 μL。PCR程序:94 ℃ 5 min; 94 ℃ 10 s, 50 ℃ 15 s, 72 ℃ 2 min, 35个循环; 72 ℃ 10 min。扩增片段长1 587 bp。将PCR产物送华大基因测序。在NCBI数据库中对DZ线虫GSA-1氨基酸序列进行分析, 选用进化关系最近的前22个同源蛋白序列, 利用MEGA 6.0进行序列比对, 并采用邻近法(neighbor-Joining method, NJ)(1 000次抽样分析)构建其系统进化树。
1.3 gsa- 1 RNAi载体构建参照文献[23-25]的方法, 根据NCBI数据库对gsa- 1结构域的预测及保守区的分析, 选取同源性较好的片段进行干扰。设计含限制酶KpnⅠ及PstⅠ酶切位点(下划线标识)的干扰引物。gsa- 1 RNAi F:5'- GCTGCAGC GGTAGACACGGAGAAC-3';gsa- 1 RNAi R:5'-GGGTACCC GAGAGCGACTAAAAGC-3'。PCR反应体系20 μL:模板cDNA 1 μL, 上、下游引物(10 μmol · L-1)各1 μL, 2×Premix TaqTM 10 μL, RNase-Free Water 7 μL。PCR程序:94 ℃ 5 min; 94 ℃ 30 s, 45 ℃ 30 s, 72 ℃ 45 s, 35个循环; 72 ℃ 10 min。扩增片段长414 bp。将PCR产物与pMD19 T-Vector(Simple)连接并转化DH5α感受态细胞, 将阳性克隆载体转化子扩增并进行质粒提取, 经双酶切后连接到载体L4440质粒上, 再转化大肠杆菌HT115(DE3)进行扩增。
1.4 单菌侵染期线虫的制备 1.4.1 无菌线虫的制备参考Sicard等[25]的方法并稍改进。挑取活体大蜡螟培养的DZ怀卵雌虫, 用灭菌自来水清洗3遍后加入1 g · L-1硫柳汞于暗处浸泡30 min进行体表消毒, 收集线虫并用灭菌自来水清洗3次后加入0.4 mol · L-1NaOH中(加入2.5%次氯酸钠至最终浓度为0.2 mol · L-1), 涡旋振荡约15 min, 直至呈细沙状。8 000 r · min-1离心2 min, 弃去上清液, 用灭菌自来水清洗虫卵2~3次。最后用灭菌自来水将无菌卵稀释至合适浓度, 小心滴加在肝琼脂固体平板上, 用封口膜封口, 正置放于25 ℃线虫培养箱培养24 h, 线虫卵孵化即可得到同期无菌L1期线虫。
1.4.2 怀特陷阱的制备参照White[26]的方法并改进。取1个直径为3.5 cm的塑料平皿盖, 正置于直径为9 cm的塑料平皿中。在直径为3.5 cm的平皿盖上平铺1层直径为7 cm的滤纸, 将收集的待分离线虫滴加在滤纸中央。在直径为9 cm的塑料平皿中加入11 mL的灭菌自来水, 将滤纸四周向下折叠浸泡在水中, 便于IJ因趋水性慢慢爬入水中。将此装置放于25 ℃线虫培养箱1~2 d, 即可在水中收集到纯净侵染期线虫。
1.4.3 单菌侵染期线虫的分离取保藏菌种划线接种于LB平板上, 28 ℃培养24~48 h。取单个菌落, 接种于LB液体培养基中, 28 ℃、180 r · min-1过夜培养。取培养好的菌液涂布于LA平板上, 于28 ℃培养24~48 h后, 接入无菌L1期线虫, 并将其正置放于25 ℃线虫培养箱培养约1周, 待LA平板中营养匮乏, 即可观察到IJ的出现。将板内的线虫富集, 并用灭菌自来水清洗2~3次, 然后将其放置于怀特陷阱中24 h, 即可在水中收集到纯净的单菌IJ。
1.4.4 gsa- 1 RNAi侵染期线虫的制备参照文献[23-24]的方法并改进。运用饲喂法对DZ线虫进行RNAi。取用NGM液体培养基过夜培养的HT115(DE3)-L4440-gsa- 1质粒菌液在终浓度为0.4 mmol · L-1IPTG诱导条件下处理8 h, 然后用其培养DZ无菌L1期线虫从而获得试验组侵染期线虫, 即gsa- 1 RNAi组。在同一时间将等量的HT115(DE3)-L4440质粒菌用同样的诱导条件进行处理, 用其培养DZ无菌L1期线虫从而获得对照组侵染期线虫, 即为L4440对照组。
1.5 DZ/S1及DZ/186线虫中gsa- 1基因的表达分析分别收集DZ/S1及DZ/186单菌侵染期线虫200条, 用RNAiso Plus提取总RNA, 用HiFiScript cDNA合成试剂盒将其反转录为cDNA并检测其质量。运用Primer Premier 5.0设计gsa- 1荧光定量引物。gsa- 1 F:5'-ATAGGTTACGGGAGTCTCTGGC-3';gsa- 1 R:5'-CTTCCTTGTCTTCGCTTTGGTC-3'。使用Applied Biosystems(ABI)Prism 7300序列检测系统进行荧光定量PCR分析。PCR反应体系20 μL:模板cDNA 1 μL, 上、下游引物(10 μmol · L-1)各1 μL, 2×UltraSYBR Mixture(Low ROX)10 μL, RNase-Free Water 7 μL。PCR程序:95 ℃ 10 min; 95 ℃ 15 s, 60 ℃ 1 min, 35个循环。以DZ线虫18S rRNA为内参基因。设计引物18S F:5'-CATCCAAGGAAGGCAGCAGG-3';18S R:5'-CCGCAGCAATGACGATTTACAC-3'。采用2-ΔΔCT相对定量法计算gsa- 1的相对表达量[27]。相对表达量=2-ΔΔCT; ΔΔCT=ΔCT(试验组)-ΔCT(对照组)。3次生物学重复。
1.6 RNAi后DZ线虫中gsa- 1基因的表达分析分别收集gsa- 1 RNAi组及L4440对照组侵染期线虫200条, 用1.5节所述方法提取其总RNA, 再反转录为cDNA并检测其质量。运用荧光定量PCR检测其相对表达量。3次生物学重复。
1.7 DZ线虫对3种挥发性化学物质的趋化性检测嗅觉趋化性测定参考文献[6, 28]的方法。将水杨酸甲酯、二庚酮及苯甲醛分别用无水乙醇以不同的稀释倍数(1 : 10、1 : 100、1 : 1 000)进行稀释, 检测其对DZ侵染期线虫的吸引能力。用直径为9 cm的塑料平皿, 制备薄层琼脂平板, 在室温条件下放置3~4 d后使用。在平板的背面两端用标记笔在距离边缘0.5 cm处做2个"*"标记, 并以该点为圆心3 cm半径画圆。在两端"*"位置分别滴加用无水乙醇稀释的挥发性化合物及无水乙醇对照各10 μL。待样品与对照液体渗入培养基后, 将含有150条前期用活体大蜡螟培养好的DZ侵染期线虫的悬液10 μL滴加在平板中央。将平板盖子小心盖好, 贴好封口膜, 避光放置于25 ℃线虫培养箱。注意所放位置水平, 避免重力作用引起试验误差。1 h后, 统计进入两侧圈内的线虫数目, 计算趋化性指数。趋化性指数=(nA-nC)/N。式中:nA为样品物质圈内的线虫数目; nC为对照物质圈内的线虫数目; N为加入的侵染期线虫总数。每组9次重复, 3次生物学重复。
1.8 DZ/S1及DZ/186线虫的趋化性检测按照1.7节方法对DZ/S1及DZ/186两组单菌侵染期线虫进行嗅觉趋化性检测。此外, 在塑料平皿盖上小心在"*"标记上方钻出2个小孔, 其上分别放置1个底部钻有小孔的1.5 mL灭菌EP管, 并用封口膜将接口处连接紧密。在灭菌EP管中放入2条新鲜活体大蜡螟幼虫, 以此来测定线虫对大蜡螟的趋化性[28]。每组9次重复, 3次生物学重复。
1.9 DZ/S1及DZ/186线虫嗅觉适应性检测嗅觉适应性测定参考Heather等[13]的方法并改进。将DZ/S1、DZ/186、gsa- 1 RNAi及L4440对照组4组单菌侵染期线虫用S.basal缓冲液清洗2~3次, 然后用去离子水清洗1次。将线虫放入加有5 mL训练液(100 mL S.basal缓冲液中加入7.5 μL苯甲醛)的6 cm平皿中, 封口并于25 ℃避光放置80 min。对照组于平皿中放置5 mL S.basal缓冲液。收集线虫, 用S.basal缓冲液清洗2~3次, 用1.7节方法检测其嗅觉趋化性。
1.10 gsa- 1 RNAi对DZ线虫嗅觉的影响按照1.7—1.9节中所述方法, 将含有150条前期培养好的gsa- 1 RNAi组及L4440对照组(未沉默组)侵染期线虫分别进行嗅觉趋化性及适应性检测。每组9次重复, 3次生物学重复。
1.11 gsa- 1 RNAi对DZ线虫体长、存活率、发育历期及雌虫比例的影响参照Pietsch等[29]的方法并改进。取前期制备好的gsa- 1 RNAi组及L4440对照组侵染期幼虫, 置于24孔板中, 每孔1条。每孔加入诱导完毕的菌液100 μL, 置于25 ℃条件下培养。每隔24 h取出6条线虫观察统计线虫的体长。统计线虫的死亡率(对线虫的头部进行机械刺激, 若线虫无反应则判定该线虫死亡)。参照Huang等[30]的方法观察线虫进入各生长发育时期的时间并稍作改进。
阶段Ⅰ繁殖期:侵染期线虫恢复发育至产卵结束。阶段Ⅱ快速摆尾期:从线虫产卵结束至每10 s摆尾次数小于10次。阶段Ⅲ咽部快速泵送期:从线虫每10 s摆尾次数小于10次至每10 s咽部抽吸次数小于10次。阶段Ⅳ咽部泵送停止至生命结束:从线虫每10 s咽部抽吸次数小于10次至线虫死亡。同时, 观察并计算线虫的雌虫比例。每隔48 h更换1次培养液, 以避免细菌生长产生的次级代谢产物对线虫生长产生毒副作用。每组24条, 3次生物学重复。
1.12 数据统计与分析试验数据使用Graphpad prism 5进行分析并绘图。体长的数据为 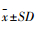
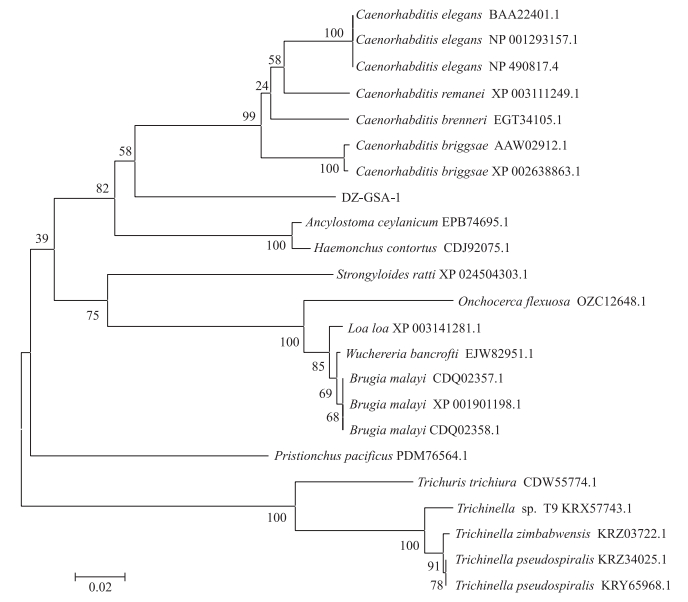
DZ线虫中gsa- 1的cDNA长度为1 587 bp, 成功扩增出且测序正确。由ORF Finder功能预测其蛋白的完整ORF序列, 共编码320个氨基酸残基。蛋白保守区为鸟嘌呤核苷酸结合的G蛋白α亚基, 含有异源三聚体G蛋白的鸟嘌呤核苷酸结合位点, 其在各种跨膜信号系统中起调节剂或转导物的作用, 传递许多激素、神经递质、趋化因子、自分泌和旁分泌因子的信号。根据NCBI中氨基酸序列BLAST的结果:DZ线虫GSA-1与其他线虫的GSA-1氨基酸序列有高度的保守性。其中, DZ线虫GSA-1与Caenorhabditis brenneri的GSA-1(GenBank登录号:EGT34105.1)相似性较高, 氨基酸序列一致性为86.24%;与秀丽隐杆线虫(C. elegans)的GSA-1(GenBank登录号:NP_490817.4)的氨基酸序列一致性为86.85%;与C. remanei的GSA-1(GenBank登录号:XP_003111249.1)的氨基酸序列一致性为87.46%。利用MAGA 6.0构建基于DZ线虫GSA-1氨基酸序列的系统发育树(图 1), 表明DZ线虫GSA-1与C.elegans和C.briggsae的G蛋白Gα亚基GSA-1互为姐妹群, 同源性较高。
|
图 1 DZ线虫GSA-1氨基酸序列的系统进化树 Fig. 1 The phylogenetic tree based on amino acid sequences of GSA-1 proteins from DZ and related nematodes |
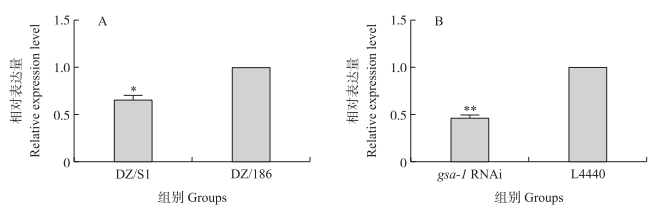
收集DZ/S1及DZ/186组单菌侵染期线虫, 以18S rRNA作为内参基因进行荧光定量PCR。结果显示:DZ/S1组线虫的gsa- 1基因表达水平显著低于DZ/186组, 下调了34.30%(图 2-A)。收集RNAi组及L4440对照组侵染期线虫, 以18S rRNA作为内参基因进行荧光定量PCR。结果显示:gsa- 1 RNAi组线虫的gsa- 1基因表达水平极显著低于L4440对照组(P < 0.01), 抑制率为54.19%(图 2-B)。
|
图 2 DZ线虫中gsa- 1的相对表达量 Fig. 2 Relative expression level of gsa- 1 in DZ nematodes DZ/S1:DZ/S1组单菌侵染期线虫; DZ/186:DZ/186组单菌侵染期线虫; L4440:对照组; gsa-1 RNAi:gsa-1 RNAi组。*P<0.05;* *P < 0.01。下同。 DZ/S1:Infected juveniles of DZ/S1;DZ/186:Infected juveniles of DZ/186;L4440:Control group; gsa-1 RNAi:gsa-1 RNAi group. *P<0.05;* *P < 0.01. The same as follows. |
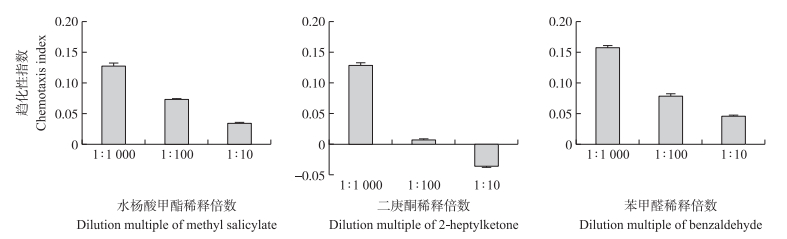
从图 3可知:DZ线虫对1 : 1 000稀释的苯甲醛的趋化性指数最高, 为0.16, 说明1 : 1 000稀释的苯甲醛对DZ侵染期线虫的吸引能力最强, 故选用其进行后续试验。
|
图 3 DZ线虫对不同浓度的3种挥发性物质的趋化性 Fig. 3 Chemotaxis of DZ nematodes to three volatile substances with different concentrations |
从图 4-A可知:DZ/S1组线虫对苯甲醛的趋化性较DZ/186组明显升高(P < 0.001)。其趋化性指数是对照组的2.99倍。同样, 将两组线虫分别对活体大蜡螟幼虫进行趋化性测试。从图 4-B可知:DZ/S1组线虫对大蜡螟的趋化性显著升高(P < 0.05), 其趋化性指数是DZ/186组的8.62倍。这说明DZ/S1组侵染期线虫对苯甲醛及活体大蜡螟幼虫的趋化性显著高于DZ/186组。
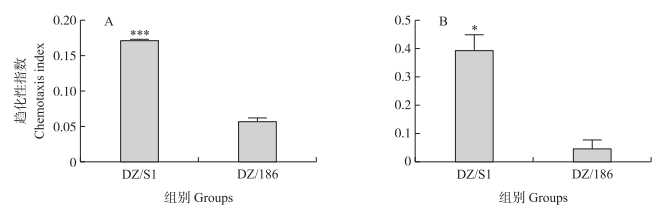
|
图 4 DZ/S1及DZ/186线虫的趋化性 Fig. 4 Chemotaxis of DZ/S1 and DZ/186 nematodes A. DZ/S1及DZ/186单菌侵染期线虫对1 : 1 000稀释的苯甲醛的趋化性; B. DZ/S1及DZ/186单菌侵染期线虫对活体大蜡螟幼虫的趋化性。* * *P < 0.001。下同。 A. Chemotaxis of DZ/S1 and DZ/186 infected juveniles to 1 : 1 000 diluted benzaldehyde; B. Chemotaxis of DZ/S1 and DZ/186 infected juveniles to alive Galleria mellonella larvae. * * *P < 0.001. The same as follows. |
从图 5可知:经过训练处理的DZ/S1组线虫对1 : 1 000稀释的苯甲醛有轻微的回避反应, 其趋化性指数为-0.03, 而处理后的DZ/186组线虫对苯甲醛趋化性降低, 但仍有趋化反应, 其趋化性指数为0.02。两组线虫的趋化性指数有极显著差异(P < 0.001)。说明DZ/S1组侵染期线虫对苯甲醛的嗅觉适应性更强, 更有助于线虫寻找辨别有利刺激。gsa- 1 RNAi组及L4440对照组的侵染期线虫对苯甲醛趋化性均降低, 趋化性指数分别为0.01和0.02, 但并无显著性差异(P>0.05)。这说明抑制gsa- 1基因的表达不能显著影响DZ侵染期线虫对苯甲醛的嗅觉适应性。
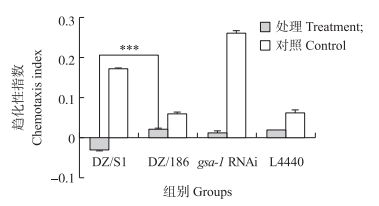
|
图 5 DZ线虫的嗅觉适应性测定 Fig. 5 Olfactory adaption of DZ nematodes |
从图 6可知:对gsa- 1干扰后, DZ线虫对苯甲醛的趋化性明显升高(P < 0.001)。其趋化性指数是对照组的4.22倍。同样, 将两组线虫分别对活体大蜡螟幼虫进行趋化性测试。对gsa- 1干扰后, DZ线虫对大蜡螟的趋化性也明显升高(P=0.006 86), 其趋化性指数是对照组的2.14倍。这说明抑制gsa- 1基因的表达可以显著提高DZ侵染期线虫对苯甲醛及活体大蜡螟幼虫的嗅觉趋化性。
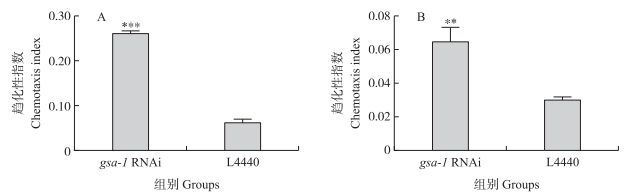
|
图 6 gsa- 1 RNAi后DZ线虫的趋化性 Fig. 6 Chemotaxis of DZ nematodes after gsa- 1 RNAi A. gsa-1 RNAi后DZ线虫对1 : 1 000稀释的苯甲醛的趋化性; B. gsa-1 RNAi后DZ线虫对活体大蜡螟幼虫的趋化性。 A. Chemotaxis of DZ nematodes to 1 : 1 000 diluted benzaldehyde after gsa-1 RNAi; B. Chemotaxis of DZ nematodes to live G. mellonella larvae after gsa-1 RNAi. |
gsa- 1干扰后, DZ线虫与L4440对照组线虫的体长在0、1、3、5和7 h处均无显著差异(图 7-A)。这表明抑制gsa- 1基因的表达对DZ线虫的体长并无影响。gsa- 1 RNAi组及L4440对照组线虫的最长寿命均为34 d, 中位生存期均为19 d(图 7-B)。这表明抑制gsa- 1基因表达后DZ线虫的存活率并无明显变化。gsa- 1 RNAi组线虫Ⅰ—Ⅳ阶段的平均时长分别为8.25、3.75、4和3 d, 而L4440对照组分别为8、3、3和2 d(P>0.05)(图 7-C)。表明抑制gsa- 1基因对线虫的生长历期无影响。gsa- 1 RNAi组的雌虫比例为66.67%, 而L4440对照组为64.07%, 两组线虫之间无显著差异(图 7-D), 在DZ线虫中抑制gsa- 1的表达, 对雌虫比例并无影响。
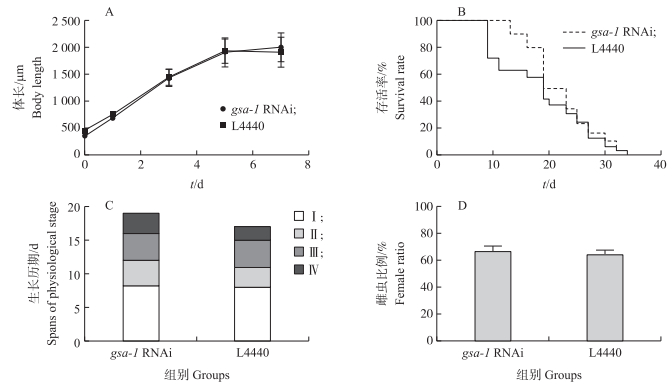
|
图 7 gsa- 1 RNAi后DZ线虫体长(A)、存活率(B)、生长历期(C)及雌虫比例(D)的变化 Fig. 7 Changes of body length(A), survival rate(B), spans of physiological stage(C)and female ratio(D) of DZ nematodes after gsa- 1 RNAi Ⅰ.繁殖期; Ⅱ.快速摆尾期; Ⅲ.咽部快速泵送期; Ⅳ.咽部泵送停止至生命结束。 Ⅰ. Reproductive stage; Ⅱ. Rapid tail-swing stage; Ⅲ. Pharyngeal rapid pumping stage; Ⅳ. Pharyngeal pumping stops till ends life. |
EPN使用复杂的化学感应系统来寻找潜在的宿主, 了解该行为的分子机制可以促进EPN生物防治方法的改进。EPN嗅觉机制的研究对其商业化产品的实际应用有重要意义。本研究发现DZ与其自身共生菌S1及非自身共生菌186共同培养时, 其侵染期线虫的嗅觉特征有显著差异。同源单菌线虫组合DZ/S1的IJ嗅觉趋化性及适应性较高。gsa- 1基因在DZ/S1 IJ中的相对表达量较DZ/186显著下调。gsa- 1 RNAi前、后DZ线虫的生物学性状差异与DZ/S1及DZ/186中的结果呈现一致性, 说明DZ线虫中gsa- 1基因对嗅觉趋化性调控起关键作用。RNAi结果证明, 在DZ线虫中gsa- 1表达水平降低后在不影响嗅觉适应性的前提下显著提高了IJ对苯甲醛及活体大蜡螟幼虫的嗅觉趋化性。Jansen等[20]的研究结果证明, 秀丽隐杆线虫中部分Gα亚基对嗅觉有显著影响。本研究结果证明昆虫病原线虫DZ中的gsa- 1基因与其对苯甲醛和大蜡螟幼虫的嗅觉趋化性有密切关系, 补充并完善了Gαs亚基gsa- 1在嗅觉适应性方面的影响。
在秀丽隐杆线虫中, AWA(Amphid wing"A"cells)和AWC(Amphid wing"C"cells)是检测吸引性气味所必需的神经元[28]。神经元中G蛋白异源三聚体偶联的信号级联用于转导细胞间介质、环境刺激及嗅觉等信号[31-32]。4个Gα亚基(GSA-1、GOA-1、EGL-30和GPA-12)与哺乳动物具有高度同源性。除GPA-12之外, 另外3个保守的Gα亚基在线虫体内广泛表达, 其中GSA-1和GOA-1在所有化感神经元中均有表达[28]。本研究鉴定了gsa- 1在DZ线虫中对嗅觉趋化性的影响, 但其调控网络及分子机制尚不清楚, 仍有待进一步研究。对嗅觉系统更进一步的研究可以帮助探索EPN定位并区分潜在宿主的机制, 有助于增强EPN作为生物农药的防治效率, 为其实际应用提供理论依据。
本实验室前期研究发现异源单菌线虫组合DZ/186的寿命、体长、发育速度、产卵量和雌虫比例等显著低于DZ/S1[17, 33-35]。本研究发现gsa- 1 RNAi组线虫的这些性状与未沉默组相比无显著差异, 表明gsa- 1不参与该线虫的寿命及繁殖发育等性状的调控。
| [1] |
Crowder D W, Northfield T D, Strand M R, et al. Organic agriculture promotes evenness and natural pest control[J]. Nature, 2010, 466(7302): 109-112. DOI:10.1038/nature09183 |
| [2] |
Griffin C T. Perspectives on the behavior of entomopathogenic Nematodes from dispersal to reproduction:traits contributing to nematode fitness and biocontrol efficacy[J]. J Nematol, 2012, 44(2): 84-177. |
| [3] |
Kenney E, Eleftherianos I. Entomopathogenic and plant pathogenic Nematodes as opposing forces in agriculture[J]. Int J Parasitol, 2016, 46(1): 13-19. DOI:10.1016/j.ijpara.2015.09.005 |
| [4] |
Darsouei R, Kariml J, Ghadamyari M, et al. Differential change patterns of main antimicrobial peptide genes during infection of entomopathogenic nematodes and their symbiotic bacteria[J]. Journal of Parasitology, 2017, 103(4): 349-358. DOI:10.1645/16-162 |
| [5] |
Lu D, Baiocchi T, Dillman A R. Genomics of entomopathogenic nematodes and implications for pest control[J]. Trends Parasitol, 2016, 32(8): 588-598. DOI:10.1016/j.pt.2016.04.008 |
| [6] |
Dillman A R, Guillermin M L, Lee J H, et al. Olfaction shapes host-parasite interactions in parasitic Nematodes[J]. Proc Natl Acad Sci USA, 2012, 109(35): E2324-E2333. DOI:10.1073/pnas.1211436109 |
| [7] |
Lawrence A L, Ramon G. Entomopathogenic Nematodes for control of insect pests above and below ground with comments on commercial production[J]. J Nematol, 2012, 44(2): 218-225. |
| [8] |
Ashton F T, Li J, Schad G A. Chemo-and thermosensory neurons:structure and function in animal parasitic Nematodes[J]. Vet Parasitol, 1999, 84(3/4): 297-316. |
| [9] |
Haas W. Parasitic worms:strategies of host finding, recognition and invasion[J]. Zoology, 2003, 106(4): 349-364. DOI:10.1078/0944-2006-00125 |
| [10] |
Haas W, Haberl B, Syafruddin, et al. Behavioural strategies used by the hookworms Necator americanus and Ancylostoma duodenale to find, recognize and invade the human host[J]. Parasitol Res, 2005, 95: 30-39. DOI:10.1007/s00436-004-1257-7 |
| [11] |
Torr P, Heritage S, Wilson M J. Vibrations as a novel signal for host location by parasitic Nematodes[J]. Int J Parasitol, 2004, 34(9): 997-999. DOI:10.1016/j.ijpara.2004.05.003 |
| [12] |
Rasmann S, Köllner T G, Jörg Degenhardt J, et al. Recruitment of entomopathogenic Nematodes by insect-damaged maize roots[J]. Nature, 2005, 434(7034): 732-737. DOI:10.1038/nature03451 |
| [13] |
Colbert H A, Bargmann C I. Odorant-specific adaptation pathways generate olfactory plasticity in C. elegans[J]. Neuron, 1995, 14(4): 803-812. DOI:10.1016/0896-6273(95)90224-4 |
| [14] |
Noelle D L, Cara M C, Jeffery E, et al. The cyclic GMP-dependent protein kinase EGL-4 regulates olfactory adaptation in C. elegans[J]. Neuron, 2002, 36(6): 1079-1089. DOI:10.1016/S0896-6273(02)01066-8 |
| [15] |
Zhang C X, Liu J R, Xu M X, et al. Heterorhabditidoides chongmingensis gen.nov., sp.nov.(Rhabditida:Rhabditidae), a novel member of the entomopathogenic Nematodes[J]. J Invertebr Pathol, 2008, 98(2): 153-168. DOI:10.1016/j.jip.2008.02.011 |
| [16] |
Zhang C X, Yang S Y, Xu M X, et al. A novel species of Serratia, family Enterobacteriaceae:Serratia nematodiphila sp. Nov., symbiotically associated with entomopathogenic Nematode Heterorhabditidoides chongmingensis(Rhabditida:Rhabditidae)[J]. Int J Syst Evol Microbiol, 2009, 59(7): 1603-1608. DOI:10.1099/ijs.0.003871-0 |
| [17] |
王莹.拟异小杆类昆虫病原线虫与其共生菌共生专化性、稳定性及其致病性研究[D].南京: 南京农业大学, 2013. Wang Y. Symbiotic specialization, stability and pathogenicity of entomopathogenic nematodes of Heterorhabdiyidoides and their symbiotic bacterial strains[D]. Nanjing: Nanjing Agricultural University, 2013(in Chinese with English abstract). |
| [18] |
Gopal B, Erika F H, Alex H. The C. elegans G-protein-coupled receptor SRA-13 inhibits RAS/MAPK signalling during olfaction and vulval development[J]. Development, 2003, 130(12): 2567-2577. DOI:10.1242/dev.00497 |
| [19] |
Mori I. Genetics of chemotaxis and thermotaxis in the nematode Caenorhabditis elegans[J]. Annu Rev Genet, 1999, 33(1): 399-422. DOI:10.1146/annurev.genet.33.1.399 |
| [20] |
Jansen G, Thijssen K L, Werner P, et al. The complete family of genes encoding G proteins of Caenorhabditis elegans[J]. Nature Genetics, 1999, 21(4): 414-419. DOI:10.1038/7753 |
| [21] |
Zhang K Y, Liu X H, Tan J, et al. Heterorhabditidoides rugaoensis n. sp.(Rhabditida:Rhabditidae), a novel highly pathogenic entomopathogenic nematode member of Rhabditidae[J]. Journal of Nematology, 2012, 44(4): 348-360. |
| [22] |
陈龙.崇明拟异小杆线虫与嗜线虫沙雷氏菌共生的基因表达谱及共生相关基因富集通路的研究[D].南京: 南京农业大学, 2015. Chen L. Digital gene expression profiling and research of symbiosis related genes enriched pathways analysis of Heterorhabditidoides chongmingensis associated with Serratia nematodiphila strains[D]. Nanjing: Nanjing Agricultural University, 2015(in Chinese with English abstract). |
| [23] |
Tabara H, Grishok A, Mello C C. RNAi in C.elegans:soaking in the genome sequence[J]. Science, 1998, 282(5388): 430-431. DOI:10.1126/science.282.5388.430 |
| [24] |
Timmons L, Court D L, Fire A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans[J]. Gene, 2001, 263(1): 103-112. |
| [25] |
Sicard M, Le Brun N, pages S, et al. Effect of native Xenorhabdus on the fitness of their Steinernema hosts:contrasting types of interaction[J]. Parasitol Res, 2003, 91(6): 520-524. DOI:10.1007/s00436-003-0998-z |
| [26] |
White G F. A method for obtaining infective nematode larvae from cultures[J]. Science, 1927, 66(1709): 302-303. |
| [27] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [28] |
Morris R, Wilson L, Sturrock M, et al. A neuropeptide modulates sensory perception in the entomopathogenic nematode Steinernema carpocapsae[J]. PLoS Pathogens, 2017, 13(3): e1006185. DOI:10.1371/journal.ppat.1006185 |
| [29] |
Pietsch K, Saul N, Menzel R, et al. Quercetin mediated lifespan extension in Caenorhabditis elegans is modulated by age-1, daf-2, sek-1 and unc-43[J]. Biogerontology, 2009, 10(5): 565-578. DOI:10.1007/s10522-008-9199-6 |
| [30] |
Huang C, Xiong C J, Kornfeld K. Measurements of age-related changes of physiological processes that predict lifespan of Caenorhabditis elegans[J]. Proc Natl Acad Sci USA, 2004, 101(21): 8084-8089. DOI:10.1073/pnas.0400848101 |
| [31] |
Zhang C, Yan J, Yao C, et al. The olfactory signal transduction for attractive odorants in Caenorhabditis elegans[J]. Biotechnology Advances, 2014, 32(2): 290-295. DOI:10.1016/j.biotechadv.2013.10.010 |
| [32] |
Sprang S R. Activation of G proteins by GTP and the mechanism of Gα-catalyzed GTP hydrolysis[J]. Biopolymers, 2016, 105(8): 449-462. DOI:10.1002/bip.22836 |
| [33] |
徐漫.崇明拟异小杆(Heterorhabditidoides chongmingensis)线虫dz-daf-36基因的鉴定及功能验证[D].南京: 南京农业大学, 2017. Xu M. Identification and functional verification of dz-daf-36 gene of Heterorhabditidoides chongmingensis[D]. Nanjing: Nanjing Agricultural University, 2017(in Chinese with English abstract). |
| [34] |
詹成修.崇明拟异小杆线虫miR-71与靶基因pdk-1的功能验证[D].南京: 南京农业大学, 2018. Zhan C X. Identification and functional verification of miR-71/pdk-1 of Heterorhabditidoides chongmingensis[D]. Nanjing: Nanjing Agricultural University, 2018(in Chinese with English abstract). |
| [35] |
詹成修, 熊阳杰, 张涛, 等. 崇明拟异小杆线虫daf-16基因的功能鉴定[J]. 昆虫学报, 2018, 61(8): 932-940. Zhan C X, Xiong Y J, Zhang T, et al. Functional identification of daf-16 in Heterorhabditidoides chongmingensis(Rhabditida:Rhabditidae)[J]. Acta Entomologica Sinica, 2018, 61(8): 932-940 (in Chinese with English abstract). |




