文章信息
- 葛占标, 殷涂童, 周倩倩, 张静, 盛下放, 何琳燕
- GE Zhanbiao, YIN Tutong, ZHOU Qianqian, ZHANG Jing, SHENG Xiafang, HE Linyan
- 产生物膜芽胞杆菌阻控叶菜吸收镉、铅及其修复菜地土壤的作用
- Reduced cadmium and lead uptake by leafy vegetables and soil remediation in the presence of the biofilm-producing Bacillus strains
- 南京农业大学学报, 2020, 43(1): 80-88
- Journal of Nanjing Agricultural University, 2020, 43(1): 80-88.
- http://dx.doi.org/10.7685/jnau.201902022
-
文章历史
- 收稿日期: 2019-02-26
由于矿山开采、污水灌溉、化石燃料燃烧和化肥、农药的过度使用等, 我国蔬菜地重金属污染严重, 以Cd污染最为突出, 超标率达24.1%[1]。丁爱芳等[2]采集南京城郊部分菜地土壤和蔬菜样品, 研究发现蔬菜样品Cd、Pb含量均超过国家食品卫生安全标准。师荣光等[3]研究表明天津市郊区蔬菜主要受Cd污染。Wang等[4]调查显示湖南省湘江中下游地区48种蔬菜Cd超标率高达68.8%。李明德等[5]对长沙市主要蔬菜种植基地进行了抽样调查与分析, 结果表明所有的叶菜类蔬菜样品Pb超标, 50%的叶菜类蔬菜样品Cd超标; 近70%的农田土壤受到重金属Cd污染, 50%以上的农田受到了多种重金属污染物复合污染。蔬菜中的重金属进入到人和动物体内会严重威胁健康, 因此开展修复重金属污染菜地土壤工作, 实现蔬菜安全生产迫在眉睫。
实现蔬菜安全生产的有效方法之一是钝化土壤重金属, 减少蔬菜吸收重金属。传统的化学钝化剂可用于减少重金属向植物转移, 但化学钝化剂的持续使用可能对土壤质量产生负面影响[6]。有研究通过培育和筛选重金属低积累品种蔬菜来减少蔬菜吸收重金属, 但也存在培育周期长和品种的地区适应性等问题。在重金属污染土壤修复中, 植物促生和重金属固定细菌被用于促进植物生长, 减少植物对重金属的吸收[7-8]。它们通常产生吲哚乙酸(IAA)和1-氨基环丙烷-1-羧酸脱氨酶(ACC脱氨酶)等物质来促进植物生长。此外, 功能菌株通过提高根际土壤pH值, 产生铁载体和其他金属离子螯合剂来降低重金属的有效性, 降低蔬菜地上部Cd含量[9]。Cd抗性细菌Bacillus megaterium H3显著降低了蔬菜地上部Cd、Pb含量和根际土壤有效态Cd含量, 并增加蔬菜地上部生物量[10]。Suksabye等[11]发现添加枯草芽胞杆菌(B.subtilis)显著降低了Cd污染土壤中水稻Cd积累。接种芽胞杆菌菌株ZAN-044也显著降低土壤中植物可利用Cd含量[12]。这些研究表明, 在重金属污染土壤中, 重金属耐受细菌可以将重金属固定在土壤中, 并减少植物对重金属的吸收。
生物膜是由菌体自身分泌的胞外聚合物(extracellular polymeric substance, EPS)包裹细菌聚合而成的聚集体[13], 是结构复杂的动态群落结构, 也是细菌在含有高浓度重金属的土壤和水中存活的关键, 在降低重金属毒性中起关键作用[14-15]。Mathieu等[16]证明Cd促进Rhizobium alamii生物膜的形成, 菌体产生的EPS能够固定Cd, 并且R. alamii也能够在植物根部形成生物膜。当枯草芽胞杆菌的EPS被去除后, 其对Cd的吸附能力显著下降, 表明EPS在枯草芽胞杆菌对Cd固定中扮演着重要角色[17]。因此, 产生物膜细菌在减少植物Cd积累的应用中具有巨大潜力。
本研究以江苏省南京市六合区Cd、Pb污染农田土壤为供试土壤, 以2株产生物膜芽胞杆菌Bacillus velezensis B9和B25为供试菌株, 采用室内培养模拟试验, 研究供试菌株对小白菜和长叶莴苣的生长、Cd与Pb积累和蔬菜根际土壤理化性质的影响, 阐述产生物膜芽胞杆菌阻控蔬菜吸收Cd、Pb的效果与机制, 以期为蔬菜安全生产、Cd与Pb污染菜地的修复提供理论依据。
1 材料与方法 1.1 供试材料供试蔬菜为小白菜(Brassica chinensis)和长叶莴苣(Lactuca sativa var. longifolia), 蔬菜种子购自江苏省农业科学院种子站。供试菌株为B.velezensis B9(GenBank登录号为MH521165)和B25(GenBank登录号为MH521167), 从栖霞山铅锌矿区周边农田小白菜根际土中分离筛选得到, 具有较强的生物膜形成能力, 均已用绿色荧光蛋白(green fluorescent protein, GFP)基因标记。供试土壤取自江苏省南京市六合区(32°29'41″N, 118°47'23″E)0~30 cm农田耕作层土壤(黄棕壤, 黏壤土)。土壤理化性质:Cd含量0.65 mg · kg-1, Pb含量103 mg · kg-1, pH7.07, 有机质含量14.71 g · kg-1, 全氮含量1.36 g · kg-1, 速效磷含量21.95 mg · kg-1, 速效钾含量117.08 mg · kg-1。
1.2 室内培养模拟试验在南京农业大学牌楼试验基地温室中进行室内培养模拟试验。每种蔬菜设置4个处理:1)接种B9灭菌悬液(B9D); 2)接种B9活菌悬液(B9L); 3)接种B25灭菌悬液(B25D); 4)接种B25活菌悬液(B25L)。将阴干粉碎过2 mm孔径筛的土壤装入塑料盆钵(直径15 cm, 高11 cm)中, 每盆装土0.5 kg, 在种植前3 d浇水保持土壤持水量约60%。选择大小均匀、饱满的蔬菜种子用去离子水漂洗, 75%乙醇表面消毒5 min, 均匀撒在装有湿润营养土的穴盘中, 再撒1层薄营养土覆盖, 放置于25 ℃黑暗培养箱中催芽; 等种子破土萌发后在温室中光照培养, 待幼苗长出3片真叶后, 挑选大小、长势一致的幼苗, 去除根系表面的浮土。
将供试菌株分别接种于1 L LB培养基, 30 ℃、180 r · min-1振荡培养16~20 h至对数生长中期, 6 000 r · min-1离心15 min收集菌体, 用PBS缓冲液清洗2次, 然后用100 mL PBS缓冲液将菌体重悬, 制成菌悬液(1×109CFU · mL-1)。对照菌悬液进行灭菌处理(121 ℃、30 min)。将蔬菜幼苗根分别浸于上述活菌和灭菌悬液, 2 h后移栽入装好土的盆钵中, 小白菜每盆种植4株, 长叶莴苣每盆种植3株, 每组处理3个重复盆钵。15 d后, 按上述方法制备菌悬液。用镊子在蔬菜根周围挖1~2 cm深的沟, 然后每个盆钵沿沟均匀加入5 mL菌悬液, 用土覆盖。
整个盆栽试验过程中, 每天适量浇水。盆栽设置时间为小白菜30 d, 长叶莴苣40 d。收获时将植物从盆钵中带根取出, 轻轻抖落非根际土壤, 用毛刷轻轻刷落黏附于根上的土壤, 即为根际土壤。然后将蔬菜分为地上部和根, 分别用去离子水清洗干净。
1.3 植物样品分析 1.3.1 蔬菜生物量清洗干净的蔬菜地上部和根, 用吸水纸吸去多余的水分并晾干, 称量鲜质量, 然后置于105 ℃烘箱中杀青30 min, 最后在80 ℃下烘干至恒质量, 称量地上部和根部的干质量。
1.3.2 蔬菜Cd、Pb含量的测定用粉碎机分别粉碎地上部和根的干燥样品, 称取0.1 g, 用HNO3和HClO4(体积比为4 : 1)于微波消解仪中进行消解。采用电感耦合等离子体发射光谱仪(ICP-OES)(Optima 2100 DV, PerkinElmer, USA)测定消解液中Cd、Pb含量[9]。
Cd或Pb的转移系数(translocation factor, TF)和富集系数(bioconcentration factor, BCF)计算公式:
转移系数=蔬菜地上部Cd或Pb含量(mg · kg-1)/蔬菜根部Cd或Pb含量(mg · kg-1)。
富集系数=蔬菜地上部或根中Cd或Pb含量(mg · kg-1)/土壤Cd或Pb含量(mg · kg-1)。
1.3.3 菌株在蔬菜根部的定殖取蔬菜新鲜的根, 用PBS缓冲液(100 mmol · L-1 NaH2PO4, 100 mmol · L-1 Na2HPO4, 1.3 mol · L-1 NaCl, pH7.2)轻轻漂洗3次以去除未在根部定殖的细菌, 然后放置在激光共聚焦显微镜(Leica TCS SP8)下观察[18]。参考Xu等[19]的方法并适当修改, 统计供试菌株在蔬菜根部的定殖数量, 取0.1 g蔬菜根, 加1.9 mL PBS缓冲液在研钵里研磨成匀浆, 取适量匀浆用PBS缓冲液梯度稀释, 然后取100 μL根悬液均匀涂布在含5 mg · L-1氯霉素的LB平板上。30 ℃培养2 d后, 在荧光显微镜下(Olympus DP71)观察细菌菌落, 统计发出绿色荧光的菌落数目。
1.4 根际土壤样品分析 1.4.1 土壤有效态Cd、Pb含量的测定根际土壤有效态Cd、Pb含量测定参考Hou等[20]的方法。称取风干研磨过2 mm孔径筛的根际土壤, 将其与二乙基三胺五乙酸(DTPA)提取剂(0.005 mol · L-1 DTPA, 0.01 mol · L-1 CaCl2, 0.1 mol · L-1三乙胺)按质量体积比为1 : 2混合, 160 r · min-1室温振荡2 h, 6 000 r · min-1离心5 min后取上清液, 用ICP-OES测定上清液中Cd、Pb含量。
1.4.2 土壤多糖含量的测定参照张弢[21]的方法并适当修改。取1 g土壤样品, 加入2.5 mL 4 mol · L-1硫酸, 沸水浴6 h后提取水解土壤多糖, 6 000 r · min-1离心5 min后, 取上清液, 调节pH值至7, 定容至10 mL, 最后用蒽酮-硫酸法测定溶液中总糖含量。
1.4.3 土壤中产生物膜菌株比例的测定参照Shank等[22]的方法并略有修改。取3 g根际土壤, 加入27 mL无菌水中, 160 r · min-1室温振荡30 min, 然后用无菌水梯度稀释, 取100 μL土壤悬液涂布于LB平板上, 2 d后随机挑取96个菌落接种到含Msgg培养基的96孔板中, 30 ℃培养3 d, 统计产生物膜的菌落数占总挑取菌落数的比例。
1.4.4 土壤pH值将风干并研磨过2 mm孔径筛的根际土壤与蒸馏水按质量体积比为1 : 2.5混合, 160 r · min-1室温振荡2 h, 6 000 r · min-1离心5 min后, 用pH计测定上清液pH值[20]。
1.4.5 土壤脲酶活性参照关松荫[23]的方法测定土壤脲酶活性。测定方法为苯酚次氯酸钠比色法, 该方法以尿素为基质, 根据酶促产物氨与苯酚-次氯酸钠作用生成靛酚的原理分析脲酶活性。
1.5 数据处理试验数据均采用Excel 2016和Origin 2016软件处理并绘图, 采用SPSS 25.0软件对数据进行统计分析, 差异显著性采用ANOVA单因素方差分析。
2 结果与分析 2.1 产生物膜芽胞杆菌对蔬菜的促生作用由图 1可知:与灭菌悬液处理相比, B9L和B25L处理小白菜地上部干质量分别显著增加54%和41%(P < 0.05), B25L处理长叶莴苣地上部干质量显著增加74%(P < 0.05), 但B9L处理对长叶莴苣的促生效果不显著。

|
图 1 产生物膜芽胞杆菌对蔬菜地上部干质量的影响
Fig. 1 Effects of biofilm-producing Bacillus spp. on the dry weight of the above-ground tissues of vegetables
1)B9D:接种B9灭菌悬液处理Dead cells of B9 innoculation; B9L:接种B9活菌悬液处理Live cells of B9 innoculation; B25D:接种B25灭菌悬液处理Dead cells of B25 innoculation; B25L:接种B25活菌悬液处理Live cells of B25 innoculation. 2)柱子上不同的小写字母表示处理间在0.05水平差异显著。下同。The different lowercase letters above the columns indicate significant difference among treatments at 0.05 level. The same as follows. |
世界卫生组织食品安全标准(CF/5 INF/1)规定, 芥菜类蔬菜和普通叶菜Cd限量分别为0.05和0.2 mg · kg-1, Pb限量为0.3 mg · kg-1。由表 1可知:小白菜地上部Cd、Pb含量普遍超标。长叶莴苣地上部Pb含量超标。接种产生物膜芽胞杆菌处理能显著降低蔬菜Cd、Pb含量, 而且接种菌株B9后小白菜地上部Cd含量降至0.055 mg · kg-1, 接近Cd限量标准。与接种灭菌悬液相比, 小白菜和长叶莴苣B9L处理地上部Cd含量分别显著降低24%和21%, Pb含量分别显著降低33%和28%;小白菜和长叶莴苣B25L处理地上部Cd含量分别显著降低16%和33%, Pb含量分别显著降低19%和35%。同时, 菌株B9和B25还能降低小白菜和长叶莴苣根中Cd、Pb含量。
| 处理Treatment | 小白菜Pakchoi | 长叶莴苣Leaf lettuce | ||||||||||
| Cd含量Cd content | Pb含量Pb content | Cd含量Cd content | Pb含量Pb content | |||||||||
| 地上部 Above-groundtissues |
根 Root |
地上部 Above-groundtissues |
根 Root |
地上部 Above-groundtissues |
根 Root |
地上部 Above-groundtissues |
根 Root |
|||||
| B9D | 0.073±0.008a | 0.249±0.015a | 0.638±0.066a | 3.310±0.340a | 0.057±0.006a | 0.111±0.015a | 0.750±0.101a | 1.182±0.161a | ||||
| B9L | 0.055±0.007b | 0.194±0.029b | 0.430±0.065c | 2.645±0.104b | 0.045±0.006b | 0.092±0.011a | 0.537±0.090b | 0.858±0.029b | ||||
| B25D | 0.069±0.004a | 0.256±0.025a | 0.673±0.073a | 3.120±0.196a | 0.055±0.007ab | 0.099±0.016a | 0.721±0.043a | 1.106±0.071a | ||||
| B25L | 0.058±0.006b | 0.188±0.028b | 0.543±0.034b | 2.867±0.122a | 0.037±0.005b | 0.073±0.005b | 0.467±0.092b | 0.868±0.151ab | ||||
| 注:同列数据不同小写字母表示处理间在0.05水平差异显著。下同。 Note: The different lowercase letters in the same columns indicate significant difference among treatments at 0.05 level. The same as follows. |
||||||||||||
从表 2可知:与接种灭菌悬液相比, 小白菜和长叶莴苣B9L处理根Cd、Pb富集系数分别显著降低18.0%~27.4%, 小白菜和长叶莴苣B25L处理根Cd、Pb富集系数比接种灭菌悬液处理分别显著降低8.1%~ 26.7%。说明2株产生物膜芽胞杆菌可以阻控Cd、Pb从土壤转移到植物根内。同时, B9L和B25L处理小白菜和长叶莴苣地上部Cd、Pb富集系数比接种灭菌悬液处理分别降低16.8%~42.9%(P < 0.05)。
| 蔬菜种类 Vegetable kinds |
处理 Treatment |
转移系数 Translocation factor |
富集系数Bioconcentration factor | ||||||
| Cd | Pb | ||||||||
| Cd | Pb | 地上部 Above-ground tissues |
根 Root |
地上部 Above-ground tissues |
根 Root |
||||
| B9D | 0.294±0.034a | 0.193±0.017abc | 0.113±0.012a | 0.383±0.024a | 0.006a | 0.032a | |||
| 小白菜 | B9L | 0.285±0.018a | 0.162±0.018c | 0.085±0.010b | 0.298±0.044b | 0.004c | 0.025b | ||
| Pakchoi | B25D | 0.272±0.019a | 0.215±0.014a | 0.107±0.006a | 0.393±0.039a | 0.007a | 0.030a | ||
| B25L | 0.309±0.019a | 0.189±0.005b | 0.089±0.010b | 0.288±0.043b | 0.005b | 0.028a | |||
| B9D | 0.512±0.025a | 0.634±0.026a | 0.088±0.009a | 0.172±0.023a | 0.007a | 0.011a | |||
| 长叶莴苣 | B9L | 0.491±0.072a | 0.625±0.085ab | 0.069±0.009b | 0.141±0.016a | 0.005b | 0.008b | ||
| Leaf lettuce | B25D | 0.567±0.082a | 0.653±0.038a | 0.085±0.010ab | 0.152±0.025a | 0.007a | 0.011a | ||
| B25L | 0.504±0.064a | 0.537±0.045b | 0.057±0.008b | 0.112±0.007b | 0.004b | 0.008ab | |||
与接种灭菌悬液相比, 小白菜和长叶莴苣B25L处理Pb转移系数显著降低, 而其他处理的蔬菜Cd、Pb转移系数没有显著变化(表 2)。小白菜Cd、Pb转移系数均低于长叶莴苣, 而小白菜根Cd、Pb富集系数显著高于长叶莴苣, 说明小白菜根部阻隔Cd、Pb向地上部转移。
2.3 产生物膜芽胞杆菌对根际土壤有效态Cd和Pb含量的影响由图 2可知:与接种灭菌悬液相比, 接种活菌悬液能显著降低蔬菜根际土壤Cd、Pb有效态, 小白菜B9L和B25L处理根际土壤有效态Cd含量分别显著降低34%和26%, 有效态Pb含量分别显著降低23%和15%;长叶莴苣B9L和B25L处理根际土壤有效态Cd含量分别显著降低25%和31%, 有效态Pb含量分别显著降低21%和30%(P < 0.05)。此外, 菌株B9对小白菜土壤有效态Cd和Pb含量的影响更显著, 菌株B25对长叶莴苣土壤有效态Cd和Pb含量的影响更显著。
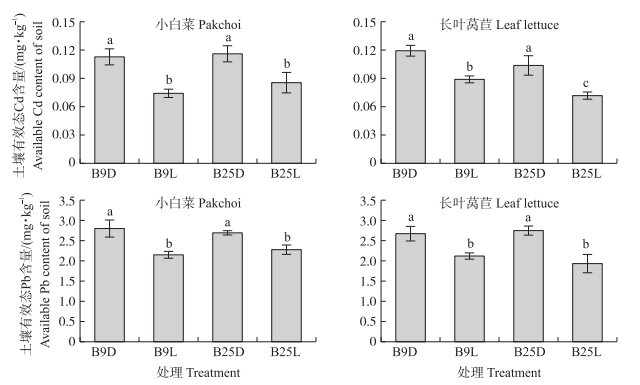
|
图 2 产生物膜芽胞杆菌对蔬菜根际土壤有效态Cd和Pb含量的影响 Fig. 2 Effects of biofilm-producing Bacillus spp. on the available content of Cd and Pb in the rhizosphere soil |
通过激光共聚焦显微镜观察和平板计数发现, 供试菌株能在小白菜和长叶莴苣根部大量定殖。菌株B9和B25均能够在小白菜和长叶莴苣根表聚集, 形成明显的生物膜结构。菌株B9和B25在小白菜和长叶莴苣根部的成膜情况稍强, 而接种灭菌悬液的蔬菜根表并没有检测到明显荧光(图 3-A)。细菌计数结果显示, 菌株B9和B25在小白菜和长叶莴苣根部的定殖数量显著高于其他处理(P < 0.05), 其结果与激光共聚焦显微镜结果基本吻合(图 3-B)。

|
图 3 产生物膜芽胞杆菌在蔬菜根部的生物膜形成(A)和定殖(B) Fig. 3 Bbiofilm formation(A)and colonization(B)of biofilm-producing Bacillus spp. on roots of vegetables |
接菌处理能够影响蔬菜根际土壤多糖含量(图 4)。与接种灭菌悬液相比, 小白菜B9L处理根际土壤多糖含量显著增加28%(P < 0.05), 而B25L处理小白菜根际土壤多糖含量增加不显著。长叶莴苣B9L和B25L处理根际土壤多糖含量分别比B9D、B25处理增加32%和35%(P < 0.05)。
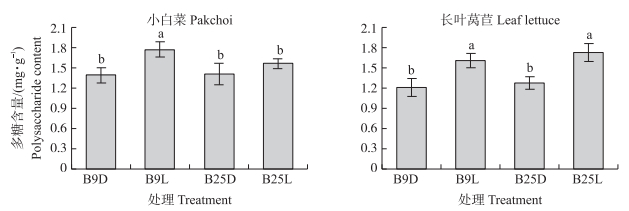
|
图 4 产生物膜芽胞杆菌对蔬菜根际土壤多糖含量的影响 Fig. 4 Effects of biofilm-producing Bacillus spp. on the polysaccharide content of the rhizosphere soil |
通过对蔬菜根际土壤产生物膜菌株比例的统计发现, 接菌处理能够显著提高根际土壤产生物膜菌株比例(图 5)。小白菜B9D和B25D处理根际土壤产生物膜菌株比例分别为12%和9%, 而B9L和B25L处理土壤产生物膜菌株比例分别为88%和69%。长叶莴苣B9D和B25D处理根际土壤产生物膜菌株比例分别为8%和13%, 而接种B9L和B25L处理土壤产生物膜菌株比例分别为72%和84%。

|
图 5 产生物膜芽胞杆菌对蔬菜根际土壤产生物膜菌株比例的影响 Fig. 5 Effects of biofilm-producing Bacillus spp. on the proportion of biofilm-producing bacteria in the vegetable rhizosphere soil |
与接种灭菌悬液相比, 小白菜B9L和B25L处理根际土壤pH值分别显著提高0.20和0.16(图 6), 长叶莴苣根际土壤pH值分别显著提高0.10和0.18, 但2株菌株之间无显著差异。
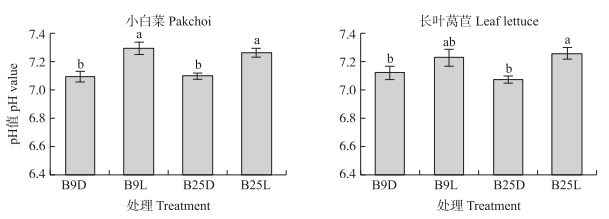
|
图 6 产生物膜芽胞杆菌对蔬菜根际土壤pH值的影响 Fig. 6 Effects of biofilm-producing Bacillus spp. on the pH value of the vegetable rhizosphere soil |
由图 7可知:接菌处理能够提高根际土壤的脲酶活性。与接种灭菌悬液相比小白菜B9L和B25L处理根际土壤脲酶活性分别提高29%(P < 0.05)和22%;长叶莴苣B9L处理根际土壤脲酶活性显著提高49%(P < 0.05), 而长叶莴苣B25L处理根际土壤脲酶活性增加不显著。对于2种蔬菜, 菌株B9更能促进对蔬菜根际土壤脲酶活性的提高。
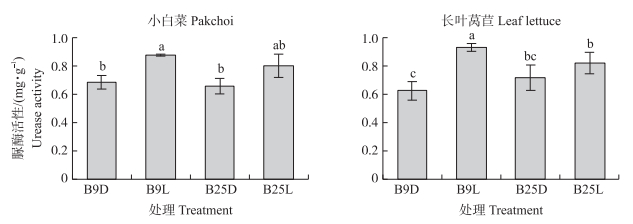
|
图 7 产生物膜芽胞杆菌对蔬菜根际土壤脲酶活性的影响 Fig. 7 Effects of biofilm-producing Bacillus spp. on urease activity of the vegetable rhizosphere soil |
植物益生菌有助于促进植物生长, 增加植物重金属耐受性, 并通过降低土壤中重金属有效态含量减少植物对重金属的吸收[7, 24], 如枯草芽胞杆菌(B.subtilis)、巨大芽胞杆菌(B.megatherium)、苏云金芽胞杆菌(B.thuringiensis)、伯克氏菌(Burkholderia cenocepacia)、根瘤菌属(Rhizobium)、假单胞菌属(Pseudomonas)、沙雷氏菌属(Serratia)等[8-10, 25]。Bacillus velezensis属于解淀粉芽胞杆菌属, 是一种能在植物根部良好定殖且能与植物互作的有益菌株。本研究中, 菌株B.velezensis B9和B25显著降低小白菜和长叶莴苣地上部和根中的Cd、Pb含量, 结果可应用于重金属污染土壤修复, 阻控蔬菜吸收重金属。
微生物在土壤中的生存能力是微生物修复重金属污染土壤的基础[25]。有研究表明, 具有生物膜形成能力的菌株一般具有良好的根部定殖生存能力[26]。菌株在植物根部大量聚集形成群体结构有利于其在复杂的土壤环境中形成竞争优势, 提高自身对重金属的抗性[27]。本研究中, 菌株B9和B25在2种蔬菜根部定殖, 形成生物膜, 提高其生存能力, 并且可能形成根系屏障, 吸附固定重金属, 阻隔并减少根对重金属的吸收。生物膜主要由细胞和EPS(胞外多糖、胞外蛋白、DNA)组成。Han等[9]研究表明在Cd溶液中生长的细菌能够大量吸附溶液中的Cd, 并且以细胞壁吸附为主。EPS中含有磷酸基、羧基、酰胺、氨基、羟基等重金属吸附基团, 能够固定重金属, 降低土壤重金属的迁移能力[28-29]。今后还需深入研究菌株B9和B25的细胞和生物膜组成以及官能团结构, 以期阐明生物膜对重金属的阻隔机制。
土壤有效态重金属含量决定了农作物的污染状况。Wang等[30]报道接种菌株Q3-11显著增加根际土壤pH值, 降低根际土壤有效态Cd含量, 并减少小白菜地上部Cd含量。土壤脲酶对土壤和肥料的氮素转化起着重要作用, 能够使尿素转化为氨态氮, 从而使土壤氨含量增加[23]。Fisher等[31]研究表明提高脲酶产生菌和脲酶基因丰度可以提高土壤pH值。Yang等[32]研究表明具有脲酶活性的细菌与土壤的氮代谢密切相关, 能够提高土壤NH4+含量和pH值。本研究中, 菌株B9和B25能提高土壤脲酶活性, 提高根际土壤pH值, 从而降低蔬菜根际土壤中有效态Cd、Pb含量。这可能是蔬菜中Cd、Pb含量下降的一个重要原因。
微生物分泌的胞外多糖在重金属吸附中扮演着十分重要的角色[33]。多糖含有葡萄糖羟基, 具有良好的亲水性, 并且存在大量具有高效吸附特性的官能团(乙酰氨基、伯氨基、羟基)和聚合链的柔性结构, 对Cu、Pb、Cd、Hg具有良好的吸附特性[34]。在本研究中, 菌株B9和B25显著增加蔬菜根际土壤中产生物膜菌株比例和多糖含量, 通过细胞、生物膜和多糖吸附Cd、Pb, 降低根际土壤有效态Cd、Pb含量, 说明产生物膜细菌通过钝化土壤中的Cd、Pb和在蔬菜根部形成生物膜阻止蔬菜对Cd、Pb的吸收。
尽管接种菌株B9和B25处理显著降低了2种叶菜地上部Cd、Pb含量, 接种B9菌株后小白菜地上部Cd含量降低至0.055 mg · kg-1, 接近世界卫生组织食品安全标准(CF/5 INF/1)规定的限量Cd(0.05 mg · kg-1), 但未达标。因此, 应该研发配套使用技术, 进一步降低蔬菜地上部Cd、Pb含量。而且, 产生物膜细菌阻控蔬菜吸收Cd、Pb的效果及其作用机制还需开展长期田间试验, 稳定生物修复菌剂的长期效果, 保障蔬菜安全生产。
综上所述, B.velezensis B9和B25能够在中轻度Cd、Pb污染农田中阻控小白菜和长叶莴苣积累Cd、Pb, 在蔬菜根部定殖形成生物膜, 增加根际土壤产生物膜菌株比例和多糖含量, 提高根际土壤脲酶活性和pH值, 降低根际土壤Cd、Pb有效性, 有利于修复蔬菜产地土壤, 保障叶菜安全生产。
| [1] |
Li Z, Ma Z, van der Kuijp T J, et al. A review of soil heavy metal pollution from mines in China:pollution and health risk assessment[J]. Science of the Total Environment, 2014, 468/469: 843-853. DOI:10.1016/j.scitotenv.2013.08.090 |
| [2] |
丁爱芳, 潘根兴. 南京城郊零散菜地土壤与蔬菜重金属含量及健康风险分析[J]. 生态环境, 2003, 12(4): 409-411. Ding A F, Pan G X. Contents of heavy metals in soils and Chinese cabbages(Brassica chinensis) from some urban vegetable fields around Nanjing and the human health risks[J]. Ecology and Environment, 2003, 12(4): 409-411 (in Chinese with English abstract). DOI:10.3969/j.issn.1674-5906.2003.04.008 |
| [3] |
师荣光, 赵玉杰, 高怀友, 等. 天津市郊蔬菜重金属污染评价与特征分析[J]. 农业环境科学学报, 2005, 24(S1): 169-173. Shi R G, Zhao Y J, Gao H Y, et al. Metals influencing the level of heavy metal contamination of vegetables in Tianjin city as derived by principal components analysis[J]. Journal of Agro-Environment Science, 2005, 24(S1): 169-173 (in Chinese with English abstract). |
| [4] |
Wang L X, Guo Z H, Xiao X Y, et al. Heavy metal pollution of soils and vegetables in the midstream and downstream of the Xiangjiang River, Hunan Province[J]. Journal of Geographical Sciences, 2008, 18(3): 353-362. DOI:10.1007/s11442-008-0353-5 |
| [5] |
李明德, 汤海涛, 汤睿, 等. 长沙市郊蔬菜土壤和蔬菜重金属污染状况调查及评价[J]. 湖南农业科学, 2005(3): 34-36. Li M D, Tang H T, Tang R, et al. The investigation and evaluation of heavy metal state form soil and vegetable in the suburb of changsha region[J]. Hunan Agricultural Sciences, 2005(3): 34-36 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-060X.2005.03.015 |
| [6] |
Liu L, Li W, Song W, et al. Remediation techniques for heavy metal-contaminated soils:principles and applicability[J]. Science of the Total Environment, 2018, 633: 206-219. DOI:10.1016/j.scitotenv.2018.03.161 |
| [7] |
Grandlic C J, Mendez M O, Jon C, et al. Plant growth-promoting bacteria for phytostabilization of mine tailings[J]. Environmental Science & Technology, 2008, 42(6): 2079-2084. |
| [8] |
Chen L, He L Y, Wang Q, et al. Synergistic effects of plant growth-promoting Neorhizobium huautlense T1-17 and immobilizers on the growth and heavy metal accumulation of above-ground tissues of hot pepper[J]. Journal of Hazardous Materials, 2016, 312: 123-131. DOI:10.1016/j.jhazmat.2016.03.042 |
| [9] |
Han H, Wang Q, He L, et al. Increased biomass and reduced rapeseed Cd accumulation of oilseed rape in the presence of Cd-immobilizing and polyamine-producing bacteria[J]. Journal of Hazardous Materials, 2018, 353: 280-289. DOI:10.1016/j.jhazmat.2018.04.024 |
| [10] |
Wang Q, Zhang W, He L, et al. Increased biomass and quality and reduced heavy metal accumulation of above-ground tissues of vegetables in the presence of Cd-tolerant and immobilizing Bacillus megaterium H3[J]. Ecotoxicology and Environmental Safety, 2018, 148: 269-274. DOI:10.1016/j.ecoenv.2017.10.036 |
| [11] |
Suksabye P, Pimthong A, Dhurakit P, et al. Effect of biochars and microorganisms on cadmium accumulation in rice grains grown in Cd-contaminated soil[J]. Environmental Science & Pollution Research, 2016, 23(2): 962-973. |
| [12] |
Jézéquel K, Perrin J, Lebeau T. Bioaugmentation with a Bacillus sp. to reduce the phytoavailable Cd of an agricultural soil:comparison of free and immobilized microbial inocula[J]. Chemosphere, 2005, 59(9): 1323-1331. DOI:10.1016/j.chemosphere.2004.11.050 |
| [13] |
Flemming H C, Wingender J, Szewzyk U, et al. Biofilms:an emergent form of bacterial life[J]. Nature Reviews Microbiology, 2016, 14(9): 563-575. DOI:10.1038/nrmicro.2016.94 |
| [14] |
Yun C, Fang Y, Yunrong C, et al. Biocontrol of tomato wilt disease by Bacillus subtilis isolates from natural environments depends on conserved genes mediating biofilm formation[J]. Environmental Microbiology, 2013, 15(3): 848-864. DOI:10.1111/j.1462-2920.2012.02860.x |
| [15] |
Likai H, Jianli L, Andreas K, et al. Mapping of heavy metal ion sorption to cell-extracellular polymeric substance-mineral aggregates by using metal-selective fluorescent probes and confocal laser scanning microscopy[J]. Applied & Environmental Microbiology, 2013, 79(21): 6524-6534. |
| [16] |
Mathieu S, Agnes F, Philippe O, et al. Modulation of metabolism and switching to biofilm prevail over exopolysaccharide production in the response of Rhizobium alamii to cadmium[J]. PLoS One, 2011, 6(11): e26771. DOI:10.1371/journal.pone.0026771 |
| [17] |
Wei X, Fang L, Cai P, et al. Influence of extracellular polymeric substances(EPS) on Cd adsorption by bacteria[J]. Environmental Pollution, 2011, 159(5): 1369-1374. DOI:10.1016/j.envpol.2011.01.006 |
| [18] |
Gotz M, Gomes N C, Dratwinski A, et al. Survival of gfp-tagged antagonistic bacteria in the rhizosphere of tomato plants and their effects on the indigenous bacterial community[J]. FEMS Microbiology Ecology, 2006, 56(2): 207-218. DOI:10.1111/j.1574-6941.2006.00093.x |
| [19] |
Xu Z H, Zhang R F, Wang D D, et al. Enhanced control of cucumber wilt disease by Bacillus amyloliquefaciens SQR9 by altering the regulation of its DegU phosphorylation[J]. Applied & Environmental Microbiology, 2014, 80(9): 2941. |
| [20] |
Hou D, Wang K, Liu T, et al. Unique rhizosphere micro-characteristics facilitate phytoextraction of multiple metals in soil by the hyperaccumulating plant Sedum alfredii[J]. Environmental Science & Technology, 2017, 51(10): 5675. |
| [21] |
张弢. 大棚蔬菜连作对土壤多糖影响的研究[J]. 北方园艺, 2009(8): 165-166. Zhang T. Study on the effects of continuous cropping of greenhouse vegetables on soil polysaccharides[J]. Northern Horticulture, 2009(8): 165-166 (in Chinese). |
| [22] |
Shank E A, Klepac-Ceraj V, Collado-Torres L, et al. Interspecies interactions that result in Bacillus subtilis forming biofilms are mediated mainly by members of its own genus[J]. Proc Natl Acad Sci USA, 2011, 108(48): E1236-E1243. DOI:10.1073/pnas.1103630108 |
| [23] |
关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986: 376. Guan S Y. Soil Enzyme and Its Research Methods[M]. Beijing: Agriculture Press, 1986: 376 (in Chinese). |
| [24] |
Tiwari S, Kumari B, Singh S N. Evaluation of metal mobility/immobility in fly ash induced by bacterial strains isolated from the rhizospheric zone of Typha latifolia growing on fly ash dumps[J]. Bioresource Technology, 2008, 99(5): 1305-1310. DOI:10.1016/j.biortech.2007.02.010 |
| [25] |
Treesubsuntorn C, Dhurakit P, Khaksar G, et al. Effect of microorganisms on reducing cadmium uptake and toxicity in rice(Oryza sativa L[J]. Environmental Science & Pollution Research, 2018, 25(26): 25690-25701. |
| [26] |
Beauregard P B, Chai Y, Vlamakis H, et al. Bacillus subtilis biofilm induction by plant polysaccharides[J]. Proc Natl Acad Sci USA, 2013, 110(17): E1621-E1630. DOI:10.1073/pnas.1218984110 |
| [27] |
Madhaiyan M, Poonguzhali S, Sa T. Metal tolerating methylotrophic bacteria reduces nickel and cadmium toxicity and promotes plant growth of tomato(Lycopersicon esculentum L[J]. Chemosphere, 2007, 69(2): 220-228. DOI:10.1016/j.chemosphere.2007.04.017 |
| [28] |
Yang L, Hu Y, Liu Y, et al. Distinct roles of extracellular polymeric substances in Pseudomonas aeruginosa biofilm development[J]. Environmental Microbiology, 2011, 13(7): 1705-1717. DOI:10.1111/j.1462-2920.2011.02503.x |
| [29] |
Mikutta R, Baumgärtner A, Schippers A, et al. Extracellular polymeric substances from Bacillus subtilis associated with minerals modify the extent and rate of heavy metal sorption[J]. Environmental Science & Technology, 2012, 46(7): 3866-3873. |
| [30] |
Wang X, Nie Z, He L, et al. Isolation of As-tolerant bacteria and their potentials of reducing As and Cd accumulation of edible tissues of vegetables in metal(loid)-contaminated soils[J]. Science of the Total Environment, 2017, 579: 179-189. DOI:10.1016/j.scitotenv.2016.10.239 |
| [31] |
Fisher K A, Yarwood S A, James B R. Soil urease activity and bacterial ureC gene copy numbers:effect of pH[J]. Geoderma, 2017, 285: 1-8. DOI:10.1016/j.geoderma.2016.09.012 |
| [32] |
Yang Y, Gao Y, Wang S, et al. The microbial gene diversity along an elevation gradient of the Tibetan grassland[J]. The ISME Journal, 2014, 8(2): 430. DOI:10.1038/ismej.2013.146 |
| [33] |
Fabienne F O, Carine L, Jean-Michel G, et al. Isolation and characterization of environmental bacteria capable of extracellular biosorption of mercury[J]. Applied & Environmental Microbiology, 2012, 78(4): 1097-1106. |
| [34] |
Crini G. Recent developments in polysaccharide-based materials used as adsorbents in wastewater treatment[J]. Progress in Polymer Science, 2005, 30(1): 38-70. DOI:10.1016/j.progpolymsci.2004.11.002 |




