文章信息
- 刘琳硕, 贺祥, 李红梅, 元青, 王暄
- LIU Linshuo, HE Xiang, LI Hongmei, YUAN Qing, WANG Xuan
- TRV介导的E3泛素连接酶基因NbE3R14沉默对烟草基础免疫及南方根结线虫寄生的影响
- Effects of TRV-mediated silencing of the E3 ubiquitin ligase gene NbE3R14 in Nicotiana benthamiana on the plant basal immunity and the parasitism of Meloidogyne incognita
- 南京农业大学学报, 2020, 43(1): 65-71
- Journal of Nanjing Agricultural University, 2020, 43(1): 65-71.
- http://dx.doi.org/10.7685/jnau.201903039
-
文章历史
- 收稿日期: 2019-03-20
根结线虫(Meloidogyne spp.)是一类植物固定内寄生线虫, 可寄生3 000多种植物, 严重危害全球农作物的产量和品质[1]。根结线虫二龄幼虫(second-stage juveniles, J2s)从根冠部根尖伸长区侵入, 然后U型折返移动至维管束, 诱导5~7个临近细胞转化为取食位点——巨细胞, 用于维持线虫的发育和繁殖[2]。根结线虫在上述寄生过程中能够利用自身分泌的效应蛋白(effectors)直接或间接作用于植物靶标蛋白从而促进其侵染和寄生。例如, 南方根结线虫(M.incognita)效应蛋白Mi8D05在线虫侵染过程中与一种植物水通道蛋白(tonoplast intrinsic protein 2, TIP2)特异性互作, 调节巨细胞内水分和溶质的运输[3]; 爪哇根结线虫(M.javanica)效应蛋白MjTTL5可以与拟南芥铁氧还原蛋白AtFTRc互作, 在线虫侵染过程中促进AtFTRc基因表达, 提高拟南芥体内过氧化物清除活性, 从而降低植物基础免疫反应, 导致拟南芥更为感病[4]。
在本研究的前期工作中, 我们发现南方根结线虫(M.incognita)的类毒液过敏原蛋白(venom allergen-like protein, VAP)MiV758能够与植物的一类E3泛素连接酶(ubiquitin-protein ligase, E3)RNF14互作。E3泛素连接酶是泛素-26S蛋白酶体途径(ubiquitin-proteasome system)的重要组成部分, 与泛素(ubiquitin, UB)、泛素激活酶(ubiquitin activating enzyme, E1)、泛素结合酶(ubiquitin conjugating enzyme, E2)协同作用, 从而完成对真核生物蛋白质转录后的泛素化修饰[5]。E3泛素连接酶由于能特异性识别底物, 是泛素蛋白酶体途径中数目最多也是最重要的一种酶[6], 许多研究证据均表明E3泛素连接酶参与多种植物抗病信号途径的调控, 在调节植物激素信号途径、抵抗病原菌侵染、胁迫应答及过敏性坏死反应等方面发挥重要作用[7-9]。
E3泛素连接酶RNF14是否参与调控植物的抗病免疫及线虫与植物的亲和互作, 目前尚未见相关报道。本文利用病毒介导的基因沉默技术(virus-induced gene silencing, VIGS)研究本氏烟中NbE3R14基因的沉默对植物基础防卫反应及卵菌和线虫寄生的影响, 以期证实NbE3R14在植物抵御病原生物侵染过程中的作用, 从而揭示植物寄生线虫可能利用E3泛素连接酶抑制植物免疫并促进线虫侵染的分子机制。
1 材料与方法 1.1 供试材料供试南方根结线虫群体采自江苏省淮安市丁集镇, 田间寄主为黄瓜。用镊子从黄瓜病株根部挑取单卵块进行纯化及种类鉴定, 并接种至6叶期感病番茄品种'Hezuo903’, 然后置于25 ℃温室中培养扩繁, 8周后收集根系上的卵块并孵化2龄幼虫, 制备2龄幼虫悬浮液用于烟草接种。
烟草为本氏烟(Nicotiana benthamiana), 由本实验室保存。烟草幼苗置于25 ℃人工温室, 在16 h光照8 h黑暗条件下培养, 待植株长至4片真叶时备用。
烟草脆裂病毒(Tobacco rattle virus, TRV)介导的基因沉默载体pTRV1、pTRV2和阳性对照八氢番茄红素脱氢酶(phytoene desaturase)基因沉默载体pTRV2-PDS由本学院陶小荣教授惠赠; 辣椒疫霉(Phytophthora capsici)由本学院窦道龙教授惠赠。flg22短肽购自金斯瑞生物科技有限公司, 本研究所用引物(表 1)均由金斯瑞生物科技有限公司合成。
| 靶标基因Target gene | 引物名称Primer name | 引物序列Primer sequence(5'→3') | 来源Source | 基因登录号GenBank ID |
| NbE3R14 | NbE3R14-TRVF/TRVR | CGGGATCCGATCAAGCTCAGGAAG/ CCGCTCGAGGGTATATAACCTCTTG |
本研究 This study |
NbS00004041g0020.1 |
| NbE3R14 | NbE3R14-RTF/RTR | GCACGTCAAGGAAGGTACAA/ CAAACTCCACTTCACCGAGTAA |
本研究 This study |
NbS00004041g0020.1 |
| GRAS2 | GRAS2-RTF/RTR | TACCTAGCACCAAGCAGATGCAGA/ TCATGAGGCGTTACTCGGAGCATT |
[11] | EH369163.1 |
| PTI5 | PTI5-RTF/RTR | CCTCCAAGTTTGAGCTCGGATAGT/ CCAAGAAATTCTCCATGCACTCTGTC |
[12] | U430823 |
| ACRE31 | ACRE31-RTF/RTR | AATTCGGCCATCGTGATCTTGGTC/ GAGAAACTGGGATTGCCTGAAGGA |
[12] | U434705 |
| WRKY7 | WRKY7-RTF/RTR | CACAAGGGTACAAACAACACAG/ GGTTGCATTTGGTTCATGTAAG |
[12] | AB445391.1 |
| WRKY8 | WRKY8-RTF/RTR | AACAATGGTGCCAATAATGC/ TGCATATCCTGAGAAACCATT |
[12] | AB445392.1 |
| NbACTIN | NbACTIN-RTF/RTR | GTTGCTATACAAGCTGTTCTCTCG/ GTCAAGACGAAGAATGACATGTGG |
[12] | AY594294.1 |
| GFP | TRV2GFP-F/R | TCTAGAATGGTGAGCAAGGGC/ CCCGGGTTACTTGTACAGCTCGTC |
本研究 This study |
MH144178.1 |
利用Plant RNA Kit(OMEGA)提取4叶期烟草叶片的总RNA, 并用5×All-In-One RT MasterMix试剂盒(abmgoodchina Inc., Canada)将提取的叶片总RNA反转录获得cDNA。利用在线工具SGN VIGS Tool筛选NbE3R14基因干扰靶标区域并设计引物(表 1), 以cDNA为模板进行PCR扩增, 扩增产物经BamHⅠ和XhoⅠ双酶切后连接到pTRV2载体上, 命名为pTRV2-NbE3R14。同时以pTRV2-PDS为阳性对照以及pTRV2-GFP为阴性对照分别转化根癌农杆菌(Agrobacterium tumefaciens)GV3101感受态细胞, 分别获得TRV∷NbE3R14、TRV∷PDS和TRV∷GFP的农杆菌转化子。挑取上述单菌落至液体LB培养基, 过夜培养。收集菌体, 重悬于MMA溶液[10 mmol · L-1 MgCl2, 10 mmol · L-12-(N-吗啡啉)乙磺酸(MES), 100 mmol · L-1乙酰丁香酮], 调整菌液浓度至D600=0.8。参照Dubreuil等[10]的方法接种农杆菌悬浮液于本氏烟, 即将TRV∷NbE3R14、TRV∷PDS和TRV∷GFP悬浊液分别与TRV1悬浮液按1 : 1混合后, 选择4~5叶期本氏烟幼苗新生叶下部长势较好的真叶2片, 用去针头的1 mL一次性无菌注射器于叶片背面分别注射200~300 μL上述悬浮液, 每个处理注射15株, 重复3次。处理后的本氏烟置于25 ℃光照培养箱中培养, 设置昼/夜温度为25 ℃/22 ℃, 光/暗时间为16 h/8 h, 观察本氏烟生长状况待用。
1.3 RT-qPCR检测NbE3R14基因沉默效率待阳性对照TRV∷PDS农杆菌接种的烟草出现白化表型时, 分别剪取不同农杆菌处理的烟草叶片及根系, 用Plant RNA Kit分别提取总RNA, 使用5×All-In-One RT MasterMix试剂盒反转录为cDNA。以本氏烟草NbACTIN为内参基因, 引物对为NbACTIN-RTF/RTR(表 1), 用EvaGreen 2× qPCR MasterMix试剂盒(abm, Canada)及引物对NbE3R14 -RTF/RTR(表 1), 进行RT-qPCR, 检测NbE3R14 基因的沉默效率。所用荧光定量PCR仪型号为Applied Biosystems 7500 system。反应体系:EvaGreen 2× qPCR MasterMix 10 μL, 5 μmol · L-1引物各1.2 μL, 模板DNA 2 μL, 加水补足至20 μL。反应程序:95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 34 s, 40个循环, 生成熔解曲线。采用2-ΔΔCT法分析数据[13], 用Excel 2007软件进行数据处理, 用SPSS 19.0软件进行单因素方差分析及数据的显著性分析。
1.4 靶标基因沉默对flg22引起PTI反应的影响选取上述经验证NbE3R14基因下调表达的植株(TRV∷NbE3R14)、野生型(WT)及阴性对照(TRV∷GFP)烟草的叶片, 用直径0.5 cm打孔器打下叶碟, 放入24孔细胞培养板, 加入1 mL无菌水静置过夜。弃无菌水, 加入20 μmol · L-1 flg22溶液1 mL, 25 ℃温育30 min; 同时以无菌水处理作为对照。分别提取叶碟总RNA并反转录成cDNA, 用RT-qPCR检测PTI相关基因ACRE31、GRAS2、PTI5、WRKY7及WRKY8 的表达量(引物序列见表 1), 用NbACTIN基因作为内参基因。反应体系:EvaGreen 2× qPCR MasterMix 10 μL, 5 μmol · L-1引物各1.2 μL, 模板DNA 2 μL, 加水补足至20 μL。反应程序:95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 34 s, 40个循环。数据分析方法同1.3节。
1.5 靶标基因沉默对辣椒疫霉侵染能力的影响参照Yu等[14]的方法接种辣椒疫霉于TRV∷NbE3R14、WT、TRV∷GFP处理的烟草叶片。剪下带叶柄的叶片, 用无菌水打湿脱脂棉并包裹叶柄, 放在垫有无菌水浸湿滤纸的托盘上, 叶背面朝上; 用直径0.5 cm打孔器在长满辣椒疫霉菌丝的平板边缘上打菌碟若干; 在烟草叶片的中心位置滴10 μL无菌水, 用灭菌牙签挑取菌碟将其倒扣于无菌水滴上。将接种后的烟草叶片密封保湿, 于25 ℃避光培养36 h后, 在手持紫外灯下拍照, 用直尺测量坏死病斑的直径并记录。各处理烟草分别接种15个叶片, 重复3次。
1.6 南方根结线虫接种靶标基因沉默烟草后的表型检测农杆菌处理烟草叶片10 d后, 参照Chi等[15]的方法接种南方根结线虫J2于TRV∷NbE3R14、WT、TRV∷GFP烟草株系根部, 每株接种量1 000条, 每个处理接种10株烟草, 重复3次, 接种后置于25 ℃光照培养箱培养。8周后将烟草根系洗净, 统计根系上产生的根结数和卵块数。用酸性品红染色法[16]对各烟草株系的根染色, 在体视镜下统计每株烟草根系内的雌虫数。每个烟草株系随机挑取10个卵块, 将单卵块置于含有5% NaClO溶液的12孔板内, 静置10 min后, 在体视镜下观察并统计单卵块的卵量[17], 各处理均重复3次。用Excel 2007和SPSS 19.0软件进行数据处理、单因素方差分析及差异显著性分析。
2 结果与分析 2.1 RT-qPCR检测NbE3R14基因的沉默效率将TRV∷NbE3R14、TRV∷GFP、TRV∷PDS农杆菌分别注射烟草10 d后, TRV∷PDS处理的叶片呈现明显白化现象(图 1-A), 其他处理的烟草叶部生长状况与WT烟草无明显区别。RT-qPCR检测显示:TRV∷NbE3R14处理烟草的叶部NbE3R14基因表达量明显下调, 与WT相比显著下降75.3%(P < 0.05), 而TRV∷GFP与WT无明显差异(图 1-B), 表明农杆菌接种植株叶部10 d后, VIGS沉默体系引起靶标基因NbE3R14的特异性下调表达, 植株可用于后续研究。
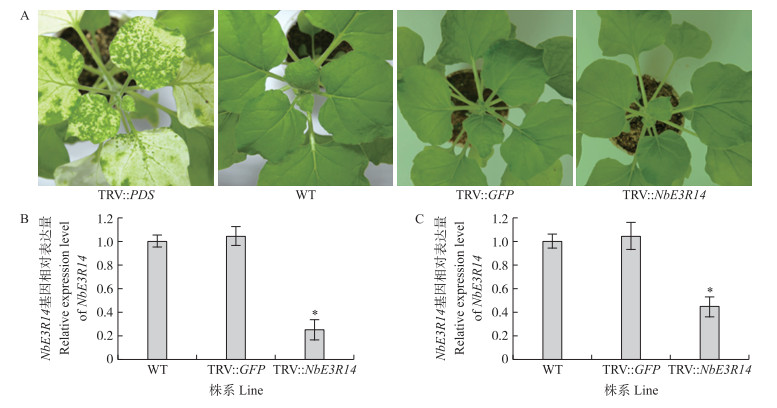
|
图 1 农杆菌接种后烟草叶部表型比较和NbE3R14基因表达量的RT-qPCR检测
Fig. 1 Phenotypic comparison of tobacco leaves after agro-inoculation and RT-qPCR detection of expression level of NbE3R14 gene
A.农杆菌接种后的烟草叶片表型Phenotype of tobacco leaves after agro-inoculation; B. RT-qPCR检测叶部NbE3R14基因表达量RT-qPCR detection of NbE3R14 gene expression in leaves; C. RT-qPCR检测根部NbE3R14基因表达量RT-qPCR detection of NbE3R14 gene expression in roots. TRV∷PDS:沉默PDS基因株系Positive control of PDS gene silencing tabacoo line; WT:野生型Wild type line; TRV∷GFP:阴性对照株系Negative control line; TRV∷NbE3R14:沉默NbE3R14基因株系Silencing NbE3R14 gene line. *P<0.05. The same as follows. |
此外, 用RT-qPCR检测不同处理10 d的烟草根部NbE3R14基因的表达量, 发现与叶部的表达量相似, 且与WT相比, TRV∷NbE3R14沉默株系的NbE3R14表达量显著下调55.8%(P<0.05), TRV∷GFP与WT无明显差异(图 1-C), 表明农杆菌接种植株叶部10 d后, TRV处理同样影响根部NbE3R14基因的表达。
2.2 沉默NbE3R14对flg22诱导烟草PTI相关基因表达的影响取不同农杆菌处理10 d后的烟草叶片, RT-qPCR检测PTI相关基因的表达水平。结果(图 2)显示:所有株系未经flg22处理时5个供试靶标基因表达量均相对较低, 且相互之间无显著差异。经flg22处理后的各靶标基因表达量均明显上调, 但各株系之间存在一定的差异, 其中flg22处理后的TRV∷NbE3R14烟草中GRAS2、WRKY7和WRKY8基因的表达量分别比WT烟草下降41.3%、63.9%和61.8%(P < 0.05), PTI5和ACRE31的表达量则在2个株系中无明显差异; 而TRV∷GFP株系中WRKY7、WRKY8、GRAS2、PTI5和ACRE31的表达量与WT烟草相比均差异不显著(P>0.05), 表明NbE3R14基因的沉默影响PTI相关基因的表达。

|
图 2 沉默NbE3R14基因对flg22诱导烟草PTI相关基因表达量的影响 Fig. 2 Effect of silencing NbE3R14 gene on the relative expression levels of PTI related genes in tobacco induced by flg22 |
取不同农杆菌处理10 d后的烟草叶片接种辣椒疫霉, 36 h后在紫外灯下观察病斑大小。结果(图 3)显示:WT烟草叶片上的病斑直径平均为1.52 cm, TRV∷NbE3R14处理烟草的病斑直径为1.89 cm, 比WT病斑扩大28.5%, 差异显著(P < 0.05);而TRV∷GFP的病斑直径平均为1.45 cm, 与WT差异并不显著, 表明沉默NbE3R14导致烟草对辣椒疫霉更为感病。
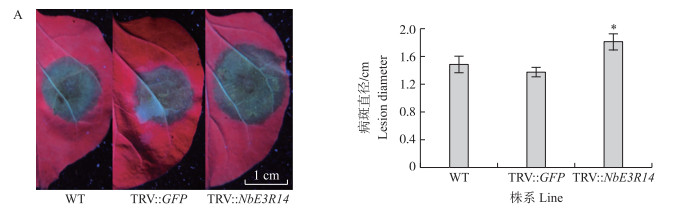
|
图 3 沉默NbE3R14基因对辣椒疫霉侵染烟草能力的影响 Fig. 3 Effect of silencing NbE3R14 gene on the infection ability of Phytophthora capsici on leaves of Nicotiana benthamiana A.本氏烟接种辣椒疫霉36 h的坏死斑Lesions of the tobacco leaves after infiltration 36 h with P.capsici; B.本氏烟叶片病斑直径大小Lesion diameters of tabacco leaves. |
由图 4可见:NbE3R14基因沉默后的烟草对线虫寄生表现更为敏感, 根系上产生的根结、卵块及雌虫数量均有增加, 其中WT烟草根系上根结数平均为每株69.8个, 而TRV∷NbE3R14株系上的根结数为每株85.2个, 比WT增加22.1%;WT烟草上产生的雌虫数平均为每株62.3个, 而TRV∷NbE3R14株系上雌虫数量增加27.4%;WT上的卵块数为每株64.1个, 而TRV∷NbE3R14株系上的卵块数增加17.2%。统计分析显示:TRV∷NbE3R14株系的根结数、卵块数和雌虫数与WT烟草相比均差异显著(P < 0.05), 而TRV∷GFP与WT烟草相比均无显著差异(图 4-A—C); 此外, WT、TRV∷NbE3R14和TRV∷GFP烟草根系上雌虫所产的卵量分别为每卵块369.4、379.1和385.1个, 没有显著差异(图 4-D), 表明沉默NbE3R14基因可以促进南方根结线虫对烟草的寄生。

|
图 4 沉默NbE3R14基因对南方根结线虫寄生的影响 Fig. 4 Effect of silencing NbE3R14 gene on the parasitism of Meloidogyne incognita |
E3泛素连接酶作为泛素化途径中决定底物特异性的关键酶, 在真核生物蛋白质降解过程中发挥重要作用。拟南芥、水稻等基因组中已发现数百个E3泛素连接酶编码基因, 功能涉及干旱和盐胁迫响应等多个过程[8, 18]。此外, E3泛素连接酶也被证实参与植物免疫的调控[19]。拟南芥的U-box型E3泛素连接酶PUB12和PUB13, 经受体激酶BAK1磷酸化后能够泛素化植物模式识别受体FLS2并促进其降解, 负向调控植物抗病反应[20]; 而水稻的E3泛素连接酶XB3和OsPUB15则分别与抗性蛋白XA21和PID2互作并调节其各自介导的抗病性[21-22]。
本研究利用VIGS沉默烟草E3泛素连接酶基因NbE3R14, 叶片经flg22处理后RT-qPCR检测显示, TRV∷NbE3R14烟草PTI相关基因表达水平与WT烟草和TRV∷GFP烟草对照相比均明显下降, 揭示NbE3R14可能参与正向调控烟草基础免疫反应。此前也有类似的研究证实, 沉默烟草和马铃薯中的E3泛素连接酶基因NbATL60和StRFP1后可导致各自植株PTI相关基因的表达下调[12], 而在植物内过表达E3泛素连接酶能够增强植物对PAMP触发的免疫反应, 如过表达拟南芥AtATL2可以促进抗性相关基因的表达[23]。进一步开展的叶片接种辣椒疫霉和根部接种线虫的侵染试验均证实沉默NbE3R14导致植物更为感病, 然而NbE3R14具体参与哪些植物抗病通路, 其沉默干扰哪些下游相关基因的表达仍有待今后进一步的阐明。
E3泛素连接酶由于参与调控植物免疫, 因此也成为病原菌攻击植物的分子靶标。致病疫霉(P.infestans)效应蛋白AVR3a能够稳定马铃薯E3泛素连接酶CMPG1的活性, 阻碍其被26S蛋白酶体途径降解, 从而抑制INF1引发的细胞坏死反应[24]。水稻黄单孢菌(Xanthomonas oryzae)TypeⅢ效应蛋白XopPxoo通过抑制水稻泛素连接酶OsPUB44的活性, 负向调控水稻的PTI反应[20]。稻瘟病菌(Magnaporthe oryzae)无毒蛋白AvrPiz-t能干扰APIP6和APIP10的E3泛素连接酶活性并促进其的降解, 从而抑制水稻的PTI反应[25-26]。我们的前期研究结果显示南方根结线虫的效应蛋白同样能与植物E3泛素连接酶进行互作, 本研究通过室内人工接种试验也证实沉默烟草NbE3R14能增加其对线虫的敏感性, 因此我们推测, 线虫同样能利用E3泛素连接酶调节寄主植物免疫, 然而具体的互作分子机制仍有待进一步深入研究。
本研究首次证实烟草E3泛素连接酶NbE3R14参与调节植物基础免疫反应, 在烟草与疫霉及南方根结线虫的亲和互作过程中均发挥作用, 为进一步揭示不同病原物利用类似植物靶标抑制植物免疫从而促进自身寄生的机制打下基础。
| [1] |
Jones M G K, Goto D B. Root-knot nematodes and giant cells[M]//Jones J T, Gheysen G, Fenoll C.Genomics and Molecular Genetics of Plant-Nematode Interactions. Heidelberg: Springer, 2011: 83-100.
|
| [2] |
Caillaud M C, Dubreuil G, Quentin M, et al. Root-knot nematodes manipulate plant cell functions during a compatible interaction[J]. Journal of Plant Physiology, 2008, 165(1): 104-113. DOI:10.1016/j.jplph.2007.05.007 |
| [3] |
Xue B Y, Hamamouch N, Li C Y, et al. The 8D05 parasitism gene of Meloidogyne incognita is required for successful infection of host roots[J]. Phytopathology, 2013, 103(2): 175-181. DOI:10.1094/PHYTO-07-12-0173-R |
| [4] |
Lin B R, Zhuo K, Chen S Y, et al. A novel nematode effector suppresses plant immunity by activating host reactive oxygen species-scavenging system[J]. New Phytologist, 2016, 209(3): 1159-1173. DOI:10.1111/nph.13701 |
| [5] |
Zeng L R, Vega-Sánchez M E, Zhu T, et al. Ubiquitination-mediated protein degradation and modification:an emerging theme in plant-microbe interactions[J]. Cell Research, 2006, 16(5): 413-426. DOI:10.1038/sj.cr.7310053 |
| [6] |
Morreale F E, Walden H. SnapShot:types of ubiquitin ligases[J]. Cell, 2016, 165(1): 248. DOI:10.1016/j.cell.2016.03.003 |
| [7] |
Zhou B J, Zeng L R. The tomato U-box type E3 ligase PUB13 acts with group Ⅲ ubiquitin E2 enzymes to modulate FLS2-mediated immune signaling[J]. Frontiers in Plant Science, 2018, 9: 615. DOI:10.3389/fpls.2018.00615 |
| [8] |
Park J J, Yi J, Yoon J, et al. OsPUB15, an E3 ubiquitin ligase functions to reduce cellular oxidative stress during seedling establishment[J]. The Plant Journal, 2011, 65(2): 194-205. DOI:10.1111/j.1365-313X.2010.04416.x |
| [9] |
Li W, Zhong S H, Li G J, et al. Rice RING protein OsBBI1 with E3 ligase activity confers broad-spectrum resistance against Magnaporthe oryzae by modifying the cell wall defence[J]. Cell Research, 2011, 21(5): 835-848. DOI:10.1038/cr.2011.4 |
| [10] |
Dubreuil G, Magliano M, Dubrana M P, et al. Tobacco rattle virus mediates gene silencing in a plant parasitic root-knot nematode[J]. Journal of Experimental Botany, 2009, 60(14): 4041-4050. DOI:10.1093/jxb/erp237 |
| [11] |
Stam R, Howden A J M, Delgado-Cerezo M, et al. Characterization of cell death inducing Phytophthora capsici CRN effectors suggests diverse activities in the host nucleus[J]. Frontiers in Plant Science, 2013, 4: 387. |
| [12] |
Zhong C, Ren Y J, Qi Y T, et al. PAMP-responsive ATL gene StRFP1 and its orthologue NbATL60 positively regulate Phytophthora infestans resistance in potato and Nicotiana benthamiana[J]. Plant Science, 2018, 270: 47-57. DOI:10.1016/j.plantsci.2018.01.016 |
| [13] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [14] |
Yu X L, Tang J L, Wang Q Q, et al. The RxLR effector Avh241 from Phytophthora sojae requires plasma membrane localization to induce plant cell death[J]. New Phytologist, 2012, 196(1): 247-260. DOI:10.1111/j.1469-8137.2012.04241.x |
| [15] |
Chi Y K, Wang X, Le X H, et al. Exposure to double-stranded RNA mediated by tobacco rattle virus leads to transcription up-regulation of effector gene Mi-vap-2 from Meloidogyne incognita and promotion of pathogenicity in progeny[J]. International Journal for Parasitology, 2016, 46(2): 105-113. DOI:10.1016/j.ijpara.2015.09.006 |
| [16] |
Bybd D W, Kirkpatrick T, Barker K R. An improved technique for clearing and staining plant tissues for detection of nematodes[J]. Journal of Nematology, 1983, 15(1): 142-143. |
| [17] |
McClure M A, Kruk T H, Misaghi I. A method for obtaining quantities of clean Meloidogyne eggs[J]. Journal of Nematology, 1973, 5(3): 230. |
| [18] |
Lee H K, Cho S K, Son O, et al. Drought stress-induced Rma1H1, a RING membrane-anchor E3 ubiquitin ligase homolog, regulates aquaporin levels via ubiquitination in transgenic Arabidopsis plants[J]. Plant Cell, 2009, 21(2): 622-641. DOI:10.1105/tpc.108.061994 |
| [19] |
Marino D, Peeters N, Rivas S. Ubiquitination during plant immune signaling[J]. Plant Physiology, 2012, 160(1): 15-27. DOI:10.1104/pp.112.199281 |
| [20] |
Lu D, Lin W, Gao X, et al. Direct ubiquitination of pattern recognition receptor FLS2 attenuates plant innate immunity[J]. Science, 2011, 332(6036): 1439-1442. DOI:10.1126/science.1204903 |
| [21] |
Wang Y S, Pi L Y, Chen X H, et al. Rice XA21binding protein 3 is a ubiquitin ligase required for full Xa21-mediated disease resistance[J]. Plant Cell, 2006, 18(12): 3635-3646. DOI:10.1105/tpc.106.046730 |
| [22] |
Wang J, Qu B Y, Dou S J, et al. The E3 ligase OsPUB15 interacts with the receptor-like kinase PID2 and regulates plant cell death and innate immunity[J]. BMC Plant Biology, 2015, 15(1): 49-63. DOI:10.1186/s12870-015-0442-4 |
| [23] |
Serrano M, Guzmán P. Isolation and gene expression analysis of Arabidopsis thaliana mutants with constitutive expression of ATL2, an early elicitor-response RING-H2 zinc-finger gene[J]. Genetics, 2004, 167(2): 919-929. DOI:10.1534/genetics.104.028043 |
| [24] |
Gilroy E M, Taylor R M, Hein I, et al. CMPG1-dependent cell death follows perception of diverse pathogen elicitors at the host plasma membrane and is suppressed by Phytophthora infestans RXLR effector AVR3a[J]. New Phytologist, 2011, 190(3): 653-666. DOI:10.1111/j.1469-8137.2011.03643.x |
| [25] |
Ishikawa K, Yamaguchi K, Sakamoto K, et al. Bacterial effector modulation of host E3 ligase activity suppresses PAMP-triggered immunity in rice[J]. Nature Communications, 2014, 5: 5430. DOI:10.1038/ncomms6430 |
| [26] |
Park C H, Shirsekar G, Bellizzi M, et al. The E3 ligase APIP10 connects the effector AvrPiz-t to the NLR receptor Piz-t in rice[J]. PLoS Pathogens, 2016, 12(3): e1005529. DOI:10.1371/journal.ppat.1005529 |




