文章信息
- 林强, 郑燕梅, 谢鸿光, 蔡秋华, 王颖姮, 张建福
- LIN Qiang, ZHENG Yanmei, XIE Hongguang, CAI Qiuhua, WANG Yingheng, ZHANG Jianfu
- 水稻CMS-WA育性对播栽温度敏感性分析
- Analysis of the fertility sensitivity to temperatures of sowing dates of CMS-WA in rice
- 南京农业大学学报, 2020, 43(1): 18-25
- Journal of Nanjing Agricultural University, 2020, 43(1): 18-25.
- http://dx.doi.org/10.7685/jnau.201904044
-
文章历史
- 收稿日期: 2019-04-22
2. 农业农村部华南杂交水稻种质创新与分子育种重点实验室/福州(国家)水稻改良分中心/福建省作物分子育种工程实验室/福建省水稻分子育种重点实验室/福建省作物种质创新与分子育种省部共建国家重点实验室培育基地/杂交水稻国家重点实验室华南研究基地, 福建 福州 350003;
3. 水稻国家工程实验室, 福建 福州 350003
2. Key Laboratory of Germplasm Innovation and Molecular Breeding of Hybrid Rice for South China, Ministry of Agriculture and Rural Affairs/Fuzhou Branch, National Rice Improvement Center of China/Fujian Engineering Laboratory of Crop Molecular Breeding/Fujian Key Laboratory of Rice Molecular Breeding/Incubator of National key Laboratory of Fujian Germplasm Innovation and Molecular Breeding between Fujian and Ministry of Sciences and Technology, China/South China Bases of National Key Laboratory of Hybrid Rice for China, Fuzhou 350003, China;
3. National Rice Engineering Laboratory of China, Fuzhou 350003, China
籼型杂交稻三系不育系以野败型(wild abortion type, WA)细胞质质源为主, 多年来以其配制的组合应用面积在生产上处于主导地位[1]。大多数细胞质源不育系的恢保关系与野败型相似或者相同, 且同属于孢子体不育, 可归为同一遗传类型[2-5]。Luo等[6]研究发现冈型(Gambiaka type, G)、印尼水田谷型(Indonesian paddy type, ID)、矮败型(dwarf abortion type, DA)等不育系含有核质互作不育关键基因WA352, 表明它们与WA型属同一细胞质雄性不育性(cytoplamic male sterility, CMS)类型。Luan等[7]对ID型、K型(K type, K)、G型、D型(Dissi type, D)、DA型的细胞质mtDNA的位点序列进行比较, 推断其细胞质都来源于WA型。野败型细胞质雄性不育性和恢复性除了受2对主效基因控制, 还可能受微效基因的修饰作用[8-10]。研究发现CMS-WA育性的恢复由1个主效QTL和3个微效QTL控制, 存在累加和互作效应[11]。李广贤等[12]则指出, Rf4具主效效应, Rf3效应较大, 而qRf10和qRf11表现出微效作用。水稻CMS的育性表达存在一定的不育基因遗传不稳定性[13], 表现为质量-数量性状特征, 不同微效QTL与遗传背景有关[14]。雷捷成等[15]发现在转育CMS-WA的花粉育性中存在隐性的恢复基因, 即微效恢复基因。微效恢复基因受隐性多基因控制, 表型为转育CMS-WA的花粉黑染特征, 由于育性反复而出现的可育粉囊花药为嵌合颖花, 育性波动大的不育系花药常出现嵌合体, 是微效恢复基因的表现型[16]。进一步研究发现, 嵌合颖花率适合作为微效恢复基因遗传分析的量化指标[17-18]。每个花粉育性位点均可导致不育系败育不彻底, 表达效应较小, 为微效基因, 多数显示隐性或部分隐性[19]。
龙特浦A、京福1A、珍汕97A不育系微效恢复基因数不同, 比例近似为5 : 3 : 1[16, 18]。黑染花粉粒的出现与微效恢复基因有关, 导致不育系自交结实, 从而产生杂株[18]。不育系花粉育性的波动是内部因素微效恢复基因和环境等外部因素共同作用的结果, 黑染花粉和嵌合颖花的出现频率、程度与环境和遗传互作有关[13]。由于WA型不育系龙特浦A微效恢复基因数较多, 受环境影响育性波动大, 许多学者以此为材料进行研究。高恒广等[20]认为该不育系育性不稳定, 具有光温敏特性。龙特浦A幼穗分化敏感期温度处于25~28.5 ℃, 黑染花粉率较高; 高于28.5 ℃或低于25 ℃, 花粉黑染率低, 自交不结实[21-22]。黄荣华[23]研究认为龙特浦A抽穗前15 d日平均温度高于28.5 ℃时, 不育较彻底, 日均温低于28.5 ℃, 则转为部分可育。在人工气候箱中, 温度越高, 花粉黑染率越高, 而在自然环境下, 高温并不导致龙特浦A花粉育性恢复, 且花粉减数分裂期日均温在25~27 ℃时, 花粉黑染率高, 小于25 ℃或大于27 ℃时, 花粉黑染率低[24]。而郑秀平等[25]研究认为温度与龙特浦A黑染花药率相关因素中, 抽穗前15 d日平均温度通径系数为正值, 表现正效应, 且温度在26~29 ℃花粉黑染率低, 过高、过低均不利于制繁种。可见花粉育性恢复与温度的关系, 前人研究结论并不一致, 育性变化的临界温度及相应的敏感期尚无定论。
不育基因存在一定的遗传不稳定性, 除受主效恢复基因控制外, 还受微效恢复基因影响, 而水稻不育系的育性表达, 与遗传因子和环境因素密切相关。近年来, 日照长度和温度对水稻两系不育系育性表达效应的影响研究较为系统, 而针对三系主要类型CMS-WA, 未见应用微效恢复基因与温度效应分析水稻CMS-WA的育性敏感性的研究报道。本试验以CMS-WA为材料构建遗传群体, 通过设置不同播栽温度(从播种至移栽时期的平均温度), 构成自然压力梯度, 探讨水稻微效恢复基因和播栽温度之间的互作以及对CMS-WA育性的影响, 该结果对不育系和保持系的提纯、遗传改良及生产制种具有指导和参考作用。
1 材料与方法 1.1 试验材料以微效恢复基因数不同野败型不育系珍汕97A(B)、龙特浦A(B)、京福1A(B)为研究材料构建遗传群体, 设珍汕97A的基因型为(S)f1f1f2f2r1rl, 京福1A的基因型为(S)f1f1f2f2r1rlr2r2r3r3, 龙特浦A的基因型为(S)f1f1f2f2r1rlr2r2r3r3r4r4r5r5[16, 18]。珍汕97A(B)、龙特浦A(B)不育系已引进20多年, 确切世代无从查考, 本试验所用株系至少已达BC20代, 京福1A(B)为本团队自育, 选用BC18代的株系在严格隔离网室中经遗传提纯处理, 并在低温冷库中保存。试验在福建省农业科学院水稻研究所农场网室(E119°21', N26°00', 海拔17 m)进行, 试验小区面积为200 m2, 土质为沙质壤土, 土壤肥力中等, 前茬为花椰菜。
1.2 试验方法2017年3—7月共分5个播栽期, 每月12日播种1期, 秧龄25 d, 单本栽插, 每期每处理不育系种植30株, 株、行距均为16.7 cm, 随机排列, 3次重复, 参照大田常规栽培方式管理。各不育系于抽穗时分别进行黑染花粉率和嵌合颖花率检测。黑染花粉率考查方法:从稻穗上、中、下部取颖花3朵, 用镊子夹出小花的6枚花药, 经1%I2-KI溶液染色, 挤出花粉粒, 在4×10倍生物显微镜下镜检, 计数黑染花粉的百分率。嵌合颖花率考查方法:将稻穗颖花中的6枚花药剥开观察, 全部为典型水渍状瘦小乳白色花药的为不育颖花, 只要出现有黄色饱满的花药即为嵌合颖花, 计数嵌合颖花的百分率。
1.3 数据统计分析采用Excel 2016软件先经平方根反正弦转换, 然后采用DPS软件进行方差、回归模型和AMMI模型分析。回归方程数学模型为:

|
式中:X表示播栽温度; Y表示不育性指标值; a是二次项系数, b是一次项系数, c是常数。根据一元二次函数的极值进行参数寻优。参照陶华等[26]的方法, AMMI模型公式为:
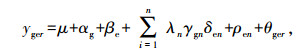
|
式中:yger是在环境e下基因型g的r次重复的观察值, μ是观察值的总平均, αg和βe分别是基因型主效应和环境型主效应, λn是第n个主成分分析的特征根, γgn是第n个主成分的基因型g的特征向量值, δen是第n个主成分的环境e的特征向量值, n是模型主成分分析中主成分因子轴的总个数, ρen为残差, θger为试验误差。稳定性参数(Di)是指特定基因型在IPCA空间中离原点的距离, 其计算公式为:
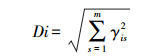
|
式中:γis指基因型i在第s个IPCA上的得分。
2 结果与分析 2.1 不同播栽期不育系的有效积温与播始历期根据福州市气象资料, 5个播栽温度分别为16.8、21.2、24.5、27.3、30.1 ℃。不同播栽期不育系的有效积温(播种至始穗日平均温度超过10 ℃的温度总和)与播始历期(播种至始穗的天数)变化幅度较大, 珍汕97A有效积温819.0~1 235.5 ℃, 播始历期63~90 d; 龙特浦A有效积温926.0~1 436.0 ℃, 播始历期78~98 d; 京福1A有效积温899.0~1 302.9 ℃, 播始历期67~95 d。同一播栽期的播始历期龙特浦A最长, 京福1A次之, 珍汕97A最短。从图 1可以看出, 随着播栽期的推迟, 不育系播始历期呈明显缩短的趋势, 生育进程加快, 表现出明显的感温性。各不育系的播始历期和有效积温均随播栽期的推迟总体呈先升后降趋势, 播始历期有效积温从多到少依次为:龙特浦A、京福1A、珍汕97A。播栽期7月12日有效积温减少的主要原因可能与不育系前期营养生长温度高, 较快进入生殖期有关。可见, 温度条件是导致不育系生育期长短的主要因素。

|
图 1 3个不育系在福州不同播栽期下播始历期和有效积温的变化 Fig. 1 Changes of period from seeding to heading and effective accumulated temperature of three CMS(cytoplasmic male sterility)lines at different sowing dates in Fuzhou |
由图 2可知, 随着播栽温度的上升, 3个不育系的黑染花粉率均呈上升趋势, 在播栽温度30.1 ℃时最高。龙特浦A黑染花粉率最高, 其次是京福1A, 珍汕97A最低。

|
图 2 不同播栽温度对不育系黑染花粉率和嵌合颖花率的影响 Fig. 2 Effect of different temperature of sowing dates treatments on dark pollen rate by I2-IK dyed and rate of florets with fertile anthers in CMS lines |
双因素方差分析表明(表 1), 具有不同微效恢复基因数的不育系间黑染花粉率差异达到极显著水平, 播栽温度之间黑染花粉率差异达到显著水平, 而不育系与播栽温度的互作效应未达到显著水平。可见交互作用不明显, 而主效应明显, 说明不同播栽温度对不同不育系产生黑染花粉率的效应不同。为此, 对各不育系进行单因素方差分析, 龙特浦A的F值=6.79**, 差异极显著, 对播栽温度响应明显, 随着播栽温度升高, 黑染花粉率呈极显著增加趋势。而京福1A和珍汕97A的F值均不显著。
| 变异来源 Source of variance |
黑染花粉率 Dark pollen rate by I2-IK dyed |
嵌合颖花率 Rate of florets with fertile anthers |
|||||||
| 自由度Table4DF | 平方和Table4SS | 均方Table4MS | F | 自由度Table4DF | 平方和Table4SS | 均方Table4MS | F | ||
| 不育系CMS lines(A) | 2 | 572.27 | 286.13 | 40.36** | 2 | 654.80 | 327.40 | 42.26** | |
| 播栽温度Temperature of sowing date(B) | 4 | 135.04 | 33.76 | 4.76* | 4 | 259.55 | 64.89 | 9.17** | |
| A×B | 8 | 56.69 | 7.09 | 1.27 | 8 | 56.62 | 7.08 | 0.40 | |
| 误差Error | 30 | 167.79 | 5.59 | 30 | 529.71 | 17.66 | |||
| 注:*P < 0.05, **P < 0.01.下同The same below. | |||||||||
随播栽温度上升, 3个不育系的嵌合颖花率均呈上升趋势(图 2), 在29.9 ℃时最高, 龙特浦A达19.4%, 京福1A为17.4%, 珍汕97A仅7.9%。龙特浦A嵌合颖花率最高, 其次是京福1A, 珍汕97A最低。
双因素方差分析表明(表 1), 含有不同微效恢复基因数的不育系间嵌合颖花率差异极显著, 播栽温度之间嵌合颖花率差异极显著, 而不育系与播栽温度的相互效应不显著。说明不同不育系嵌合颖花率对播栽温度的反应不同。经多重比较分析, 京福1A与龙特浦A嵌合颖花率差异不显著, 珍汕97A与京福1A、龙特浦A差异显著。对各不育系进行单因素方差分析, 京福1A和珍汕97A的F值均不显著, 龙特浦A的F值=7.56**, 差异极显著, 表明随着播栽温度升高, 嵌合颖花率极显著增加。
2.3 不同播栽温度下不育性指标的模型参数优化含有不同微效恢复基因数的不育系不育性指标与播栽温度的关系可用开口向上的一元二次方程模拟。从表 2可见, 京福1A的黑染花粉率和嵌合颖花率、龙特浦A的嵌合颖花率拟合度较好, 均达到显著水平(P < 0.05)。根据相应的回归方程, 绘制不育性指标与温度互作动态拟合图(图 3), 可见不同微效基因型不育系对播栽温度反应的数量特征差异。在试验处理温度范围内, 珍汕97A黑染花粉率和嵌合颖花率与播栽温度的关系均为二次抛物线形式, 随温度上升, 不育性指标数值呈先降后升趋势。京福1A、龙特浦A的黑染花粉率和嵌合颖花率随播栽温度上升均呈平方形式加剧, 表现显著正向效应。
| 不育系CMS lines | 不育性指标/% Sterility indexes | 拟合方程Fitting equation | R2 | Tmax/℃ | SImax/% | Tmin/℃ | SImin/% |
| 珍汕97A Zhenshan 97A |
黑染花粉率 Dark pollen rate by I2-IK dyed |
Y=0.005 6X2-0.217 5X+3.285 | 0.742 0 | 30.1 | 1.79 | 19.5 | 1.16 |
| 嵌合颖花率 Rate of florets with fertile anthers |
Y=0.041 8X2-1.764 0X+22.960 | 0.932 0 | 30.1 | 7.78 | 21.1 | 4.37 | |
| 龙特浦A Longtepu A |
黑染花粉率 Dark pollen rate by I2-IK dyed |
Y=0.041 3X2-1.387 0X+18.468 | 0.913 0 | 30.1 | 14.10 | 16.8 | 6.81 |
| 嵌合颖花率 Rate of florets with fertile anthers |
Y=0.044 7X2-1.552 9X+25.369 | 0.971 4* | 30.1 | 19.10 | 17.4 | 11.88 | |
| 京福1A Jingfu 1A |
黑染花粉率 Dark pollen rate by I2-IK dyed |
Y=0.019 4X2-0.435 3X+6.461 | 0.977 7* | 30.1 | 10.90 | 16.8 | 4.62 |
| 嵌合颖花率 Rate of florets with fertile anthers |
Y=0.039 4X2-1.124 0X+15.241 | 0.950 2* | 30.1 | 17.13 | 16.8 | 7.48 | |
| 注: T:播栽温度Temperature of sowing date; SI:不育性指标Sterility indexes; Tmax、SImax、Tmin、SImin:播栽温度理论最大值或最小值及其对应的SI值Theoretical maximum or minimum and its SI value for temperature of sowing dates. | |||||||
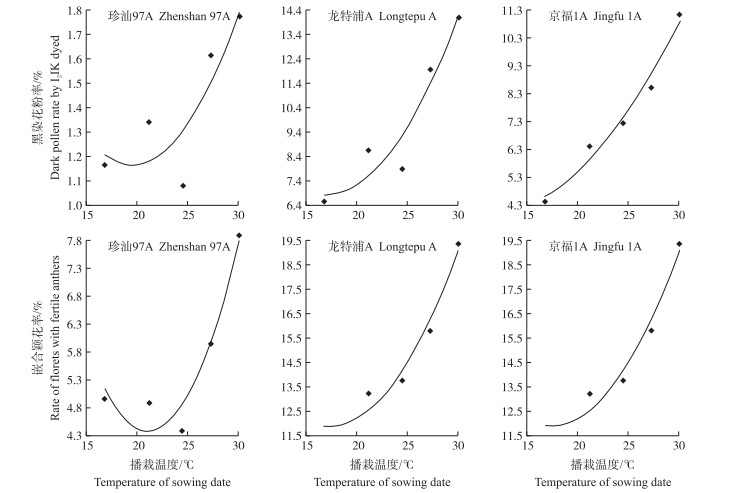
|
图 3 不同播栽温度下不育性指标的模拟图 Fig. 3 Simulation of sterility indexes by different temperatures of sowing dates |
从表 2可见, 黑染花粉率的理论最大值和最小值以龙特浦A均为最大, 京福1A次之, 珍汕97A最小, 各个不育系嵌合颖花率的理论最大值和最小值变化规律与黑染花粉率大致相同。结合不育系的生育期, 说明在一定范围内温度能提高不育系黑染花粉率和嵌合颖花率, 表现正效应。
2.4 不同基因型不育系育性对播栽温度的敏感性AMMI模型可以显示各不育系在不同播期下花粉育性的动态变化, 反映基因型与环境互作的特点[26]。不育系黑染花粉率和嵌合颖花率的AMMI模型分析表明, 基因型、播栽温度效应F值均极显著或显著(表 3)。黑染花粉率和嵌合颖花率基因型SS分别占总SS的74.89%和67.34%, 说明基因型差异是主要的影响因素。播栽温度SS分别占总SS的18.01%和26.74%, 具有明显效应。嵌合颖花率互作项IPCA1的均方(MS)呈显著水平, 且2个育性指标的IPCA1的变异平方和分别占交互作用的92.01%和93.75%。
| 变异来源 | 自由度 DF |
黑染花粉率/% Dark pollen rate by I2-IK dyed |
嵌合颖花率/% Rate of florets with fertile anthers |
|||||
| SS | MS | F | SS | MS | F | |||
| 总Tatal | 14 | 254.84 | 18.20 | 323.75 | 23.13 | |||
| 基因型Genotype | 2 | 190.84 | 95.42 | 189.44** | 218.32 | 109.16 | 277.68** | |
| 播栽温度Temperature of sowing date | 4 | 45.09 | 11.27 | 22.38* | 86.57 | 21.64 | 55.05** | |
| G×E | 8 | 18.91 | 2.36 | 4.69 | 18.87 | 2.36 | 6.00 | |
| IPCA1 | 5 | 17.40 | 3.48 | 6.91 | 17.69 | 3.54 | 9.00* | |
| 误差Error | 3 | 1.51 | 0.50 | 1.18 | 0.39 | |||
| 注: G:基因型Genotype; E:播栽温度条件的环境因素Environmental factor under temperature of sowing date. IPCA1:互作效应主成分轴Interaction principal component axis. | ||||||||
基因型主效应值可以判别不育系育性相对稳定性, 播栽温度从主效应进行分析, 珍汕97A黑染花粉率和嵌合颖花率分别为1.398%、5.628%, 相对较低, 表明不育性稳定; 龙特浦A、京福1A黑染花粉率和嵌合颖花率分别为9.836%和7.580%、14.788%和11.810%, 均较高, 表明不育性较不稳定。3个不育系按不育性稳定性从大到小依次为珍汕97A、京福1A、龙特浦A。
基因型和播栽温度在IPCA1的得分见表 4。基因型IPCA1值可以反映不育系对环境影响的敏感性, 珍汕97A黑染花粉率和嵌合颖花率的基因型IPCA1分别为-1.632、-1.512, 为负数, 说明其花粉育性对播栽温度敏感度小。龙特浦A、京福1A黑染花粉率和嵌合颖花率的基因型IPCA1分别为1.114和0.518、0.133和1.379, 均为正数且数值相对较大, 说明其花粉育性对播栽温度敏感度大。播栽温度IPCA1互作值大小, 一定程度上反映其对花粉育性的影响, 效应值越小, 表明不育性越稳定。随着播栽温度升高, 黑染花粉率的IPCA1值从-1.175上升至1.433, 嵌合颖花率的IPCA1值从-1.257上升至1.172, 其变化趋势反映出播栽温度越高, 不育性越不稳定。从互作效应进行分析, 当基因型和播栽温度同为正或同为负的效应值时, 基因型与播栽温度呈正向互作, 而两者正负相反时为负向互作。在16.8、21.2、24.5 ℃较低温度下, 珍汕97A基因型IPCA1值和播栽温度IPCA1值均为负, 表现为正向互作效应, 随着播栽温度升高, 播栽温度IPCA1值转为正值, 因而在较高温度下表现负向互作; 龙特浦A和京福1A基因型IPCA1值在16.8、21.2 ℃较低温度下为正值, 而其播栽温度IPCA1值为负, 表现为负向互作效应, 随着播栽温度升高, 龙特浦A、京福1A基因型和播栽温度IPCA1值均为正值, 表现正向互作。
| 不育系或播栽温度 CMS lines or temperature of sowing date |
黑染花粉率/% Dark pollen rate by I2-IK dyed |
嵌合颖花率/% Rate of florets with fertile anthers |
|||
| 平均花粉可育度 Mean pollen fertility |
IPCA1 | 平均花粉可育度 Mean pollen fertility |
IPCA1 | ||
| 珍汕97A Zhenshan 97A | 1.398 | -1.632 | 5.628 | -1.512 | |
| 龙特浦A Longtepu A | 9.836 | 1.114 | 14.788 | 0.133 | |
| 京福1A Jinfu 1A | 7.580 | 0.518 | 11.810 | 1.379 | |
| 16.8 ℃ | 4.057 | -1.175 | 8.067 | -1.257 | |
| 21.2 ℃ | 5.477 | -0.434 | 8.903 | -0.856 | |
| 24.5 ℃ | 5.423 | -0.427 | 10.267 | 0.668 | |
| 27.3 ℃ | 7.383 | 0.603 | 11.557 | 0.271 | |
| 30.1 ℃ | 9.017 | 1.433 | 14.917 | 1.172 | |
珍汕97A不育系中微效恢复基因数较少, 黑染花粉率和嵌合颖花率较低, 花粉不育性对播栽温度的反应不敏感, 因此不育性稳定; 而龙特浦A和京福1A中微效恢复基因数较多, 花粉不育性指标平均值较高, 对播栽温度变化相对敏感, 不育性不稳定。这与游年顺等[16]、林强等[18]的试验结果一致。郑秀萍等[25]的研究结果也表明, 在一定范围内温度能提高不育系黑染花粉率和嵌合颖花率, 表现正效应。由于育性遗传受微效恢复基因干扰, 其结果表现为不育系花粉嵌合现象, 出现嵌合花粉越多说明细胞核中微效恢复基因数越多, 不育性越不稳定, 对环境因素中温度也越敏感, 而且微效恢复基因具有累加效应, 因此选育不育系时适宜在低代进行排除, 进入高代之后排除就愈加困难。根据温度对不育系育性影响的变化规律, 在大面积生产上, 尤其是对播栽温度敏感的不育系, 可以采取早季繁殖、早季制种的措施, 保证种子纯度。
温度是影响不育系不育性的重要环境因素, 三系不育系在自然条件下的育性差异因生态条件和应用的不育性指标而有所不同。在特定条件下黑染花粉率与结实率不存在显著相关性[27], 高温胁迫阻碍花粉成熟与花药开裂, 并阻碍花粉在柱头上发芽、花粉管伸长, 其结果引起不受精, 造成不育[28], 这与微效恢复基因与温度互作导致不育性不稳定的作用机制有所不同。避开高温高湿等胁迫因素, 在一定范围内温度能提高不育系黑染花粉率和嵌合颖花率, 表现正效应。温度过高过低, 均不利于种子纯度和生产。本试验中播栽期在操作上可控, 而且气候时间序列的"记忆性"好[29], 播栽温度年际间变化相对较小, 所获得的回归方程具有一定可靠性和实用性。京福1A播栽温度与不育性指标值显著相关, 方程拟合度较好, 适宜在30.1 ℃提纯不育系, 在16.8 ℃繁殖制种。珍汕97A未达显著水平, 但相关程度高, 拟合方程仍具有一定的参考意义。
三系不育系的不育性表达, 不仅受微效恢复基因表达影响, 还与环境因素有关, 含有不同微效恢复基因数的不育系对播栽温度的反应并非简单的线性关系, 因此正确估算互作效应值必不可少。基因型与温度互作分析可以显示不育系在不同播栽期下花粉育性的动态变化规律, 研究三系不育系的感温和感光特性, 可以借鉴两系不育系的研究方法, 严格控制环境因素, 可获得较理想的效果。
| [1] |
曾千春, 周开达, 朱祯, 等. 中国水稻杂种优势利用现状[J]. 中国水稻科学, 2000, 14(4): 243-246. Zeng Q C, Zhou K D, Zhu Z, et al. Current status in the use of hybrid rice heterosis in China[J]. Chinese Journal of Rice Science, 2000, 14(4): 243-246 (in Chinese with English abstract). DOI:10.3321/j.issn:1001-7216.2000.04.012 |
| [2] |
Duroc Y, Gaillard C, Hiard S, et al. Nuclear expression of a cytoplasmic male sterility gene modifies mitochondrial morphology in yeast and plant cells[J]. Plant Sci, 2006, 170(4): 755-767. DOI:10.1016/j.plantsci.2005.11.008 |
| [3] |
富昊伟, 薛庆中. 三种水稻胞质雄性不育恢复基因的比较[J]. 分子植物育种, 2004, 2(3): 336-341. Fu H W, Xue Q Z. Analysis of restoring genes of three type of cytoplasmic male sterility in rice[J]. Molecular Plant Breeding, 2004, 2(3): 336-341 (in Chinese with English abstract). DOI:10.3969/j.issn.1672-416X.2004.03.006 |
| [4] |
Lee D S, Chen L J, Suh H S. Genetic characterization and fine mapping of a novel thermo-sensitive genic male-sterile gene tms6 in rice(Oryza sativa L.)[J]. Theoretical and Applied Genetics, 2005, 111(7): 1271-1277. DOI:10.1007/s00122-005-0044-x |
| [5] |
Tao D Y, Xu P, Li J, et al. Inheritance and mapping of male sterility restoration gene in upland japonica restorer lines[J]. Euphytica, 2004, 138(3): 247-254. DOI:10.1023/B:EUPH.0000047090.59320.a3 |
| [6] |
Luo D, Xu H, Liu Z, et al. A detrimental mitochondrial-nuclear interaction causes cytoplasmic male sterility in rice[J]. Nat Genet, 2013, 45(5): 573-577. DOI:10.1038/ng.2570 |
| [7] |
Luan J, Liu T R, Luo W Q, et al. Mitochondrial DNA genetic polymorphism in thirteen rice cytoplasmic male sterile lines[J]. Plant Cell Reports, 2013, 32(4): 545-554. DOI:10.1007/s00299-013-1386-5 |
| [8] |
张桂权, 卢永根. 水稻质核互作孢子体雄性不育性的基因分析[J]. 作物学报, 1987, 13(1): 23-28. Zhang G Q, Lu Y G. Genetic analysis for the cytoplasmic-nuclear sporophytic male sterility in rice[J]. Acta Agronomica Sinica, 1987, 13(1): 23-28 (in Chinese with English abstract). DOI:10.3321/j.issn:0496-3490.1987.01.004 |
| [9] |
杨华德, 陈芳远. 野败型杂交水稻不育性及恢复性的遗传研究[J]. 广西农学院学报, 1990, 9(2): 61-69. Yang H D, Chen F Y. A study on heredity of hibrid rice with wild abortive cytoplasm male sterility and restore character[J]. Journal of Guangxi Agricultural College, 1990, 9(2): 61-69 (in Chinese with English abstract). |
| [10] |
曾慧杰, 易自力, 蒋建雄, 等. 水稻雄性不育研究概况[J]. 湖南农业科学, 2006(3): 15-18. Zeng H J, Yi Z L, Jiang J X, et al. A research survey of male sterility in rice[J]. Hunan Agricultural Sciences, 2006(3): 15-18 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-060X.2006.03.007 |
| [11] |
庄杰云, 樊叶杨, 吴建利, 等. 水稻CMS-WA育性恢复基因的定位[J]. 遗传学报, 2001, 28(2): 129-134. Zhuang J Y, Fan Y Y, Wu J L, et al. Mapping genes for rice CMS-WA fertility restoration[J]. Acta Genetica Sinica, 2001, 28(2): 129-134 (in Chinese with English abstract). |
| [12] |
李广贤, 屠国庆, 张克勤, 等. 应用微卫星标记定位水稻恢复系密阳46的主效和微效恢复基因[J]. 中国水稻科学, 2005, 19(6): 506-510. Li G X, Tu G Q, Zhang K Q, et al. SSR marker-based mapping of fertility-restoring genes in rice restorer line Milyang 46[J]. Chinese Journal of Rice Science, 2005, 19(6): 506-510 (in Chinese with English abstract). DOI:10.3321/j.issn:1001-7216.2005.06.005 |
| [13] |
周天理, 郑秀萍, 陈金泉, 等. 水稻不育系中杂株的来源及遗传分析[J]. 作物学报, 1992, 18(1): 9-16. Zhou T L, Zheng X P, Chen J Q, et al. Studies on the origin and genetic analysis of abnormal plants appeared in MS lines of rice[J]. Acta Agronomica Sinica, 1992, 18(1): 9-16 (in Chinese with English abstract). DOI:10.3321/j.issn:0496-3490.1992.01.002 |
| [14] |
谢建坤, 舒庆尧, 陈大洲, 等. 水稻细胞质雄性不育育性恢复遗传研究[J]. 浙江大学学报(农业与生命科学版), 2002, 28(4): 373-378. Xie J K, Shu Q Y, Chen D Z. The inheritance of the fertility restoration of cytoplasmic male sterility in rice(Oryza sativa L.)[J]. Journal of Zhejiang Agricultural University(Agric. & Life Sci.), 2002, 28(4): 373-378 (in Chinese with English abstract). DOI:10.3321/j.issn:1008-9209.2002.04.006 |
| [15] |
雷捷成, 游年顺, 郑秀萍. 野败水稻雄性不育保持系选育的遗传分析[J]. 中国农业科学, 1984(5): 30-34. Lei J C, You N S, Zheng X P. Genetic analysis for breeding maintainer line of male sterility of wild rice with abortive pollen[J]. Scientia Agricultura Sinica, 1984(5): 30-34 (in Chinese with English abstract). |
| [16] |
游年顺, 黄利兴, 雷上平, 等. 水稻微效恢复基因与不育系选育研究[J]. 江西农业大学学报, 2003, 25(4): 487-492. You N S, Huang L X, Lei S P, et al. Rice mini-efficient restoring gene and practice for breeding male sterile line[J]. Acta Agriculturae Universitis Jiangxiensis, 2003, 25(4): 487-492 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-2286.2003.04.004 |
| [17] |
富昊伟, 李友发, 马兴华, 等. "三系"不育系微效恢复基因表现型研究[J]. 作物研究, 2010, 21(1): 8-11. Fu H W, Li Y F, Ma X H. Study on phenotype of restoring gene with minor effect in three-line sterile lines in rice(Oryza sativa L.)[J]. Crop Research, 2010, 21(1): 8-11 (in Chinese with English abstract). DOI:10.3969/j.issn.1001-5280.2010.01.003 |
| [18] |
林强, 郑燕梅, 张建福, 等. 水稻CMS-WA微效恢复基因的遗传分析[J]. 福建农业学报, 2013, 28(9): 872-875. Lin Q, Zheng Y M, Zhang J F, et al. Genetic analysis for minor effect restoring gene for CMS-WA in rice(Oryza sativa L.)[J]. Fujian Journal of Agricultural Sciences, 2013, 28(9): 872-875 (in Chinese with English abstract). DOI:10.3969/j.issn.1008-0384.2013.09.008 |
| [19] |
李新奇, Xu Yunbi, Xiao Jinhua, 等. 水稻质核互作雄性不育系的微效恢复基因定位和排除方法研究[J]. 杂交水稻, 2010, 25(S1): 276-281. Li X Q, Xu Y B, Xiao J H, et al. Studies on mapping and discarding of minor fertility genes in rice CMS lines[J]. Hybrid Rice, 2010, 25(S1): 276-281 (in Chinese). |
| [20] |
高恒广, 何顺椹, 杨立彬, 等. 三系不育系龙特浦A具有光温敏特性[J]. 杂交水稻, 1993(1): 44-45. Gao H G, He S S, Yang L B, et al. Long-Te-Pu A(a three-line sterile line) is characterized by its sensitivity to photoperiod and temperature[J]. Hybrid Rice, 1993(1): 44-45 (in Chinese). |
| [21] |
高明亮, 冯建成, 王雪珍, 等. 龙特浦A的利用及其改良研究[J]. 杂交水稻, 2001, 16(2): 5-6. Gao M L, Feng J C, Wang X Z, et al. Utilization of Longtepu A and its improvement[J]. Hybrid Rice, 2001, 16(2): 5-6 (in Chinese with English abstract). DOI:10.3969/j.issn.1005-3956.2001.02.002 |
| [22] |
郭建夫, 魏荷, 王丰青, 等. 龙特浦A在湛江的育性稳定性研究[J]. 安徽农业科学, 2007, 35(9): 2540-2542, 2559. Guo J F, Wei H, Wang F Q, et al. Study on the fertility stability of rice:Longtepu A in Zhanjiang[J]. Journal of Anhui Agricultural Sciences, 2007, 35(9): 2540-2542, 2559 (in Chinese with English abstract). DOI:10.3969/j.issn.0517-6611.2007.09.012 |
| [23] |
黄荣华. 环境因素对籼稻不育系龙特甫A育性稳定性的影响[J]. 福建稻麦科技, 1997, 15(4): 13-18. Huang R H. Effect of different environmental factors on male-fertility stability of Longtepu A CMS lines[J]. Fujian Science and Technology of Rice and Wheat, 1997, 15(4): 13-18 (in Chinese with English abstract). |
| [24] |
潘润森, 张功宙, 张轼, 等. 光周期和温度对水稻雄性不育系龙特浦A育性恢复的影响[J]. 福建农业大学学报, 1994, 23(3): 257-261. Pan R S, Zhang G Z, Zhang S, et al. Effect of photoperiod and temperature on pollen fertility restoration of cytoplasmic male sterile rice:Longtepu A[J]. Journal of Fujian Agricultural University(Natural Sciences Edition), 1994, 23(3): 257-261 (in Chinese with English abstract). |
| [25] |
郑秀萍, 周天理, 张功宙, 等. 龙特甫A杂株来源及其分析[J]. 杂交水稻, 1998, 13(1): 8-11. Zheng X P, Zhou T L, Zhang G Z, et al. Studies on the origin of extraneous plants in rice CMS line of Longtepu A[J]. Hybrid Rice, 1998, 13(1): 8-11 (in Chinese with English abstract). |
| [26] |
陶华, 薛庆中. 应用基因型与播期互作效应分析水稻光温敏核不育系对光周期和温度的育性敏感性[J]. 作物学报, 2005, 31(12): 1586-1592. Tao H, Xue Q Z. AMMI analysis of genotype by sowing date interaction reveals the fertility sensitivity to photoperiod and temperature of P(T) GMS rice[J]. Acta Agronomica Sinica, 2005, 31(12): 1586-1592 (in Chinese with English abstract). DOI:10.3321/j.issn:0496-3490.2005.12.010 |
| [27] |
徐海波, 王光明, 隗溟, 等. 高温胁迫下水稻花粉粒性状与结实率的相关分析[J]. 西南农业大学学报, 2001, 23(3): 205-207. Xu H B, Wang G M, Wei M, et al. Correlation analysis of the characters of pollen grains and seed-setting of rice under high temperature stress[J]. Journal of Southwest Agricultural University, 2001, 23(3): 205-207 (in Chinese with English abstract). DOI:10.3969/j.issn.1673-9868.2001.03.005 |
| [28] |
张桂莲, 陈立云, 张顺堂, 等. 高温胁迫对水稻花粉粒性状及花药显微结构的影响[J]. 生态学报, 2008, 28(3): 1089-1097. Zhang G L, Chen L Y, Zhang S T, et al. Effects of high temperature stress on pollen characters and anther microstructure of rice[J]. Acta Ecologica Sinica, 2008, 28(3): 1089-1097 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-0933.2008.03.023 |
| [29] |
时少英, 刘式达, 付遵涛, 等. 天气和气候的时间序列特征分析[J]. 地球物理学报, 2005, 48(2): 259-264. Shi S Y, Liu S D, Fu Z T, et al. The characteristic analysis of weather and climate time series[J]. Chinese Journal of Geophysics, 2005, 48(2): 259-264 (in Chinese). DOI:10.3321/j.issn:0001-5733.2005.02.004 |




