文章信息
- 余含, 戈贤平, 孙盛明, 朱健, 任鸣春, 张武肖, 苏艳莉, 米海峰
- YU Han, GE Xianping, SUN Shengming, ZHU Jian, REN Mingchun, ZHANG Wuxiao, SU Yanli, MI Haifeng
- 膨化饲料中蛋白水平对大规格鳙生长、消化酶活性和抗氧化能力的影响
- The effect of dietary protein level on the growth, digestive enzymes activities and antioxidant ability of the bighead carp (Aristichthys nobilis)
- 南京农业大学学报, 2019, 42(6): 1158-1166
- Journal of Nanjing Agricultural University, 2019, 42(6): 1158-1166.
- http://dx.doi.org/10.7685/jnau.201807009
-
文章历史
- 收稿日期: 2018-07-04
2. 中国水产科学研究院淡水渔业研究中心, 江苏 无锡 214081;
3. 通威股份有限公司水产研究所, 四川 成都 610041
2. Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization, Chinese Academy of Fishery Sciences, Wuxi 214081, China;
3. Institute of Fisheries, Tongwei Co. Ltd., Chengdu 610041, China
在水产养殖中, 饲料是水生动物摄取蛋白质的最佳来源, 而控制饲料成本的关键又在于饲料蛋白质水平[1]。蛋白质是水生动物的重要营养素[2-3], 饲料蛋白质水平过高会造成资源浪费、成本增加, 同时排出的氨类代谢物会污染养殖水体; 而饲料蛋白质水平过低则会阻碍生长, 严重时可导致死亡[4]。因此, 饲料蛋白水平的高低一方面决定了饲料的质量和成本[5], 另一方面又能反映鱼体对蛋白质的利用能力[6]。因此, 研究鱼体对蛋白质的适宜需求量是鱼类等水生动物对饲料蛋白吸收状况的反馈, 也是设计成本合理、配制均衡蛋白饲料配方的重要组成部分[7-9]。迄今, 有关蛋白需求量的研究在鲫(Carassius aurat)[10]、泥鳅(Carassius auratus)[11]、鲟(Acipenser sinensis)[12]、团头鲂(Megalobrama amblycephala)[13]、草鱼(Ctenopharyngodon idellus)[14]、大菱鲆(Scophthalmus maximus)[15]等鱼类中均有报道。传统养殖的鳙主要摄食浮游生物, 而鳙对蛋白需求量的研究鲜有报道。
鳙属鲤科(Cyprinidae), 是我国传统的“四大淡水鱼”之一。该种类分布广, 在我国从南到北淡水流域几乎都有养殖, 其头大、肉质鲜美, 具有极高的食用价值[16]和养殖前景[17]。混养为我国养殖鳙的首选方式, 这种方式虽然一定程度上减少了环境污染, 但在面对庞大的市场需求下, 高效低成本的人工配合饲料则成为提升养殖效率的关键。目前, 对鳙的研究主要集中在养殖方式[18]和生产质量[19]等方面, 而有关鳙配合饲料的研制[4]、饲料原料消化率分析[5]与生物饲料开发[20]的研究较少。优质的膨化饲料不仅具有易消化、易利用的特点, 而且膨化饲料在水中长时间漂浮且营养不易流失的特性适合于中上层群游的鳙摄食[21-22]。因此, 本试验利用膨化饲料探明适宜蛋白需求量, 为研发鳙配合饲料提供数据支撑。本试验以鳙为研究对象, 通过投喂6种不同蛋白梯度的膨化饲料, 研究不同蛋白水平饲料对鳙生长性能、肝脏抗氧化能力、肠道消化酶活性和血清生理生化指标的影响, 从而确定鳙人工配合饲料的最适蛋白需求量。
1 材料与方法 1.1 试验设计与饲料以秘鲁鱼粉和豆粕为蛋白源, 鱼油和大豆油为脂肪源制备6组不同蛋白水平的膨化饲料。饲料蛋白含量(质量分数)分别为20%、24%、28%、32%、36%和40%(实测值分别为21.0%、24.2%、27.0%、32.5%、36.8%和39.6%)。饲料配方和营养成分见表 1。饲料原料均购自无锡通威股份有限公司。所有原料粉碎后过250 μm筛, 将原料按配方称取混合, 混匀后依次加入鱼油、豆油混合均匀, 再加入16%(质量分数)的水揉匀, 使各原料充分混匀后, 最后用中型饲料膨化机(华强膨化机械JLY80M1-2)制成粒径2.0 mm的膨化饲料, 经50 ℃烘干后于-20 ℃冰柜中保存备用。
| 组成Composition | 饲料蛋白质水平/% Dietary protein level(Different groups) | |||||
| 20 | 24 | 28 | 32 | 36 | 40 | |
| 饲料组成Feed composition | ||||||
| 红鱼粉Red fish meal | 5 | 12 | 20 | 27 | 35 | 42 |
| 豆粕Soybean meal | 25 | 21 | 15 | 10 | 5 | 1 |
| 玉米蛋白粉Corn gluten meal | 2 | 5 | 8 | 11 | 14 | 16 |
| 棉粕Cottonseed meal | 2 | 2 | 2 | 2 | 2 | 2 |
| 小麦淀粉Wheat starch | 27 | 27 | 27 | 27 | 27 | 27 |
| 鱼油Fish oil | 2 | 2 | 2 | 2 | 2 | 2 |
| 豆油Soybean oil | 4.5 | 4.0 | 3.5 | 3.0 | 2.5 | 2.0 |
| 米糠Rice bran | 26.0 | 20.5 | 16.0 | 11.5 | 6.0 | 1.5 |
| 营养组成Nutrient compositions | ||||||
| 粗蛋白Crude protein | 21.0 | 24.2 | 27.0 | 32.5 | 36.8 | 39.6 |
| 粗脂肪Crude lipid | 6.8 | 7.0 | 6.9 | 6.5 | 6.5 | 6.8 |
| 灰分Ash | 10.10 | 9.87 | 10.20 | 12.00 | 12.20 | 12.20 |
| 水分Moisture | 9.59 | 7.88 | 9.07 | 10.04 | 11.25 | 11.66 |
| 消化能Digestible energy | 14.83 | 15.20 | 14.92 | 14.38 | 13.85 | 13.93 |
| 注: 1)各组均含维生素预混料、矿物质预混料、大豆磷脂、氯化胆碱、磷酸二氢钙、乙氧基喹啉:1%、2%、1%、0.15%、2.3%、0.05%。2)每千克维生素预混料含:维生素A, 900 000 IU; 维生素D, 250 000 IU; 维生素C, 5 000 mg; 维生素E, 4 500 mg; 维生素B2, 1 090 mg; 维生素K3, 220 mg; 维生素B12, 0.02 mg; 维生素B1, 320 mg; 维生素B6, 5 000 mg; 泛酸盐, 1 000 mg; 生物素, 50 mg; 叶酸, 165 mg; 烟酸, 2 500 mg; 胆碱, 60 000 mg。3)每千克矿物质预混料含:硫酸铜, 2.5 g; 硫酸铁, 28 g; 硫酸锌, 22 g; 硫酸锰, 9 g; 亚硒酸钠, 0.045 g; 碘化钾0.026 g; 氯化钴0.1 g。4)消化能为计算值(单位:kJ · g-1)[23]. Note: 1)Each group including vitamin premix, mineral premix, soybean phospholipids, choline chloride, ethoxyqui:1%, 2%, 1%, 0.15%, 2.3%, 0.05%. 2)Per kilogram vitamin premix contained:vitamin A, 900 000 IU; vitamin D, 250 000 IU; vitamin C, 5 000 mg; vitamin E, 4 500 mg; vitamin B2, 1 090 mg; vitamin K3, 220 mg; vitamin B12, 0.02 mg; vitamin B1, 320 mg; vitamin B6, 5 000 mg; pantothenate, 1 000 mg; biotin, 50 mg; folic acid, 165 mg; niacin acid, 2 500 mg; choline, 60 000 mg. 3)Per kilogram mineral contained:CuSO4 · 5H2O, 2.5 g; FeSO4 · 7H2O, 28 g; ZnSO4 · 7H2O, 22 g; MnSO4 · 4H2O, 9 g; Na2SeO3, 0.045 g; KI, 0.026 g; CoCl2 · 6H2O, 0.1 g. 4)Calculated digestible energy(the unit is kJ · g-1)[23]. | ||||||
试验用鱼购自无锡淡水渔业研究中心南泉水产养殖基地, 正式试验前先经过2周的暂养驯化, 然后挑选出体格健壮、规格一致、平均初始体质量为(174.57±1.49)g的鳙180尾, 随机分成6组, 每组3重复, 每个重复10尾鱼, 饲养于室内循环水养殖桶(550 L)中。采用室内循环水养殖系统(青岛中科海公司)养殖。整个试验周期均定时(08:00、11:30、16:00)采用饱食投喂, 每天收集残饵并记录实际投喂量, 试验期为8周。养殖水体溶解氧含量大于6.0 mg L-1, 水温(27.0±1.5)℃, pH 7.0~8.0, 铵态氮含量小于0.5 mg · L-1, 硝态氮含量小于0.06 mg · L-1, 光照周期为自然光照周期。
1.3 样品采集试验结束后饥饿24 h, 统计每桶鱼的数量并称质量, 计算增重率、特定生长率、成活率。统计摄食情况, 计算饲料效率、蛋白质效率和蛋白质保留率。对6个处理组54条鳙先取尾静脉血于抗凝管内, 7 500 r · min-1离心5 min后取血清分管保存在-20 ℃冰箱以备待测血清指标; 然后称体质量、量体长、解剖, 分离出肝胰脏、肠道, 再利用节点处的褶皱区将肠道分割成前肠(前1/6处取2 cm)、中肠(中3/6处取4 cm)和后肠(后2/6处取3 cm), 计算肝体指数、脏体指数和肥满度指数; 最后分别将肝脏和肠道分装5份, 于-80 ℃冰箱保存待测消化酶和抗氧化酶活性。
1.4 指标及测定 1.4.1 生长、形态学指标计算6个生长指标:增重率(weight gain rate, WG)、特定生长率(specific growth rate, SGR)、成活率(survival rate, SR)、饲料效率(feed efficiency rate, FER)、蛋白质保留率(protein retention efficiency, PRE)、蛋白质效率(protein efficiency ratio, PER); 3个形态学指标:肝体指数(hepatosomatic index, HSI)、脏体指数(viscera index, VI)、肥满指数(condition factor, CF)。

|
肝脏/肠道组织匀浆液的制备:准确称取肝脏、肠道(前、中、后)组织, 分别按质量(g) :体积(mL)=1 : 9和1 : 4的比例, 分别加入9倍体积和4倍体积的生理盐水, 冰水浴条件下机器匀浆, 制成10%和20%的组织匀浆, 2 500 r · min-1离心10 min, 取上清液, 分管保存于-80 ℃冰箱以备待测。
肝脏/肠道组织总蛋白含量测定:取10%组织匀浆的上清液用生理盐水按体积比1 : 9的比例稀释, 采用考马斯亮蓝试剂盒(南京建成生物工程研究所)测定肠道/肝脏组织总蛋白含量值。
肝脏抗氧化酶活性测定:超氧化物歧化酶(SOD)活性采用试剂盒微粒板法测定; 丙二醛(MDA)含量采用试剂盒TBA法测定; 过氧化氢酶(CAT)活性采用试剂盒可见光法测定。具体测定步骤均参照试剂盒(南京建成生物工程研究所)说明书进行。
肠道消化酶活性测定:脂肪酶活性采用微粒板法测定; 淀粉酶活性采用试剂盒碘-淀粉比色法测定; 蛋白酶活性则采用福林酚试剂法测定。具体测定步骤均参照试剂盒(南京建成生物工程研究所)说明书进行。
1.4.3 血清生化指标血清样品保存于-20 ℃冰箱, 利用上海执成生物科技有限公司试剂盒, 通过血液生化分析仪(BS-400 Q2080, 深圳迈瑞生物医疗电子股份有限公司)测定血清生化指标。
1.5 数据的统计与处理试验数据用SPSS 16.0进行单因素方差分析, 再用Duncan's多重比较法进行差异显著性分析。结果均用平均值±标准差(x±SD)来表示; 利用Excel 2013将饲料效率和特定生长率与蛋白水平之间的关系用二次曲线模型进行拟合。二次曲线模型在范围内取极大值作为最大蛋白含量。
2 结果与分析 2.1 不同蛋白水平饲料对鳙生长和饲料利用的影响如表 2所示:鳙在32%蛋白组中的增重率和特定生长率显著高于20%和24%蛋白组(P < 0.05)。鳙的肥满度在蛋白水平为24%时最高, 显著高于20%和28%蛋白组(P < 0.05)。而脏体指数和肝体指数在所有蛋白组中均无明显变化(P>0.05)。鳙的饲料效率在32%蛋白组中最高, 显著高于20%和24%低蛋白组(P < 0.05)。另外, 蛋白质效率和蛋白质保留率在所有试验组中无显著差异(P>0.05)。
| 指标 Parameter |
饲料蛋白水平/% Dietary protein level | |||||
| 20 | 24 | 28 | 32 | 36 | 40 | |
| 初始体质量/g Initial body weight(IBW) |
180.06±2.58 | 172.49±2.94 | 171.68±3.89 | 170.38±4.77 | 176.43±3.97 | 176.40±0.95 |
| 终末体质量/g Final body weight(FBW) |
221.10±14.17b | 230.60±6.29ab | 256.00±17.58b | 261.75±9.88a | 246.64±5.49ab | 250.36±12.22ab |
| 增重率/% Weight gain rate(WGR) |
22.88±9.25c | 33.74±4.08bc | 49.10±8.56ab | 53.76±8.65a | 39.84±4.50abc | 41.91±6.32abc |
| 特定生长率/(%·d-1) Specific growth rate(SGR) |
0.36±0.14b | 0.52±0.05ab | 0.71±0.10a | 0.77±0.09a | 0.59±0.06ab | 0.62±0.08a |
| 成活率/% Survival rate(SR) |
100 | 100 | 100 | 100 | 100 | 100 |
| 饲料效率/% Feed efficiency rate(FER) |
18.04±6.21c | 22.28±1.64bc | 31.34±11.56ab | 34.84±1.75a | 29.89±7.87abc | 34.04±3.11ab |
| 蛋白质效率/% Protein efficiency rate(PER) |
0.86±0.17 | 0.92±0.39 | 1.16±0.25 | 1.07±0.03 | 0.81±0.12 | 0.85±0.05 |
| 蛋白质保留率/% Protein retention efficiency(PRE) |
53.11±4.27a | 53.95±4.79a | 59.10±9.35a | 45.91±5.25a | 40.96±6.57a | 42.74±4.64a |
| 脏体指数/% Viscera index(VI) |
4.77±0.14 | 4.82±0.32 | 5.52±0.18 | 5.42±0.16 | 5.45±0.27 | 5.27±0.27 |
| 肝体指数/% Hepatosomatic index(HSI) |
1.35±0.21 | 1.36±0.41 | 1.37±0.13 | 1.27±0.19 | 1.29±0.35 | 1.28±0.19 |
| 肥满指数/% Condition factor(CF) |
1.89±0.13b | 2.16±0.52a | 1.84±0.13b | 1.92±0.07ab | 1.95±0.16ab | 1.96±0.14ab |
| 注:同行数据肩标不同小写字母表示差异显著(P < 0.05)。下同。 Note:Values in the same line with different small letter superscripts mean significant difference(P < 0.05). The same as follows. | ||||||
以饲料蛋白质水平梯度为自变量(X), 以特定生长率(Y1)和蛋白质效率(Y2)变化为因变量进行二次回归曲线模型分析:Y1=-23.292X2+15.112X-1.731 4(R2=0.856 5);Y2=-23.438X2+13.727X-0.954 3(R2=0.574 1)。由二次回归方程得出, 饲料中适宜蛋白质水平为29.28%~32.44%(图 1)。
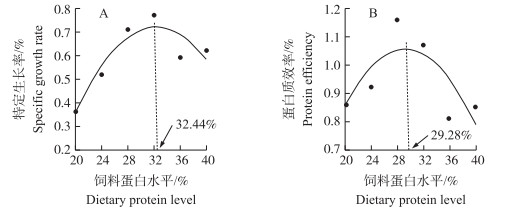
|
图 1 饲料蛋白水平与特定生长率(A)和蛋白质效率(B)的关系 Fig. 1 Relationship between dietary protein level with specific growth(A) and protein efficiency(B)respectively |
如表 3所示:鳙血清血糖和甘油三酯水平随饲料蛋白水平的增加呈先增后减趋势。在蛋白水平为28%时, 血糖含量最高, 显著高于除32%蛋白组的其他组(P < 0.05);40%蛋白组的血糖显著低于32%蛋白组(P < 0.05)。32%蛋白组溶菌酶和血清补体C3含量显著高于20%和40%蛋白组(P < 0.05)。鳙血清中丙氨酸氯基转移酶活性和天门冬氨酸氨基转移酶活性在20%~32%蛋白组中无显著变化(P>0.05), 均显著低于36%蛋白组(P < 0.05)。
| 指标 Parameter |
饲料蛋白水平/% Dietary protein level | |||||
| 20 | 24 | 28 | 32 | 36 | 40 | |
| 血糖含量/mmol·l-1 Content of glucose |
7.63±0.77b | 6.42±0.30bc | 10.31±0.28a | 10.48±1.12a | 7.49±0.13bc | 6.01±0.18c |
| 甘油三酯水平/(mmol·L-1) Content of triglyceride |
2.34±0.09 | 2.37±0.11 | 2.43±0.13 | 1.97±0.08 | 2.03±0.14 | 1.95±0.06 |
| 总胆固醇含量/(mmol·L-1) Content of total cholesterol |
3.48±0.08 | 3.46±0.14 | 3.40±0.08 | 3.54±0.30 | 3.81±0.16 | 3.88±0.23 |
| 血清补体C3含量/(μg·mL-1) Content of serum complement C3 |
21.92±0.58b | 22.06±0.38bc | 22.68±0.27ab | 23.74±0.54a | 21.46±0.43bc | 20.81±0.20c |
| 溶菌酶含量/(μg·mL-1) Content of lysozyme |
0.57±0.12 | 0.54±0.13 | 0.70±0.16 | 0.87±0.13 | 0.72±0.14 | 0.76±0.16 |
| 丙氨酸氯基转移酶活性/(U·mL-1) Activity of ALT |
5.78±0.29b | 5.58±0.32b | 6.22±0.32b | 6.32±0.37b | 8.61±0.58a | 8.08±0.89a |
| 天门冬氨酸氨基转移酶活性/(U·mL-1) Activity of AST |
26.40±2.51b | 24.49±1.78b | 27.42±1.02b | 28.10±1.04b | 35.76±1.01a | 38.88±0.75a |
| Note:ALT:Alanine aminotransferase; AST:Aspartate aminotransferase. | ||||||
如图 2-A所示:鳙淀粉酶活性在前中肠保持较高水平, 后肠淀粉酶活性总体相对较低, 以蛋白水平28%的最高, 显著高于其他组(P < 0.05)。如图 2-B所示:鳙前肠为脂肪消化的重要场所, 肠道各部分脂肪酶活性随饲料蛋白水平的增加无明显变化(P>0.05)。如图 2-C所示:中肠是鳙蛋白消化的重要场所, 鳙肠道各部分蛋白酶活性除前肠外各有差异, 中肠和后肠蛋白酶活性在蛋白水平为28%时达最高值, 其中中肠显著高于20%蛋白组(P < 0.05), 而后肠则显著高于其他试验组(P < 0.05)。

|
图 2 不同蛋白水平饲料对鳙肠道淀粉酶(A)、脂肪酶(B)和蛋白酶(C)活性的影响(n=9) Fig. 2 Effects of dietary protein level on intestinal amylas(A), lipase(B)and proteas(C)activities in A.nobilis |
由图 3显示:鳙肝脏丙二醛含量呈先下降后升高的变化趋势, 当饲料蛋白水平为28%时达到最低, 显著低于20%蛋白组(P < 0.05)。过氧化氢酶和超氧化物歧化酶活性则随饲料蛋白水平的升高而先升高后降低。2种酶活性都在28%蛋白组中最高, 并且2种酶在高蛋白组中的活性显著低于其余各组(P < 0.05)。
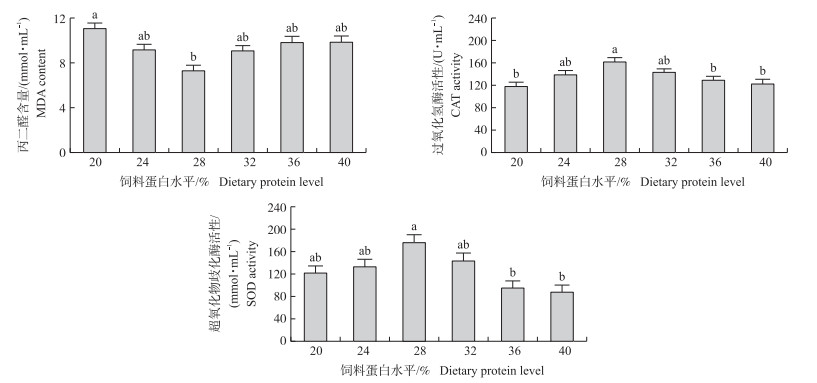
|
图 3 不同蛋白水平饲料对鳙肝脏丙二醛含量和过氧化氢酶、超氧化物歧化酶活性的影响(n=9) Fig. 3 Effects of dietary protein level on liver malondialdehyde(MDA)and catalase(CAT), superoxide dismutase(SOD)activities in A.nobilis |
饲料蛋白质水平决定了鱼体生长活动状况[24], 适宜蛋白水平可提高蛋白质的消化能力并促进鱼体生长[25]。本试验表明, 鳙增重率和特定生长率在饲料蛋白水平为32%时达最大, 这与青鱼[26]和草鱼[27]的研究结果相一致。饲料中的蛋白水平过低, 提供鳙生长的氨基酸较少, 影响其生长速度[28]。若蛋白水平过高, 剩余蛋白质转换合成脂肪沉积在肝脏中, 肝脏代谢负担加重, 导致蛋白质利用率下降, 抑制其生长[28]。蛋白质效率和蛋白质保留率能反映蛋白质在鱼体内的转化程度, 而能量又是影响蛋白质效率的重要因素[29]。Santiago等[29]认为高水平蛋白饲料中, 多余的蛋白被鳙代谢转化为能量, 从而导致蛋白质效率下降, 这与本试验结果相吻合。脏体指数和肝体指数能反映鱼体内脏的生长情况, 本试验肝体指数和脏体指数在各试验组间都无显著性差异, 与对蒙古鲌[30]的研究结果相近, 这是由于饲料中的小麦淀粉水平相同, 沉积在肝脏中的碳水化合物一致导致的。
血糖主要来自饲料中消化吸收的葡萄糖和肝糖原分解[31]。鳙血糖随饲料蛋白水平的升高呈先升后降趋势, 说明开始消化吸收的蛋白质能促进肝细胞分解葡萄糖, 再释放至血液, 血糖水平上升[32]。而随着蛋白水平继续升高, 过量的蛋白质沉积在肝脏中会加重肝脏的负担, 影响肝功能, 导致肝糖原的分解与合成能力下降, 血糖降低[5]。侯红利[33]在对鲤鱼的研究中指出, 正常鱼体肝脏中的氨基转移酶活性较高, 血清中较低。当肝细胞受损时, 细胞膜的通透性增大, 肝细胞内的氨基转移酶迅速释放至血清, 血清中的氨基转移酶浓度快速增加[34]。当蛋白水平超过32%时, 血清中的氨基转移酶活性显著升高, 说明鳙摄食高水平蛋白能够导致肝功能损伤[35]。C3补体是水生动物血清中类似酶活性的糖蛋白, 它可以通过体内的抗体参与灭杀细菌或病毒, 具有防御功能[36]。32%蛋白水平组的鳙血清中补体C3水平显著高于其他组, 表明饲料中适宜蛋白水平能提高鳙机体免疫机能。
鳙蛋白酶活性在中、后肠中较高, 说明中、后肠是鳙消化蛋白的主要场所。鳙中后肠的蛋白酶活性随饲料蛋白水平的升高呈先升后降趋势, 说明适宜蛋白水平能诱导鳙体内肠道蛋白酶的分解来提高消化能力, 改善生长。但若超过适宜蛋白水平, 过量的蛋白则会增加鳙肠道消化负担, 从而抑制吸收。对南亚野鲮(Labeo rohita)[37]、鳜鱼(Siniperca chuatsi)[38]的研究也都表明过多的蛋白不仅使鱼体在代谢中产生较多含氮物质, 还会对消化酶分泌产生负反馈调节。而淀粉酶活性在同一肠道的不同部分存在差异, 淀粉酶在前肠和中肠中较高, 说明肝脏产生的淀粉酶在前、中肠中被激活, 但不同鱼类或同种鱼的不同个体淀粉酶的分泌组织存在差别[39]。淀粉酶活性会依据外界饲料的淀粉含量的变化而变化[39], 鉴于本试验鳙膨化饲料中淀粉含量相同, 故鳙肠道的淀粉酶活性在不同蛋白水平下无显著变化。鳙脂肪酶活性在前肠较高, 说明前肠为脂肪消化的重要场所。Lundstedt等[40]研究指出, 肠道脂肪酶属于底物依赖型酶, 鳙膨化饲料中脂肪含量相似, 故鳙前、中、后肠的脂肪酶活性在不同蛋白水平下无显著差异。
适宜的蛋白水平可以提高鱼类的抗氧化能力, 钱前等[41]对岩原鲤幼鱼(Procypris rabaudi)的研究发现, 适宜的蛋白水平能使肝脏的总抗氧化能力达到最高。本研究结果表明摄食28%蛋白组鳙的肝脏丙二醛含量和过氧化氢酶、超氧化物歧化酶活性达到最佳值, 说明适宜的蛋白质水平可提高鳙清除活性氧自由基的能力, 从而减少丙二醛的产生。当饲料蛋白水平超过鱼体需要量时, 多余的蛋白质水解产生活性氧自由基, 过量的活性氧自由基破坏了原本维持的动态平衡, 脂质过氧化物增加会导致肝细胞膜通透性增加, 甚至肝功能紊乱[42]。故此, 摄食高蛋白饲料的鳙肝脏过氧化氢酶、超氧化物歧化酶活性较低。
| [1] |
Barrows F T, Lellis W A. The effect of dietary protein and lipid source on dorsal fin erosion in rainbow trout, Oncorhynchus mykiss[J]. Aquaculture, 1999, 180: 167-175. DOI:10.1016/S0044-8486(99)00188-X |
| [2] |
余含, 戈贤平, 孙盛明, 等. 鳙对10种蛋白质饲料原料中营养物质的表观消化率[J]. 动物营养学报, 2017, 29(4): 1427-1436. Yu H, Ge X P, Sun S M, et al. Apparent digestibility of 10 kinds of feed ingredients for bighead carp(Aristichthys nobilis)[J]. Chinese Journal of Animal Nutrition, 2017, 29(4): 1427-1436 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-267x.2017.04.042 |
| [3] |
National Research Council. Nutrient Requirements of Fishes[M]. Washington, DC: National Academy of Sciences, 1993: 324.
|
| [4] |
Wang J T, Li X Y, Han T, et al. Effects of different dietary carbohydrate levels on growth, feed utilization and body composition of juvenile grouper Epinephelus akaara[J]. Aquaculture, 2016, 459: 143-147. DOI:10.1016/j.aquaculture.2016.03.034 |
| [5] |
廖畅宇.锦鲤幼鱼适宜蛋白需要量的研究[D].宁波: 宁波大学, 2012: 2-4. Liao C Y. Study of protein requirements of juvenile Koi Carp(Cryprinus carpiod)[D]. Ningbo: Ningbo University, 2012: 2-4(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-11646-1012050998.htm |
| [6] |
缪凌鸿, 高启平, 帅柯, 等. 鳙人工配合饲料养殖方式探索[J]. 科学养鱼, 2015(1): 67-68. Miao L H, Gao Q P, Shuai K, et al. Exploration of the artificial mating method of bighead fish[J]. Scientific Fish Farming, 2015(1): 67-68 (in Chinese with English abstract). |
| [7] |
Lovell T. Nutrition and Feeding of Fish[M]. New York: Kluwer Academic Publishers, 1998: 27-42.
|
| [8] |
申屠基康.大黄鱼对21种饲料原料表观消化率及色氨酸营养需要研究[D].青岛: 中国海洋大学, 2010: 13-17. Shen T J K. Apparent digestibility coefficient of 21 feed ingredients and dietary tryptophan requirement for the large yellow croaker[D]. Qingdao: Ocean University of China, 2010: 13-17(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10423-1011027245.htm |
| [9] |
吕耀平, 陈建明, 叶金云. 饲料蛋白质水平对刺鲃幼鱼的生长、胴体营养组成及消化酶活性的影响[J]. 农业生物技术学报, 2009, 17(2): 276-281. Lü Y P, Chen J M, Ye J Y. Effects of diet protein level on the growth, body composition and digestive enzyme activities of the Barbudes caldwell juvenile[J]. Journal of Agricultural Biotechnology, 2009, 17(2): 276-281 (in Chinese with English abstract). DOI:10.3969/j.issn.1674-7968.2009.02.016 |
| [10] |
刘颖.饲料蛋白水平及蛋白质量对彭泽鲫养殖全期生长的影响[D].北京: 中国农业科学院, 2008: 16. Liu Y. Long-term effects of dietary protein levels and protein quality on growth performance on crutian carp: two-year study[D]. Beijing: Chinese Academy of Agricultural Sciences, 2008: 16(in Chinese with English abstract). http://cdmd.cnki.com.cn/article/cdmd-82101-2008130043.htm |
| [11] |
叶文娟, 韩冬, 朱晓鸣, 等. 饲料蛋白水平对泥鳅幼鱼生长和饲料利用的影响[J]. 水生生物学报, 2014, 38(3): 571-575. Ye W J, Han D, Zhu X M, et al. Effect of dietary protein level on growth and feed utilization of juvenile Misgurnus anguillicaudatus[J]. Acta Hydrobiologica Sinica, 2014, 38(3): 571-575 (in Chinese with English abstract). |
| [12] |
宋兵, 高露姣, 艾春香. 鲟鱼蛋白质营养需求及饲料蛋白源研究[J]. 华东师范大学学报, 2000(6): 165-169. Song B, Gao L J, Ai C X. Requirements of protein and protein sources for Amursturgeon[J]. Journal of East China Normal University, 2000(6): 165-169 (in Chinese with English abstract). |
| [13] |
姚林杰.团头鲂(Megalobrama amblycephala)三个生长阶段适宜蛋白/脂肪(蛋白/能量)比和脂肪需要量的研究[D].苏州: 苏州大学, 2013. Yao L J. Research on the optimal protein to lipid(energy)ratio and lipid content of blunts nout bream(Megalobrama amblycephala)in different growth stages[D]. Suzhou: Soochow University, 2013(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10285-1013295949.htm |
| [14] |
于晓彤.不同蛋白源对草鱼摄食反应、免疫应答及肉质的影响研究[D].北京: 中国农业科学院, 2016. Yu X T. Effects of dietary protein sources on feeding response, immunology response and flesh quality of grass carp(Ctenopharyngodon idellus)[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-82101-1016171316.htm |
| [15] |
张瑞玲, 冀芳烁, 杨振才. 不同蛋白源对大菱鲆生长性能和体成分的影响[J]. 中国饲料, 2014(5): 35-38. Zhang R L, Ji F Y, Yang Z C. Effects of different protein sources on growth performance and body composition of turbot[J]. China Feed, 2014(5): 35-38 (in Chinese with English abstract). DOI:10.3969/j.issn.1004-3314.2014.05.012 |
| [16] |
黄春红, 曾伯平, 董建波. 青鱼、草鱼、鲢鱼和鳙鱼头营养成分比较[J]. 湖南文理学院学报, 2008, 20(3): 46-57. Huang C H, Zeng B P, Dong J B. Comparison of nutrients in the head of black carp, grass carp, silver carp and bighead carp[J]. Hunan University of Arts and Science, 2008, 20(3): 46-57 (in Chinese with English abstract). DOI:10.3969/j.issn.1672-6164.2008.03.013 |
| [17] |
黄明, 唐宗宁, 王颜权. 鳙养殖前景及技术探讨[J]. 河北渔业, 2013(6): 51-54. Huang M, Tang Z N, Wang Y Q. Prospect and technical discussion of bighead fish[J]. Hebei Fisheries, 2013(6): 51-54 (in Chinese). DOI:10.3969/j.issn.1004-6755.2013.06.022 |
| [18] |
Hong H, Fan H B, Wang H, et al. Seasonal variations of fatty acid profile in different tissues of farmed bighead carp(Aristichthys nobilis)[J]. Journal of Food Science, 2015, 52: 903-911. |
| [19] |
Chen J, Huang J, Deng S G, et al. Combining ozone and slurry ice to maximize shelf-life and quality of bighead croaker(Collichthys niveatus)[J]. Journal of Food Science, 2016, 53: 3651-3660. |
| [20] |
刘家驹, 孙建国. 鳙生物饲料的开发与应用[J]. 科学养鱼, 2012(7): 73-74. Liu J J, Sun J G. Development and application of bighead fish biological feed[J]. Scientific Fish Farming, 2012(7): 73-74 (in Chinese). |
| [21] |
冷向军. 水产膨化饲料应用中的几个问题[J]. 饲料工业, 2014, 35(8): 1-5. Leng X J. The application strategy of extruded diet in aquaculture[J]. Feed Industry, 2014, 35(8): 1-5 (in Chinese). |
| [22] |
江星, 陈立侨, 孙盛明, 等. 中华绒螯蟹对10种常见饲料蛋白源的表观消化率[J]. 海洋渔业, 2013, 35(2): 209-216. Jiang X, Chen L Q, Sun S M, et al. Apparent digestibility of 10 feed ingredients for Chinese mitten crab Eriocheir sinensis[J]. Marine Fisheries, 2013, 35(2): 209-216 (in Chinese with English abstract). DOI:10.3969/j.issn.1004-2490.2013.02.013 |
| [23] |
Jover M, Fernandez C J, Del R M C, et al. Effect of feeding cooked-extruded diets, containing different levels of protein, lipid and carbohydrate on growth of red swamp craysh(Procambarus clarkii)[J]. Aquaculture, 1999, 178: 127-137. DOI:10.1016/S0044-8486(99)00119-2 |
| [24] |
Yan J, Li X T, Shi W X, et al. Interactions between dietary protein levels, growth performance, feed utilization, gene expression and metabolic products in juvenile grass carp(Ctenopharyngodon idella)[J]. Aquaculture, 2014, 437: 75-83. |
| [25] |
Coutinho F, Peres H, Guereiroi R, et al. Dietary protein requirement of sharpsnout sea bream (Diplodus puntazzo)juveniles[J]. Aquaculture, 2012, 356/357: 391-397. DOI:10.1016/j.aquaculture.2012.04.037 |
| [26] |
冷向军. 青鱼的营养需求与配合饲料研究[J]. 饲料工业, 2016, 37(6): 1-7. Leng X J. Nutrients requirement and formula feed of black carp[J]. Feed Industry, 2016, 37(6): 1-7 (in Chinese with English abstract). |
| [27] |
李彬.饲料蛋白质水平对三种规格草鱼生长、饲料利用以及氮代谢的影响[D].武汉: 华中农业大学, 2014. Li B. Effects of dietary protein level on growth, feed utinization and nitrogen metabolism of grass carp(Ctenopharyngodon idellus)in three growth stages[D]. Wuhan: Huazhong Agricultural University, 2014(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10504-1014231425.htm |
| [28] |
李勇, 王优军, 蒋克勇, 等. 水产动物营养的生态适宜与环保饲料[J]. 海洋科学, 2004, 28(3): 76-78. Li Y, Wang Y J, Jiang K Y, et al. Aquaculture nutrition, eco-fitness and environmental protection[J]. Marine Fisheries, 2004, 28(3): 76-78 (in Chinese). DOI:10.3969/j.issn.1000-3096.2004.03.018 |
| [29] |
Santiago G, Corazon B, Ofelia S, et al. Optimum dietary protein level for growth of bighead carp(Aristichthys nobilis)fry in a static water system[J]. Aquaculture, 1991, 93: 155-165. DOI:10.1016/0044-8486(91)90214-R |
| [30] |
方桂萍.蛋白质水平对蒙古鲌生长、体成分及消化酶活性的影响[D].福州: 福建农林大学, 2014. Fang G P. Effect of protein levels on growth performance, body composition and digestive enzyme activity of Culter mongolicus[D]. Fuzhou: Fujian Agriculture and Forestry University, 2014(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10389-1014323047.htm |
| [31] |
Melo J F B, Lundstedt L M, Metón I, et al. Effects of dietary levels of protein on nitrogenous metabolism of Rhamdia quelen(Teleostei:Pimelodidae)[J]. Comparative Biochemistry and Physiology:Part A, 2006, 145: 181-187. DOI:10.1016/j.cbpa.2006.06.007 |
| [32] |
唐玲, 徐奇友, 王常安, 等. 不同水温和饲料蛋白质水平对镜鲤血清生化指标影响[J]. 大连海洋大学学报, 2011, 26(1): 41-46. Tang L, Xu Q Y, Wang C A, et al. Effects of dietary protein levels on blood biochemical parameters in mirror common carp(Cyprinus specularis)at different temperatures[J]. Journal of Dalian Ocean University, 2011, 26(1): 41-46 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-9957.2011.01.008 |
| [33] |
侯红利.棉粕替代豆粕对鲤安全性评价[D].武汉: 华中农业大学, 2006. Hou H L. Security evaluation dietary soybean meal replacement by cottonseed meal Cyprinus carpio[D]. Wuhan: Huazhong Agricultural University, 2006(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10504-2006190901.htm |
| [34] |
吴凡, 文华, 蒋明, 等. 饲料碳水化合物水平对吉富罗非鱼幼鱼生长性能和血液主要生化指标的影响[J]. 西北农林科技大学学报(自然科学版), 2012, 40(12): 8-14. Wu F, Wen H, Jiang M, et al. Effects of different dietary carbohydrate levels on growth performance and blood biochemical parameters of juvenile GIFT tilapia(Oreochromis niloticus)[J]. Journal of Northwest A & F University(Natural Science Edition), 2012, 40(12): 8-14 (in Chinese with English abstract). |
| [35] |
肖金星, 李广经, 华颖, 等. 饲料碳水化合物水平对黑鲷幼鱼生长性能和血清指标的影响[J]. 江苏农业科学, 2017, 45(10): 125-129. Xiao J X, Li G J, Hua Y, et al. Effects of carbohydrate level on growth performance and serum biochemical indexes of black sea bream[J]. Jiangsu Agricultural Sciences, 2017, 45(10): 125-129 (in Chinese with English abstract). |
| [36] |
孙浪, 鲁双庆, 肖调义, 等. 饲料中添加茶氨酸对草鱼免疫和血清生化指标的影响[J]. 水生动物营养, 2012(6): 63-65. Sun L, Lu S Q, Xiao T Y, et al. Effects of theanine on immunity and serum biochemical parameters of grass carp[J]. Chinese Journal of Animal Nutrition, 2012(6): 63-65 (in Chinese). |
| [37] |
Debnath D, Pal A K, Sahu N P, et al. Digestive enzymes and metabolic profile of Labeo rohita fingerlings fed diets with different crude protein levels[J]. Comparative Biochemistry & Physiology Part B, 2007, 146: 107-114. |
| [38] |
赵东海. 饲料蛋白水平对鳜鱼试验种群胃肠道消化酶[J]. 河北渔业, 2004(2): 66-69. Zhao D H. The protein level of the feed protein was used to test the digestive enzymes of the gastrointestinal gastrointestinal tract[J]. Hebei Fisheries, 2004(2): 66-69 (in Chinese). |
| [39] |
周兴华, 向枭, 叶元土, 等. 中华倒刺鱼巴、黄颡鱼和华鲮消化酶活性的比较研究[J]. 安徽农业大学学报, 2003, 30(1): 78-81. Zhou X H, Xiang X, Ye Y T, et al. Comparisons of activities of the digestive enzymes among Spinibarbus sinensis Bleeker, Pelteobagrus fulvidraco Richardson and Sinilabeo rendahli Kimura[J]. Journal of Anhui Agricultural University, 2003, 30(1): 78-81 (in Chinese with English abstract). DOI:10.3969/j.issn.1672-352X.2003.01.017 |
| [40] |
Lundstedt L M, Jose F B M, Gilberto M, et al. Digestive enzymes and metabolic profile of Pseudoplatystoma corruscans(Teleostei:Siluriformes)in response to diet composition[J]. Comparative Biochemistry and Physiology Part B, 2004, 137: 331-339. DOI:10.1016/j.cbpc.2003.12.003 |
| [41] |
钱前, 罗莉, 白富瑾, 等. 岩原鲤幼鱼的蛋白质需求量[J]. 动物营养学报, 2013, 25(12): 2934-2942. Qian Q, Luo L, Bai F J, et al. Dietary protein requirement of juvenile rock carp(Procypris rabaudi)[J]. Chinese Journal of Animal Nutrition, 2013, 25(12): 2934-2942 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-267x.2013.12.021 |
| [42] |
Kiron V, Watanabe T, Fukuda H, et al. Protein nutrition and defence mechanisms in rainbow trout Oncorhynchus mykiss[J]. Comparative Biochemistry and Physiology, 1995, 111: 351-359. DOI:10.1016/0300-9629(95)00043-7 |




