文章信息
- 张国敏, 程春雨, 刘建玲, 安世钰, 张婷婷, 王子玉, 孟繁星, 樊懿萱, 雷治海, 王锋
- ZHANG Guomin, CHENG Chunyu, LIU Jianling, AN Shiyu, ZHANG Tingting, WANG Ziyu, MENG Fanxing, FAN Yixuan, LEI Zhihai, WANG Feng
- 补偿生长对湖羊肝脏组织中Hippo信号通路相关基因表达的影响
- Effects of nutrient compensation on the Hippo signal pathway gene expressions in the liver of Hu sheep
- 南京农业大学学报, 2019, 42(6): 1141-1149
- Journal of Nanjing Agricultural University, 2019, 42(6): 1141-1149.
- http://dx.doi.org/10.7685/jnau.201901046
-
文章历史
- 收稿日期: 2019-01-28
2. 南京农业大学江苏省家畜胚胎工程实验室, 江苏 南京 210095;
3. 南京农业大学动物科学类国家级实验教学中心, 江苏 南京 210095
2. Jiangsu Livestock Embryo Engineering Laboratory, Nanjing Agricultural University, Nanjing 210095, China;
3. National Experimental Teaching Demonstration Center of Animal Science, Nanjing Agricultural University, Nanjing 210095, China
湖羊是我国太湖流域重要的绵羊品种, 因其具有高繁殖力、四季发情和适应性强等特点, 被引入到全国各地[1]。在湖羊饲养过程中, 春夏季节饲料资源丰富, 可为湖羊的生长提供充足营养物质, 但冬季草料相对缺乏, 饲草品质下降, 直接影响湖羊的生长发育, 易造成羔羊体质瘦弱, 使养殖效益未能实现最大化。研究发现, 适当水平的营养限饲后再补偿, 可促进牛和羊等反刍动物的生长发育[2]。然而, 在肉羊的饲养管理中, 补偿生长能力并未得到很好的重视和利用, 并且补偿生长的调控机制尚不完全清楚。因此, 研究湖羊营养受限与补偿的调控机制, 可为湖羊科学饲养管理提供理论依据。
肝脏是重要的消化器官, 其能量代谢与动物的生长发育密切相关[3]。代谢组学研究发现, 能量限饲主要通过影响肝脏组织的代谢而参与机体发育的调节[4]。基因组学和蛋白组学研究发现, 能量限饲也可以通过调控细胞的增殖和凋亡来影响机体器官的发育[5]。近期研究报道, Hippo通路在参与调节器官大小、细胞周期和凋亡以及维持内环境稳态等方面具有重要作用[6]; 同时也参与机体能量代谢的调节[7]。Hippo信号通路的核心因子主要包括MST1/2 (Mammalian sterile 20-like protein kinase 1/2)和LATS1/2 (large tumor suppressor 1/2), 以及效应基因YAP1 (Yes-associated protein 1)[8]。Wang等[9]发现, 能量限饲(葡萄糖饥饿)会激活LATS1/2激酶活性, 抑制YAP1 及其下游基因葡萄糖转运蛋白3的表达, 并通过调节能量代谢来参与癌症的发生过程。Deran等[7]发现, 能量限饲激活AMP依赖的蛋白激酶(AMP-activated protein kinase, AMPK, 由PRKAA1 基因编码)通过诱导YAP1蛋白的磷酸化而参与调节细胞的增殖和能量代谢。Mo等[10]也发现, Hippo通路和AMPK通路在调节能量代谢平衡中具有协同作用, 在能量应激条件下, AMPK蛋白的激活是Hippo信号通路激活并调控细胞功能的重要调节因子。AMPK是生物能量代谢调节的关键分子, 本课题组研究表明, 不同能量水平通过调节AMPK信号通路关键因子的表达而参与调控湖羊睾丸和精子的发育[11]; 能量限饲通过调节Hippo信号通路关键基因的表达参与湖羊肝脏组织的发育[12]。因此, 本试验以湖羊为研究对象, 探究早期能量限饲与后期能量补偿对湖羊生长性能和肝脏组织中Hippo通路相关基因和AMPK表达的影响, 为研究反刍动物补偿生长效应的作用机制提供理论依据, 并进一步指导生产实践。
1 材料与方法 1.1 试验动物、日粮组成和试验设计试验在江苏省泰州市海伦羊业有限公司进行。参考文献[13], 将试验分为能量限饲(60 d)和补偿饲养(90 d)2个阶段。选取32只体质量相近、体况良好、系谱清楚、遗传背景相似的3月龄雄性湖羊公羔, 随机均分为2组:在限饲阶段和补偿阶段分别称为限饲对照组、限饲组和补偿对照组和补偿组。所有试验羊均采用分栏饲养, 每天饲喂2次(08:00和16:00), 自由饮水。试验日粮营养水平参考《肉羊饲养标准:NY 816—2004》, 配制颗粒饲料, 预混料由北京精准动物研究中心提供。日粮组成及营养水平见表 1。试验羊在预饲15 d后开始正式试验。试验设计如图 1所示。
| 原料组成 Ingredients |
限饲阶段 Caloric restriction period |
补偿阶段① Caloriccompensationperiod |
营养水平 Nutrient levels |
限饲阶段 Caloric restriction period |
补偿阶段① Caloriccompensationperiod |
|||
| 对照组Control group | 限饲组Restriction group | 对照组Control group | 限饲组Restriction group | |||||
| 大麦Barley husk | 0.00 | 0.00 | 26.00 | 粗蛋白Crude protein | 15.19 | 15.17 | 15.62 | |
| 稻草Rice straw | 0.00 | 64.00 | 0.00 | 粗脂肪Ether extract | 2.48 | 0.71 | 2.18 | |
| 豆秸Soybean straw | 30.00 | 0.00 | 0.00 | 粗纤维Crude fiber | 60.64 | 60.33 | 57.01 | |
| 木薯渣Cassava residue | 12.00 | 4.00 | 21.00 | 代谢能③ Metabolic energy | 11.64 | 6.84 | 12.86 | |
| 玉米Corn | 28.00 | 0.00 | 18.00 | |||||
| 豆粕Soybean meal | 18.00 | 23.00 | 23.00 | |||||
| 麸皮Corn bran | 8.00 | 5.00 | 7.00 | |||||
| 预混料② Premix | 4.00 | 4.00 | 5.00 | |||||
| 注: ①补偿阶段对照组和补偿组的饲料原料组成和营养水平相同。In the caloric compensation period, the composition and nutrition levels of the diets were same in the control and the caloric compensation group. ②预混料为每千克饲料提供:Fe 56 mg, Cu 15 mg, Mn 30 mg, Zn 40 mg, I 1.5 mg, Se 0.5 mg, Co 0.25 mg, S 3.2 g, vitamin A 2 150 IU, vitamin D 170 IU, vitamin E 131 IU, 超浓缩源康宝2.7 g, 2%莫能霉素1.6 g, 硫酸钠10.1 g。The premix provided the following per kilogram of diets:Fe 56 mg, Cu 15 mg, Mn 30 mg, Zn 40 mg, I 1.5 mg, Se 0.5 mg, Co 0.25 mg, S 3.2 g, vitamin A 2 150 IU, vitamin D 170 IU, vitamin E 131 IU, super concentrated Yuankangbao 2.7 g, monensin(2%)1.6 g, sodium sulfate 10.1 g. ③代谢能单位为MJ · kg-1。Metabolic energy unit is MJ · kg-1. | ||||||||

|
图 1 试验设计 Fig. 1 The design of the experiment CR-Ctr:能量限饲对照组The control group of caloric restriction period; CR:能量限饲组Caloric restriction group; Refed-Ctr:能量补偿对照组The control group of caloric compensation period; CR-refed:能量补偿组Caloric compensation group。下同。The same as follows. |
在正式试验的第60天和第150天早晨饲喂前称取各试验羊的体质量。在能量限饲(60 d)和补偿饲(150 d)喂结束后, 对照组和试验组各随机挑选8只羊屠宰, 屠宰前禁食24 h、禁水12 h。屠宰结束后立即取出肝脏称质量并采集同一部位肝脏组织样品。一部分样品保存于4%多聚甲醛中, 经石蜡包埋后进行免疫组织化学检测; 另一部分样品立即冻存于液氮中, 用于后续RNA和蛋白提取, 进行荧光定量PCR(RT-qPCR)、Western blot和氨基转移酶活性等检测。
1.3 肝脏组织氨基转移酶活性检测称取相同质量的冻存肝脏组织, 匀浆后离心取上清液, 按照Sigma公司的天门冬氨酸氨基转移酶(AST)和丙氨酸氨基转移酶(ALT)活性测定试剂盒检测样品中AST和ALT活性。测定方法严格按照试剂盒说明书进行。
1.4 RNA提取、反转录与实时荧光定量PCR(qPCR)检测用Invitrogen公司的Trizol试剂盒提取肝脏组织总RNA, 经过RNA均一性和完整性检测合格后, 按照TaKaRa公司的反转录试剂盒将RNA反转录成cDNA。根据NCBI提供的序列信息, 用Primer-BLAST软件设计各目的基因引物(表 2)。以cDNA为模板, 进行目的基因的qPCR检测。体系包括:SYBR Green Master 10 μL, 上、下游引物各0.6 μL, cDNA 1 μL, 补加超纯水至20 μL。反应条件:95 ℃ 10 min; 95 ℃ 15 s, 60 ℃ 30 s, 72 ℃ 30 s, 共40个循环; 72 ℃ 10 min。PCR程序结束后绘制熔解曲线, 以GAPDH作为内参基因。为了便于不同处理组之间的比较, 将能量限饲阶段对照组羔羊肝脏组织中目的基因表达量的平均值设置为1.00。
| 基因名称 Target gene |
引物对序列 Primer pairs sequences(5′→3′) |
GenBank ID | 产物大小/bp Product size |
| MST1 | AGACGGTGCAGCTTAGGAAC/TAGCTTTGTACACGCTGCCA | XM_004014591.2 | 138 |
| MST2 | TTAAAAGCGCTGGACCCCAT/TGCTGTCTTCTTTTCTTCGCA | XM_015097905.1 | 113 |
| LATS1 | CTGAAACCACTGGAGCGGAG/CTTGCGGTGGGATGTGAAGA | NM_001306113.1 | 253 |
| LATS2 | CGCGCGTCTTGGTCTGAA/AAGCAAGTGCCGCGGATAA | XM_015098193.1 | 168 |
| YAP1 | CTGCTTCGGCAGGAATTAGC/CGTCGCGAGAGTGATAGGTG | NM_001267881.2 | 166 |
| PRKAA1 | TTGCGTGTTCGGAGGAAGAA/GGCGTAGCAGTCCCTGATTT | XM_004017019.2 | 146 |
| GAPDH | CGACTTCAACAGCGACACTCAC/CCCTGTTGCTGTAGCCGAATTC | NM_001034034.1 | 119 |
| 注: MST 1(STK4) :哺乳动物STE-20样激酶1 Mammalian sterile 20-like 1(serine/threonine kinase 4);MST 2(STK3) :哺乳动物STE-20样激酶2 Mammalian sterile 20-like 2(serine/threonine kinase 3);LATS 1 :大肿瘤抑制因子1 Large tumor suppressor kinase 1;LATS 2 :大肿瘤抑制因子2 Large tumor suppressor kinase 2;YAP1 :Yes相关蛋白1 Yes associated protein 1;PRKAA1 :AMP依赖的蛋白激酶Protein kinase, AMP-activated, alpha 1 catalytic subunit(AMPK); GAPDH:油醛-3-磷酸脱氢酶Glyceraldehyde-3-phosphate dehydrogenase.下同。The same as follows. | |||
用多聚甲醛固定后的肝脏组织经石蜡包埋后进行组织切片(7 μm)。石蜡切片经脱蜡复水处理后, 抗原修复10 min并自然冷却至室温。通透处理后用3%甲醇-过氧化氢处理20 min。室温封闭1 h后, 加一抗[YAP/YAP1抗体, 1 : 200稀释; 磷酸化AMPKα(pAMPKα, Thr172)抗体, 1 : 100稀释]4 ℃过夜孵育。经DPBS洗涤后, 加二抗(HRP标记羊抗兔IgG, 1 : 2 000稀释)室温孵育2 h。DAB染色后用苏木素复染, 脱水透明处理后封片镜检。阴性对照用一抗来源动物(兔)的血清代替一抗, 其余步骤相同。
1.6 Western blot检测用RIPA强裂解液裂解提取肝脏组织总蛋白, BCA蛋白检测试剂盒检测蛋白浓度后进行蛋白变性处理。30 μg(20 μL)的蛋白样品经SDS-PAGE电泳后转膜, 并用50 g · L-1牛血清白蛋白室温封闭1 h。加一抗[YAP/YAP1抗体, 1 : 2 000(稀释); AMPKα1多克隆抗体, 1 : 1 000;pAMPKα(Thr172)抗体, 1 : 1 000;GAPDH抗体, 1 : 2 000]4 ℃孵育过夜后, 加二抗(HRP标记羊抗兔IgG, 1 : 2 000)室温孵育2 h。用ECL发光液(Advansta)显影并拍照。拍照后用Image J软件进行灰度分析。
1.7 数据处理与统计分析所有试验至少重复3次。试验数据先用Excel 2010处理, 并用SPSS 18.0软件进行描述性分析(检验其是否符合正态分布), 然后用t测验进行差异显著性分析。试验结果均以平均数±标准误(x±SE)表示。
2 结果与分析 2.1 能量限饲与补偿对湖羊羔羊生长性能的影响如表 3所示:在能量限饲阶段, 限饲组羔羊的平均日增重显著低于对照组(P < 0.05);而在能量补偿阶段, 补偿组羔羊平均日增重显著高于对照组(P < 0.05)。补偿结束时, 补偿组羔羊体质量与对照组羔羊的体质量差异不显著。此外, 在能量限饲和补偿阶段, 补偿组羔羊的平均日采食量与对照组羔羊的差异也不显著。
| 项目 Items |
限饲阶段 Caloric restriction period |
补偿阶段 Caloric compensation period |
|||
| 对照组 Control group(CR-Ctr) |
限饲组 Restriction group(CR) |
对照组 Control group(Refed-Ctr) |
补偿组 Compensation group(CR-refed) |
||
| 初始体质量/kg Initial body weight | 22.39±0.54 | 22.27±0.64 | 31.14±1.34# | 25.38±1.21& | |
| 终末体质量/kg Final body weight | 31.08±1.18 | 25.51±1.43* | 44.64±1.29# | 42.73±1.09$ | |
| 平均日增重/g Average daily gain | 144.80±12.7 | 53.90±9.4* | 150.50±13.9 | 192.80±18.2&$ | |
| 平均日采食量/kg Average daily feed intake | 1.12±0.09 | 1.04±0.11 | 1.69±0.14 | 1.72±0.17 | |
| 注: *表示能量限制阶段限饲组和对照组间差异显著(P < 0.05)*value represents significant difference between control group and restriction group under the caloric restriction period(P < 0.05);&表示能量补偿阶段补偿组和对照组间差异显著(P < 0.05)&value represents significant difference between control group and re-alimentation group under the caloric compensation period(P < 0.05);#表示能量限制阶段对照组和能量补偿阶段对照组间差异显著(P < 0.05)#value represents significant difference between the control group of caloric restriction period and caloric compensation period(P < 0.05);$表示能量限制组和补偿生长组间差异显著(P < 0.05)$ value represents significant difference between caloric restriction group and caloric re-alimentation group(P < 0.05).下同The same as follows. | |||||
如表 4所示:能量限饲显著降低了湖羊肝脏质量和肝脏指数(肝脏质量/宰前体质量, P < 0.05);能量补偿后, 补偿组湖羊肝脏质量和肝脏指数均达到对照组水平。能量限饲和补偿结束时, 试验组和对照组湖羊的肝脏组织中AST和ALT活性差异均不显著。此外, 能量限饲组和补偿组肝脏组织中的AST和ALT活性的差异也不显著。
| 项目 Items |
限饲阶段 Caloric restriction period |
补偿阶段 Caloric compensation period |
|||
| 对照组 Control group(CR-Ctr) |
限饲组 Restriction group(CR) |
对照组 Control group(Refed-Ctr) |
补偿组 Compensation group(CR-refed) |
||
| 肝脏质量/g Liver weight | 547.00±18.7 | 359.00±13.6* | 837.75±21.2# | 841.53±15.7$ | |
| 肝脏指数/% Liver index | 1.73±0.09 | 1.45±0.11* | 1.87±0.11 | 1.94±0.13$ | |
| AST活性/(U·L-1)AST activity | 25.79±1.49 | 26.53±1.81 | 28.54±1.68 | 27.83±1.01 | |
| ALT活性/(U·L-1)ALT activity | 37.58±1.89 | 38.13±2.35 | 36.79±1.49 | 34.44±2.57 | |
| 注:1)AST:天门冬氨酸氨基转移酶Aspartate aminotransferase; ALT:丙氨酸氨基转移酶Alanine aminotransferase. | |||||
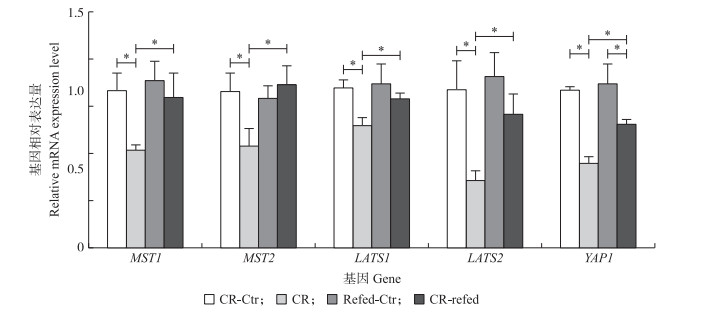
由图 2可知:在能量限饲阶段, Hippo通路核心基因在营养限饲组湖羊肝脏组织中的表达量显著低于对照组(P < 0.05)。能量补偿后, Hippo通路中MST1/2和LATS1/2基因的表达量在对照组和补偿组湖羊肝脏组织中差异不显著, 但效应基因YAP1 在补偿组中的表达量显著低于对照组(P < 0.05)。此外, 补偿组肝脏中Hippo通路核心基因的表达量显著高于其在能量限饲组中的表达量(P < 0.05)。
|
图 2 RT-qPCR检测能量限饲与补偿对肝脏组织中Hippo通路核心基因表达的影响 Fig. 2 Gene expression levels of Hippo pathway related genes in liver of Hu sheep ram lambs with calorie restriction and compensation detected by RT-qPCR |
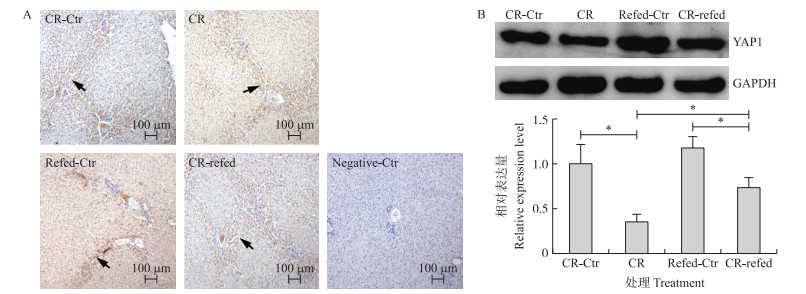
如图 3-A所示:YAP1蛋白主要在肝脏组织的汇管区及其附近肝小叶交界周围的肝细胞中表达。与对照组相比, 能量限饲组与补偿组湖羊肝脏组织中YAP1蛋白的免疫着色较弱; 而在阴性对照中, 无YAP1蛋白的阳性表达。如图 3-B所示:在能量限饲阶段, 能量限饲组湖羊肝脏组织中YAP1蛋白的表达量显著低于限饲对照组(P < 0.05);能量补偿后, 补偿组湖羊肝脏组织中YAP1蛋白的表达量显著升高(P < 0.05), 但是补偿组湖羊肝脏组织中YAP1蛋白的表达量仍然显著低于补偿对照组(P < 0.05)。
|
图 3 能量限饲与补偿对湖羊肝脏组织中YAP1蛋白表达的影响 Fig. 3 Location and expression of YAP1 in liver of Hu sheep ram lambs with calorie restriction and compensation A.免疫组化检测YAP1的表达定位(箭头表示YAP1蛋白在肝脏组织中的阳性表达区域)Localization of YAP1 protein was detected by immunohistochemistry(Arrowhead indicates the positive area of YAP1 immunostaining); B. Western blot检测YAP1表达量Protein expression levels of YAP1 were detected by Western blot. |
如图 4-A所示:能量限饲显著降低了肝脏组织中PRKAA1 基因的表达量(P < 0.05), 能量补偿后, 补偿组湖羊肝脏组织中PRKAA1 基因的表达量显著低于能量限饲组的表达量(P < 0.05), 但仍显著高于补偿对照组(P < 0.05)。如图 4-B所示:AMPK蛋白在肝细胞的细胞质和核内均有表达, 并且能量限饲组肝脏组织中的免疫染色增强。在阴性对照中, 则无AMPK蛋白的阳性表达。如图 4-C所示:尽管能量限饲和补偿对肝脏组织中AMPK蛋白的表达水平没有显著影响, 但能量限饲显著增加pAMPK的表达量(P < 0.05), 并且能量补偿后, pAMPK的表达量显著降低(P < 0.05)。

|
图 4 能量限饲与补偿对湖羊肝脏组织中AMPK表达的影响 Fig. 4 Expression of AMPK in liver of Hu sheep ram lambs with calorie restriction and compensation A. RT-qPCR检测PRKAA1 基因表达量The mRNA expression levels of PRKAA1 were detected by RT-qPCR; B.免疫组化检测AMPK的定位Localization of AMPK protein was detected by immunohistochemistry; C.Western blot检测AMPK及pAMPK的表达量Protein expression levels of AMPK and pAMPK were detected by Western blot. |
补偿生长是自然界广泛存在的一种生物现象, 其在改善机体蛋白质沉积、提高饲料利用率和增加动物出栏体质量等方面具有较高的应用价值; 然而能量限饲时动物所处的生长发育阶段、能量限饲程度和时间以及补偿生长时的采食量、补偿时间和日粮组成等因素均能显著影响补偿生长的结果[14]。研究发现, 在动物过早或过晩的发育阶段对其能量限饲容易导致损失的体质量无法通过补偿生长而恢复[15]。在能量限饲期间, 受限程度越严重, 动物对能量恢复期的日粮能量水平要求越高, 受限动物恢复至正常体质量所需的时间也越长[16]。因此, 适当程度的能量限饲可以得到相对较高的补偿生长; 但高强度的限饲可能导致动物生产性能出现不可逆性的降低或者补偿生长所需的时间会较长。在本研究中, 限饲组羔羊(3月龄、55%生长能量需要量)平均日增重显著低于对照组, 而补偿饲喂时机体迅速增重, 在补偿试验结束时, 限饲组肝脏的质量与对照组无显著性差异, 这与李东[13]对蒙古羊能量补偿试验的结果相似。本课题组王震等[17]发现, 3月龄湖羊羔羊在85%和70%生长能量需要量的条件下限饲60 d后再补偿生长90 d, 其补偿指数分别是108.44%和89.31%, 且各组的生长性能均恢复到正常水平。上述结果表明, 在一定范围内, 限饲组羔羊在后期生长过程中具有补偿生长的能力和潜力。
AST和ALT是氨基酸代谢过程中2个重要的氨基转移酶。这2种酶活性的高低不仅能反映湖羊体内氨基酸的代谢水平, 而且在一定程度上能反映肝脏的功能。在正常的生理条件下, ALT和AST主要存在于细胞内; 当组织细胞特别是肝细胞受到损伤时, 大量的ALT和AST会从细胞内逸出, 因此通常根据这2种转氨酶活性的变化判断肝脏等组织器官的功能状况。通过测定发现, 能量限饲和补偿组的湖羊肝脏组织中AST和ALT的活性与对照组无显著性差异。Mladenović等[18]发现, 小鼠60%~70%能量限饲5周后并不影响血液中AST与ALT活性, 而高强度的限饲(超过40%)会显著增加血液中AST与ALT活性。此外, Anikó等[19]也报道, 大鼠50%能量限饲12周后并不影响血液中AST的活性。上述结果表明, 在一定范围内的能量限饲并不影响肝脏组织中转氨酶的活性。
3.2 能量限饲与补偿对湖羊肝脏组织中Hippo通路相关基因表达的影响补偿生长是多种机制和多因素联合作用的结果。研究显示, 能量限饲和补偿可以通过调控细胞的增殖和凋亡来影响机体组织器官的发育[5, 20]。Hyatt等[21]发现, 母羊妊娠早期给予能量限饲, 可能通过促进细胞的凋亡使得子代羔羊肝脏增长受损。张冬梅等[22]也发现, 能量限饲显著降低了蒙古羊肝脏细胞的增殖效率, 而补偿生长能恢复肝脏细胞的增殖效率。上述结果表明, 在一定范围内, 能量限饲和补偿可能通过调节细胞的增殖和凋亡来决定肝脏组织细胞的分裂程度和数量, 进而影响肝脏质量。有研究报道, Hippo信号通路在维持肝细胞的状态和出生后限制肝脏生长中发挥了重要的作用[23], Hippo信号通路与其他信号通路存在诸多交互, 共同参与调节细胞周期和凋亡, 能有效控制组织器官发育成熟的时机, 调控器官大小并稳定内环境等生理过程[24]。在Hippo通路中, YAP1上游信号失活会导致成年小鼠肝脏细胞过度生长, 并使肝脏体积生长至原体积的3~4倍; 而抑制YAP1表达时, 肝脏迅速恢复至正常大小[25]。此外, LATS1 基因启动子区域的甲基化会降低LATS1蛋白的磷酸化和抑制Hippo通路的激活, 提高单酰甘油脂肪酶的活性和促进脂肪酸的β氧化, 进而调节肝癌细胞的能量代谢和增殖活力[26]。尾静脉注射脊髓间充质干细胞能通过提高mTOR通路关键因子和YAP1的表达, 调节小鼠肝细胞的代谢变化而促进肝脏损伤后的再生和恢复[27]。在本试验中, 能量限饲显著降低Hippo信号通路关键基因的表达, 使效应蛋白YAP1表达量减少, 抑制了细胞的增殖能力, 从而使能量限饲组湖羊肝脏发育缓慢; 然而随着能量的补偿, YAP1上游调控基因MST1/2和LATS1/2的表达量显著升高, 能量补偿减缓了限饲对YAP1表达的抑制作用, 使肝脏也得到了补偿生长, 最后补偿生长组肝脏质量与对照组差异不显著。上述结果表明, 在能量限饲或补偿条件下, 机体可能通过调节Hippo通路核心基因的表达, 参与细胞的凋亡和增殖调控, 进而调节肝脏和机体的发育。
能量代谢平衡在组织器官的发育和机体稳态的维持等方面具有重要的作用。在调节能量代谢过程中, AMPK被认为是细胞的“能量感受器”和“燃料表”, 它的激活有助于纠正代谢紊乱, 使细胞代谢趋向生理平衡。研究发现, 在能量限饲或体内能量被耗竭时, 细胞内的腺苷三磷酸浓度降低, 而腺苷一磷酸的浓度升高, 进而激活AMPK的磷酸化; 随着对下游基因的调节, 机体能量合成代谢加强, 高浓度的腺苷三磷酸会抑制AMPK的磷酸化, 进而达到能量代谢的动态平衡[28]。在本研究中, 能量限饲使肝脏组织中pAMPK的表达量显著升高; 而随着能量补偿, pAMPK含量显著降低, 表明AMPK可能通过参与能量代谢而调节器官的发育。AMPK通过调控众多的下游分子来实现其对能量代谢的调控[29]。在近期的研究中发现, AMPK与Hippo信号通路形成调控网络参与机体或细胞的能量代谢与平衡调节[9]。能量限饲会激活AMPK, pAMPK会依次激活AMOTL1、LATS1和YAP1的磷酸化, YAP1磷酸化后在胞质中降解从而减弱了细胞的增殖能力[7]。同时AMPK能感知细胞内AMP/ATP比率, 在能量限饲时, AMPK能在多个位点直接磷酸化YAP1并抑制其进入细胞核[9]。YAP1在细胞核内会结合葡萄糖转运蛋白3和己糖激酶2等糖转运与代谢相关的关键基因, 通过调节糖酵解等来维持细胞内的能量平衡[30]。此外, Valis等[31]发现, MST1-YAP1-TEAD1通路的激活会抑制葡萄糖转运蛋白1和C-MYC等的表达, 扰乱细胞能量代谢平衡的同时抑制细胞的增殖。Son等[32]也发现, Hippo信号通路与mTOR和AKT等通路存在互作, 共同调节机体能量平衡和组织器官发育。在本试验中, AMPK的激活可能促进了Hippo信号通路中YAP1蛋白的磷酸化, 使得YAP1蛋白滞留在细胞质内, 不能进入细胞核与TEAD或其他转录因子结合, 从而抑制其转录活性, 下调促增殖和抑凋亡基因的表达; 而能量补偿后, 这种抑制细胞增殖的作用会被逆转。这一结果与Inoki等[33]发现的活化AMPK会抑制细胞增殖的结果一致。此外, 本试验中, 在能量限饲和补偿条件下YAP1的表达量均下降可能是因为在不同能量水平下, YAP1会受不同信号通路的调控而发挥不同的功能[34]。Hippo通路参与能量代谢和器官发育的调控机制还有待于进一步的研究。
总之, 3月龄雄性湖羊羔羊受60 d的能量限饲及90 d的营养恢复后, 湖羊的体质量和肝脏质量均表现出补偿生长效应; Hippo通路和AMPK共同参与湖羊补偿生长过程中肝脏组织发育的调控。
| [1] |
张吉顺, 刘念, 谈娇嫣, 等. 湖羊消化道各段T1R1、T1R3及PepT1基因表达水平的分析[J]. 畜牧与兽医, 2017(2): 51-56. Zhang J S, Liu N, Tan J Y, et al. Expression levels of T1R1/T1R3 and PepT1 genes in the gastrointestinal tract of Hu Sheep[J]. Animal Husbandry & Veterinary Medicine, 2017(2): 51-56 (in Chinese with English abstract). |
| [2] |
Ryan W, Williams I, Moir R. Compensatory growth in sheep and cattle. 1. Growth pattern and feed intake[J]. Australian Journal of Agricultural Research, 1993, 44(7): 1609-1621. DOI:10.1071/AR9931609 |
| [3] |
Picklo M J, Johnson L A, Idso J. PPAR mRNA levels are modified by dietary n-3 fatty acid restriction and energy restriction in the brain and liver of growing rats[J]. Journal of Nutrition, 2017, 147(2): 161-169. DOI:10.3945/jn.116.237107 |
| [4] |
Palma M, Scanlon T, Kilminster T, et al. The hepatic and skeletal muscle ovine metabolomes as affected by weight loss:a study in three sheep breeds using NMR-metabolomics[J]. Scientific Reports, 2016, 6: 39120-39130. DOI:10.1038/srep39120 |
| [5] |
Cui Y J, Hao Y, Li J L, et al. Chronic heat stress induces immune response, oxidative stress response, and apoptosis of finishing pig liver:a proteomic approach[J]. International Journal of Molecular Sciences, 2016, 17(5): 393-416. DOI:10.3390/ijms17050393 |
| [6] |
Edgar B A. From cell structure to transcription:hippo forges a new path[J]. Cell, 2006, 124(2): 267-273. DOI:10.1016/j.cell.2006.01.005 |
| [7] |
Deran M, Yang J, Shen C H, et al. Energy stress regulates Hippo-YAP signaling involving AMPK-mediated regulation of angiomotin-like 1 protein[J]. Cell Reports, 2014, 9(2): 495-503. DOI:10.1016/j.celrep.2014.09.036 |
| [8] |
Zhao B, Tumaneng K, Guan K L. The Hippo pathway in organ size control, tissue regeneration and stem cell self-renewal[J]. Nature Cell Biology, 2011, 13(8): 877-883. DOI:10.1038/ncb2303 |
| [9] |
Wang W, Xiao Z D, Li X, et al. AMPK modulates Hippo pathway activity to regulate energy homeostasis[J]. Nature Cell Biology, 2015, 17(4): 490-512. DOI:10.1038/ncb3113 |
| [10] |
Mo J S, Meng Z, Kim Y C, et al. Cellular energy stress induces AMPK-mediated regulation of YAP and the Hippo pathway[J]. Nature Cell Biology, 2015, 17(4): 500-510. DOI:10.1038/ncb3111 |
| [11] |
Pang J, Li F, Feng X, et al. Influences of different dietary energy level on sheep testicular development associated with AMPK/ULK1/autophagy pathway[J]. Theriogenology, 2018, 108: 362-370. DOI:10.1016/j.theriogenology.2017.12.017 |
| [12] |
Zhang T T, Zhang G M, Jin Y H, et al. Energy restriction affect liver development in Hu sheep ram lambs through Hippo signaling pathway[J]. Tissue and Cell, 2017, 49(5): 603-611. DOI:10.1016/j.tice.2017.08.004 |
| [13] |
李东.蒙古羔羊补偿生长能力的研究[D].呼和浩特: 内蒙古农业大学, 2011. Li D. The study of compensation growth in lamb of Mongolia[D]. Hohhot: Inner Mongolia Agricultural University, 2011(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10129-1011178432.htm |
| [14] |
祁东风, 杨苏亮, 李海静, 等. 动物补偿生长研究进展[J]. 动物营养学报, 2016, 28(6): 1655-1660. Qi D F, Yang S L, Li H J, et al. Research progress on compensatory growth in animals[J]. Chinese Journal of Animal Nutrition, 2016, 28(6): 1655-1660 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-267x.2016.06.004 |
| [15] |
伍喜林, 杨凤. 动物补偿生长效应研究[J]. 中国饲料, 2003(5): 9-11. Wu X L, Yang F. Research progress on compensatory growth[J]. China Feed Magazine, 2003(5): 9-11 (in Chinese). DOI:10.3969/j.issn.1004-3314.2003.05.005 |
| [16] |
晓利.蒙古绵羊妊娠后期限制饲养对其羔羊补偿生长的影响及机理的研究[D].呼和浩特: 内蒙古农业大学, 2006. Xiao L. Study of feed restriction of Mongolian ewes during late pregnancy on the compensatory growth of lambs and the mechanism Involved[D]. Hohhot: Inner Mongolia Agricultural University, 2006(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10129-2006101213.htm |
| [17] |
王震, 马铁伟, 邓凯平, 等. 能量限饲和补偿对湖羊生长性能及相关激素和肉品质的影响[J]. 南京农业大学学报, 2018, 41(4): 722-729. Wang Z, Ma T W, Deng K P, et al. Effects of energy restriction and compensation on growth performance, and related hormones and meat quality of Hu sheep[J]. Journal of Nanjing Agricultural University, 2018, 41(4): 722-729 (in Chinese with English abstract). DOI:10.7685/jnau.201703042 |
| [18] |
Mladenović D, Ninković M, Aleksić V, et al. The effect of calorie restriction on acute ethanol-induced oxidative and nitrosative liver injury in rats[J]. Environmental Toxicology & Pharmacology, 2013, 36(2): 296-302. |
| [19] |
Anikó P, Renáta S, Krisztina K, et al. Exercise training and calorie restriction influence the metabolic parameters in ovariectomized female rats[J]. Oxidative Medicine and Cellular Longevity, 2015, 2015: 1-8. |
| [20] |
Golbidi S, Daiber A, Korac B, et al. Health benefits of fasting and caloric restriction[J]. Current Diabetes Reports, 2017, 17(12): 123-133. DOI:10.1007/s11892-017-0951-7 |
| [21] |
Hyatt M A, Gopalakrishnan G S, Bispham J, et al. Maternal nutrient restriction in early pregnancy programs hepatic mRNA expression of growth-related genes and liver size in adult male sheep[J]. Journal of Endocrinology, 2007, 192(1): 87-97. DOI:10.1677/joe.1.06801 |
| [22] |
张冬梅, 侯先志, 杨金丽, 等. 饲粮能氮限饲与补偿对蒙古羔羊肝脏重量、肝细胞增殖和增肥及生长激素受体、类胰岛素生长因子基因表达量的影响[J]. 动物营养学报, 2013, 25(7): 1632-1640. Zhang D M, Hou X Z, Yang J L, et al. Dietary restriction and realimentation on energy and nitrogen:effects on liver weight, proliferation and expansion of liver cells and expression levels of GHR and IGFs genes in liver of Mongolian lambs[J]. Chinese Journal of Animal Nutrition, 2013, 25(7): 1632-1640 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-267x.2013.07.030 |
| [23] |
Zhou D, Conrad C, Xia F, et al. Mst1 and Mst2 maintain hepatocyte quiescence and suppress hepatocellular carcinoma development through inactivation of the YAP1 oncogene[J]. Cancer Cell, 2009, 16(5): 425-438. DOI:10.1016/j.ccr.2009.09.026 |
| [24] |
Meng Z, Moroishi T, Guank L. Mechanisms of Hippo pathway regulation[J]. Genes & Development, 2016, 30(1): 1-17. |
| [25] |
Dong J, Felamann G, Huang J, et al. Elucidation of a universal size-control mechanism in drosophila and mammals[J]. Cell, 2007, 130(6): 1120-1133. DOI:10.1016/j.cell.2007.07.019 |
| [26] |
Zhang J, Liu Z, Lian Z, et al. Monoacylglycerol lipase:a novel potential therapeutic target and prognostic indicator for hepatocellular carcinoma[J]. Scientific Reports, 2016, 6: 35784. DOI:10.1038/srep35784 |
| [27] |
Yang L, Faji Y, Jun L, et al. Mesenchymal stem cells enhance liver regeneration via improving lipid accumulation and Hippo signaling[J]. Stem Cells International, 2018, 2018: 1-11. |
| [28] |
Hardie D G. AMPK:positive and negative regulation, and its role in whole-body energy homeostasis[J]. Curr Opin Cell Biol, 2015, 33: 1-7. DOI:10.1016/j.ceb.2014.09.004 |
| [29] |
Garcia D, Shaw R J. AMPK:mechanisms of cellular energy sensing and restoration of metabolic balance[J]. Molecular Cell, 2017, 66(6): 789-800. DOI:10.1016/j.molcel.2017.05.032 |
| [30] |
Wang W, Li X, Chen J. Energy crisis and the Hippo pathway[J]. Cell Cycle, 2015, 14(13): 1995-1996. DOI:10.1080/15384101.2015.1046788 |
| [31] |
Valis K, Talacko P, Grobárová V, et al. Shikonin regulates C-MYC and GLUT1 expression through the MST1-YAP1-TEAD1 axis[J]. Experimental Cell Research, 2016, 349(2): 273-281. DOI:10.1016/j.yexcr.2016.10.018 |
| [32] |
Son S, Stevens M M, Chao H X, et al. Cooperative nutrient accumulation sustains growth of mammalian cells[J]. Scientific Reports, 2015, 5: 17401-17408. DOI:10.1038/srep17401 |
| [33] |
Inoki K, Zhu T, Guan K L. TSC2 mediates cellular energy response to control cell growth and survival[J]. Cell, 2003, 115(5): 577-590. DOI:10.1016/S0092-8674(03)00929-2 |
| [34] |
Hariharan I K. Energy stress tames the Hippo pathway[J]. Nat Cell Biol, 2015, 17(4): 362-363. DOI:10.1038/ncb3141 |




