文章信息
- 徐蓉, 陆明青, 张海涛, 黄灿平, 张冠卿, 鲍恩东, 孙卫东, 吕英军
- XU Rong, LU Mingqing, ZHANG Haitao, HUANG Canping, ZHANG Guanqing, BAO Endong, SUN Weidong, LÜ Yingjun
- 一株雏鹅痛风型鹅星状病毒的分离鉴定及其生物学特性研究
- Identification and characterization of a goose astrovirus causing gout in goslings
- 南京农业大学学报, 2019, 42(6): 1124-1132
- Journal of Nanjing Agricultural University, 2019, 42(6): 1124-1132.
- http://dx.doi.org/10.7685/jnau.201902008
-
文章历史
- 收稿日期: 2019-02-19
2. 立华牧业股份有限公司, 江苏 常州 213168;
3. 南京农业大学资产经营公司, 江苏 南京 210095
2. Lihua Muye Company Limited, Changzhou 213168, China;
3. Asset Management Company, Nanjing Agricultural University, Nanjing 210095, China
星状病毒(astrovirus, AstV)是一种无囊膜的、单链正义RNA病毒, 直径约为35 nm。病毒基因组大小从6.2 kb(人)到7.7 kb(鸭)不等, 包括1个5′-未翻译区、3个开放阅读框(ORF)、1个3′-未翻译区和1个Poly A尾[1]。ORF 1编码包括蛋白酶(ORF1a)和RNA依赖型RNA聚合酶(ORF1b)在内的非结构蛋白, ORF 2编码病毒衣壳蛋白(Cap蛋白), 是基因组中的高变区域, 特别是ORF2的3′端部分。
根据感染禽类和哺乳动物的能力, 星状病毒可分为两大类:哺乳动物星状病毒和禽星状病毒。按照国际病毒分类委员会规定, 哺乳动物星状病毒属由19个星状病毒种组成, 而禽星状病毒属包含3个种。哺乳动物星状病毒可感染人、牛、羊、狗等多种宿主, 多引起腹泻[2-5]。禽星状病毒主要感染火鸡、鸡和鸭, 在火鸡中检测到的火鸡星状病毒1型和2型(TAstV-1和TAstV-2)可引起禽肠炎综合征[6-10]; 在鸡中包括禽肾炎病毒(ANV)和鸡星状病毒(CAstV), 它们与生长发育迟缓、肠炎、肾脏疾病、内脏痛风、孵化问题和出生雏鸡羽毛发白(white chick)有关[11-14]; 鸭星状病毒包括鸭星状病毒1型(DAstV-1)和鸭星状病毒2型(DAstV-2), 主要导致雏鸭肝脏病变和25%~50%的死亡率[15-17]。在2018年前还未有鹅感染星状病毒的报道, 此后陆续在表现肠炎和内脏痛风症状的雏鹅中检测到星状病毒[18-23]。
2017年以来, 江苏省部分鹅场中4~16日龄雏鹅爆发了严重的内脏痛风, 发病鹅出现精神沉郁和2%~20%的死亡, 降低饲料中蛋白含量并不能缓解痛风症状。为了明确导致此次雏鹅痛风流行的病原, 我们从有明显内脏痛风症状的雏鹅脏器中进行病毒分离鉴定、生物学特性分析, 并对其进行动物回归实验, 以期阐明导致雏鹅痛风发生的原因。
1 材料与方法 1.1 材料 1.1.1 样本来源2017年8-11月, 在江苏地区6个鹅场中采集23只具有明显痛风症状病鹅的肝脏、脾脏、肾脏等组织。
1.1.2 试验动物10日龄和25日龄健康鹅胚若干, 分别用于病毒分离和肾脏上皮细胞的分离培养; 1日龄健康雏鹅(扬州白鹅)45只, 用于雏鹅痛风模型的复制。
1.1.3 主要试剂及仪器病毒核酸提取试剂盒(Thermo, 美国), 高保真酶(TaKaRa, 中国), Trizol、DNA聚合酶预混液、反转录试剂盒(Vazyme, 中国), DH5α感受态细胞(建成, 中国), T4连接酶、pUCm-T载体(上海生工, 中国), 5′/3′RACE试剂盒(Clontech, 美国), 胎牛血清(Sigma, 美国); 主要仪器:组织匀浆机(Servicebio, 中国), 高速冷冻离心机(Thermo, 美国), 普通PCR仪(TaKaRa, 中国), 电泳仪(北京市六一仪器厂), 凝胶成像系统(Tanon, 中国)。
1.2 病毒的分离与鉴定 1.2.1 病毒分离收集在PCR测定中仅为AstV阳性的样品用于病毒分离。将阳性样品混合, 加入PBS制备匀浆液(200 g · L-1), 冻融3次, 12 000 g离心5 min。经220 nm过滤后, 经卵黄囊途径按每个胚胎0.2 mL的量将悬浮液接种到10日龄的鹅胚中。将接种过的鹅胚放于37 ℃孵育, 每天检查存活情况。在盲传3代后, 在感染后10 d收集尿囊液并通过PCR检测鹅星状病毒(goose astrovirus, GAstV), 并观察胚体病变情况, 获得的病毒命名为GAstrV JSHA株。
1.2.2 PCR鉴定利用病毒核酸提取试剂盒提取样本中的病毒核酸, 然后使用逆转录试剂盒将RNA逆转录成cDNA。针对国内商品鹅群常发的病毒性疾病, 利用已报道的这些相关病毒特异性引物(表 1), 对样本进行病毒检测, 包括鹅细小病毒(GPV)[24]、鹅出血性多瘤病毒(GHPV)[25]、鹅呼肠孤病毒(GRV)[26]、鹅副黏病毒(GPMV)[27]、鸭坦布苏病毒(TMUV)[28], 并根据ORF1b设计AstV通用引物。
| 引物名称 Name of primer |
引物对序列 Primer pairs sequences(5′→3′) |
产物大小/bp Product size |
| GPV-F/R | AGACTTATCAACAACCATCAT(C)T/TCACTTATTCCTGCTGTAG | 779 |
| GHPV-F/R | GGATGCTGCCTCTAATTCTA/CGCAGTTAATCAGCTTACAA | 1 232 |
| GRV-F/R | TGAGACGCCTGACTACGATT/ATGCTTGGAGTGAGACGACT | 380 |
| GPMV-F/R | TGCTTTCCCGAATCACCATGAC/GTTGCAACCCCAAGAGCTACAC | 524 |
| Tembusu-F/R | GCCACGGAATTAGCGGTTGT/TAATCCTCCATCTCAGCGGTGTAG | 401 |
| AstV-F/R | CGCTTYGATGGNATHCC/GGYTTKACCCACATNCCRAA | 428 |
将25日龄的健康鹅胚肾脏在无菌条件下取出, 切成小块, 用PBS冲洗4次。添加Ⅰ型胶原酶(1 mg · L-1)在4 ℃放置消化14~16 h, 加入含10%胎牛血清的DMEM, 然后1 000 g 4 ℃离心10 min。再用含10%胎牛血清、100 U · L-1青霉素和100 U · L-1链霉素的DMEM重悬细胞团, 转移至细胞培养皿中, 置于CO2培养箱中培养1 h后, 将细胞转移到新的细胞培养皿上, 加入0.1 mmol · L-1 5-溴脱氧尿嘧啶核苷(BrdU)抑制成纤维细胞生长, 获得细胞即为鹅肾脏上皮细胞(GEK)。将GEK细胞接种96孔板, 当细胞铺满70%时, 弃培养液, 用无菌PBS洗涤细胞2次, 将传至第3代的尿囊液用含2%胎牛血清的DMEM(维持液)进行10-2~10-10的梯度稀释, 每孔100 μL, 接种GEK细胞, 每个稀释梯度6个平行。阴性对照组加入等体积不含病毒的维持液。37 ℃继续培养4 d, 观察并记录每个病毒稀释梯度出现细胞病变的孔数, 并根据Reed-Muench的方法计算病毒滴度。
1.2.4 病毒基因的克隆及序列分析参照Zhang等[22]的方法合成扩增鹅星状病毒JSHA株全基因序列的引物6对(1F-6F, 1R-6R)以及特异性鉴定引物1对(7F, 7R)。同时, 用5′/3′RACE试剂盒, 按照说明书扩增病毒基因组的5′和3′末端。所有扩增产物纯化并克隆到pUCm-T载体, 送上海生工生物工程有限公司测序。使用DNASTAR 6.0对测序结果进行序列拼接, 将拼接结果提交GenBank, 获得序列号:MK125058。根据NCBI中收录的其他禽星状病毒序列, 使用MEGA 7.0软件进行核苷酸、氨基酸序列的比对分析, 采用邻接法构建系统进化树, 选择遗传距离模式(P-distance), 自举检验取值1 000。
1.3 动物回归实验 1.3.1 病毒接种与病料样本采集实验前, 从45只1日龄健康雏鹅(扬州白鹅)中随机挑选5只处死, 未发现明显剖检病变, PCR检测各脏器均不含有鹅星状病毒。将剩下的40只鹅随机分成2组, 每组20只, 阴性对照组每只肌肉注射0.5 mL PBS; 攻毒组每只肌肉注射第3代病毒尿囊液0.5 mL(约含有5×103.25 TCID50 · mL-1)。每天观察鹅的临床症状, 每隔3 d(即接种后3、6、9、12、15 d)对攻毒组和阴性对照组的鹅分别称质量并收集泄殖腔拭子, 并在接种后7和15 d翅静脉采集血样。在15 d时, 处死所有存活的雏鹅, 采集心脏、肝脏、脾脏、肺脏、肾脏、肠、胰腺和脑并观察剖检变化。将这些组织的一部分固定于10%甲醛溶液中, 用于组织病理学检查, 其余的储存于-80 ℃。
1.3.2 雏鹅攻毒后肾脏、肝脏和脾脏组织病理学检测将固定于10%甲醛中的组织样品经不同浓度梯度乙醇脱水, 二甲苯中透明后, 包埋于石蜡中, 然后将样品连续切成4 μm薄片, 进行常规的苏木精和伊红(HE)染色, 最后用光学显微镜观察染色的切片。
1.3.3 雏鹅攻毒后各组织中病毒含量的检测用PBS将组织样品制成300 g · L-1悬浮液, 加入小钢珠, 放于高通量组织研磨机中匀浆, 然后, 将匀浆液置于4 ℃, 12 000 g离心5 min。取200 μL上清液用于RNA提取。使用试剂盒将提取的总RNA逆转录为cDNA, 用基于病毒ORF 2基因设计的一组特异性引物对其进行PCR扩增。
1.3.4 雏鹅攻毒后泄殖腔拭子病毒含量检测用PBS浸泡泄殖腔拭子并以12 000 g离心5 min, 按照步骤1.2.7处理200 μL上清液, 用于PCR检测。
1.3.5 雏鹅攻毒后血清中尿酸含量检测收集血液样品并以3 000 g离心, 获得血清, 用尿酸检测试剂盒(碧云天)按照说明书测量血清中的尿酸含量。
1.4 数据分析采用t测验分析对照组和试验组的体质量和血清中尿酸含量的差异, 结果表示为平均值±标准差(x±SD)。
2 结果与分析 2.1 样本病毒检测由图 1可知:通过PCR方法检测样本中可能存在的病原, 检测结果表明样本仅为星状病毒阳性。

|
图 1 临床采集病鹅样本中的病原鉴定 Fig. 1 Identification of pathogens in clinical goose samples M. DNA标准品DNA marker; 1.星状病毒Goose astrovirus; 2.阴性对照Negative control; 3.鹅细小病毒Goose parvorirus; 4.鹅出血性多瘤病毒Goose hemorrhagic polyomavirus; 5.鹅呼肠孤病毒Goose reovius; 6.鹅源副黏病毒Goose paramyxovirus; 7.鸭坦布苏病毒Duck tembusu virus. |
选择鹅星状病毒阳性样本用来分离病毒。将样品组织匀浆液接种5个10日龄的鹅胚中, 进行3次传代。传至第3代时鹅胚出现死亡, 死亡率为40%。由图 2可见:对照组胚体及肾脏未见明显变化(图 2-A、C、E), 但感染的胚胎表现出典型的病理学变化:绒毛膜尿囊膜增厚(图 2-B), 发育不良、水肿、出血(图 2-D), 肾脏发白肿胀、输尿管尿酸盐沉积(图 2-F)。将星状病毒阳性尿囊液接种于肾脏上皮细胞后, 细胞出现明显的病变:变圆、聚团、脱落等。根据Reed-Muench方法, 计算得到病毒滴度为104.25 TCID50 · L-1。
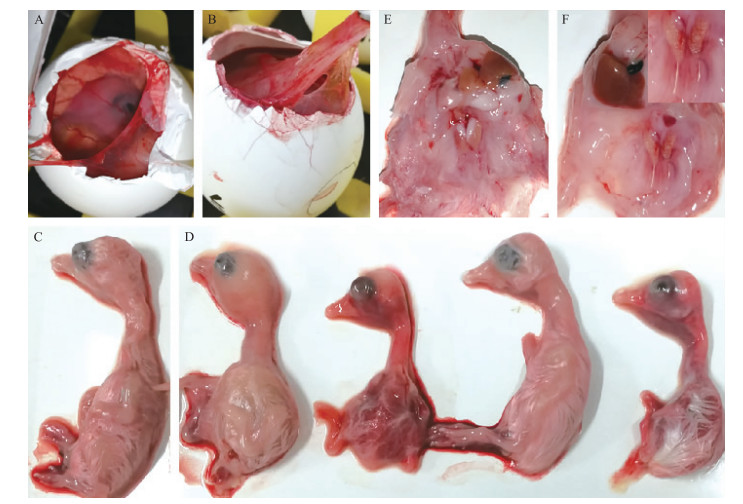
|
图 2 鹅胚接种JSHA病毒10 d后的病理学变化 Fig. 2 Pathological changes of goose embryos at 10 d after inoculation with GAstV JSHA A-B.阴性对照组鹅胚、攻毒组鹅胚的尿囊膜Chorioallantoic membrane of negative control and infected embryo, respectively; C-D.阴性对照组鹅胚、攻毒组鹅胚胚体变化Appearance of negative control and infected embryo, respectively; E-F.阴性对照组鹅胚、攻毒组鹅胚的肾脏Kidney of negative control and infected embryo, respectively. |
测序结果显示, JSHA全基因组长度为7 175 bp。全基因组核苷酸序列和ORF2基因氨基酸序列的系统进化分析表明:JSHA与2018年报道的引起痛风的鹅星状病毒毒株(SD01、SDPY、GD)聚成1个分支, 并与TAstV-2和DAstV-1形成1个邻近的进化支, 而与其他禽星状病毒形成了独立的进化支(图 3)。

|
图 3 基于禽星状病毒的核苷酸全序列(A)和ORF2氨基酸序列(B)的进化树分析 Fig. 3 Phylogenetic analysis of avastroviruses based on the complete genome(A)and amino acid sequence of full-length ORF2(B) TAstV-1:火鸡星状病毒1型Tukey astrovirus type 1;TAstV-2:火鸡星状病毒2型Tukey astrovirus type 2;ANV-1:禽肾炎病毒1型Avian nephritis virus type 1;CAstV-A:鸡星状病毒A亚群Chicken astrovirus type A; CAstV-B:鸡星状病毒B亚群Chicken astrovirus type B; DAstV-1:鸭星状病毒1型Duck astrovirus type 1;DAstV-2:鸭星状病毒2型Duck astrovirus type 2;DAstV-3:鸭星状病毒3型Duck astrovirus type 3;DAstV-4:鸭星状病毒4型Duck astrovirus type 4;GAstV:鹅星状病毒Goose astrovirus.下表同此。The same as in the Table 2. |
进一步分析3种ORF的全基因组核苷酸序列和氨基酸序列, 得到了JSHA与其他禽星状病毒的进化关系(表 2)。JSHA与2018年报道的引起痛风的鹅星状病毒毒株(SD01、SDPY、GD)同源性最高(全长序列>98%;ORF1a >99%;ORF1b 100%;ORF2 >99%), 与能导致雏鹅肠炎的鹅星状病毒(FLX)同源性较低(全长序列54.6%;ORF1a 47.5%;ORF1b 60.9%;ORF2 40.7%)。JSHA与其他星形病毒的同源性也较低:全基因组为46.5%~62.0%, ORF1a为28.1%~59.0%, ORF1b为8.1%~68.4%, ORF2为27.3%~57.0%。鹅星状病毒JSHA与其他从患有痛风的鹅中分离得到的星状病毒毒株遗传距离较近, 为0.002~0.005, 与禽星状病毒属的其他代表性毒株遗传距离较远, 为0.389~0.713(表 2)。
| 禽星状病毒种类 Avastrovirusspecies |
病毒类型 Type of virus |
毒株 Strain |
基因序列号 GenBankaccession No. |
序列同源性/% Sequence identity |
遗传距离(ORF2) Genetic distance |
|||
| 全基因组Genome | ORF1a | ORF1b | ORF2 | |||||
| 禽星状病毒1型 Astrovirus 1 |
TAstV-1 | - | Y15936.2 | 51.7 | 39.6 | 55.7 | 38.5 | 0.601 |
| TAstV-2 | - | AF206663 | 46.5 | 28.1 | 8.1 | 27.3 | 0.713 | |
| 禽星状病毒2型 Astrovirus 2 |
ANV-1 | G-4260 | BAA92848 | 62.0 | 59.0 | 68.4 | 57.0 | 0.429 |
| CAstV-A | G059 | KT886453 | 58.5 | 48.6 | 64.3 | 56.3 | 0.389 | |
| CAstV-B | GA2011 | JF414802 | 59.4 | 58.2 | 68.0 | 38.2 | 0.592 | |
| 禽星状病毒3型 Astrovirus 3 |
DAstV-1 | C-NGB | FJ434664 | 55.9 | 49.9 | 65.1 | 37.1 | 0.620 |
| DAstV-2 | SL1 | KF753804 | 53.2 | 42.0 | 61.4 | 35.5 | 0.643 | |
| 未分类的 Unassigned |
DAstV-3 | CPH | KJ020899 | 54.9 | 48.4 | 65.1 | 37.0 | 0.597 |
| DAstV-4 | YP2 | JX624772 | 55.2 | 48.4 | 65.1 | 37.4 | 0.618 | |
| GAstV | FLX | KY271027 | 54.6 | 47.5 | 60.9 | 40.7 | 0.581 | |
| GAstV | SD01 | MF772821 | 98.8 | 99.3 | 100 | 99.1 | 0.005 | |
| GAstV | SDPY | MH052598 | 98.7 | 99.8 | 100 | 99.3 | 0.005 | |
| GAstV | GD | MG934571 | 99.0 | 99.6 | 100 | 99.7 | 0.002 | |
采用肌肉注射的方式将0.5 mL尿囊液注射于20只2日龄的雏鹅, 攻毒组鹅从攻毒后的12 d开始体质量明显减轻, 在12、15 d时, 平均体质量明显低于阴性对照组(P < 0.05)(图 4), 表明鹅星状病毒JSHA株对雏鹅具有致病性; 而阴性对照组雏鹅一直未见死亡或明显的临床症状(图 5-A-E)。
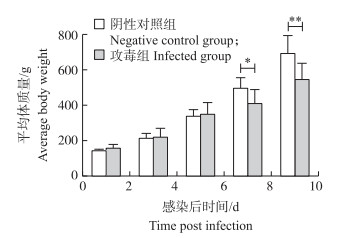
|
图 4 JSHA攻毒后对雏鹅平均体质量的影响(n=10) Fig. 4 Average body weights of goslings in response to JSHA attacking *P < 0.05;* *P < 0.01. The same as follows. |
20只攻毒雏鹅中有5只死亡, 尸检发现死亡的雏鹅表现为肝、心、肾、腺胃黏膜表面及胆囊内、关节腔均有尿酸盐沉积(图 5-a-e), 肾肿大、发白, 输尿管内有白色尿酸盐(图 5-b)。然而, 大多数存活的雏鹅没有出现痛风病变, 只有肾脏发白、肿胀。
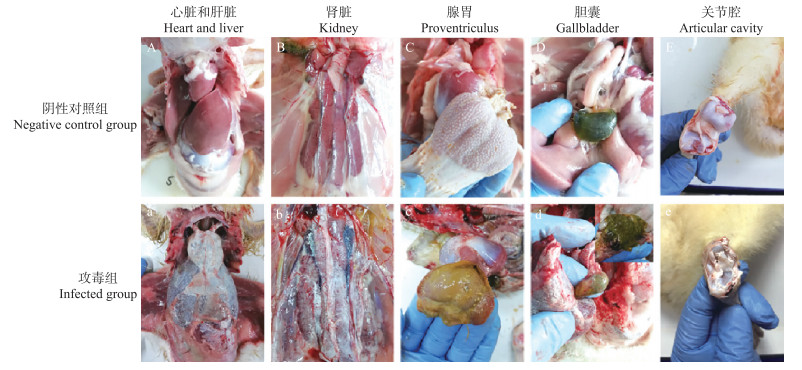
|
图 5 雏鹅攻毒15 d后各脏器病变 Fig. 5 Gross lesions of goslings at 15 d post infection with GAstV JSHA |
经组织病理学检查, 阴性对照组雏鹅的肾脏、肝脏和脾脏未见明显病理变化(图 6-A、B、C)。攻毒组雏鹅肾脏出现肾小管上皮细胞变性坏死、尿酸盐结晶形成、炎性细胞浸润, 包括淋巴细胞、巨噬细胞, 偶尔还可见肾内出现多核巨细胞(图 6-a)。肝脏和脾脏也出现了坏死和炎性细胞浸润(图 6-b、c)。
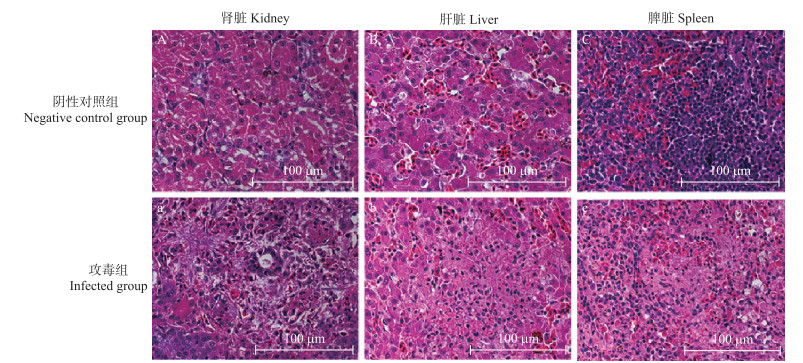
|
图 6 雏鹅攻毒后肾脏、肝脏和脾脏组织病理学变化 Fig. 6 Histopathological changes in kidney, liver and speen of experimentally infected goslings |
随机选取3只攻毒组雏鹅和2只阴性对照组雏鹅, 取相同的器官样本(0.3 g), PCR检测鹅星状病毒, 如图 7所示, 阴性对照组各脏器中均未检出鹅星状病毒, 而攻毒组雏鹅的心、肝、脾、肺、肾、肠、胰、脑等器官均检出该病毒, 尤其是肝脏、脾脏和肾脏的病毒含量较高。

|
图 7 雏鹅攻毒后各脏器病毒载量 Fig. 7 Virus load in different experimentally infected gosling organs M. DNA标准品; 1.心脏; 2.肝脏; 3.脾; 4.肺; 5.肾; 6.大脑; 7.肠; 8.胰腺。 M. DNA marker; 1. Heart; 2. Liver; 3. Spleen; 4. Lung; 5. Kidney; 6. Brain; 7. Intestine; 8. Pancreas. |
采用PCR方法检测10只攻毒组雏鹅的泄殖腔拭子样本, 进行排毒情况的观察, 如图 8-A所示, 试验结果表明, 雏鹅从感染后的3 d开始排毒, 一直到15 d, 排毒高峰出现在6~9 d。对照组的泄殖腔拭子样本中未检测到病毒。

|
图 8 雏鹅攻毒后排毒情况(A)和血清尿酸含量(B)(n=10) Fig. 8 Virus shedding and serum uric acid content in experimentally infected goslings |
攻毒组雏鹅血清尿酸含量在7 d时两组无显著差异, 而在15 d时极显著高于对照组(P < 0.01)(图 8-B)。
3 讨论本试验分离出了1株能引起肾痛风的鹅星状病毒, 命名为JSHA株。JSHA毒株与2018年报道的能引起痛风的鹅星状病毒毒株(SD01、SDPY、GD)在ORF1a、ORF1b和ORF2的氨基酸序列上有98%以上的同源性[20, 22-23]。由此推断, 2017年以来, 我国流行的雏鹅痛风是由同种星状病毒引起的。禽肾炎病毒、鸡星状病毒属B亚群(Biii)也可引起肾脏疾病和内脏痛风[11, 29-30], 而与其代表毒株相比JSHA毒株ORF2基因氨基酸同源性仅为27.3%和37.4%, 说明JSHA毒株与它们有很大区别, 很可能并非是从它们进化而来的。对ORF2基因氨基酸序列的进化分析表明, JSHA株与火鸡星状病毒2型(TAstV-2)和鸭星状病毒1型(DAstV-1)亲缘关系较近, 形成了邻近支, 因此推测JSHA毒株可能是从鸭演变而来的, 由于鹅和鸭都生活在水里, 经常互相接触, 为病毒的跨种属传播创造了有利条件。但目前尚不清楚JSHA毒株对鸭是否具有易感性, 这有待进一步研究。
JSHA毒株可在鹅胚中复制, 引起典型的病理学变化, 如绒毛尿囊膜增厚、发育不良、水肿、出血、输尿管内尿酸盐沉积, 这与自然感染鹅星状病毒的临床症状非常相似, 说明该分离株与雏鹅痛风的发生有关。为进一步证实JSHA毒株是痛风的致病因素, 本试验对20只雏鹅肌内注射尿囊液, 约25%的感染雏鹅死亡, 死亡后出现了典型的痛风病理变化, 与自然感染临床症状相似, 表明JSHA毒株是雏鹅痛风发生的原因。然而, 从雏鹅感染后的死亡率来看, 虽然JSHA与报道的能引起雏鹅痛风的毒株在基因组序列上具有较高的同源性, 但死亡率却相差很大(0%~75%)[20, 22-23], 这可能与使用的病毒剂量、感染途径和雏鹅的健康状况有关。
在动物回归实验中, 部分感染雏鹅虽未死亡或未出现内脏痛风, 但均表现肾脏发白、肿胀, 表明肾脏是病毒感染的主要靶器官, 这和本试验及以前研究中肾脏的病毒滴度高于其他组织[23]的结果相符合, 而且组织病理学结果显示肾脏近曲小管上皮细胞变性坏死和炎性细胞浸润, 从中我们可以推断该病毒容易攻击肾脏上皮细胞, 引起肾脏结构和功能损伤, 进而影响尿酸的排泄。在我们随后的试验中也证实雏鹅攻毒15 d后血清中尿酸含量明显升高。已有研究表明人星状病毒感染肠上皮细胞后能增加肠道上皮屏障的通透性[31-32], 鹅星状病毒是否通过感染肾脏上皮细胞进而引起尿酸的升高, 其机制有待进一步研究。
综上所述, 本研究从患痛风的雏鹅中分离到1株新的鹅星状病毒毒株JSHA, 该毒株与2018年报道的引起痛风的鹅星状病毒毒株同源性较高, 而与其他禽类星状病毒的同源性较低; 该毒株可在鹅胚和鹅肾上皮细胞中复制; JSHA毒株感染雏鹅后引起血清中尿酸含量升高以及内脏和关节腔内痛风。因此, 分离到的鹅星状病毒是临床上观察到的雏鹅痛风的主要病原。
| [1] |
Cydney J, Virginia H, Valerie C, et al. Astrovirus pathogenesis[J]. Viruses, 2017, 9(1): 22. DOI:10.3390/v9010022 |
| [2] |
Jonassen C M, Jonassen T T, Sveen T M, et al. Complete genomic sequences of astroviruses from sheep and turkey:comparison with related viruses[J]. Virus Research, 2003, 91(2): 195-201. DOI:10.1016/S0168-1702(02)00269-1 |
| [3] |
Li L, Diab S, McGraw S, et al. Divergent astrovirus associated with neurologic disease in cattle[J]. Emerging Infectious Diseases, 2013, 19(9): 1385-1392. DOI:10.3201/eid1909.130682 |
| [4] |
Madeley C, Cosgrove B. Viruses in infantile gastroenteritis[J]. The Lancet, 1975, 2(7925): 124. |
| [5] |
Martella V, Moschidou P, Catella C, et al. Enteric disease in dogs naturally infected by a novel canine astrovirus[J]. Journal of Clinical Microbiology, 2012, 50(3): 1066-1069. DOI:10.1128/JCM.05018-11 |
| [6] |
Jindal N, Patnayak D P, Chander Y, et al. Detection and molecular characterization of enteric viruses from poult enteritis syndrome in turkeys[J]. Poultry Science, 2010, 89(2): 217-226. DOI:10.3382/ps.2009-00424 |
| [7] |
Mor S K, Abin M, Costa G, et al. The role of type-2 turkey astrovirus in poult enteritis syndrome[J]. Poultry Science, 2011, 90(12): 2747-2752. DOI:10.3382/ps.2011-01617 |
| [8] |
Mor S K, Sharafeldin T A, Abin M, et al. The occurrence of enteric viruses in light turkey syndrome[J]. Avian Pathology, 2013, 42(5): 497-501. DOI:10.1080/03079457.2013.832145 |
| [9] |
Pantin-Jackwood M J, Day J M, Jackwood M W, et al. Enteric viruses detected by molecular methods in commercial chicken and turkey flocks in the United States between 2005 and 2006[J]. Avian Diseases, 2008, 52(2): 235-244. DOI:10.1637/8174-111507-Reg.1 |
| [10] |
Schultz-Cherry S, Kapczynski D R, Simmons V M, et al. Identifying agent(s)associated with poult enteric mortality syndrome:importance of the thymus[J]. Avian Diseases, 2000, 44(2): 256-265. DOI:10.2307/1592538 |
| [11] |
Bulbule N R, Mandakhalikar K D, Kapgate S S, et al. Role of chicken astrovirus as a causative agent of gout in commercial broilers in India[J]. Avian Pathology, 2013, 42(5): 464-473. DOI:10.1080/03079457.2013.828194 |
| [12] |
Sajewicz-Krukowska J, Pac K, Lisowska A, et al. Astrovirus-induced 'White chicks' condition-field observation, virus detection and preliminary characterization[J]. Avian Pathology, 2016, 45(1): 2-12. DOI:10.1080/03079457.2015.1114173 |
| [13] |
Smyth V, Trudgett J, Wylie M, et al. Chicken astrovirus detected in hatchability problems associated with 'White chicks'[J]. Veterinary Record, 2013, 173(16): 403-404. DOI:10.1136/vr.f6393 |
| [14] |
Todd D, Wilkinson D S, Jewhurst H L, et al. A seroprevalence investigation of chicken astrovirus infections[J]. Avian Pathology, 2009, 38(4): 301-309. DOI:10.1080/03079450903055421 |
| [15] |
Gough R E, Borland E D, Keymer L F, et al. An outbreak of duck hepatitis type Ⅱ in commercial ducks[J]. Avian Pathology, 1985, 14(2): 227-236. DOI:10.1080/03079458508436224 |
| [16] |
Sandhu T S, Calnek B W, Zeman L. Pathologic and serologic characterization of a variant of duck hepatitis type Ⅰ virus[J]. Avian Diseases, 1992, 36(4): 932-936. DOI:10.2307/1591552 |
| [17] |
Todd D, Smyth V J, Ball N W, et al. Identification of chicken enterovirus-like viruses, duck hepatitis virus type 2 and duck hepatitis virus type 3 as astroviruses[J]. Avian Pathology, 2009, 38(1): 21-30. |
| [18] |
Zhang Y X, Wang F M, Liu N, et al. Complete genome sequence of a novel avastrovirus in goose[J]. Archives Virology, 2017, 162(7): 2135-2139. DOI:10.1007/s00705-017-3297-1 |
| [19] |
Jin M L, Wang X Y, Ning K, et al. Genetic characterization of a new astrovirus in goslings suffering from gout[J]. Archives Virology, 2018, 163(10): 2865-2869. DOI:10.1007/s00705-018-3932-5 |
| [20] |
Niu X Y, Tian J J, Yang J, et al. Novel goose astrovirus associated gout in gosling, China[J]. Veterinary Microbiology, 2018, 220: 53-56. DOI:10.1016/j.vetmic.2018.05.006 |
| [21] |
Yang J, Tian J J, Tang Y, et al. Isolation and genomic characterization of gosling gout caused by a novel goose astrovirus[J]. Transboundary and Emerging Diseases, 2018, 65(6): 1689-1696. DOI:10.1111/tbed.12928 |
| [22] |
Zhang Q S, Cao Y X, Wang J, et al. Isolation and characterization of an astrovirus causing fatal visceral gout in domestic goslings[J]. Emerging Microbes & Infections, 2018, 7(1): 71. |
| [23] |
Zhang X Y, Ren D, Li T F, et al. An emerging novel goose astrovirus associated with gosling gout disease, China[J]. Emerging Microbes & Infections, 2018, 7(1): 152. |
| [24] |
Li P F, Zhang R H, Chen J H, et al. Development of a duplex semi-nested PCR assay for detection of classical goose parvovirus and novel goose parvovirus-related virus in sick or dead ducks with short beak and dwarfism syndrome[J]. Journal of Virological Methods, 2017, 249: 165-169. DOI:10.1016/j.jviromet.2017.09.011 |
| [25] |
Corrand L, Gelfi J, Albaric O, et al. Pathological and epidemiological significance of goose haemorrhagic polyomavirus infection in ducks[J]. Avian Pathology, 2011, 40(4): 355-360. DOI:10.1080/03079457.2011.582481 |
| [26] |
Niu X Y, Zhang B Q, Yu X L, et al. Preparation and evaluation of goose reovirus inactivated vaccine[J]. BMC Veterinary Research, 2017, 13(1): 214. DOI:10.1186/s12917-017-1134-0 |
| [27] |
黄宇翔, 李洪彬, 张军, 等. 一株鹅副黏病毒的初步分离及鉴定[J]. 中国家禽, 2018, 40(2): 63-65. Huang Y X, Li H B, Zhang J, et al. Preliminary isolation and identification of a goose paramyxovirus[J]. China Poultry, 2018, 40(2): 63-65 (in Chinese). |
| [28] |
Su J. Duck egg-drop syndrome caused by BYD virus, a new tembusurelated flavivirus[J]. PLoS One, 2011, 6(3): e18106. DOI:10.1371/journal.pone.0018106 |
| [29] |
Imada T, Yamaguchi S, Kawamura H. Pathogenicity for baby chicks of the G-4260 strain of the picornavirus"avian nephritis virus"[J]. Avian Diseases, 1979, 23(3): 582-588. DOI:10.2307/1589733 |
| [30] |
Imada T, Yamaguchi S, Mase M, et al. Avian nephritis virus(ANV)as a new member of the family Astroviridae and construction of infectious ANV cDNA[J]. Journal of Virology, 2000, 74(18): 8487-8493. DOI:10.1128/JVI.74.18.8487-8493.2000 |
| [31] |
Cortez V, Meliopoulos V A, Karlsson E A, et al. Astrovirus biology and pathogenesis[J]. Annual Review of Virology, 2017, 4: 327-348. DOI:10.1146/annurev-virology-101416-041742 |
| [32] |
Moser L A, Carter M, Schultz-Cherry S. Astrovirus increases epithelial barrier permeability independently of viral replication[J]. Journal of Virology, 2007, 81(21): 11937-11945. DOI:10.1128/JVI.00942-07 |




