文章信息
- 刘朋, 徐宏军, 王麒文, 王永恒, 董婷婷, 杨倩
- LIU Peng, XU Hongjun, WANG Qiwen, WANG Yongheng, DONG Tingting, YANG Qian
- 口服表达猪流行性腹泻病毒S蛋白的重组枯草芽胞杆菌对母猪乳源性免疫力的影响
- Effect on lactogenic immunity of sows by orally recombinant Bacillus subtilis expressing the spike protein of porcine epidemic diarrhea virus
- 南京农业大学学报, 2019, 42(6): 1118-1123
- Journal of Nanjing Agricultural University, 2019, 42(6): 1118-1123.
- http://dx.doi.org/10.7685/jnau.201902002
-
文章历史
- 收稿日期: 2019-02-14
2. 青岛蔚蓝生物制品有限公司, 山东 青岛 266114
2. Qingdao Weilan Biological Products Co. Ltd., Qingdao 266114, China
猪流行性腹泻是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)引起的一种以水样腹泻为主要特征的传染病。在新生仔猪中尤其严重, 感染后死亡率可达100%, 给养猪业造成了巨大的经济损失[1]。目前市场上预防猪流行性腹泻的疫苗多数是传统的肌肉注射疫苗, 由于新生仔猪免疫系统发育不完善, 注射疫苗不能及时产生保护力, 导致免疫屡屡失败。通过给母猪免疫, 在初乳中产生的母源抗体使新生仔猪获得被动性乳源性免疫力是目前预防新生仔猪肠道传染病理想的策略。
猪肠道中分布有大量肠道相关的淋巴样组织(gut-associated lymphoid tissue, GALT)。口服免疫可诱导该部位产生较多的IgA浆母细胞和T细胞, 这些细胞除了分布在局部肠道外, 还有一部分借助“肠道—乳腺—SIgA轴”向乳腺中进行迁移, 在乳汁中产生较多的SIgA和细胞因子[2]。但由于动物胃肠道内胃酸和蛋白酶的存在, 从而影响了口服疫苗的效果。近年来很多学者在研究如何提高口服免疫的效果, 其中抗原递呈载体的应用是一种有效策略。枯草芽胞杆菌(Bacillus subtilis)是目前应用广泛的饲料添加剂, 不仅本身具有免疫增强效果, 还能作为抗原递呈载体用于口服免疫[3]。此外, 枯草芽胞杆菌储存不需要冷藏, 降低了运输成本[4]。因此, 口服枯草芽胞杆菌更安全方便, 尤其适合母猪。本课题组牟春晓成功构建了表达PEDV S蛋白的重组枯草芽胞杆菌, 经口服在小鼠体内已表现出良好的免疫效果[5], 在母猪上的免疫效果尚未得到验证。
母猪乳汁中除了营养物质外, 还含有大量免疫球蛋白、细胞因子以及淋巴细胞[2]。SIgA是乳源性免疫中重要的免疫球蛋白, 有研究表明仔猪采食了含有较高特异性SIgA抗体的乳汁, 其粪便中有较低的PEDV载量[6]。此外, 乳汁中还含有丰富的细胞, 其中淋巴细胞占15%~25%, 它们可穿过新生儿肠上皮细胞进入肠系膜淋巴结, 促进新生儿免疫系统的发育[7]。因此, 本试验通过给母猪口服表达PEDV S蛋白的重组枯草芽胞杆菌, 检测乳汁中特异性SIgA及其乳汁细胞中特异性IgA和细胞因子的水平, 以期为预防新生仔猪流行性腹泻提供简便有效的方法。
1 材料与方法 1.1 试验材料表达PEDV S蛋白的重组枯草芽胞杆菌由本实验室构建[5]。IgA和IgG抗体均用本实验室保存的PEDV S蛋白包被的间接ELISA试剂盒检测, 猪IFN-γ和TGF-α ELISA试剂盒购自上海沪宇生物科技有限公司; PEDV浙江08株(1×107 TCID50 · mL-1)由北京大北农科技集团有限公司兽医医学研究中心提供。
所用的试验母猪是由与青岛市蔚蓝生物制品有限公司合作的猪场平度市惠友良种猪场提供。所用长白母猪为第2胎次, 且猪流行性腹泻、猪瘟、猪繁殖与呼吸综合征、猪伪狂犬和猪圆环病均为阴性。
1.2 试验方法 1.2.1 试验设计从猪场中挑选了15头健康的生产母猪(PEDV阴性), 分为3组, 每组5头。第1组(口服组)在产前40 d经口饲喂2 mL表达PEDV S蛋白重组枯草芽胞杆菌(1×109 CFU · mL-1); 第2组(肌注组)在产前40 d肌肉注射2 mL灭活的PEDV疫苗, 10 d后再肌肉注射1次, 剂量相同; 第3组(对照组)既不注射灭活苗也不饲喂重组枯草芽胞杆菌。
1.2.2 样品采集和处理15头母猪分娩后1 d, 采集乳汁、鼻腔、口腔、肛门分泌物以及血液。乳汁处理:取20 mL乳汁置于冰上, 用210 μm孔径的尼龙网过滤一次, 4 ℃ 1 600~1 700 r · min-1离心15 min, 收集上清液; 沉淀的细胞用25 mL PBS重悬, 重复上步骤一次; 5 mL PBS轻轻重悬细胞, 避免脂肪沉积, 将细胞悬液转移至新的无菌管中。采用超声波破碎, 以使细胞破坏并放出细胞内成分, 4 ℃ 2 000~3 000 r · min-1离心20 min, 收集上清液, 分装后-80 ℃保存。收集的上清液和细胞裂解后的上清液用于检测特异性SIgA和IgA以及INF-γ和TGF-α水平。血液处理:4 ℃ 5 000 r · min-1离心5 min, 收集上清液, 用于检测特异性IgG。鼻腔、口腔和肛门拭子处理:4 ℃ 12 000 r · min-1离心15 min, 收集上清液, 用于检测特异性SIgA以及INF-γ和TGF-α。
1.2.3 乳汁中特异性SIgA及其乳汁中细胞IgA水平的检测取1 μg · mL-1纯化的PEDV S蛋白包被酶标板, 每孔100 μL, 4 ℃孵育过夜; PBST洗涤5次(每次5 min), 甩干后每孔加400 μL 30 g · L-1牛血清白蛋白, 37 ℃孵育2 h; 洗涤后每孔加100 μL乳汁和乳汁细胞裂解后的上清液(1 : 40稀释液和原液), 37 ℃孵育1.5 h; 将待检样品洗涤后每孔加100 μL HRP标记的羊抗猪IgA(1 : 4 000和1 : 2 000), 37 ℃孵育1 h; 洗涤后每孔加100 μL底物显色液TMB液, 37 ℃避光作用5 min; 加50 μL终止液终止显色; 酶标仪读D450值。
1.2.4 口腔、鼻腔和肛门分泌物中特异性SIgA的检测方法具体同1.2.3节。样品换成口腔、鼻腔和肛门分泌物, 稀释浓度为1 : 1。HRP标记的羊抗猪IgA稀释浓度分别为1 : 2 000、1 : 2 000和1 : 1 000。
1.2.5 血清中特异性IgG的检测方法具体同1.2.3节。样品换成血清(1 : 100), HRP标记的羊抗猪IgG稀释浓度为1 : 1 000。
1.2.6 乳汁和乳汁细胞中以及口腔和鼻腔分泌物中INF-γ和TGF-α的检测将试剂盒中的标准品原液按倍比稀释法稀释5个梯度, 检测D450值, 制作标准曲线; 在酶标包被板上, 标准品准确加样50 μL, 待测样品孔中先加样品稀释液40 μL, 然后再加待测样品10 μL(乳汁和乳汁中细胞裂解后的上清液以及口腔和鼻腔分泌物), 轻轻晃动混匀, 用封板膜封板后置37 ℃温箱孵育30 min; 甩干, 加洗涤液, 静置30 s后弃去, 如此重复5次; 每孔加入酶标试剂50 μL, 空白孔除外; 用封板膜封板后置37 ℃温箱孵育30 min; 洗涤后加入显色剂, 37 ℃避光显色10 min; 加终止液终止反应; 以空白孔调零, 测量各孔的光密度值(D450)。
1.2.7 空斑减少中和试验(PRNT)检测乳汁中PEDV和抗体的滴度参照文献[8]中的方法并稍作修改。乳汁从1 : 16倍比稀释到1 : 256, 在37 ℃下与PEDV(MOI=0.01)孵育1 h。转移到铺好细胞的12孔板中, 37 ℃温箱孵育1 h。加入甲基纤维素和2×DMEM(1 : 1)的混合液孵育3 d。用结晶紫染色后, 在显微镜下观察细胞病变效应。
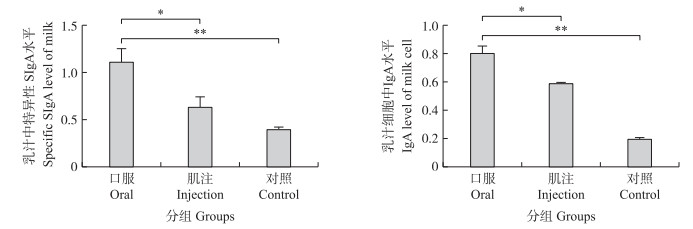
2 结果与分析 2.1 口服重组枯草芽胞杆菌对母猪乳汁中特异性SIgA及乳汁细胞中IgA水平的影响由图 1可知:口服重组枯草芽胞杆菌母猪乳汁中的特异性SIgA水平较肌注组和对照组显著增加(P < 0.05, P < 0.01);而乳汁细胞中的IgA水平也显著提高(P < 0.05, P < 0.01)。
|
图 1 乳汁中特异性SIgA及乳汁细胞中IgA水平 Fig. 1 Specific SIgA of milk and IgA in its cells *, * *分别表示差异显著(P < 0.05)和差异极显著(P < 0.01)。下同。 *, * *mean significant difference extremely at 0.05 and 0.01 levels. The same as follows. |
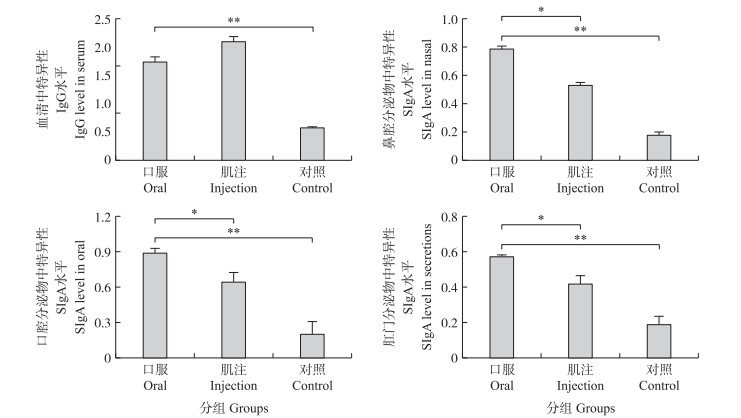
在口腔、鼻腔和肛门分泌物中, 口服组母猪SIgA抗体水平显著提高(P < 0.05, P < 0.01);而在母猪血清中, IgG抗体水平差异不显著(图 2)。
|
图 2 血清中特异性IgG及鼻腔、口腔和肛门分泌物中特异性SIgA抗体水平 Fig. 2 Specific IgG in serum and specific SIgA antibody levels in nasal, oral and anal secretions |
图 3结果表明:口服重组枯草芽胞杆菌母猪的乳汁和乳汁细胞中IFN-γ和TGF-α水平显著增加(P < 0.05, P < 0.01)。鼻腔分泌物中IFN-γ水平无显著性差异, 而TGF-α显著上升(P < 0.05, P < 0.01);母猪口腔分泌物中IFN-γ水平显著增加(P < 0.05), 而TGF-α无显著性变化。

|
图 3 乳汁(A)和乳汁细胞(B)中以及口腔(C)和鼻腔(D)分泌物中INF-γ和TGF-α水平 Fig. 3 The levels of INF-γ and TGF-α in milk(A)and its cells(B), oral(C)and nasal secretions(D) |
空斑减少中和试验(PRNT)检测了乳汁中PEDV中和抗体滴度的结果显示:肌注组母猪乳汁中的中和抗体滴度为1 : 64, 而口服重组枯草芽胞杆菌能有效降低PEDV的空斑形成能力, 中和抗体滴度为1 : 128(图 4)。以上结果表明口服重组枯草芽胞杆菌能刺激母猪乳汁分泌高水平的PEDV中和抗体。

|
图 4 母猪乳汁中PEDV中和抗体的水平 Fig. 4 The levels of PEDV neutralization antibody in sow milk |
20世纪70年代有学者报道, 给母猪口服传染性胃肠炎病毒(Transmissible gastroenteritis virus, TGEV)可诱导其初乳和常乳中产生高滴度的SIgA, 保护仔猪免受TGEV的感染[9]。乳源性免疫是给怀孕母猪口服疫苗, 使其肠道黏膜诱导部位中病原-特异性IgA浆母细胞借助“肠道—乳腺—SIgA轴”转运到乳腺效应部位(黏膜固有层), 并向乳汁中分泌SIgA。有学者通过比较仔猪吃初乳前和后血清中IgA和IgG的水平发现仔猪吃初乳之前血清中均未检出IgG和IgA, 而在仔猪哺乳后血清中约有20 mg · mL-1 IgG和1.6 mg · mL-1 IgA, 因此, 新生仔猪可通过初乳和常乳获得直接的保护[10]。那么, 对于同属于冠状病毒科冠状病毒属的PEDV, 我们可以借鉴TGEV诱导乳源性免疫的方法, 以期为仔猪提供相应的PED防治措施[11]。目前, 有些猪场常用返饲(给母猪饲喂感染仔猪粪便和肠组织)的方式来激发母猪对PEDV产生免疫力, 再通过初乳/常乳将其转移到仔猪身上, 使仔猪在最易感染阶段获得有效保护, 降低了仔猪的发病率和死亡率, 但由于返饲所用的材料不容易获得以及安全性差, 使得返饲策略很难推广[10]。而枯草芽胞杆菌本身就是一种饲料添加剂, 口服安全。并且有研究表明口服免疫表达尿素酶B抗原的重组枯草芽胞杆菌的疫苗后, 诱导机体产生的黏膜特异性SIgA能够显著降低幽门螺杆菌(Helicobacter pylori)的入侵, 从而产生很好的疗效[12]。
母猪口服免疫后肠道中产生大量的IgA浆母细胞, 后者迁移到乳腺中分化形成IgA分泌细胞。IgA分泌细胞可分泌由2个单体IgA与J链蛋白聚合的多聚IgA, 与乳腺上皮细胞基底侧表达的聚合免疫球蛋白受体结合后形成SIgA, 释放到乳汁中。SIgA是乳汁中重要的免疫球蛋白, SIgA与PEDV的纤突胞外域(受体结合亚基S1和膜融合亚基S2)的结合将抑制病毒进入细胞和随后的病毒感染[10]。因此, 新生仔猪保护率的提高与初乳和常乳中高滴度的SIgA密切相关[13]。本研究应用重组枯草芽胞杆菌饲喂母猪后, 可诱导其乳汁中产生高水平的特异性SIgA。口服感染PEDV的母猪在乳腺分泌物中产生高滴度的SIgA, 可以保护其仔猪免受PEDV感染[14]。本试验中口服组母猪乳汁中不仅特异性SIgA水平显著增加, 细胞内特异性IgA也显著增加, 这与母猪感染PEDV后导致小肠中抗体分泌细胞数量增加较为一致[15]。另外, 口服重组枯草芽胞杆菌能刺激母猪乳汁分泌高水平的PEDV中和抗体。
乳汁中除了免疫球蛋白外, 还含有较多的淋巴细胞以及细胞因子[16-17]。初乳中的淋巴细胞不仅进入新生仔猪肠腔, 还可通过肠道进入体内, 甚至进入到新生仔猪的血液中, 影响新生仔猪的免疫功能[18-19]。乳汁中的细胞因子可在母猪产后的第1天即可进入到仔猪体内[20], 发挥清除病毒的作用。本研究通过口服重组枯草芽胞杆菌可以显著提高乳汁以及细胞中INF-γ和TGF-α的水平。IFN-γ是由T细胞和自然杀伤细胞(NK)产生, 具有抗病毒的作用; TGF-α促进新生仔猪肠上皮细胞生长发育[21], 有利于维持肠道屏障的完整性, 进而抵御病毒入侵肠道。因此, 刚分娩的仔猪可通过乳汁获得更多的INF-γ和TGF-α, 而这些细胞因子可通过新生仔猪肠道直接进入体内, 对PEDV的清除发挥重要的作用。
总的来说, 通过给母猪饲喂表达PEDV S蛋白的重组枯草芽胞杆菌, 可以有效提高母猪乳汁及其分离的细胞中特异性SIgA和中和抗体以及INF-γ和TGF-α的水平。它们能通过乳汁被动地转移给新生仔猪, 为其提供免疫保护, 降低PEDV造成的死亡率。
| [1] |
Stevenson G W, Hoang H, Schwartz K J, et al. Emergence of porcine epidemic diarrhea virus in the United States:clinical signs, lesions and viral genomic sequences[J]. J Vet Diagn Invest, 2013, 25: 649-654. DOI:10.1177/1040638713501675 |
| [2] |
Song D S, Oh J S, Kang B K, et al. Oral efficacy of Vero cell attenuated porcine epidemic diarrhea virus DR13 strain[J]. Research in Veterinary Science, 2007, 82(1): 134-140. DOI:10.1016/j.rvsc.2006.03.007 |
| [3] |
Mou C X, Zhu L Q, Xing X P, et al. Immune responses induced by recombinant Bacillus subtilis expressing the spike protein of transmissible gastroenteritis virus in pigs[J]. Antiviral Research, 2016, 131: 74-84. DOI:10.1016/j.antiviral.2016.02.003 |
| [4] |
Hong H A, Duc L H, Cutting S M. The use of bacterial spore formers as probiotics[J]. FEMS Microbiol Rev, 2005, 29(4): 813-835. DOI:10.1016/j.femsre.2004.12.001 |
| [5] |
牟春晓.表达TGEV S蛋白的重组枯草芽胞杆菌的构建及其免疫效力的研究[D].南京: 南京农业大学, 2015. Mou C X. Immune responses induced by recombinant Bacillus subtilis expressing the spike protein of transmissible gastroenteritis virus[D]. Nanjing: Nanjing Agricultural University, 2015(in Chinese with English abstract). |
| [6] |
Duc L H, Hong H A, Uyen N Q, et al. Intracellular fate and immunogenicity of B. subtilis spores[J]. Vaccine, 2004, 22(15/16): 1873-1885. |
| [7] |
Le Jan C. A study by flow cytometry of lymphocytes in sow colostrum[J]. Res Vet Sci, 1994, 57: 300-304. DOI:10.1016/0034-5288(94)90121-X |
| [8] |
Chang S H, Bae J L, Kang T J, et al. Identification of the epitope region capalle of inducing neutralizing antibodies against the procine epidemic diarrhea virus[J]. Mol Cells, 2002, 14: 295-299. |
| [9] |
Bohl E H, Gupta R K, McCloskey L W, et al. Immunology of transmissible gastroenteritis[J]. J Am Vet Med Assoc, 1972, 160: 543-549. |
| [10] |
Bandrick M, Ariza-Nieto C, Baidoo S K, et al. Colostral antibody-mediated and cell-mediated immunity contributes to innate and antigen-specific immunity in piglets[J]. Developmental & Comparative Immunology, 2014, 43(1): 114-120. |
| [11] |
Chattha K S, Roth J A, Saif L J. Strategies for design and application of enteric viral vaccines[J]. Annu Rev Anim Biosci, 2015, 3: 375-395. DOI:10.1146/annurev-animal-022114-111038 |
| [12] |
Schumann W. Production of recombinant proteins in Bacillus subtilis[J]. Adv Appl Microbiol, 2007, 62: 137-189. DOI:10.1016/S0065-2164(07)62006-1 |
| [13] |
Lycke N. Recent progress in mucosal vaccine development:potential and limitations[J]. Nat Rev Immunol, 2012, 12(8): 592-605. DOI:10.1038/nri3251 |
| [14] |
Poonsuk K, Zhang J, Chen Q. Quantifying the effect of lactogenic antibody on porcine epidemic diarrhea virus infection in neonatal piglets[J]. Veterinary Microbiology, 2016, 197: 83-92. DOI:10.1016/j.vetmic.2016.11.002 |
| [15] |
Ouyang K, Shyu D L, Dhakal S, et al. Evaluation of humoral immune status in porcine epidemic diarrhea virus(PEDV)infected sows under field conditions[J]. Veterinary Research, 2015, 46(1): 1-11. DOI:10.1186/s13567-014-0124-5 |
| [16] |
Tedin L S, Redmer S K. Probiotic treatment decreases the number of CD14-expressing cells in porcine milk which correlates with several intestinal immune parameters in the piglets[J]. Frontiers in Immunology, 2015, 6: 1-10. |
| [17] |
Bandrick M, Pieters M, Pijoan C, et al. Passive transfer of maternal mycoplasma hyopneumoniae-specific cellular immunity to piglets[J]. Clin Vaccine Immunol, 2008, 15: 540-543. DOI:10.1128/CVI.00466-07 |
| [18] |
Bandrick M, Nieto C A. Colostral antibody-mediated and cell-mediated immunity contributes to innate and antigen-specific immunity in piglets[J]. Dev Comp Immunol, 2014, 43(1): 114-120. DOI:10.1016/j.dci.2013.11.005 |
| [19] |
Tuboly S, Bernath S, Glavits R, et al. Intestinal absorption of colostral lymphoid cells in newborn pigs[J]. Vet Immunol Immunopath, 1988, 20: 75-85. DOI:10.1016/0165-2427(88)90027-X |
| [20] |
Nguyen T V, Yuan L, Azevedo M S, et al. Transfer of maternal cytokines to suckling piglets:in vivo and in vitro models with implications for immunomodulation of neonatal immunity[J]. Vet Immunol Immunopathol, 2007, 117: 236-248. DOI:10.1016/j.vetimm.2007.02.013 |
| [21] |
Carol L, Wagner D W, Forsythe M T, et al. The effect of recombinant TGF-α, human milk, and human milk macrophage media on gut epithelial proliferation is decreased in the presence of a neutralizing TGF-α antibody[J]. Biology Neonate, 1998, 74: 363-371. DOI:10.1159/000014054 |




