文章信息
- 李志琳, 解宇峰, 吴杰, 徐佳迎, 王珏, 蒋静艳
- LI Zhilin, XIE Yufeng, WU Jie, XU Jiaying, WANG Jue, JIANG Jingyan
- 一株高效柴油降解菌Serratia sp.J-3的筛选、鉴定和降解特性
- Isolation and identification of a high efficiency diesel oil degrading strain Serratia sp. J-3 and its degradation characteristics
- 南京农业大学学报, 2019, 42(6): 1098-1107
- Journal of Nanjing Agricultural University, 2019, 42(6): 1098-1107.
- http://dx.doi.org/10.7685/jnau.201901050
-
文章历史
- 收稿日期: 2019-01-31
2. 生态环境部南京环境科学研究所, 江苏 南京 210042
2. Nanjing Institute of Environmental Sciences, Ministry of Ecology and Environment, Nanjing 210042, China
柴油作为一种常见的石油制品, 常被应用于工业发展以及日常生活中, 与此同时其带来的环境问题也不容忽视。柴油主要由中长链烷烃以及少量芳烃和脂肪物质组成, 在柴油冶炼、运输、储存等过程中不可避免会泄露于周围环境[1-2]。其隔绝水体空气交换, 影响土壤的通透性, 及含有的持久性有机污染物等对水、土等环境造成了严重的影响[3]。目前处理柴油污染的方法主要有物理机械法、化学处理法和生物修复法[4]。其中生物修复法是一种依靠微生物自身代谢的潜能来降解和去除污染物的生物学方法[5], 由于其具有经济、有效并对环境破坏性小等优点, 近年来尤其受到关注。
目前已报道的能够参与石油烃类降解的微生物有数百种, 其中大部分为细菌[6], 如假单胞菌属(Pseudomonas)[7]、不动杆菌属(Acinetobacter)[8]、红球菌属(Rhodococcus)[7]、芽胞杆菌属(Bacillus)[9]等。这些已报道的石油降解菌株分别由不同的地域和样品中分离获得, 对石油的降解能力也高低不一。如王佳楠等[10]从天津大港油田筛选获得4株芽胞杆菌, 在同样培养条件下, 即使是同属间的微生物也具有不同的石油降解率。另外, 不同研究筛选的菌株产生表面活性剂的能力也不相同[6, 11]。这说明菌株的降解能力受到石油烃性质、细菌自身特性以及降解环境等方面的影响[5-6]。
关于石油降解菌的机制研究, 已有报道证明大部分的生物代谢途径是由基因编码酶介导的, 如烷烃羟化酶基因alkB、P450等[12]。目前对恶臭假单胞菌中的AlkB蛋白研究最为深入, 氧化是AlkB在AlkG和AlkT的辅助下完成烷烃的催化[13]。不动杆菌中也发现了与此相类似的酶催化系统, alkB与alkMa、alkMb协同作用共同完成烷烃的降解[14]。也有研究发现红球菌属细菌中的烷烃羟化酶系统至少含有4种AlkB的同系物, 分别是alkB1、alkB2、alkB3和alkB4 [15]。很多微生物体内可能含有不止1种相关的降解酶体系。因此, 需要进一步筛选高效石油烃降解菌株, 并进行相应的降解机制研究, 以便提供更多的菌种资源并了解高效降解菌株的生物降解规律。
本文从南京扬子石化厂含油废水口的油泥沉积物中筛选出1株高效降解柴油菌株, 经鉴定为沙雷氏菌属(Serratia sp.)。目前关于沙雷氏菌属的较多报道是产灵菌红素及耐受重金属和防虫研究[16-17], 关于其降解石油烃类及其降解机制的报道较少。本文对筛选的菌株的生长条件、乳化能力以及柴油降解性能进行研究, 确定其在水中的最适降解条件, 并进一步研究其在土壤中降解柴油的能力和机制, 以期为生物修复多介质环境石油烃污染提供参考, 为将来工业化菌剂制备提供菌种资源。
1 材料与方法 1.1 材料来源从南京扬子石化厂区废水口采集油泥沉积物作为菌种筛选材料; 试验中的供试土壤采自南京化工岩土工程有限公司的模拟柴油污染场地, 自然风干7 d, 去除砾石等杂质后过0.85 mm孔径筛使用; 所用柴油样品购自中国石油加油站, 型号为0#(密度:0.84 kg·L-1), 经0.22 μm有机相滤膜过滤去除杂菌后使用。
1.2 培养基细菌富集培养基:酵母膏0.15 g, (NH4)2SO4 5 g, 葡萄糖2 g, KCl 1.1 g, K2HPO4·3H2O 1.5 g, NaCl 1.1 g, KH2PO4 1.5 g, MgSO4·7H2O 0.5 g, 超纯水1 L, 微量元素液5 mL, pH7.0~7.5, 灭菌后加入经0.22 μm滤膜过滤后的5 g·L-1柴油样品。
分离培养基:细菌富集培养基中去除葡萄糖, 加入20 g琼脂粉。由于柴油与水难以互溶, 因此柴油用石油醚溶解后加至分离培养基的固体平板表面并使其均匀分散。
无机盐培养基:(NH4)2SO4 1 g, KH2PO4 1 g, Na2HPO4 1 g, CaCl2 0.1 g, NaCl 2 g, MgSO4 0.2 g, FeSO4·7H2O 0.01 g, 超纯水1 L, pH7.0。灭菌后加入过滤后的柴油作为碳源。
1.3 柴油降解菌的筛选与鉴定取10 g油泥沉积物加入90 mL无菌水, 200 r·min-1、28 ℃振荡1 h使其分散, 静置30 min, 吸取10 mL上清液加入细菌富集培养基, 200 r·min-1、28 ℃条件下培养5 d。取浑浊的5 mL培养液继续富集培养, 连续培养7次。将第7次培养液稀释至10-9~10-1, 分别取0.1 mL涂布于分离培养基中, 28 ℃培养2 d, 待长出菌落后挑取不同形态的单菌落接种于含5 g·L-1柴油的分离培养基中, 分离纯化得到的单菌落即为柴油降解菌。将分离出的菌株接种至斜面培养基, 4 ℃保存备用, 并命名为J-3。
参照《伯杰氏系统细菌学手册》对筛选的菌株进行生理生化试验, 观察菌株形态、颜色特征; 利用E.Z.N.A.® Bacterial DNA Kit(OMEGA, USA)提取菌株的总DNA, 采用通用引物27F和1492R扩增16S rRNA序列。将PCR产物纯化后送至生工生物工程(上海)股份有限公司进行DNA测序。将基因序列在NCBI数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)中进行同源序列搜索, 利用CLASTAL X2和MEGA 5.0软件构建系统进化树。
1.4 菌株J-3的生长特性将活化后的菌株J-3以1%(体积分数)的接种量接种至无机盐培养基, 160 r·min-1振荡培养7 d。测定菌株在不同温度(20、25、30、35和40 ℃), 不同pH值(5、6、7、8和9), 不同NaCl质量浓度(1、2、5、10和15 g·L-1), 不同柴油质量浓度(0.5、1、2和5 g·L-1)下的生长量(D600)和柴油降解率。
微生物生长量以分光光度计测定600 nm处的光密度值(D600)表示。
柴油降解率的测定:采用石油醚(60~90 ℃)萃取, 在紫外分光光度计下以石油醚为参比液测定225 nm处的光密度值, 通过柴油-石油醚在225 nm处的标准曲线计算柴油降解效率。
1.5 菌株J-3亲油指标的测定排油圈直径的测定[18]:取直径为9 cm的培养皿, 加入50 mL的蒸馏水, 在水表面加1 mL的液体石蜡形成油膜。在油膜中心加20 μL已经离心除去菌体的发酵液, 测量发酵液推开油膜的直径。
乳化性能的测定[19]:取5 mL发酵液和2 mL柴油于试管中混合, 涡旋振荡2 min, 室温静置24 h后, 测量乳化层高度, 以灭菌水为阴性对照, 利用吐温80进行乳化性能比较。计算公式:乳化稳定值(E24)=乳化层高度/液体总高度×100%。
细胞表面疏水性的测定[19]:收集培养至对数生长期的LB培养液, 8 000 r·min-1离心5 min, 弃去上清液, 用磷酸盐缓冲液清洗并重悬沉淀调D600为0.8~1.0;取2 mL菌悬液加入2 mL柴油, 25 ℃培养10 min, 涡旋振荡2 min, 静置60 min分层后, 测定菌悬液D600值。计算公式:细胞表面疏水性(CSH)=(1-D600后)/D600前×100%。
1.6 柴油经菌株J-3降解后组分变化测定利用石油醚萃取水样, 紫外分光光度计检测菌株在最适生长条件下(pH7, 30 ℃, NaCl 1 g·L-1, 柴油质量浓度0.5 g·L-1)的降解能力。
利用二氯甲烷萃取发酵液中的剩余柴油, 超声波处理10 min后, 用装有2 g硅胶和2 g无水硫酸钠的层析柱过滤, 去除杂质, 重复2~3次, 合并萃取液; 在常温条件下氮吹至溶液近干, 用二氯甲烷(色谱纯)重新溶解, 定容至1 mL后进行GC-MS检测。
气相色谱条件(Agilent 6890N):色谱柱:HP-5MS(0.32 mm×30 m×0.25 μm), FID检测器; 进样量1 μL, 不分流; 载气(He)流量:1 mL·min-1; 氢气流量:30 mL·min-1, 空气流量:300 mL·min-1, 尾吹气流量:28 mL·min-1; 进样口温度300 ℃, 检测器温度300 ℃; 柱温升温程序:40 ℃保持5 min, 以10 ℃·min-1升至290 ℃, 保持10 min。质谱条件:EI源, 离子源温度200 ℃, 接口温度220 ℃。溶剂切除时间1.5 min, 扫描范围10~800 amu, 自动调谐。
1.7 菌株全基因组测序和烷烃羟化酶分析采用试剂盒提取菌株J-3的总DNA, 送至生工生物工程(上海)有限公司, 采用Illumina Hiseq1.9平台进行细菌基因组框架图测序分析, 采用NCBI BLAST+将基因蛋白序列与CDD、KOG、COG、NR、NT、PFAM、Swissprot、TrEMBL等数据库进行比对, 得到其功能注释信息。将注释得到的烷烃羟化酶基因与已有的烷烃羟化酶基因进行BLAST同源性分析, 利用Clustal X软件对蛋白序列进行比对。
1.8 菌株J-3对柴油污染土壤的修复取处理好的柴油污染风干土模拟土壤修复试验, 以筛选到的柴油降解菌J-3作为投加菌。设置4个处理, 分别为不灭菌CK(不投加菌种)、灭菌CK(不投加菌种)、不灭菌J3和灭菌J3, 每个处理取土壤(土壤含水率为18.89%)40 g, 外接菌液14.54 g(菌悬液浓度为3.8×108 CFU·mL-1), 保证接入菌液后每个处理土壤含水率为40%, 每处理3个重复, 采用γ射线对土壤进行灭菌, 由南京喜悦科技股份有限公司完成。在25 ℃、土壤含水率40%条件下培养45 d后, 对土壤中柴油含量进行检测。
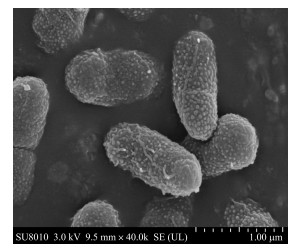
2 结果与分析 2.1 菌株J-3的筛选、鉴定和生理生化特性通过柴油无机盐培养基培养、筛选和分离, 纯化初筛得到1株高效降解柴油的菌株J-3。通过生理生化试验和扫描电镜观察, 确定菌株J-3为好氧革兰氏阴性菌。其菌落形态为圆形, 四周白色, 中间粉色, 表面湿滑不透明, 边缘整齐, 菌体为短杆状(图 1), 菌长约为1.1~1.3 μm; 在液体培养基中呈扩散性浑浊, 并可产生恶臭气味。
|
图 1 菌株J-3的扫描电镜细胞观察图 Fig. 1 The scanning electron microscope image of the strain J-3 |
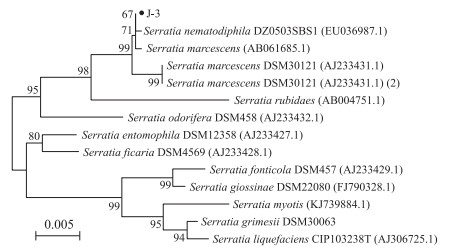
将菌株J-3的16S rRNA基因序列(GenBank登录号:MK473381)在NCBI数据库序列比对, 选取部分相似性较高的模式菌株序列, 构建系统发育进化树(图 2)。
|
图 2 菌株J-3的系统发育进化树 Fig. 2 The phylogenetic tree of the bacterial strain J-3 |
菌株J-3与其他相似的沙雷氏菌种的生理生化特征见表 1。菌株J-3在产吲哚试验与其他菌种结果不一致, 在淀粉水解以及硝酸盐利用试验中, 与黏质沙雷氏菌结果一致, 与嗜线虫沙雷氏菌结果相反, 其他生理生化指标结果均一致。进化树(图 2)显示:J-3与嗜线虫沙雷氏菌(Serratia nematodiphila)聚集在同一分支。基于生理生化特征和16S rRNA基因序列分析可以确定菌株J-3属于Serratia属, 命名为Serratia sp. J-3。
| 鉴定特征 Identification features | 嗜线虫沙雷氏菌 Serratia nematodiphila | 黏质沙雷氏菌 Serratia mnarcescens | J-3 |
| 革兰氏染色 Gram staining | - | - | - |
| 芽孢染色 Spore staining | - | - | - |
| 鞭毛运动 Flagellar movement | + | + | + |
| 荚膜 Capsule | - | - | - |
| 甲基红试验 Methyl red test | - | - | - |
| 吲哚试验 Indole test | - | - | + |
| H2S试验 Hydrogen sulfide test | - | - | - |
| V.P试验 Voges-Proskauer test | + | + | + |
| 明胶液化 Gelatin liquefaction | + | + | W |
| 淀粉水解 Starch hydrolysis | + | - | - |
| 葡萄糖发酵 Glucose fermentation | + | + | + |
| 蔗糖发酵 Saccharose fermentation | + | + | W |
| 接触酶反应 Catalase reaction | + | + | + |
| 氧化酶试验 Oxidase test | - | - | - |
| 硝酸盐还原 Nitrate reduction | - | + | + |
| 柠檬酸盐 Citrate utilization | + | + | + |
| 注: +为阳性反应Positive; -为阴性反应Negative; W为弱阳性反应Weak positive.标准菌株的生理生化指标来源于《伯杰氏系统细菌学手册》Pkysiological and biochemical indexes of the standard strains were derived from Bergey ’ s Manual of Systematic Bacteriology. | |||
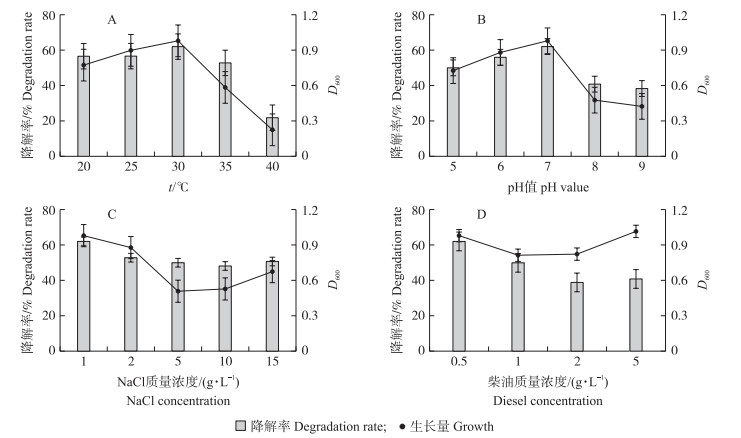
从图 3-A可以看出:菌株J-3对温度的适应范围较广, 在20~35 ℃时, 降解率均可达到50%以上。菌株J-3在30 ℃时生长量最大, 此时的降解率最高, 其次是25 ℃。当温度超过30 ℃, 降解率开始下降, 生长量也降低, 说明高温不利于J-3的生长和代谢, 从而会影响柴油的降解。
|
图 3 不同温度、pH值、NaCl浓度和柴油浓度对菌株J-3降解率和生长量的影响 Fig. 3 Effects of different temperature, pH, NaCl and diesel oil concentration on the strain growth and the degradation rate of diesel oil |
菌株J-3对pH值具有较广泛的适应范围, 在pH5~9均能够生长(图 3-B)。菌株生长的最适pH值为7, 在弱酸和中性环境下生长良好, 降解率达50%, 生长量达到0.8;在碱性条件下生长受到明显抑制, 降解率和生长量均较低。
菌株在低盐条件下生长较好, 降解率超过60%(图 3-C)。随无机盐培养基中NaCl质量浓度增加, 菌株生长受到抑制, 当NaCl质量浓度高于5 g·L-1时, 生长量降低, 但降解率仍达50%左右。总体来看, 菌株J-3有一定的耐盐能力。
由图 3-D可以看出:当柴油质量浓度为0.5 g·L-1时, 降解率和生长量均最高, 其次是1 g·L-1。增加柴油浓度, 菌株J-3的生长量相差不大, 但降解率明显下降。这可能是由于细菌接触油类物质后, 先进行乳化, 再进行氧化过程, 而过高浓度的油物质不断积累, 会影响空气的通透性, 阻隔菌体与氧气的接触, 导致菌体活性降低进而降解率降低[20]。
2.3 菌株J-3乳化能力分析通过发酵培养和排油圈测定, 菌株J-3能够形成(3.1±0.2)cm的排油圈(图 4-A), 而对照液滴则由石蜡穿过, 没有形成排油圈。排油圈的直径与表面活性剂含量成正比, 试验结果表明, 菌株J-3能够产生表面活性物质。

|
图 4 菌株J-3排油圈直径(A)和乳化性能(B) Fig. 4 Oil spreading ability(A)and emulsion stability(B)of strain J-3 |
菌株J-3的乳化性能稳定性如图 4-B所示, 48 h后乳化层高度不变, 灭菌水作为阴性对照, 对柴油几乎没有乳化能力, 菌株J-3对柴油乳化率为45.6%, 与对照吐温80相比, 增加了4.0%。菌株J-3的细胞表面疏水性(CSH)在稳定1 h后可达到80.2%, 比吐温80增加了9.9%, 说明菌株J-3具有较高的乳化能力, 且稳定性较好。
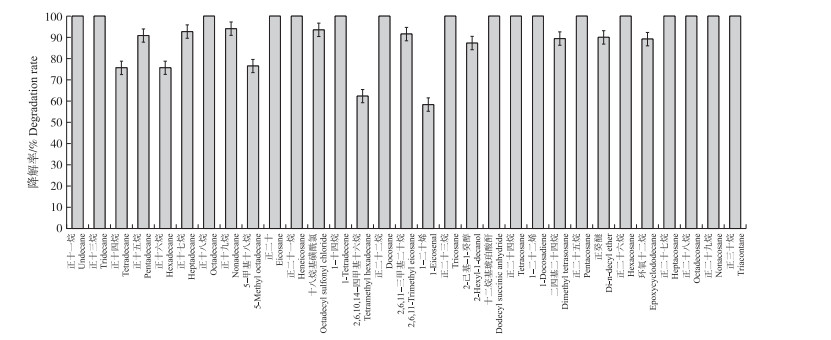
2.4 菌株J-3对柴油的降解能力分析利用二氯甲烷萃取水样, GC-MS法检测菌株最适生长条件下(pH7, 30 ℃, NaCl 1 g·L-1, 柴油质量浓度0.5 g·L-1)对柴油的利用能力(图 5)。与未接菌的对照CK相比, 培养7 d后菌株J-3对柴油中各组分均有很好的降解效果, 残油组分种类明显减少, 柴油单一组分含量大幅降低。菌株J-3对柴油中的C11—C28的直链烷烃具有99%以上的降解率, 对部分烯烃、环烷烃以及大分子的醚类、醇类降解率为58.4%~62.3%(图 6)。可以看出在最适培养条件下, 菌株J-3对柴油各组分的降解能力均较强, 对高碳数的醇类、醚类物质也有一定的降解能力, 具有较广泛的降解范围, 可稳定用于后续的柴油污染土壤修复试验。

|
图 5 菌株J-3降解柴油的GC分析 Fig. 5 The diesel degradation of strain J-3 analyzed by GC methods |
|
图 6 菌株J-3对柴油各组分利用情况 Fig. 6 Utilization of diesel components by strain J-3 |
对菌株J-3进行全基因组测序分析可知, 基因组全长4 999 503 bp, GC含量为60%, 基因平均长度为927 bp, 其中编码区基因总数为4 757个, 占整个基因组序列的88.2%。采用NCBI BLAST将基因蛋白序列与CDD、KOG、COG、NR、NT、PFAM、Swissprot、TrEMBL等数据库进行比对, 得到其功能注释信息。在上述数据库中, NR和TrEMBL数据库比对得到的注释基因最多, 分别占基因总数的99.9%和99.8%, 选择这2个数据库重合的注释基因进行后续分析。
通过基因功能注释预测菌株J-3有2 771个蛋白编码基因(CDS)。菌株J-3在基因组上有多个与烷烃以及酚类相关的氧化酶基因, 其中包括烷烃羟化酶基因(alkB)和长链烷烃羟化酶基因(almA)。alkB基因主要对C5—C12等短链烷烃具有主要的降解作用, 而almA主要降解C16以上长链烷烃[12]。将AlkB和AlmA蛋白的氨基酸序列分别进行NCBI比对(图 7)所示, 菌株J-3的AlkB和Serratia sp. FS14菌株的AlkB蛋白氨基酸相似性最高, 达100%, AlmA和Serratia nematodiphila DZ0503SBS1菌株中alkane 1-monooxygenase蛋白的氨基酸相似性最高, 达100%。

|
图 7 菌株J-3中烷烃降解基因氨基酸序列比对 Fig. 7 Comparison of amino acid sequence of alkane degradation gene in strain J-3 |
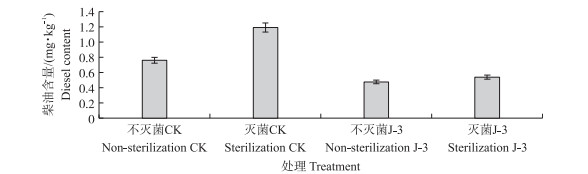
从图 8可知:不灭菌CK处理的土壤柴油含量明显低于灭菌CK处理的, 柴油含量降低36.1%;不灭菌J-3与灭菌J-3处理相比, 柴油含量降低11.6%;灭菌J-3处理和灭菌CK相比, 由于灭菌处理的土壤中没有土著微生物生长, 柴油浓度较高, 因此接种菌株J-3后柴油含量明显降低, 其降解率为48.9%;不灭菌J-3处理和不灭菌CK相比较, 在土著微生物存在情况下, 菌株J-3接种土壤后对柴油的降解率为33.8%。这表明大量土著微生物在自然情况下能够起到降解作用, 当接种菌株J-3至土壤后, 能够提高土壤样品中柴油的去除率。
|
图 8 不同处理土壤样品中柴油含量 Fig. 8 Diesel content in soil samples under different treatments 不灭菌CK:不灭菌且不外接菌种的土壤处理; 灭菌CK:灭菌且不外接菌种的土壤处理; 不灭菌J-3:不灭菌且外接菌种J-3的土壤处理; 灭菌J-3:灭菌且外接菌种J-3的土壤处理。 Non-sterilization CK:Soil treatment of non-sterilized without external strain J-3;Sterilization CK:Soil treatment of sterilized without external strain J-3;Non-sterilization J-3:Soil treatment of non-sterilized and external strain J-3;Sterilization J-3:Soil treatment of sterilized and external strain J-3. |
从图 9可知:菌株J-3对土壤中柴油的降解主要集中在中长链烷烃, 对C30以上的组分降解不明显(C30在图谱中主要为保留时间大于32.5 min的组分)。灭菌J-3处理与灭菌CK相比, C11—C28长度的各组分含量均明显降低, 不灭菌J-3处理与不灭菌CK相比, 2个处理柴油降解组分大致相同, 降解量也相似, 但不灭菌J-3处理对中长链烷烃降解更彻底, 说明菌株J-3可以促进柴油中的中长链组分降解。

|
图 9 不同处理土壤样品中柴油组分变化 Fig. 9 Composition variation of diesel oil in soil under different treatments |
近年来, 研究发现微生物能够在耐寒、耐盐以及厌氧等极端不利环境对烃类进行降解。Mukherji等[20]从海底沉积物筛选到的耐盐菌株好氧培养8 d对柴油降解率达到30%;胡春辉等[21]从辽河口湿地石油污染土壤获得1株耐盐柴油降解菌, 鉴定为不动杆菌属, 培养5 d后对柴油降解率为61.5%。本试验从扬子石化油泥沉积物中筛选到的柴油降解菌J-3, 可以耐受高盐和高浓度柴油, 能够在15 g·L-1 NaCl和5 g·L-1柴油含量的环境中生长, 且柴油降解率均能超过50%, 跟目前已报道的降解菌株相比, 其降解能力属于中等偏上水平。由于石油成分复杂, 混合降解菌群降解比单一菌株降解更有优势。Sathishkumar等[22]研究了降解能力较高的4株单菌和57株降解菌组成的菌群的降解效果, 发现菌群的降解效率最高达到77%, 比单菌高出8%;而本试验分离出的高效柴油降解菌J-3, 对石油烃类有很好的乳化能力和降解能力, 可以为后续构建复合微生物菌群等工作提供菌种资源。
目前, 许多高效石油降解菌都被发现其能够产生表面活性物质, 对石油烃类产生乳化作用以促进石油烃类的生物降解。邓振山等[23]筛选到1株产脂肽类表面活性剂的菌株A-08, 其可促进原油乳化, 提高原油的分散程度从而促进菌株对石油烃的降解; 刘伟等[24]通过向柴油中预先24 h投加产脂肽类表面活性剂的芽胞杆菌B26, 再投加降解菌株, 发现降解率提高了9.5%, 降解周期缩短了48 h。这些报道的菌株大多为产脂肽类表面活性剂的假单胞菌和芽胞杆菌等, 对于其他类型表面活性剂和产表面活性剂的菌株报道较少。本试验获得的可产表面活性剂菌株J-3属于沙雷氏菌属, 该菌目前的报道大多研究集中于产灵杆素以及防治虫害方面, 在石油烃类降解和表面活性剂方面的研究较少, 且该菌所产表面活性剂具有稳定的乳化性能, 对柴油具有分散和增溶作用, 极大促进菌株对柴油的降解。吴秉奇等[25]筛选出7株产表面活性剂菌株, 对柴油降解能力结果表明, 一些菌株产表面活性特征不明显却依然对柴油有较强的降解能力, 这说明培养条件、底物浓度等外界因素也与细菌产表面活性剂相关。本研究中菌株J-3所产生的表面活性剂具有稳定的乳化性, 但一直难以进行提取鉴定与定量, 这可能与其细胞的表面特性或分泌其他代谢物质有关, 后续还需借助红外法、薄层层析等手段进行深入研究。
菌株GC-MS图谱和柴油组分利用情况表明, 菌株J-3对柴油中烃类具有不同程度的降解能力, 具有较广泛的降解范围。一般认为, 微生物对石油烃类中的短链组分更容易利用[26], 但菌株J-3对柴油中的中长直链和支链烷烃(C11—C28)降解率几乎为100%, 对短链组分降解不彻底, 这可能与菌株J-3中含有催化中长链烷烃降解的基因almA有关。石油烃类生物降解的关键是降解菌株的功能基因表达的特异性酶, 参与微生物利用石油烃类污染物的代谢转化过程中。许多高效降解石油烃类的菌株都被检测出含有多个烷烃羟化酶基因, Schneiker等[27]筛选出的菌株SK2含有2个alkB基因和1个P 450基因, 这3个基因编码的酶可催化不同长度的碳链烷烃, 使该菌具有高效的降解率。本试验从菌株J-3的全基因组中测序检测出alkB和almA基因, 这2个基因编码的酶可有效结合利用不同碳链长度的烷烃, 使其具有较宽的底物利用范围, 同时具有较强的柴油降解能力。结合柴油各组分利用率可知, 菌株J-3也能利用柴油中的一些醇类和醚类大分子物质, 但降解率不高。这说明菌株J-3中可能还存在其他能够催化苯系物的羟化酶基因, 目前基因比对并未发现其他相关功能基因, 这可能是由于该基因序列与目前已报到的苯酚羟化酶序列相似性较低。后续研究要侧重于菌株J-3对萘、菲等芳香烃类的降解, 利用苯系物培养诱导J-3中的相关功能基因。
土壤中的石油污染治理与水体中不同, 由于土壤颗粒的黏附性和石油的疏水性, 利用微生物对土壤中石油进行降解的工作一直存在很大的阻碍。目前, 很多报道的石油高效降解菌在含油废水中的降解率能够达到37%~71%, 而在石油类污染土壤修复的降解率难以提高, 只有14.5%~33.5%[28-29]。将菌株J-3应用于柴油污染土壤进行模拟生物修复, 发现单菌对土壤柴油降解率为48.9%, 高于目前报道的平均降解率(14.5%~33.5%), 这说明菌株J-3在土壤石油污染应用方面具有很大的潜力。土壤作为一个复杂体系, 除了考虑微生物本身, 土壤的结构性质、环境变化以及营养物质等也会通过改变微生物的代谢、酶活性等改变石油烃类的降解, 这有待进一步研究。
| [1] |
Moubasher H A, Hegazy A K, Mohamed N H, et al. Phytoremediation of soils polluted with crude petroleum oil using Bassia scoparia and its associated rhizosphere microorganisms[J]. International Biodeterioration & Biodegradation, 2015, 98: 113-120. |
| [2] |
Ghosh P, Gupta A, Thakur I S. Combined chemical and toxicological evaluation of leachate from municipal solid waste landfill sites of Delhi, India[J]. Environmental Science and Pollution Research, 2015, 22(12): 9148-9158. DOI:10.1007/s11356-015-4077-7 |
| [3] |
Megharaj M, Ramakrishnan B, Venkateswarlu K, et al. Bioremediation approaches for organic pollutants:a critical perspective[J]. Environment International, 2011, 37(8): 1362-1375. DOI:10.1016/j.envint.2011.06.003 |
| [4] |
Balseiro-Romero M, Gkorezis P, Kidd P S, et al. Characterization and degradation potential of diesel-degrading bacterial strains for application in bioremediation[J]. International Journal of Phytoremediation, 2017, 19(10): 955-963. DOI:10.1080/15226514.2017.1337065 |
| [5] |
Varjani S J. Microbial degradation of petroleum hydrocarbons[J]. Bioresource Technology, 2017, 223: 277-286. DOI:10.1016/j.biortech.2016.10.037 |
| [6] |
Varjani S J, Upasani V N. A new look on factors affecting microbial degradation of petroleum hydrocarbon pollutants[J]. International Biodeterioration & Biodegradation, 2017, 120: 71-83. |
| [7] |
Petrikov K, Delegan Y, Surin A, et al. Glycolipids of Pseudomonas and Rhodococcus oil-degrading bacteria used in bioremediation preparations:formation and structure[J]. Process Biochemistry, 2013, 48(5/6): 931-935. |
| [8] |
Huang L, Xie J, Lv B Y, et al. Optimization of nutrient component for diesel oil degradation by Acinetobacter beijerinckii ZRS[J]. Marine Pollution Bulletin, 2013, 76(1/2): 325-332. |
| [9] |
Yadav A K, Manna S, Pandiyan K, et al. Isolation and characterization of biosurfactant producing Bacillus sp. from diesel fuel-contaminated site[J]. Microbiology, 2016, 85(1): 56-62. |
| [10] |
王佳楠, 石妍云, 郑力燕, 等. 石油降解菌的分离鉴定及4株芽胞杆菌种间效应[J]. 环境科学, 2015, 36(6): 2245-2251. Wang J N, Shi Y Y, Zheng L Y, et al. Isolation and identification of petroleum degradation bacteria and interspecific interactions among four Bacillus strains[J]. Chinese Journal of Environmental Science, 2015, 36(6): 2245-2251 (in Chinese with English abstract). |
| [11] |
Souza E C, Vessoni-Penna T C, de Souza O R P. Biosurfactant-enhanced hydrocarbon bioremediation:an overview[J]. International Biodeterioration & Biodegradation, 2014, 89: 88-94. |
| [12] |
唐景春, 吕宏虹, 刘庆龙, 等. 石油烃污染及修复过程中的微生物分子生态学研究进展[J]. 微生物学通报, 2015, 42(5): 944-955. Tang J C, Lü H H, Liu Q L, et al. Recent review on the microbial molecular ecology during contamination and remediation of petroleum hydrocarbons[J]. Microbiology, 2015, 42(5): 944-955 (in Chinese with English abstract). |
| [13] |
Smits T H, Witholt B, van Beilen J B. Functional characterization of genes involved in alkane oxidation by Pseudomonas aeruginosa[J]. Antonie van Leeuwenhoek, 2003, 84(3): 193-200. DOI:10.1023/A:1026000622765 |
| [14] |
Powell S M, Bowman J P, Snape I. Degradation of nonane by bacteria from Antarctic marine sediment[J]. Polar Biology, 2004, 27(10): 573-578. |
| [15] |
刘芳明.南极海洋石油烃低温降解菌的筛选、鉴定及其低温降解特性研究[D].青岛: 国家海洋局第一海洋研究所, 2008. Liu F M. Screening, identification and low-temperature degradation characteristics study of cold-adapted petroleum hydrocarbon-degrading bacteria isolated from Antarctic sea[D]. Qingdao: First Institute of Oceanography of the State Oceanic Administration, 2008(in Chinese with English abstract). http://d.wanfangdata.com.cn/Thesis/Y1368662 |
| [16] |
牛洪涛, 肖李俊杰, 王娜, 等. 粘质沙雷氏菌S-JS1与5种杀虫剂对灰飞虱的联合作用及该菌对灰飞虱相关酶活性的影响[J]. 农药学学报, 2018, 20(2): 185-191. Niu H T, Xiao L J J, Wang N, et al. Combined effects of Serratia marcescens S-JS1 with five insecticides against Laodelphax striatellus and the effect of S-JS1 on activities of relative enzymes in L.striatellus[J]. Chinese Journal of Pesticide Science, 2018, 20(2): 185-191 (in Chinese with English abstract). |
| [17] |
刘思航, 邹宜均, 常菲菲, 等. 一株高产灵菌红素粘质沙雷氏菌的分离鉴定及发酵条件优化[J]. 应用与环境生物学报, 2018, 24(1): 26-32. Liu S H, Zou Y J, Chang F F, et al. Isolation and identification of Serratia marcescens producing high levels of prodigiosin and its fermentation optimization[J]. Chinese Journal of Applied and Environmental Biology, 2018, 24(1): 26-32 (in Chinese with English abstract). |
| [18] |
Morales-Guzmán G, Ferrera-Cerrato R, del Carmen R C M, et al. Diesel degradation by emulsifying bacteria isolated from soils polluted with weathered petroleum hydrocarbons[J]. Applied Soil Ecology, 2017, 121: 127-134. DOI:10.1016/j.apsoil.2017.10.003 |
| [19] |
马斌斌, 李少君, 马恒轶, 等. 一株海洋柴油降解菌的分离筛选鉴定及其生物表面活性剂特性分析[J]. 海洋环境科学, 2017, 36(5): 754-759. Ma B B, Li S J, Ma H Y, et al. Isolation, screening, and characterization of a diesel degrading darine bacteria and chemical characterization and properties of its biosurfactant[J]. Marine Environmental Science, 2017, 36(5): 754-759 (in Chinese with English abstract). |
| [20] |
Mukherji S, Jagadevan S, Mohapatra G, et al. Biodegradation of diesel oil by an Arabian Sea sediment culture isolated from the vicinity of an oil field[J]. Bioresource Technology, 2004, 95(3): 281-286. DOI:10.1016/j.biortech.2004.02.029 |
| [21] |
胡春辉, 于浩, 赵阳国, 等. 高效耐盐柴油降解菌的筛选、鉴定及降解基因[J]. 中国环境科学, 2017, 37(11): 4251-4258. Hu C H, Yu H, Zhao Y G, et al. Isolation and identification of a high-efficient diesel degrading bacterial strain Acinetobacter sp. L7[J]. China Environmental Science, 2017, 37(11): 4251-4258 (in Chinese with English abstract). |
| [22] |
Sathishkumar M, Binupriya A R, Baik S H, et al. Biodegradation of crude oil by individual bacterial strains and a mixed bacterial consortium isolated from hydrocarbon contaminated areas[J]. Clean, 2008, 36(1): 92-96. |
| [23] |
邓振山, 马琳, 张袭, 等. 一株产表面活性剂石油降解菌筛选及其特性[J]. 环境工程学报, 2017, 11(5): 3295-3303. Deng Z S, Ma L, Zhang X, et al. Isolation and characteristics of oil-degrading bacteria with biosurfactant production[J]. Chinese Journal of Environmental Engineering, 2017, 11(5): 3295-3303 (in Chinese with English abstract). |
| [24] |
刘伟, 刘红玉, 曾光明, 等. 产表面活性剂菌筛选及其对柴油降解影响研究[J]. 环境工程学报, 2010, 4(1): 219-225. Liu W, Liu H Y, Zeng G M, et al. Isolation of biosurfactant producing microorganisms and influence on degradation of diesel oil[J]. Chinese Journal of Environmental Engineering, 2010, 4(1): 219-225 (in Chinese with English abstract). |
| [25] |
吴秉奇, 刘淑杰, 陈福明, 等. 海洋石油降解菌的筛选及复合菌系的构建[J]. 生物技术通报, 2016, 32(8): 184-193. Wu B Q, Liu S J, Chen F M, et al. Screening of marine crude oil-degrading bacteria and construction of cicrobial consortium[J]. Biotechnology Bulletin, 2016, 32(8): 184-193 (in Chinese with English abstract). |
| [26] |
Mukred A M, Hamid A A, Hamzah A, et al. Development of three bacteria consortium for the bioremediation of crude Petroleum-oil in contaminated water[J]. Journal of Biological Sciences, 2008, 8(4): 73-79. |
| [27] |
Schneiker S, dos Santos V A M, Bartels D, et al. Genome sequence of the ubiquitous hydrocarbon-degrading marine bacterium Alcanivorax borkumensis[J]. Nature Biotechnology, 2006, 24(8): 997-1004. DOI:10.1038/nbt1232 |
| [28] |
吴蔓莉, 张晨, 祁燕云, 等. 生物修复对黄土壤中石油烃的去除作用及影响因素[J]. 农业环境科学学报, 2018, 37(6): 1159-1165. Wu M L, Zhang C, Qi Y Y, et al. Degradation of petroleum hydrocarbons during the bioremediation of cultivated loessial soil[J]. Journal of Agro-Environment Science, 2018, 37(6): 1159-1165 (in Chinese with English abstract). |
| [29] |
董丁, 卢彦珍, 唐美华, 等. 一株石油烃高效降解菌的筛选及降解性能研究[J]. 南京工业大学学报(自然科学版), 2017, 39(3): 58-62, 89. Dong D, Lu Y Z, Tang M H, et al. Screening of a high efficient bacterial strain for petroleum hydrocarbons degradation and its characteristics[J]. Journal of Nanjing Tech University(Natural Science Edition), 2017, 39(3): 58-62, 89 (in Chinese with English abstract). |




