文章信息
- 吕娜娜, 沈宗专, 陶成圆, 欧燕楠, 王蓓蓓, 阮云泽, 李荣, 沈其荣
- LÜ Nana, SHEN Zongzhuan, TAO Chengyuan, OU Yannan, WANG Beibei, RUAN Yunze, LI Rong, SHEN Qirong
- 蕉园土壤及香蕉植株不同组织可培养细菌的群落特征
- The characteristics of culturable bacterial community in soils and tissue parts of banana
- 南京农业大学学报, 2019, 42(6): 1088-1097
- Journal of Nanjing Agricultural University, 2019, 42(6): 1088-1097.
- http://dx.doi.org/10.7685/jnau.201902019
-
文章历史
- 收稿日期: 2019-02-25
2. 海南大学热带作物学院, 海南 海口 570228
2. College of Tropical Crop Science, Hainan University, Haikou 570228, China
香蕉是全球最为重要的大宗水果之一[1]。由尖孢镰刀菌香蕉古巴专化型4号生理小种(Fusarium oxysporum f. sp. cubense Snyder and Hansen race 4, 简称Foc4)侵染引起的土传枯萎病的爆发严重制约我国香蕉产业的发展[2]。目前, 防控香蕉枯萎病的措施主要有土壤熏蒸[3]、抗性品种选育[4]、轮作[5]和生物防治[6]等。其中, 生物防治作为防控香蕉枯萎病的措施之一, 不仅安全、长效、经济效益高, 且对生态平衡和可持续农业的发展具有重要意义[7]。
筛选生防菌株是生物防控香蕉土传枯萎病发生的重要前提[8]。近年来, 国内外学者从香蕉不同组织中筛选、分离出可有效抑制香蕉枯萎病发生的生防菌株[9]。土传病害的防控不能仅靠某一种或某一类生防微生物, 而要依靠微生物菌群(microbial consortia)[10]。因此, 收集并建立健康香蕉土壤微生物及内生菌群的资源库, 对于组合高效且稳定的微生物生防菌群具有十分重要的意义。张晨智等[11]利用高通量测序研究比较健康与发病香蕉植株内生菌群的多样性差异; 王梦颖[12]通过T-RFLP技术研究易感与抗病香蕉品种在健康和发病状态下内生菌群落结构, 然而, 关于土体土壤、根际土壤及不同香蕉植株组织的微生物资源的系统报道却很少。
抑病型土壤(disease-suppressive soil)是指即使在病原菌存在的情况下发病也很轻的土壤[13]。与之相对应的是导病型土壤(disease-conducive soil), 指容易爆发土传病害的土壤。抑病型土壤中微生物群落是土壤抑制土传病害爆发的主要原因之一[14]。目前, 有关抑病型土壤微生物的研究多集中于群落组成特征的解析上, 以期揭示抑制土传病害发生的微生物群落组成特征, 为连作障碍频发的土壤微生物区系调控提供理论指导和方向。然而, 在抑病型与导病型土壤上种植香蕉的内生菌群落组成差异, 以及内生菌群如何受抑病型及导病型土壤微生物区系的影响机制研究较少。
目前, 一些常用的分子生物学方法, 使我们全面地认识土壤微生物群落的多样性, 但其不能区分土壤中活体与死亡的微生物[15], 因此, 无法判断其是否具有生态活性。土壤中容易培养的细菌具有更高的生物量和代谢活性, 在土壤中起主要生态功能, 可培养微生物菌群的变化可以提供与生态功能紧密相关的信息[16-17], 对研究土壤微生物非常重要。本实验室先前在海南香蕉主产区发现一处抑病型蕉园, 其连作多年而土传枯萎病发病率稳定维持在较低水平, 蕉园土壤微生物区系组成明显区别于相邻导病型蕉园土壤微生物群落[18]。基于此, 本研究运用传统稀释涂布法分离筛选抑病型及导病型蕉园健康香蕉土体、根际、根部、茎部及叶部可培养细菌, 比较抑病型及导病型土壤微生物及香蕉内生菌群组成差异, 再根据组成差异的分析结果, 定向筛选可用于抑制尖孢镰刀菌的生防拮抗菌, 以建立抑病型蕉园健康香蕉土壤、根际微生物及内生菌群资源库, 为香蕉土传枯萎病的防控提供生防菌种资源。
1 材料与方法 1.1 供试材料 1.1.1 蕉园基本信息抑病型蕉园及相邻导病型蕉园位于海南省澄迈县福山镇(109.92°E, 19.83°N), 均已多年连作‘巴西蕉’, 2016年抑病型及导病型蕉园枯萎病发病率分别为7.3%和66.8%。两处蕉园土壤均为砖红壤。抑病型蕉园土壤基本理化性质为:pH7.02, 总碳含量14.76 g·kg-1, 总氮含量1.68 g·kg-1, 有效磷含量226 mg·kg-1, 有效钾含量468 mg·kg-1; 导病型蕉园土壤基本理化性质为:pH5.22, 总碳含量14.15 g·kg-1, 总氮含量1.47 g·kg-1, 有效磷含量157 mg·kg-1, 有效钾含量343 mg·kg-1。
1.1.2 土壤及组织样品的采集于2017年7月香蕉收获期, 分别从抑病型及导病型蕉园随机各选取5株健康(未有明显发病症状)香蕉, 于每株香蕉滴水线内随机挖取3个土壤剖面(深0~20 cm), 采集根系(连根带土)及地上部茎、叶组织, 每株3个样品充分混合后作为1个供试样品。
1.1.3 培养基细菌分离筛选采用R2A培养基:酵母膏0.5 g, 蛋白胨0.5 g, 酪蛋白氨基酸0.5 g, 葡萄糖0.5 g, 可溶性淀粉0.5 g, 丙酮酸钠0.3 g, 磷酸氢二钾0.3 g, 硫酸镁0.05 g, 琼脂15.0 g, 蒸馏水定容至1.0 L, pH(7.2±0.2)。假单胞菌分离筛选采用KB培养基:蛋白胨20.0 g, 磷酸氢二钾1.5 g, 硫酸镁1.5 g, 甘油10.0 g, 蒸馏水1.0 L, 115 ℃高压蒸汽灭菌30 min后加入青霉素75.0 mg、新生霉素45.0 mg、放线菌酮100.0 mg。拮抗性能鉴定采用PDA培养基:马铃薯200 g, 葡萄糖20.0 g, 蒸馏水1.0 L。
1.2 试验方法 1.2.1 样品预处理轻抖采集的香蕉根系, 抖下来的土壤作为土体土壤。用无菌手术刀将采集的香蕉根均切成长5 cm片段, 称取200 g香蕉根并置入预先装有200 mL无菌水的三角烧瓶中, 室温下170 r·min-1振荡30 min后, 将香蕉根完全挑出后4 000 g离心5 min, 所获沉淀即为根际土壤[19]。取切至5 cm的香蕉根、茎、叶组织样品各10个, 无菌水冲洗干净后分别转移至2%(体积分数)次氯酸钠溶液中充分浸泡, 15 min后用无菌水冲洗5次。再将各组织样品转移至70%乙醇中充分浸泡, 5 min后用无菌水冲洗7次, 最后用无菌吸水纸吸干表层水分待用。
1.2.2 不同梯度稀释液制备无菌条件下用灭菌手术刀将根、茎、叶组织切成长约1 cm的碎块, 立即转移至灭菌研钵中研磨, 将磨碎植物组织4 ℃保存备用。称取土体土和根际土及根、茎、叶磨碎的组织各5 g至预先载有45 mL无菌生理盐水的150 mL三角瓶中, 30 ℃、170 r·min-1振荡30 min后, 制成不同梯度的10倍稀释液。
1.2.3 可培养细菌及假单胞菌分离、筛选及纯化分别吸取100 μL相应的不同梯度稀释液涂布至R2A培养基或KB培养基, 30 ℃培养3 d后, 挑取形态完整、差异明显的单菌落划线纯化培养, 抑病型和导病型土壤的土体、根际和植物各部分组织样品均各挑选100个单菌落, 纯化后甘油管保存备用。
1.2.4 细菌和假单胞菌的分子生物学鉴定采用菌落PCR方法鉴定所分离、纯化细菌及假单胞菌。用灭菌牙签挑取单菌落至20 μL无菌ddH2O水中, 沸水浴5 min, 吸取2.5 μL悬液用于PCR扩增。引物采用16S rDNA通用引物, 其中上游引物为27F(5′-GTGCCAGCMGCCGCGGTAA-3′), 下游引物为1492R(5′-GGACTACHVGGGTWTCTAAT-3′)。PCR反应体系:DNA模板2.5 μL, 上、下游引物各2.0 μL, 扩增Mix酶(TaKaRa公司)25.0 μL, ddH2O 18.5 μL。PCR扩增条件:95 ℃ 5 min; 95 ℃ 30 s, 55 ℃ 45 s, 72 ℃ 30 s, 30个循环; 72 ℃10 min, PCR产物送南京金斯瑞生物科技有限公司测序。
1.2.5 假单胞菌拮抗香蕉尖孢镰刀菌的能力测定参照Zhao等[20]的方法筛选假单胞菌拮抗尖孢镰刀菌4号小种Foc4的能力, Foc4菌株由本实验室自行筛选并保存。用直径为8 mm的打孔器打取已预先在PDA平板上培养7 d的尖孢镰刀菌菌丝饼, 置于新的PDA平板中心处培养1 d。用灭菌牙签点取假单胞菌单菌落至平板离病原菌中心2 cm处, 28 ℃培养72 h, 观察有无拮抗圈产生并测定大小。
1.3 数据整理及统计分析利用UPARSE分析平台对16S rDNA测序数据进行分析。首先在99%相似度下对序列进行OTU(operational taxonomic unit)聚类, 挑选出各OTU代表性序列与RDP数据库进行比对, 获取类群在门及属水平上的分类信息。然后再与NCBI数据库比对获取代表性序列在种水平最为可能的分类信息。在R软件中用“vegan”软件包基于序列丰度表格贝叶斯距离进行可培养细菌群落近似性约束成分分析(constrained analysis of proximities, CAP)[21]。在R软件中用“ggplot2”软件包绘制各处理属水平相对丰度气泡图。在R软件中用“vegan”软件包比较各属在抑病型及导病型处理群落组成差异的相似度比例(similarity percentage analysis, SIMPER), 采用置换多元方差分析(permutationtal multivariate analyses of variance, PERMANOVA)群落组成差异的驱动因素。
2 结果与分析 2.1 蕉园土壤及香蕉内生微生物的群落分析经分离纯化、分子生物学鉴定后, 抑病型蕉园共分离鉴定出377株细菌, 其中土体土、根际土、根、茎及叶样品分别筛选到86、61、80、75和75株; 导病型蕉园则为389株, 其中土体土、根际土、根、茎及叶样品分别筛选到93、80、71、77和68株。
经16S rDNA分子生物学鉴定发现, 抑病型及导病型蕉园所筛选到的可培养细菌属于放线菌门、拟杆菌门、厚壁菌门及变形菌门(图 1)。总体上看, 变形菌门在所有样品中相对丰度最高, 抑病型及导病型蕉园处理中分别有197株(52.1%)及158株(40.6%)。变形菌门在根和茎部组织中相对丰度较高, 而放线菌门在土体土及叶部组织中相对丰度较高。
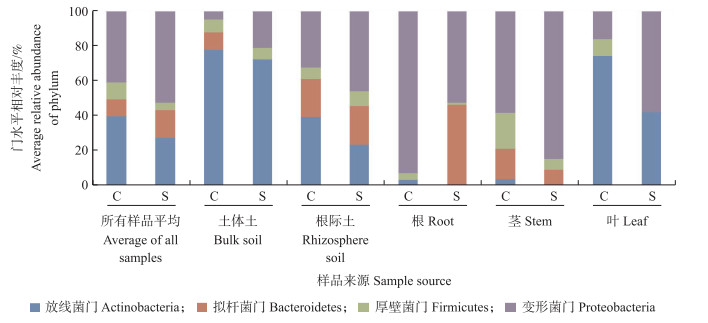
|
图 1 蕉园土体土、香蕉根际土及香蕉不同组织部位筛选到的细菌门水平相对丰度 Fig. 1 Relative abundance of culturable bacteria at phylum level isolated from bulk soil, rhizosphere soil and different banana tissues C:导病型蕉园Disease conducive banana orchards; S:抑病型蕉园Disease suppressive banana orchards.下同。The same as follows. |
进一步的属分类水平分析(图 2)表明, 所筛选的细菌共属于49个属。相对于植株组织样品, 土体及根际土壤样品细菌组成更为丰富。抑病型蕉园土体土壤中共分离到13个属的细菌, 而导病型蕉园土体土壤中共分离到12个属的细菌, 其中抑病型蕉园土体土壤中筛选的特有属为节杆菌属、微杆菌属、不动杆菌属、居真菌细菌属、鞘氨醇盒菌属、寡养单胞菌属、短小杆菌属和假单胞菌属。抑病型蕉园根际土壤中共分离12个属的细菌, 而导病型蕉园根际土壤中共分离16个属的细菌, 其中抑病型蕉园根际土壤中筛选的特有属为鲍特氏菌属、丛毛单胞菌属、成对杆菌属、Fictibacillus、Siphonobacter和Sinomonas。抑病型蕉园根、茎、叶组织中分别筛选到6、16和9个属的细菌, 而导病型蕉园根、茎、叶组织中分别筛选到7、16和7个属的细菌, 其中抑病型蕉园香蕉根组织筛选的特有属为金黄杆菌属, 茎组织筛选的特有属为假单胞菌属、食酸菌属、德沃斯氏菌属、草螺菌属、赖氨酸芽胞杆菌属、红长命菌属、鞘氨醇杆菌属和短波单胞菌属, 而叶组织筛选的特有属分别为泛菌属、鞘氨醇单胞菌属、考克氏菌属和链霉菌属。
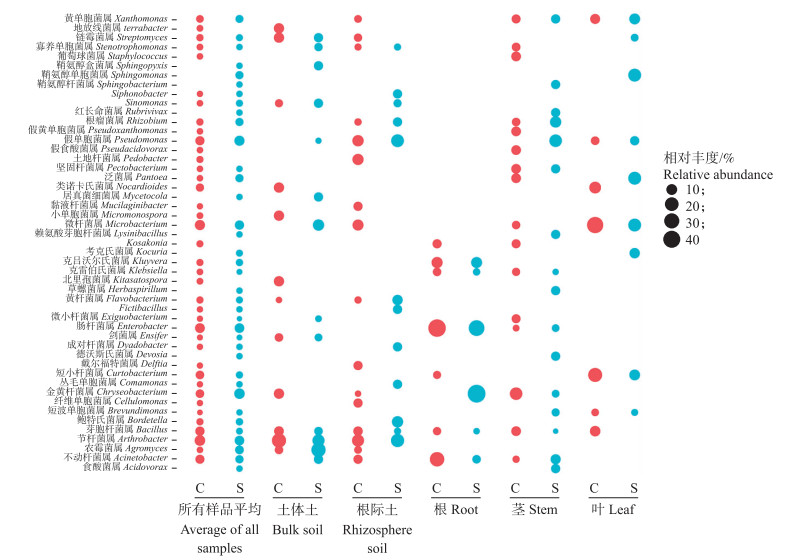
|
图 2 蕉园土体土、香蕉根际土及香蕉不同组织部位可培养细菌属水平相对丰度气泡图 Fig. 2 Bubble graph of the relative abundance of bacteria at genus level isolated from bulk soil, rhizosphere soil and different banana tissues |
近似性约束成分分析(CAP)结果(图 3)表明, 第1主成分(CAP1)及第2主成分(CAP2)对群落差异的解释率达68.9%, 其中土壤样品(根际土和土体土)细菌组成与香蕉组织样品(根、茎和叶)细菌组成处理沿第1轴明显区分; 抑病型及导病型蕉园各处理之间有差异, 但不明显。进一步的多元方差分析(PERMANOVA)结果表明, 样品属性(土壤、不同组织)是细菌群落组成差异的主要驱动因素(R2=0.286, P=0.014), 而土壤类型对其无显著影响(R2=0.056, P=0.840)。
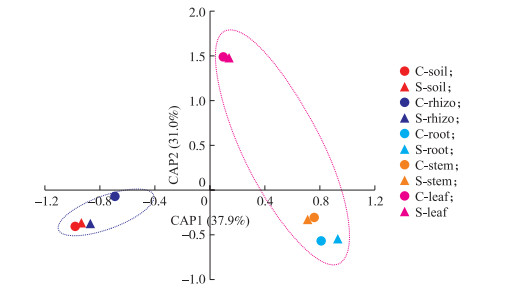
|
图 3 蕉园土体土、香蕉根际土及香蕉不同组织部位可培养细菌群落组成近似性约束成分分析 Fig. 3 Constrained analysis of proximities(CAP)of culturable bacteria isolated from bulk soil, rhizosphere soil and different banana tissues C-soil:导病型蕉园土体土Bulk soil of disease conducive banana orchards; S-soil:抑病型蕉园土体土Bulk soil of disease suppres-sive banana orchards; C-rhizo:导病型蕉园根际土Rhizosphere soil of disease conducive banana orchards; S-rhizo:抑病型蕉园根际土Rhizosphere soil of disease suppressive banana orchards; C-root:导病型蕉园香蕉根Banana root of disease conducive orchards; S-root:抑病型蕉园香蕉根Banana root of disease suppressive orchards; C-stem:导病型蕉园香蕉茎Banana stem of disease conducive orchards; S-stem:抑病型蕉园香蕉茎Banana stem of disease suppressive orchards; C-leaf:导病型蕉园香蕉叶Banana leaf of disease conducive orchards; S-leaf:抑病型蕉园香蕉叶Banana leaf of disease suppressive orchards. |
分析比较各个属对抑病型及导病型蕉园处理可培养细菌群落组成差异的贡献度, 即研究导致抑病型及导病型蕉园处理间细菌群落组成差异的主要菌属。从表 1可知:假单胞菌在抑病型蕉园所有处理中平均相对丰度高于导病型蕉园所有处理中平均相对丰度, 是导致抑病型处理群落有别于导病型处理群落的主要菌属之一, 其贡献度达0.042。
| 属 Genus | 导病型蕉园样品 Samples of disease conducive banana orchards | 抑病型蕉园样品 Samples of disease suppressive banana orchards | 平均贡献度 Average contribution degree |
| 肠杆菌属 Enterobacter | 9.14 | 7.29 | 0.066 |
| 金黄杆菌属 Chryseobacterium | 5.47 | 9.93 | 0.063 |
| 微杆菌属 Microbacterium | 10.37 | 6.30 | 0.058 |
| 节杆菌属 Arthrobacter | 8.01 | 7.19 | 0.049 |
| 假单胞菌属 Pseudomonas | 3.45 | 8.68 | 0.042 |
| 不动杆菌属 Acinetobacter | 6.86 | 3.94 | 0.037 |
| 短小杆菌属 Curtobacterium | 5.54 | 2.19 | 0.033 |
| 农霉菌属 Agromyces | 1.50 | 5.06 | 0.030 |
| 芽胞杆菌属 Bacillus | 7.08 | 1.70 | 0.027 |
| 泛菌属 Pantoea | 1.49 | 3.81 | 0.024 |
| 类诺卡氏菌属 Nocardioides | 4.63 | 0.00 | 0.023 |
| 黄单胞菌属 Xanthomonas | 3.37 | 3.47 | 0.022 |
| 根瘤菌属 Rhizobium | 1.38 | 3.75 | 0.020 |
| 鞘氨醇单胞菌属 Sphingomonas | 0.00 | 3.81 | 0.019 |
| 克吕沃尔氏菌属 Kluyvera | 2.37 | 2.33 | 0.019 |
| 链霉菌属 Streptomyces | 2.61 | 1.90 | 0.016 |
| 鲍特氏菌属 Bordetella | 0.00 | 2.51 | 0.013 |
| 土地杆菌属 Pedobacter | 2.41 | 0.00 | 0.012 |
| Kosakonia | 2.30 | 0.00 | 0.012 |
| 黄杆菌属 Flavobacterium | 0.68 | 1.88 | 0.011 |
| 坚固杆菌属 Pectobacterium | 1.49 | 1.25 | 0.011 |
| Sinomonas | 0.72 | 2.02 | 0.011 |
| 考克氏菌属 Kocuria | 0.00 | 1.91 | 0.010 |
| 寡养单胞菌属 Stenotrophomonas | 1.39 | 1.26 | 0.009 |
| 克雷伯氏菌属 Klebsiella | 1.66 | 0.74 | 0.009 |
| 北里孢菌属 Kitasatospora | 1.80 | 0.00 | 0.009 |
| 小单胞菌属 Micromonospora | 1.80 | 0.00 | 0.009 |
| 地放线菌属 Terrabacter | 1.80 | 0.00 | 0.009 |
| 假食酸菌属 Pseudacidovorax | 1.49 | 0.00 | 0.007 |
| 假黄单胞菌属 Pseudoxanthomonas | 1.49 | 0.00 | 0.007 |
| 葡萄球菌属 Staphylococcus | 1.49 | 0.00 | 0.007 |
| 短波单胞菌属 Brevundimonas | 0.57 | 1.13 | 0.007 |
| 微小杆菌属 Exiguobacterium | 1.12 | 0.32 | 0.007 |
| 剑菌属 Ensifer | 0.90 | 0.63 | 0.006 |
| 居真菌细菌属 Mycetocola | 0.00 | 1.26 | 0.006 |
| 鞘氨醇盒菌属 Sphingopyxis | 0.00 | 1.26 | 0.006 |
| 丛毛单胞菌属 Comamonas | 0.00 | 1.26 | 0.006 |
| 成对杆菌属 Dyadobacter | 0.00 | 1.26 | 0.006 |
| Fictibacillus | 0.00 | 1.26 | 0.006 |
| Siphonobacter | 0.00 | 1.26 | 0.006 |
| 食酸菌属 Acidovorax | 0.00 | 1.25 | 0.006 |
| 德沃斯氏菌属 Devosia | 0.00 | 1.25 | 0.006 |
| 草螺菌属 Herbaspirillum | 0.00 | 1.25 | 0.006 |
| 赖氨酸芽胞杆菌属 Lysinibacillus | 0.00 | 1.25 | 0.006 |
| 红长命菌属 Rubrivivax | 0.00 | 1.25 | 0.006 |
| 鞘氨醇杆菌属 Sphingobacterium | 0.00 | 1.25 | 0.006 |
| 纤维单胞菌属 Cellulomonas | 1.21 | 0.00 | 0.006 |
| 戴尔福特菌属 Delftia | 1.21 | 0.00 | 0.006 |
| 黏液杆菌属 Mucilaginibacter | 1.21 | 0.00 | 0.006 |
分离到609株假单胞菌, 鉴定后分属于11个种, 其中抑病型蕉园分离362株。从图 4可知:抑病型蕉园样品中假单胞菌组成多样性更高, 有铜绿假单胞菌、香茅醇假单胞菌、荧光假单胞菌、黄褐假单胞菌、香鱼假单胞菌、蒙氏假单胞菌、硝基还原假单胞菌、恶臭假单胞菌、台湾假单胞菌、藤黄假单胞菌和根际假单胞菌; 导病型蕉园样品仅有4种假单胞菌, 分别为荧光假单胞菌、蒙氏假单胞菌、硝基还原假单胞菌及恶臭假单胞菌。抑病型蕉园土体土壤中筛选的特有假单胞菌为铜绿假单胞菌、香茅醇假单胞菌、黄褐假单胞菌和香鱼假单胞菌, 而根际土壤中筛选的特有假单胞菌为硝基还原假单胞菌、台湾假单胞菌和香鱼假单胞菌。抑病型及导病型蕉园根组织中筛选到的假单胞菌组成类似, 均为荧光假单胞菌、蒙氏假单胞菌和恶臭假单胞菌。从抑病型及导病型蕉园茎部组织中均筛选出荧光假单胞菌和恶臭假单胞菌, 而根际假单胞菌仅在抑病型蕉园香蕉茎中筛选出。从抑病型及导病型蕉园香蕉植株叶部组织中均筛选出荧光假单胞菌、蒙氏假单胞菌及恶臭假单胞菌, 而藤黄假单胞菌仅在抑病型蕉园香蕉叶中筛选出。

|
图 4 蕉园土体土、香蕉根际土及香蕉不同组织部位分离筛选的假单胞菌相对丰度 Fig. 4 Relative abundance of Pseudomonas spp. strain isolated from bulk soil, rhizosphere soil and different banana tissues |
假单胞菌对尖孢镰刀菌4号小种的拮抗能力测定(图 5)表明:尽管抑病型蕉园样品中分离的假单胞菌多样性高于导病型蕉园样品, 但具有拮抗功能的假单胞菌仅有17株, 明显少于导病型蕉园样品(35株)。而且, 无论是导病型还是抑病型蕉园样品, 具有拮抗能力的假单胞菌菌株多筛自于土体土、根际土及叶部。
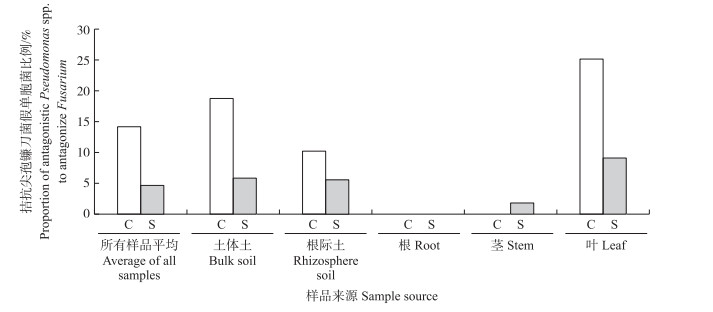
|
图 5 蕉园土体土、香蕉根际土及香蕉不同组织部位筛选到的拮抗尖孢镰刀菌的假单胞菌数量 Fig. 5 Proportion of Pseudomonas spp. with antagonistic ability to Fusarium isolated from bulk soil, rhizosphere soil and different banana tissues |
假单胞菌中具有拮抗尖孢镰刀菌能力的菌株属于荧光假单胞菌、香鱼假单胞菌、蒙氏假单胞菌、硝基还原假单胞菌和恶臭假单胞菌, 其中大部分菌株为恶臭假单胞菌。抑病型蕉园土体土中特有的具有拮抗能力的假单胞菌为荧光假单胞菌, 而导病型蕉园土体土中特有的具有拮抗能力的假单胞菌为蒙氏假单胞菌。抑病型蕉园香蕉植株根际土中特有的具有拮抗能力的假单胞菌为香鱼假单胞菌, 而导病型蕉园香蕉植株根际土中特有的具有拮抗能力的假单胞菌为荧光假单胞菌(图 6)。
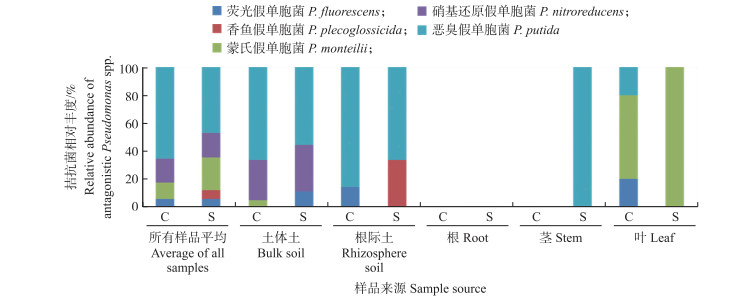
|
图 6 蕉园土体土、香蕉根际土及香蕉不同部位具有拮抗能力的假单胞菌的相对丰度 Fig. 6 Relative abundance of Pseudomonas spp. with antagonnistic ability to Fusarium isolated from bulk soil, rhizosphere soil and different banana tissues |
细菌群落不仅对驱动陆地生态系统的土壤生物、化学和物理过程非常重要, 而且对土壤健康和土传病害的防控起着重要作用[22]。虽然利用稀释涂布分离筛选菌种的方法有缺陷, 但能获取实体菌株资源, 实体菌株资源是研究微生物及其生理意义功能的首要前提, 为开发利用微生物资源提供基础[23]。我国在香蕉枯萎病防控研究方面起步较晚, 现有的生防菌资源库有限, 且有些菌株在实际应用过程中常发生变异和退化现象[24], 本研究可为生物防控枯萎病补充新的高效生防菌株。
本研究通过稀释涂布及划线纯化培养研究了蕉园土体土、香蕉根际土及香蕉不同组织部位内生可培养细菌群落组成差异。尽管筛选到的菌株分类上只有49个属, 但本研究中不同样品之间分离获得的可培养内生菌组成在属水平上仍有很大差异。Zarraonaindia等[25]利用高通量测序技术研究发现葡萄土壤及葡萄不同组织部位微生物群落组成及结构差异显著。本研究中从土壤样品筛选的细菌与从香蕉植株不同部位筛选的内生细菌群落有明显差异, 而且香蕉不同组织部位之间内生菌群落结构和组成也存在明显差异, 可能与不同组织间不同的生理构造及内生菌来源多样化有关[26-27]。相比于叶部内生菌, 茎与根部的细菌群落更相似, 表明茎部内生菌可能是由根部侵入并通过输导组织到达茎部[28]。
近年来, 香蕉植株内生菌的研究多集中于利用T-RFLP或高通量测序等分子生物学技术比较健康与患病香蕉植株内生菌群的组成差异[11-12], 较少关注不同感病程度蕉园内香蕉可培养细菌群落的组成。本研究筛选的49个属中假单胞菌属、芽胞杆菌属、微杆菌属、肠杆菌属、短小杆菌属、金黄杆菌属、节杆菌属和不动杆菌属等的相对丰度较高, 是优势菌属, 与先前的研究结果[29-30]一致。假单胞菌属[31]和芽胞杆菌属[32]在促进植物生长和防控土传病害方面研究很多, 不动杆菌属[33]和节杆菌属[34]在拮抗病原菌和高效降解有机污染物也有过相关报道, 说明这些细菌容易培养而且具有较高的生物量和代谢活性, 起着重要的生态功能。本研究中分离获取的香蕉土壤及内生细菌菌株经鉴定多属于放线菌门、变形菌门、厚壁菌门和拟杆菌门。这与先前利用高通量测序技术的研究结果[11]类似。
通过比较抑病型及导病型蕉园样品可培养细菌属水平平均相对丰度及其对群落差异贡献度可知, 肠杆菌属、金黄杆菌属等4个属贡献度均高于假单胞菌属, 但是未见与抑病型土壤抑病功能相关的报道, 假单胞菌是被大量报道与抑病相关且容易选择性培养的细菌。香蕉抑病型土壤中假单胞菌属的相对丰度也被报道高于导病型土壤[18], 所以本研究中选择假单胞菌进行拮抗试验验证。本研究中抑病型蕉园总体样品中假单胞菌相对丰度高于导病型蕉园样品。假单胞菌具有杀虫、改善植物营养、降解有毒物质、产生抗生素和植物生长调节物质、改善植物微环境和诱导系统抗性等特性, 被广泛用于植物土传病害的生物防治[35]。因此, 本研究进一步筛选各样品假单胞菌以研究抑病型及导病型土壤及香蕉组织样品中假单胞菌的组成及功能差异。除根际土样品外, 抑病型蕉园土体土、根、茎及叶部分离筛选的假单胞菌数量及组成多样性均高于导病型蕉园, 但导病型蕉园各样品中具有拮抗病原菌的假单胞菌的比例要高于抑病型蕉园各样品。这可能是因为导病型蕉园中尖孢镰刀菌数量多, 香蕉虽未发病, 但受病原菌侵染胁迫的程度要重于抑病型蕉园香蕉, 因而诱导出了更多具有拮抗能力的假单胞菌以抵御尖孢镰刀菌入侵[36]。而抑病型蕉园各样品因假单胞菌的多样性高, 不仅占据了病原菌的生态位, 还提高了群落总体稳定性, 因而更加有效地抵御了土壤中尖孢镰刀菌的入侵。
综上所述, 抑病型蕉园土壤及香蕉不同组织内生可培养细菌及假单胞菌组成具有自身的独特性, 变形菌门居多, 特有属为鞘氨醇单胞菌属、食酸菌属和草螺菌属等10个属; 抑病型蕉园假单胞菌有11种, 特有属为铜绿假单胞菌、香茅醇假单胞菌、黄褐假单胞菌、香鱼假单胞菌、台湾假单胞菌、藤黄假单胞菌及根际假单胞属; 生防假单胞菌数量更多, 但具有拮抗潜能的比例较低。未来可结合更多分子生物学的方法, 全面深入了解香蕉组织内生菌的种类及分布, 可为香蕉可持续生产提供更重要的理论指导。
| [1] |
黄永红.韭菜对香蕉枯萎病的防控效果及其作用机理的研究[D].长沙: 湖南农业大学, 2011. Huang Y H. The effect and mechanism of Chinese leek(Allium tuberosum)on the control of banana Fusarium wilt[D]. Changsha: Hunan Agricultural University, 2011(in Chinese with English abstract). http://cdmd.cnki.com.cn/article/cdmd-10537-1011203926.htm |
| [2] |
Butler D. Fungus threatens top banana[J]. Nature, 2013, 504(7479): 195-196. DOI:10.1038/504195a |
| [3] |
钟书堂, 吕娜娜, 孙逸飞, 等. 连作香蕉园生态熏蒸剂的筛选及其对土壤微生物群落结构的影响[J]. 土壤, 2015, 47(6): 1092-1100. Zhong S T, Lü N N, Sun Y F, et al. Screening eco-fumigants for banana orchards with serious Fusarium wilt disease and their influences on soil microflora[J]. Soils, 2015, 47(6): 1092-1100 (in Chinese with English abstract). |
| [4] |
Li W M, Dita M, Wu W, et al. Resistance sources to Fusarium oxysporum f. sp. cubense tropical race 4 in banana wild relatives[J]. Plant Pathology, 2015, 64(5): 1061-1067. DOI:10.1111/ppa.12340 |
| [5] |
Wang B B, Li R, Ruan Y Z, et al. Pineapple-banana rotation reduced the amount of Fusarium oxysporum more than maize-banana rotation mainly through modulating fungal communities[J]. Soil Biology and Biochemistry, 2015, 86: 77-86. DOI:10.1016/j.soilbio.2015.02.021 |
| [6] |
Akila R, Rajendran L, Harish S, et al. Combined application of botanical formulations and biocontrol agents for the management of Fusarium oxysporum f. sp. cubense(Foc)causing Fusarium wilt in banana[J]. Biological Control, 2011, 57(3): 175-183. DOI:10.1016/j.biocontrol.2011.02.010 |
| [7] |
何欣, 郝文雅, 杨兴明, 等. 生物有机肥对香蕉植株生长和香蕉枯萎病防治的研究[J]. 植物营养与肥料学报, 2010, 16(4): 978-985. He X, Hao W Y, Yang X M, et al. Effects of bioorganic fertilization on growth and controlling Fusarium wilt disease of banana[J]. Journal of Plant Nutrition and Fertilizers, 2010, 16(4): 978-985 (in Chinese with English abstract). |
| [8] |
Raza W, Ling N, Zhang R F, et al. Success evaluation of the biological control of Fusarium wilts of cucumber, banana, and tomato since 2000 and future research strategies[J]. Critical Reviews in Biotechnology, 2017, 37(2): 202-212. |
| [9] |
Ho Y N, Chiang H M, Chao C P, et al. In planta biocontrol of soilborne Fusarium wilt of banana through a plant endophytic bacterium, Burkholderia cenocepacia 869T2[J]. Plant and Soil, 2015, 387(1/2): 295-306. |
| [10] |
Raaijmakers J M, Mazzola M. Soil immune responses[J]. Science, 2016, 352(6292): 1392-1393. DOI:10.1126/science.aaf3252 |
| [11] |
张晨智, 张旭, 陈抒瑶, 等. 健康与发病香蕉植株内生细菌菌群差异研究[J]. 南京农业大学学报, 2019, 42(2): 284-291. Zhang C Z, Zhang X, Chen S Y, et al. Endophytic bacterial community between healthy and diseased banana plants[J]. Journal of Nanjing Agricultural University, 2019, 42(2): 284-291 (in Chinese with English abstract). DOI:10.7685/jnau.201804036 |
| [12] |
王梦颖.香蕉内生菌多样性分析及广谱拮抗菌筛选[D].海口: 海南大学, 2014. Wang M Y. Diversity research of endophytes and broad-spectrum antagonistic bacterium screening from banana[D]. Haikou: Hainan University, 2014(in Chinese with English abstract). http://cdmd.cnki.com.cn/article/cdmd-10589-1014238972.htm |
| [13] |
Baker K, Cook R J. Biological Control of Plant Pathogens[M]. San Francisco: APS Press, 1974.
|
| [14] |
Weller D M. Microbial populations responsible for specific soil suppressiveness to plant pathogens[J]. Annual Review of Phytopathology, 2002, 40(1): 309-348. DOI:10.1146/annurev.phyto.40.030402.110010 |
| [15] |
Mijangos I, Becerril J M, Albizu I, et al. Effects of glyphosate on rhizosphere soil microbial communities under two different plant compositions by cultivation-dependent and-independent methodologies[J]. Soil Biology and Biochemistry, 2009, 41(3): 505-513. DOI:10.1016/j.soilbio.2008.12.009 |
| [16] |
Edenborn S L, Sexstone A J. DGGE fingerprinting of culturable soil bacterial communities complements culture independent analyses[J]. Soil Biology and Biochemistry, 2007, 39(7): 1570-1579. DOI:10.1016/j.soilbio.2007.01.007 |
| [17] |
Tamaki H, Sekiguchi Y J, Hanada S, et al. Comparative analysis of bacterial diversity in freshwater sediment of a shallow eutrophic lake by molecular and improved cultivation-based techniques[J]. Applied and Environmental Microbiology, 2005, 71(4): 2162-2169. DOI:10.1128/AEM.71.4.2162-2169.2005 |
| [18] |
Shen Z Z, Ruan Y Z, Xue C, et al. Soils naturally suppressive to banana Fusarium wilt disease harbor unique bacterial communities[J]. Plant and Soil, 2015, 393(1/2): 21-33. |
| [19] |
Rumberger A, Yao S R, Merwin I A, et al. Rootstock genotype and orchard replant position rather than soil fumigation or compost amendment determine tree growth and rhizosphere bacterial community composition in an apple replant soil[J]. Plant and Soil, 2004, 264(1/2): 247-260. DOI:10.1023/B:PLSO.0000047760.13004.94 |
| [20] |
Zhao Q Y, Dong C X, Yang X M, et al. Biocontrol of Fusarium wilt disease for Cucumis melo melon using bio-organic fertilizer[J]. Applied Soil Ecology, 2011, 47(1): 67-75. DOI:10.1016/j.apsoil.2010.09.010 |
| [21] |
Shepard R N. The analysis of proximities:multidimensional scaling with an unknown distance function Ⅱ[J]. Psychometrika, 1962, 27(3): 219-246. DOI:10.1007/BF02289621 |
| [22] |
Wu T H, Chellemi D O, Graham J H, et al. Comparison of soil bacterial communities under diverse agricultural land management and crop production practices[J]. Microbial Ecology, 2008, 55(2): 293-310. |
| [23] |
张苗苗.白木香中内生菌的分离鉴定及其分布规律的初步研究[D].广州: 广州中医药大学, 2017. Zhang M M. Apreliminary study on the isolation and identification of endophytic bacteria in white fragrant and distribution[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2017(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10572-1017110608.htm |
| [24] |
邱炜, 黄惠琴, 叶建军, 等. 抗香蕉枯萎病放线菌的筛选及菌株DA07408的鉴定[J]. 农业现代化研究, 2009, 30(1): 126-128. Qiu W, Huang H Q, Ye J J, et al. Screening of actinomycete against Fusarium oxysporum f. sp. cubense and identification of strain DA07408[J]. Research of Agricultural Modernization, 2009, 30(1): 126-128 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-0275.2009.01.030 |
| [25] |
Zarraonaindia I, Owens S M, Weisenhorn P, et al. The soil microbiome influences grapevine-associated microbiota[J]. mBio, 2015, 6(2): e0252714. DOI:10.1128/mBio.02527-14 |
| [26] |
Hallmann J, Quadt-Hallmann A, Mahaffee W F, et al. Bacterial endophytes in agricultural crops[J]. Canadian Journal of Microbiology, 1997, 43(10): 895-914. DOI:10.1139/m97-131 |
| [27] |
姚领爱, 胡之璧, 王莉莉, 等. 植物内生菌与宿主关系研究进展[J]. 生态环境学报, 2010, 19(7): 1750-1754. Yao L A, Hu Z B, Wang L L, et al. Research development of the relationship between plant endophyte and host[J]. Ecology and Environmental Sciences, 2010, 19(7): 1750-1754. DOI:10.3969/j.issn.1674-5906.2010.07.042 |
| [28] |
蓝江林, 刘波, 焦会民, 等. 香蕉植株内生细菌群落多态性研究[J]. 热带亚热带植物学报, 2012, 20(3): 285-291. Lan J L, Liu B, Jiao H M, et al. Community and diversity of endophytic bacteria in Musa nana[J]. Journal of Tropical and Subtropical Botany, 2012, 20(3): 285-291 (in Chinese with English abstract). DOI:10.3969/j.issn.1005-3395.2012.03.012 |
| [29] |
刘晨.甘蓝型冬油菜内生细菌多样性及生防潜力评估[D].武汉: 华中农业大学, 2016. Liu C. Evaluation of diversity and biocontrol potential of the endophytic bacteria in Brassica napus[D]. Wuhan: Huazhong Agricultural University, 2016(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10504-1016156101.htm |
| [30] |
池淼.杨属植物茎干内生菌多样性及拮抗细菌筛选[D].北京: 中国林业科学研究院, 2014. Chi M. The endophyte diversity and the screening of antagonistic bacteria in poplar stems[D]. Beijing: Chinese Academy of Forestry Sciences, 2014(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-82201-1014336713.htm |
| [31] |
武居宝, 陈立杰, 朱晓峰, 等. 诱导玉米抗弯孢菌叶斑病促生细菌的鉴定及生防效果评价[J]. 中国农学通报, 2018, 34(11): 97-102. Wu J B, Chen L J, Zhu X F, et al. Identification and biocontrol effect of growth promoting bacteria to induce resistance against Curvularia leaf spot in maize[J]. Chinese Agricultural Science Bulletin, 2018, 34(11): 97-102. DOI:10.11924/j.issn.1000-6850.casb17110018 |
| [32] |
刘杉, 安屹, 程慧洁, 等. 短小芽胞杆菌Y106对棉花黄萎病的防治作用[J]. 河南大学学报(自然科学版), 2018, 48(3): 85-92. Liu S, An Y, Cheng H J, et al. The effect of Bacillus pumilus Y106 on controlling cotton Verticillium wilt[J]. Journal of Henan University(Natural Science Edition), 2018, 48(3): 85-92. |
| [33] |
林玲, 王明江, 周益军. 棉花根部拮抗枯萎病菌或黄萎病菌的可培养内生细菌多样性分析[J]. 棉花学报, 2015, 27(2): 166-175. Lin L, Wang M J, Zhou Y J. Diversity analysis of culturable endophytic bacteria with antagonistic activity against Fusarium oxysporum f. sp. vasinfectum or Verticillium dahliae from the roots of Gossypium hirsutum[J]. Cotton Science, 2015, 27(2): 166-175 (in Chinese with English abstract). |
| [34] |
李娟, Uwaremwe C, 冷艳, 等. 节杆菌属细菌处理有机物和重金属污染物的研究进展[J]. 环境科学与技术, 2017, 40(10): 89-97. Li J, Uwaremwe C, Leng Y, et al. Progress on the study of biodegradation of organic pollutants and adsorption of heavy metals with Arthrobacter strains[J]. Environmental Science and Technology, 2017, 40(10): 89-97. |
| [35] |
杨海君, 谭周进, 肖启明, 等. 假单胞菌的生物防治作用研究[J]. 中国生态农业学报, 2004, 12(3): 158-161. Yang H J, Tan Z J, Xiao Q M, et al. Biocontrol functions of Pseudomonad[J]. Chinese Journal of Eco-Agriculture, 2004, 12(3): 158-161 (in Chinese with English abstract). |
| [36] |
刘重喜, 宋佳, 王相晶, 等. 植物招募防御微生物与植物保护[J]. 中国科学:生命科学, 2016, 46(5): 491-497. Liu C X, Song J, Wang X J, et al. Recruitment of defensive microbes and plant protection[J]. Scientia Sinica Vitae, 2016, 46(5): 491-497 (in Chinese with English abstract). |




