文章信息
- 张晓, 任惠惠, 曹婧, 苗其军, 金奇江, 王彦杰, 徐迎春
- ZHANG Xiao, REN Huihui, CAO Jing, MIAO Qijun, JIN Qijiang, WANG Yanjie, XU Yingchun
- 弱光导致荷花花芽败育的机制探析
- Analysis of the mechanism of lotus flower bud abortion caused by low light
- 南京农业大学学报, 2019, 42(6): 1040-1049
- Journal of Nanjing Agricultural University, 2019, 42(6): 1040-1049.
- http://dx.doi.org/10.7685/jnau.201904027
-
文章历史
- 收稿日期: 2019-04-15
2. 江苏省响水县小尖镇张集中心社区农业中心, 江苏 响水 224613
2. Zhangji Center Community Agriculture Center, Xiaojian Town, Xiangshui, Jiangsu Province, Xiangshui 224613, China
对于以观花特性为主的观赏植物来说, 开花品质是衡量其观赏价值的决定因素之一, 而不适宜的生长环境对植物开花则会产生不利影响。弱光逆境是指光照强度短暂或持久低于光饱和点, 但不低于限制其生存最低光照强度时的环境[1], 而持续的弱光环境会使植物生长发育受限[2]。植物生殖发育尤其是花芽分化离不开光照。弱光引起的光强度、光质等因素的改变, 对于植物最直接的影响就是导致其光合效率下降[3], 合成的糖类物质减少。已有报道指出, 碳水化合物的积累与花芽分化密切相关[4-5]。海藻糖途径是植物糖类代谢中的重要组成部分, 近年的研究表明, 海藻糖-6-磷酸合成酶(TPS)能够作为糖的感受器, 在植物的逆境胁迫及开花调控上起到关键作用[6]。通过干扰拟南芥TPS1基因的表达, 拟南芥中开花相关基因的表达量显著下调, 植株表现出晚开花的特征[7]。这表明TPS1在植物开花调控中具有重要作用。在调控植物开花时, TPS1信号位于已知的开花调控信号如光质、光周期、赤霉素(GA)和春化信号的下游或者与这些信号途径平行[8]。
荷花是夏季重要的水生观赏植物之一, 具有典型的喜阳特性。在荷花的生长季节(4至10月), 荷花在生长立叶的每个节间处都会形成花芽[9]。但是荷花开花的数量通常比立叶的数目少得多。对于荷花产生如此多败育花芽的原因, 尚未有研究阐释其中的作用机制。因此, 本研究以‘霞光染指’‘红盏托珠’‘雪恋’3种观赏荷花品种为研究对象, 通过设置遮阴处理, 对其生长指标、开花品质、光合指标、可溶性糖含量、败育花芽细胞凋亡检测及定量验证进行探究, 旨在系统阐释弱光胁迫下荷花花芽败育的内在机制, 为解决弱光下荷花花芽易败育、无法开花和耐阴性差等问题的分子育种和生长调节剂开发提供思路。
1 材料与方法 1.1 试验材料与处理 1.1.1 遮阴处理试验于2018年4月至8月在南京市浦口区艺莲苑进行。于4月初选取种藕厚实饱满的3个荷花品种(‘霞光染指’‘红盏托珠’‘雪恋’), 种植于花盆(直径35 cm, 深20 cm)中, 采用人工遮阴棚遮阴栽培。棚架高度2 m, 攀缘柱间距为1.2 m, 行距为1.8 m, 攀缘铁线固定于攀缘柱1.2 m高处, 遮阴网固定于棚架顶部。待荷花第1~3片立叶长出之后分别进行2种处理:对照处理(全光照, 遮光率为0%)和遮阴处理(遮光率为70%), 阴天透光率略有降低。每个处理每个品种重复3盆。
1.1.2 外源施糖处理荷花种子破壳后, 浸入白色塑料桶(直径10 cm, 高15 cm)中, 每隔3 d换1次水。实生苗生长10 d后, 在叶与根尚未长出时, 加入1.5 g蔗糖作为试验组, 以不加蔗糖为对照组。每3 d换1次水, 每处理3盆, 每盆4株荷花幼苗。将幼苗置于25 ℃培养箱中, 光照强度为70 μmol·m-2·s-1, 光照/黑暗时间为16 h/8 h, 处理1周后, 取叶片作为试验材料。
1.2 测定指标与方法 1.2.1 生长指标测定于2018年7月初每处理选取长势相似的3株植株并标号, 测定株高、叶片数、叶面积、花蕾直径、花柄高度、开花量。花期统计:从第1朵荷花花苞露出水面时记为始花期, 最后1朵荷花凋零时记为末花期, 每隔1周不间断进行统计。成花率=开花数/叶片数×100%。
1.2.2 光响应曲线测定于2018年8月, 选择无风晴天的日子进行试验。采用LI-6800便携式光合测量系统, 设定的光照强度为1 500、1 200、900、600、300、200、100、50、20、10、0 μmol·m-2·s-1 11个梯度, 每个梯度测定时间为180 s。测定时, 将叶室夹紧叶片, 系统设置选择“light response”, 当净光合速率的变化幅度低于0.5时连续记录3个值, 最终结果取其平均值。光响应曲线的拟合曲线方程采用非直角双曲线模型[10]。
1.2.3 可溶性糖含量测定采用姚改芳等[11]的方法测定荷花根状茎中的果糖、葡萄糖、蔗糖及可溶性总糖含量, 每个样品重复3次。
1.2.4 花芽切片制作及细胞凋亡检测于盛花期前后(4至6月), 采用活体取样法[12]采集莲叶背部的花芽。将荷花正常花芽和败育花芽分别置于FAA固定液中固定24 h以上。石蜡切片制作采用靳丹丹[13]的方法。细胞凋亡检测参照Tunnel细胞凋亡检测试剂盒说明书。
1.2.5 组学数据分析及共表达网络构建本研究所用到的转录组数据包括热胁迫[14]、铜胁迫、水淹胁迫[15]、遮阴处理及腐败病菌处理的转录组数据, 由苏州农业科学院姜红卫老师提供。原始数据通过SRA toolkit转为FASTQ格式, 然后使用NGS QC Toolkit(v2.3.3)进行数据过滤获得clean reads。使用Bowtie2建立荷花基因组索引, 并用TopHat软件进行clean reads比对。通过cufflinks v2.2.142软件计算每个基因的表达量。使用R语言包WGCNA(V 1.49)对上述转录组数据进行分析, 构建逆境下荷花基因的共表达网络。
1.2.6 NnTPS1及NnSnRK1的基因表达分析于7月中旬, 对2种光照处理下的荷花品种‘红盏托珠’和‘雪恋’进行取样。取与新立叶相连的根状茎, 鲜样称质量后, -40 ℃下冷冻保存备用。采用SYBR Premix Ex TaqTM(perfect real time)试剂盒(TaKaRa公司)测定NnTPS1及NnSnRK1的表达量。NnTPS1上游引物:5′-GGAGACTGGATGACAACAATGC-3′, 下游引物:5′-ATCGGCTACCTTGGACAACAT-3′; NnSnRK1上游引物:5′-TGACAGTGCCTCCACCAGATACC-3′, 下游引物:5′-GCCAGTGAACCCACATTCCATTGA-3′。实时荧光定量反应体系20.0 μL, 包含10.0 μL SYBR Premix Ex TaqTM, 正、反向引物各0.8 μL, 反转录cDNA模版2.0 μL, 灭菌蒸馏水6.4 μL。反应于Bio-Rad CFX manager 3.1 PCR仪上进行, 内参基因为Actin, 每个样品重复5次。采用两步法扩增标准程序:95 ℃ 3 min, 95 ℃ 10 s, 60 ℃ 30 s, 39个循环。反应完成后, 得到含所有样品的记录点曲线, 得出循环阈值(CT值)。
1.3 数据处理采用Excel 2016和SPSS 25.0软件进行数据处理和显著性分析, 采用Excel 2016和GraphPad Prism 5软件作图。
2 结果与分析 2.1 遮阴处理对荷花生长及光合特性的影响 2.1.1 遮阴处理对荷花形态指标的影响荷花3月下旬至4月初, 叶片开始萌动, 4月上旬至5月初生长缓慢, 以浮叶为主; 5月上旬各品种荷花的第3片立叶基本长出, 于5月中旬进行遮阴处理, 5月下旬至6月, 荷花进入快速生长期, 主要以叶片数量增加为主, 遮阴处理下植株长势与全光照(对照)相比有明显不同; 6月下旬至7月下旬为荷花盛花期, 7月中旬各形态指标达到最大值, 之后没有明显变化, 因此以遮阴60 d时(7月22日)荷花形态指标分析遮阴对荷花生长发育的影响。
由表 1可见:遮阴对荷花的形态生长和开花性状产生显著的影响, 且不同品种之间表现出一定程度的耐阴差异。遮阴处理的荷花叶柄高度、叶面积、叶片数量整体呈下降趋势。遮阴处理后, ‘霞光染指’叶柄高度比对照减少了26%, ‘雪恋’减少了14%, 而‘红盏托珠’叶柄高度则增加了24%。‘红盏托珠’遮阴处理的叶面积和叶片数量比对照显著减少, ‘雪恋’变化不显著。遮阴处理使各荷花品种植株生长矮小, 但‘雪恋’形态指标的变化幅度比其他品种小, 表现出相对较强的弱光适应能力。遮阴处理荷花花径和花柄高度比对照减少, 但‘雪恋’花径在遮阴条件下有显著增加。
| 品种 Variety | 处理 Treatment | 叶柄高度/cm Petiole height | 叶面积/cm2 Leaf area | 叶片数量 Leaves number | 花柄高度/cm Flower handle height | 花径/cm Corolla diameter |
| 霞光染指 | 对照 Control | 38.83±1.61c | 187.06±8.93cd | 38.33±1.15a | 5.37±0.06d | 48.27±2.70c |
| Xiaguangranzhi | 遮阴 Shading | 28.23±0.67d | 151.33±3.10d | 18.33±4.04d | 4.90±0.20d | 35.57±1.37d |
| 红盏托珠 | 对照 Control | 31.90±2.38d | 273.89±10.65b | 27.00±2.00b | 14.97±0.31b | 37.23±0.68d |
| Hongzhantuozhu | 遮阴 Shading | 42.13±1.83c | 192.66±1.80c | 20.33±2.31c | — | — |
| 雪恋 | 对照 Control | 56.30±4.40a | 363.40±32.20a | 12.00±1.00d | 16.23±0.70a | 85.10±0.85b |
| Xuelian | 遮阴 Shading | 48.29±1.82b | 295.89±34.48b | 9.33±1.53d | 14.17±0.47c | 91.67±4.73a |
| 注:不同小写字母表示差异显著(P < 0.05)。下同。 Note:Different small letters indicate significant difference at 0.05 level. The same as follows. | ||||||
对照处理下, ‘霞光染指’花期为5月上旬至8月上旬, 约75 d; ‘红盏托珠’花期较短, 从5月中旬至6月中旬为盛花期, 约30 d; ‘雪恋’花期较长, 从4月中旬至7月上旬, 不间断开花。遮阴处理下, ‘霞光染指’整体花期延迟变短, 开花时间为8月上旬至9月初, 比对照缩短了54 d; ‘红盏托珠’完全败育; ‘雪恋’花期相对较长, 开花时间为6月上旬至8月中旬, 比对照缩短了13 d, 同时其雌蕊发生不同程度的泡化和瓣化现象(图 1)。

|
图 1 遮阴处理下‘雪恋’雌蕊的泡化和瓣化现象 Fig. 1 The blistering and petalization of'Xuelian'pistil under shading treatment |
由图 2可见:遮阴处理下3个品种的成花率均比对照显著下降。其中‘霞光染指’下降了45.3%, ‘红盏托珠’完全不开花, ‘雪恋’下降了59.8%。表明弱光条件不利于荷花的形态发育, 尤其是生殖发育。

|
图 2 遮阴处理对荷花成花率的影响 Fig. 2 Effect of shading treatment on flowering rate of lotus |
由表 2可见:3个荷花品种的光补偿点(LCP)在遮阴处理下均比对照降低, 表明在遮阴环境下, 荷花叶片提高了对弱光的利用能力, 以适应不利的光环境。与对照相比, ‘霞光染指’和‘红盏托珠’的光饱和点(LSP)分别增加了16.9%和8.0%, 而‘雪恋’下降了1.6%, 且差异显著, 这可能是因为在8月上旬2种处理下的荷花生长状态不同。表观量子效率(AQY)与光饱和点变化趋势相同, 也证明了‘霞光染指’和‘红盏托珠’2个品种在8月利用光能的能力比对照有所提高。
| 品种 Variety | 处理 Treatment | 光饱和点 Light saturation point | 光补偿点 Light compensation point | 表观量子效率 Apparent quantum efficiency |
| 霞光染指 | 对照 Control | 483.701±8.28c | 85.90±1.76a | 0.021 1±0.000 2f |
| Xiaguangranzhi | 遮阴 Shading | 565.498±11.32ab | 65.51±3.89b | 0.031 1±0.000 2c |
| 红盏托珠 | 对照 Control | 297.682±5.23e | 30.61±2.24b | 0.027 7±0.000 1d |
| Hongzhantuozhu | 遮阴 Shading | 390.053±5.03d | 26.72±1.08c | 0.035 6±0.000 2a |
| 雪恋 | 对照 Control | 556.602±12.64a | 57.31±1.57b | 0.032 7±0.000 4b |
| Xuelian | 遮阴 Shading | 547.541±8.80b | 31.71±1.86c | 0.023 3±0.000 2e |
如图 3所示:遮阴处理下3个品种的果糖、葡萄糖和蔗糖含量比对照显著下降, 其中蔗糖含量下降的幅度最大。‘雪恋’对照处理的可溶性糖含量最高, 且遮阴处理下相对其他2个品种也能维持较高的糖含量, 对比开花性状, 如花期, 可以看出‘雪恋’受遮阴条件影响较小, 也证实了糖含量与开花之间具有密不可分的关联。
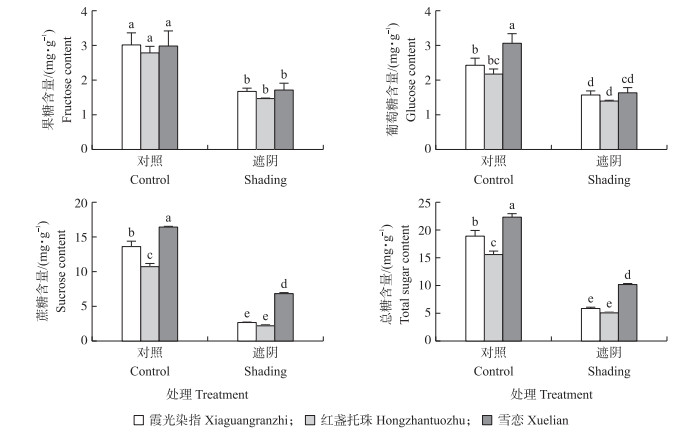
|
图 3 遮阴处理对荷花根状茎中可溶性糖含量的影响 Fig. 3 Effect of shading treatment on soluble sugar content in lotus rhizome |
田间调查发现, 荷花开花量仅占叶片数量的20%~30%, 但是弱光环境加剧了花芽败育现象的发生。对没有开花的花芽进行观察, 发现花芽早期发生了败育, 因而未能正常生长。荷花花芽生长包括花芽分化和发育2个阶段, 2个时期都会发生不同程度的败育情况。与正常花芽(图 4-A、B)相比, 败育花芽(图 4-C、D)花柄部分率先失水老化, 花芽由鲜黄色逐渐变为灰褐色最后呈现为黑色。通过切片观察, 发现与正常花芽(图 4-E)相比, 败育花芽(图 4-F)的花瓣原基呈现缩水干瘪状态, 雄蕊原基呈现出瓦解断裂状态; 而心皮原基部分也表现出断层发育畸形的特征, 表明该花芽停留在荷花花芽的心皮和花托部位继续分化期, 之后终止发育, 走向衰老。
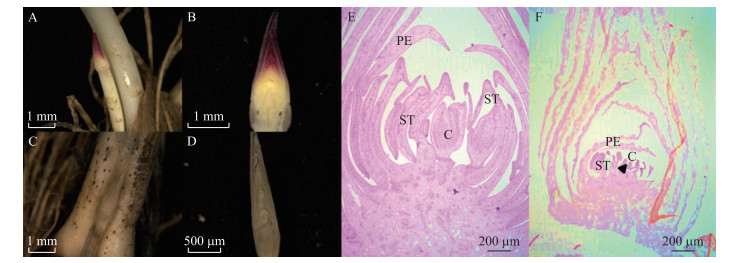
|
图 4 荷花正常花芽及败育花芽形态发育观察 Fig. 4 Observation of morphological development of lotus normal flower buds and aborted flower buds A.正常花芽; B.正常花芽纵切面; C.败育花芽; D.败育花芽纵切面; E.正常花芽石蜡切片; F.败育花芽石蜡切片。PE:花瓣原基; ST:雄蕊原基; C:心皮原基。 A. Normal flower bud; B. Normal flower bud longitudinal section; C. Aborted flower bud; D. Aborted flower bud longitudinal section; E. Normal flower bud paraffin section; F:Aborted flower bud paraffin section; PE:Petal primordial; ST:Stamen primordial; C:Carpel primordium. |
为了鉴定花芽的败育过程是否为植物主动调控的结果, 我们通过TUNNEL法检测细胞凋亡。正常细胞经过DNA酶处理后会发生细胞凋亡, 最终使部分细胞呈现绿色(图 5-A), 证明试剂酶活性正常。阴性对照中没有绿色颗粒, 均被染成蓝色(图 5-B), 证明试验组标记的荧光特异, 非假阳性。正常花芽(图 5-C)几乎没有绿色荧光, 而败育花芽(图 5-D)中呈现明显的绿色荧光, 证明其细胞核内DNA已经发生降解, 发生细胞程序性凋亡。
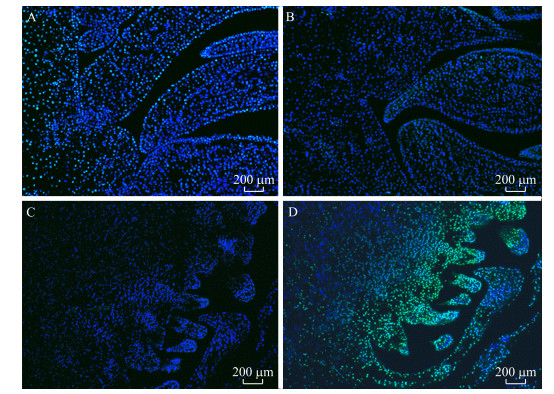
|
图 5 Tunnel法检测荷花败育花芽细胞凋亡情况 Fig. 5 Detection of apoptosis of flower bud cells in lotus affected by Tunnel method A.正常细胞; B.阴性对照; C.正常花芽; D.败育花芽。 A. Normal cell; B. Negative control; C. Normal flower bud; D. Aborted flower bud. |
为了更深入地探寻荷花在遮阴情况下的响应, 我们对获得的遮阴处理下荷花转录组测序数据进行测序, 发现1个与植物碳水化合物感知相关的基因家族, 海藻糖-6-磷酸合成酶基因(TPS)在遮阴处理下发生显著变化。在遮阴处理下, TPS基因家族成员表达量的变化非常大, 从下调2.1倍(NNU_024672)到上调2.8倍(NNU_020889)。其中6个基因发生显著上调, 1个基因显著下调(图 6)。
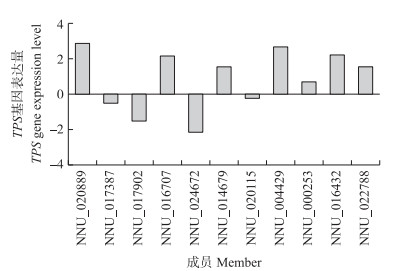
|
图 6 TPS基因家族表达量 Fig. 6 The expression level of TPS gene family |
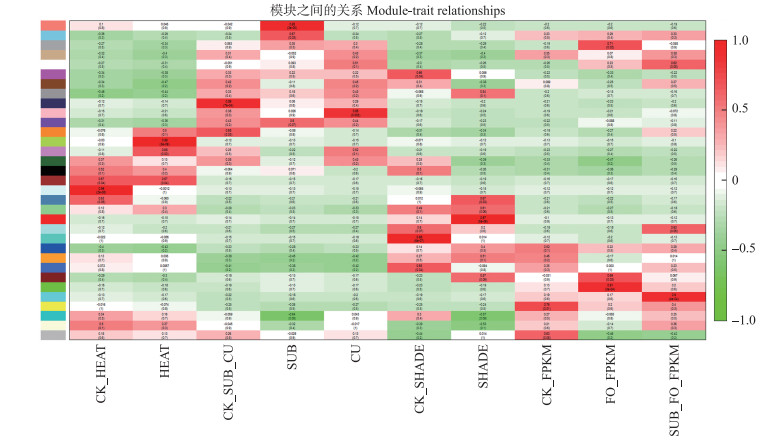
为进一步探究在荷花弱光响应中占主导地位的基因, 采用加权基因共表达分析(WGCNA)的方法对不同胁迫下的基因进行基因共表达分析。利用pickSoftThreshold函数, 计算得到在不同加权系数情况下连接度对数与该基因出现的概率对数之间的相关系数, 同时按照软阈值作图。将临接矩阵转化为拓扑矩阵, 然后利用相异度进行拓扑重叠, 构建系谱树后识别共表达网络, 最终得到38个不同的模块(图 7)。将不同处理作为因子, 计算矩阵与模块特征向量间的相关系数, 相关系数越大, 代表模块与该处理的相关性越高。通过与处理信息的关联, 发现了与不同胁迫显著关联的模块。通过分析, 在turquoise模块中找到1个以TPS1 (NNU_017902)为核心基因的亚网络与遮阴处理显著相关。GO分析TPS1调控的网络基因与能量代谢、生长及胁迫响应密切相关, 暗示其可能参与了荷花对弱光的响应。
|
图 7 模块与处理相关性的热图
Fig. 7 A heat map of the module and processing correlation
1)每个模块由模块特征向量代表, 颜色代表模块基因表达与组织间的关系。Each module is represented by a module feature vector, and the color represents the relationship between the module gene expression and the organization. 2)CK:对照Control; HEAT:热胁迫Heat stress; SUB:水淹胁迫Flooding stress; CU:铜胁迫Copper stress; SHADE:遮阴处理Shading treatment; FO_FPKM:尖孢链孢菌处理Treatment of Streptococcus acarii; SUB_FO_FPKM:水淹后尖孢链孢菌处理Treatment of Streptococcus acarii after flooding. |
研究表明TPS1在正常生长情况下调控植物发育、营养贮存, 在胁迫情况下由于碳水化合物水平下降, 表达量下降, 受其负调控的SnRK1 (蔗糖非依赖1蛋白激酶)表达提高, 增加光合和代谢增强植物在逆境下的生存, 同时减少不必要的消耗, 例如开花等过程。SnRK1在植物细胞的PCD发生中也起重要的作用[16]。测序转录组数据显示, NnTPS1在各胁迫下表达量下调, 而LOC104598048是鉴定到的唯一NnSnRK1基因, 表达量呈现上调趋势(图 8), 表明弱光下NnTPS1表达量的下降引起的NnSnRK1表达量上升可能是诱导荷花花芽败育的主要原因。

|
图 8 TPS1和SnRK1基因在不同胁迫处理下的表达量热图 Fig. 8 Heat map of TPS1 and SnRK1 genes expression under different stress treatments CK:对照Control; S:遮阴处理Shading treatment; FO:病菌感染Bacterial infection; Sub:水淹胁迫Flooding stress; Cu:铜胁迫Copper stress; H:热胁迫Heat stress. |
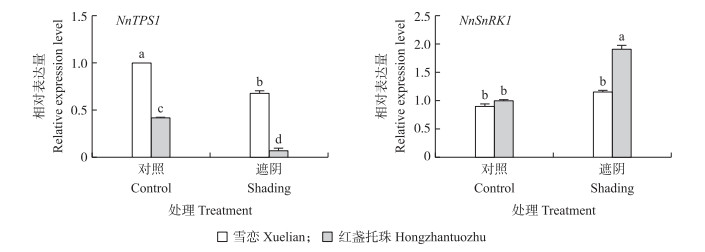
较耐阴荷花品种‘雪恋’和不耐阴品种‘红盏托珠’的根状茎中的2个基因的表达检测结果显示(图 9):根状茎中, 对照处理‘雪恋’的NnTPS1表达量高于‘红盏托珠’, 遮阴处理下, 2个品种的NnTPS1表达量都下降, 但‘红盏托珠’的NnTPS1表达量显著下调, 且低于‘雪恋’; NnSnRK1的表达与之相反, 在对照处理下, ‘雪恋’略高于‘红盏托珠’, 在遮阴处理下, ‘红盏托珠’中NnSnRK1的表达量则显著上调。表明NnTPS1基因在弱光下表达量下调, 而NnSnRK1基因表达量则上调, 且耐阴品种的NnTPS1表达量比不耐阴品种要高一些。
|
图 9 遮阴处理对荷花根状茎NnTPS1及NnSnRK1基因表达量的影响 Fig. 9 Effect of shading treatment on the expression level of NnTPS1 and NnSnRK1 in lotus rhizome |
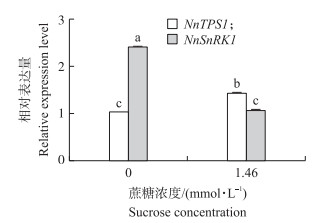
通过对荷花幼苗施加蔗糖, 发现1.46 mmol·L-1蔗糖可以促使荷花显著生长, 定量检测数据显示, 蔗糖处理促使NnTPS1基因表达量上升, 而NnSnRK1则呈下降趋势(图 10)。且两者之间的表达量呈现负相关关系, 这表明荷花NnTPS1基因受蔗糖调控, 而NnTPS1与NnSnRK1基因则呈拮抗关系, 在一定浓度蔗糖范围内, NnTPS1基因表达量随蔗糖浓度的升高而上升, NnSnRK1则随浓度升高而下降。
|
图 10 蔗糖处理对荷花叶片NnTPS1和NnSnRK1基因表达的影响 Fig. 10 Effect of sugar treatment on the relative expression of NnTPS1 and NnSnRK1 in leaves of lotus |
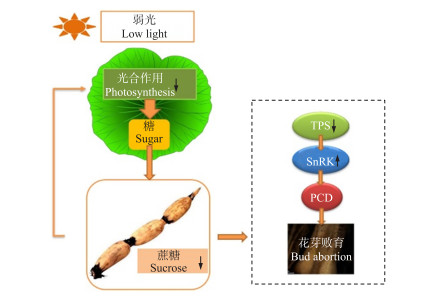
综合生理数据及转录组分析, 从分子层面进一步证实, 弱光引起的荷花糖含量降低导致关键基因产生相对应的调控反馈, 从而诱发荷花花芽败育。如图 11所示:弱光胁迫下, 荷花的光合作用受到严重限制, 通过调整光补偿点和光饱和点以维持基本的生长需求, 由于光合能力不足, 光合产物倾向于分配至营养器官, 对荷花的花芽投入较少的能量, 根状茎中积累的碳水化合物含量下降, NnTPS1响应弱光引起的低糖含量而表达量下降, 进而引起NnSnRK1基因表达量上升, 最终引发荷花花芽发生细胞程序性死亡, 导致花芽败育。
|
图 11 弱光下花芽败育机制模型 Fig. 11 Mechanism model of flower bud abortion under low light TPS:海藻糖-6-磷酸合成酶Trehalose-6-phosphate synthase; SnRK1:蔗糖非依赖1蛋白激酶Sucrose non-fermenting 1-related protein kinases 1;PCD:细胞程序性死亡Programmed cell death. |
光照是植物生长发育及形态建成的重要因素之一, 植物适应不利的弱光环境主要包括避阴和耐阴2种机制[17]。本研究通过对3个荷花品种生长指标及生理指标的比较, 发现不同品种对弱光有不同的响应策略。‘霞光染指’表现出晚开花的特征, 遮阴下不开花的荷花‘红盏托珠’则出现明显的避阴反应; 而‘雪恋’在遮阴条件下, 各形态指标与对照相比变化幅度最小, 且遮阴下倾向于维持开花状态, 虽然未出现伸长生长, 但雌蕊发生泡化和瓣化, 因此减少雄蕊、雌蕊及果实发育造成的养分过度消耗, 可以在弱光下维持比较好的开花特性。
弱光主要影响植物的碳代谢, 从而降低植物中可溶性糖含量[18]。而碳水化合物的供应是否充足, 对花芽分化质量优劣起决定性作用[19]。荷花的主要繁殖器官是种藕, 种藕顶芽属于混合芽, 花芽位于叶芽背部, 通常在立叶出水后花芽才会发育。与营养器官相比, 新生的繁殖器官对营养获得不具优势, 主要因为它们通常远离叶片, 营养物质运输量较低, 营养物质分布不均, 在韧皮部分布较少, 导致其储存和伸长受到阻碍[20]。花芽分化期, 莲藕中的可溶性糖含量呈现先升高后降低的特点, 且在花瓣分化期达到最高值[12]。本研究表明, 弱光条件促使荷花根状茎中蔗糖与总糖含量显著降低, 与开花量呈正相关关系, 表明弱光减少了荷花能量的固定, 分配到有性生殖的能量减少, 这与前人对矮牵牛[21]的研究结论一致。
花芽败育现象在核果类树木与蔬菜上比较常见, 自身的生理原因或不良的栽培条件都可能导致花器败育, 致使开花率或坐果率降低[22]。Liu等[23]的研究证实了败育花芽呈现细胞程序性死亡的特征。我们通过对荷花花芽的解剖学观察和Tunnel检测也发现, 败育的荷花花芽在花芽分化期间启动了细胞程序性死亡, 花芽内部构造停止发育、逐渐萎缩, 这表明荷花花芽败育系荷花自身主动调控的结果。张鲁刚等[24]通过cDNA-AFLP技术对大白菜败育花芽进行随机测序, 发现其花芽败育是与代谢密切相关的一系列基因共同调节的结果。在正常生长环境下, 荷花花芽败育现象也会出现, 其中一部分是因为前一年夏末秋初休眠期时形成的花芽在次年生长时因为顶芽的顶端优势而受到抑制, 但是弱光环境加速了败育花芽数量的增加, 细胞程序性死亡的检测也验证了我们的推测。
NnTPS1是合成海藻糖-6-磷酸(T6P)的关键酶, 拟南芥中TPS1缺失可以阻碍营养生长到开花的过渡[25]。本研究中, 遮阴处理后, 荷花生长发育受到胁迫, 荷花根状茎的可溶性糖含量显著下降, 其中蔗糖的响应最为明显。定量结果证实遮阴处理下NnTPS1表达量下降, 而NnSnRK1的表达水平则显著上升, 且表达量高于NnTPS1; 外源施加1.46 mmol·L-1蔗糖, 荷花中NnTPS1表达量上升, 而NnSnRK1的表达量则显著受到抑制。当荷花体内碳水化合物不足时, NnSnRK1表达量增加以调控植物碳水化合物水平, 进一步对植物的生长发育以及引起能量变化的逆境作出应答, 这与李丹丹等[26]的研究结果相似。这些结果都表明弱光下, 荷花中NnTPS1的表达量能够响应蔗糖含量下降而出现下调, 同时其表达呈现与NnSnRK1相反的模式, 对T6P/SnRK糖信号途径产生影响, 引起NnSnRK1的激活, 进而抑制植物生长发育、调控成花中的细胞程序性死亡。
综上, 持续的弱光环境对荷花的生长发育产生胁迫效应, 花芽败育率升高, 不同品种荷花在开花方面对光的适应性不同。TPS/SnRK1信号通过调节碳水化合物的分配进而调节花芽发育及植株生长。但TPS/SnRK1信号通路在植物生长发育中的生物学功能还需要进一步研究, 而花芽的分化发育也受温度、水肥等多重因素的影响, 其败育的根本原因也需要更深入地探索。
| [1] |
战吉宬, 黄卫东, 王利军. 植物弱光逆境生理研究综述[J]. 植物学通报, 2003, 38(1): 43-50. Zhan J C, Huang W D, Wang L J. Research of weak light stress physiology in plants[J]. Chinese Bulletin of Botany, 2003, 38(1): 43-50 (in Chinese with English abstract). DOI:10.3969/j.issn.1674-3466.2003.01.005 |
| [2] |
Fu Y M, Li H Y, Yu J, et al. Interaction effects of light intensity and nitrogen concentration on growth, photosynthetic characteristics and quality of lettuce(Lactuca sativa L. var. Youmaicai)[J]. Scientia Horticulturae, 2017, 214: 51-57. DOI:10.1016/j.scienta.2016.11.020 |
| [3] |
Bertamini M, Muthchelian K, Nedunchezhaian N. Shade effect alters leaf pigments and photosynthetic responses in Norway spruce(Picea abies L.)grown under field conditions[J]. Photosythetica, 2006, 44(2): 227-234. DOI:10.1007/s11099-006-0011-z |
| [4] |
赵秋芳, 陈娅萍, 顾文亮, 等. 香草兰花芽分化期蛋白质及碳水化合物变化研究[J]. 热带作物学报, 2015, 36(6): 1053-1058. Zhao Q F, Chen Y P, Gu W L, et al. Change of protein and carbohydrate in Vanilla planifolia Andrews during flower bud differentiation period[J]. Chinese Journal of Tropical Crops, 2015, 36(6): 1053-1058 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-2561.2015.06.008 |
| [5] |
全振炫, 魏冬, 吴国麟, 等. 莲雾遮阴诱导成花过程中顶芽结构与淀粉粒分布的变化[J]. 果树学报, 2018, 35(7): 845-852. Quan Z X, Wei D, Wu G L, et al. Changes in the structure of apical buds and distribution of starch grains in wax apple during flower formation[J]. Journal of Fruit Science, 2018, 35(7): 845-852 (in Chinese with English abstract). |
| [6] |
Fernandez J, Wilson R. The sugar sensor, trehalose-6-phosphate synthase(Tps1), regulates primary and secondary metabolism during infection by the rice blast fungus:will Magnaporthe oryzae's "sweet tooth" become its "Achilles' heel"?[J]. Mycology, 2011, 2(1): 46-53. DOI:10.1080/21501203.2011.563431 |
| [7] |
van Dijken A J, Schluepmann H, Smeekens S C M. Arabidopsis trehalose-6-phosphate synthase 1 is essential for normal vegetative growth and transition to flowering[J]. Plant Physiology, 2004, 135(2): 969-977. DOI:10.1104/pp.104.039743 |
| [8] |
Paul M J, Jhurreea D, Zhang Y H, et al. Up-regulation of biosynthetic processes associated with growth by trehalose 6-phosphate[J]. Plant Signaling & Behavior, 2010, 5(4): 386-392. |
| [9] |
Ishizuna F, Tsutsumi N. Flower bud formation of sacred lotus(Nelumbo nucifera Gaertn.):a case study of 'Gyozankouren' grown in a container[J]. HortScience, 2014, 49(4): 516-518. DOI:10.21273/HORTSCI.49.4.516 |
| [10] |
刘颖嘉, 程习梅, 荣俊冬, 等. 7个荷花品种光合特性的研究[J]. 江西农业大学学报, 2012, 34(1): 40-43. Liu Y J, Cheng X M, Rong J D, et al. The photosynthetic characteristics of seven varieties of Nelumbo nucifera Gaertn[J]. Acta Agriculturae Universitatis Jiangxiensis, 2012, 34(1): 40-43 (in Chinese with English abstract). |
| [11] |
姚改芳, 张绍铃, 吴俊, 等. 10个不同系统梨品种的可溶性糖与有机酸组分含量分析[J]. 南京农业大学学报, 2011, 34(5): 25-31. Yao G F, Zhang S L, Wu J, et al. Analysis of components and contents of soluble sugars and organic acids in ten cultivars of pear by high performance liquid chromatography[J]. Journal of Nanjing Agricultural University, 2011, 34(5): 25-31 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2011.05.005 |
| [12] |
胡鑫, 王彦杰, 金奇江, 等. 活体取样并鉴定荷花花芽分化时期的方法研究[J]. 江苏农业科学, 2018, 46(24): 113-115. Hu X, Wang Y J, Jin Q J, et al. Study on methods of sampling in vivo and flower bud differentiation period identification of Nelumbo nucifera[J]. Jiangsu Agricultural Sciences, 2018, 46(24): 113-115 (in Chinese with English abstract). |
| [13] |
靳丹丹.碗莲花芽分化形态发育以及相应时期生理生化的动态研究[D].郑州: 河南农业大学, 2008: 28-29. Jin D D. Studies on the morphological development and the physiological changes during flower bud differentiation processes in Nelumbo nucifera[D]. Zhengzhou: Henan Agricultural University, 2008: 28-29(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10466-2008212476.htm |
| [14] |
Liu X, Du F, Li N, et al. Gene expression profile in the long-living lotus:insights into the heat stress response mechanism[J]. PLoS One, 2016, 11(3): e0152540. DOI:10.1371/journal.pone.0152540 |
| [15] |
Wang B, Jin Q J, Zhang X, et al. Genome-wide transcriptional analysis of submerged lotus reveals cooperative regulation and gene responses[J]. Scientific Reports, 2018, 8(1): 9187-9189. DOI:10.1038/s41598-018-27530-x |
| [16] |
Liu Y H, Offler C E, Ruan Y L, et al. Regulation of fruit and seed response to heat and drought by sugars as nutrients and signals[J]. Frontiers in Plant Science, 2013, 4(8): 282. |
| [17] |
温冰消, 刘卫国, 杨文钰. 植物面对荫蔽的两种策略:避荫与耐荫反应机制研究进展[J]. 分子植物育种, 2019, 17(3): 1028-1033. Wen B X, Liu W G, Yang W Y. Two strategies for plants to face shading:advances in the mechanism of shade avoidance and shade tolerance response[J]. Molecular Plant Breeding, 2019, 17(3): 1028-1033 (in Chinese with English abstract). |
| [18] |
Jänkänpää H J, Mishra Y, Schröder W P, et al. Metabolic profiling reveals metabolic shifts in Arabidopsis plants grown under different light conditions[J]. Plant Cell and Environment, 2012, 35(10): 1824-1836. DOI:10.1111/j.1365-3040.2012.02519.x |
| [19] |
金亚征, 姚太梅, 丁丽梅, 等. 果树花芽分化机理研究进展[J]. 北方园艺, 2013(7): 193-196. Jin Y Z, Yao T M, Ding L M, et al. Research progress on the mechanism of flower bud differentiation of fruit trees[J]. Northern Horticulture, 2013(7): 193-196 (in Chinese with English abstract). |
| [20] |
Ruan Y L. Signaling role of sucrose metabolism in development[J]. Molecular Plant, 2012, 5(4): 763-765. DOI:10.1093/mp/sss046 |
| [21] |
岳远征, 刘思禹, 殷超群, 等. 弱光和短日照下'幻想'矮牵牛花芽代谢组学研究[J]. 园艺学报, 2017, 44(12): 2391-2398. Yue Y Z, Liu S Y, Yin C Q, et al. Study on the flower bud metabolomics of Petunia hybrida 'Fantasy' grown under weak light or short day conditions[J]. Acta Horticulturae Sinica, 2017, 44(12): 2391-2398 (in Chinese with English abstract). |
| [22] |
Wang S, Xue J, Ahmadi N, et al. Molecular characterization and expression patterns of PsSVP genes reveal distinct roles in flower bud abortion and flowering in tree peony(Paeonia suffruticosa)[J]. Canadian Journal of Plant Science, 2017, 94: 1181-1193. |
| [23] |
刘静, 张鲁刚, 王风敏, 等. 萝卜花蕾败育过程中的组织细胞学特征观察[J]. 西北农业学报, 2008, 17(5): 272-276. Liu J, Zhang L G, Wang F M, et al. Observation of histocytological feature on radish flower bud during aborting[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2008, 17(5): 272-276 (in Chinese with English abstract). DOI:10.3969/j.issn.1004-1389.2008.05.059 |
| [24] |
张鲁刚, 贾晋, 张少丽, 等. 大白菜花蕾败育相关基因的cDNA-AFLP差异表达分析[J]. 农业生物技术学报, 2010, 18(3): 489-492. Zhang L G, Jia J, Zhang S L, et al. cDNA-AFLP differential expression analysis of genes related with aborting bud in Chinese cabbage[J]. Journal of Agricultural Biotechnology, 2010, 18(3): 489-492 (in Chinese with English abstract). DOI:10.3969/j.issn.1674-7968.2010.03.012 |
| [25] |
Eastmond P J, van Dijken A J H, Spielman M, et al. Trehalose-6-phosphate synthase 1, which catalyses the first step in trehalose synthesis, is essential for Arabidopsis embryo maturation[J]. The Plant Journal, 2002, 29(2): 225-235. DOI:10.1046/j.1365-313x.2002.01220.x |
| [26] |
李丹丹, 许馨露, 翟建云, 等. 毛竹笋竹快速生长期可溶性糖质量分数与PeTPS1/PeSnRK1基因表达分析[J]. 浙江农林大学学报, 2017, 34(6): 1016-1023. Li D D, Xu X L, Zhai J Y, et al. Soluble sugar content and PeTPS1/PeSnRK1 gene expression in Phyllostachys edulis during rapid growth[J]. Journal of Zhejiang A & F University, 2017, 34(6): 1016-1023 (in Chinese with English abstract). |




