文章信息
- 徐霞, 钟秋怡, 何彬, 张震, 王绍华, 丁艳锋, 李刚华
- XU Xia, ZHONG Qiuyi, HE Bin, ZHANG Zhen, WANG Shaohua, DING Yanfeng, LI Ganghua
- 外源虾青素对分蘖期受淹水稻的补救效应
- Remedial effect of exogenous astaxanthin on submerged rice at tillering stage
- 南京农业大学学报, 2019, 42(6): 1006-1013
- Journal of Nanjing Agricultural University, 2019, 42(6): 1006-1013.
- http://dx.doi.org/10.7685/jnau.201903024
-
文章历史
- 收稿日期: 2019-03-15
洪涝灾害一方面阻碍植株通气组织气体交换, 另一方面阻挡光照, 不利于光合作用和呼吸作用[1-2]。遭受涝害的植株碳氮代谢受阻, 发育迟缓[3-4]。除了直接伤害外, 洪涝对植株后续生长还将造成间接伤害, 遭受涝害的植株直接暴露在外界环境中, 新环境因子(强光照和复氧)将对植株造成额外的氧化胁迫, 同时涝害期间导致的根系受损容易引起植株脱水[5]。因此, 淹水胁迫可以被视为一个连续、复合的胁迫。可见, 作物对淹水胁迫的适应能力不仅取决于适应淹水期间的直接胁迫, 还取决于适应淹水解除后间接胁迫, 即自我恢复能力。然而, 现阶段淹水胁迫研究多关注淹水期间胁迫对植株的直接伤害, 关于淹水胁迫后植株生长及恢复的相关研究较少。研究作物在解除淹水胁迫后的恢复性生长将有助于加深淹水胁迫对植株伤害的机制认识, 为抗涝害栽培措施提供理论依据[6-7]。
水稻是我国重要的粮食作物, 水稻分蘖期常遭遇连续的降雨或暴雨, 特别是在长江中下游地区, 洪涝灾害严重影响分蘖期水稻正常生长甚至造成死亡, 产量损失严重[8]。外源物质施用可促进受淹水稻的恢复性生长, 提高植株耐涝能力, 减少产量损失, 是现阶段缓解植物涝害的有效途径之一。本课题组前期研究表明, 外源施用亚精胺可在一定程度上缓解分蘖期受淹水稻的氧化损伤, 减少产量损失[9]。此外, 外源矿质元素, 如氮、磷、钾、硅施用等可提高遭遇淹水胁迫的水稻植株的抗氧化能力, 促进植株快速恢复生长[10-12]。然而, 目前仍缺乏抗涝栽培的有效栽培措施。
植物生长调节物质在农作物的生长发育、提高产量和改良品质方面有明显调控作用, 在生产上广泛应用[13]。施用外源植物生长调节物质可提高植株抗氧化能力, 有效缓解各类胁迫造成的氧化损伤, 提高植株抗逆能力[14-16]。虾青素(astaxanthin, ASTA)是一种具有强抗氧化活性的类胡萝卜素, 其抗氧化能力是β-胡萝卜素的10倍, 茶多酚的200倍, 比天然维生素E高500多倍[17-18], 合理使用虾青素有望缓解淹水胁迫导致的氧化损伤。在安全性方面, 富含虾青素的功能米可作为日常的保健膳食[19]。
虾青素作为植物生长调节物质将在缓解淹水胁迫对水稻伤害方面发挥较大的潜力。然而, 目前鲜有关于外源虾青素调节水稻抗氧化损伤的研究报道。本研究将探讨外源虾青素对分蘖期受淹水稻抗氧化能力的影响, 以期为长江中下游地区分蘖期受淹水稻的补救技术提供依据。
1 材料与方法 1.1 试验材料与设计试验以常规粳稻品种‘宁粳7号’为材料, 于2017年在南京农业大学丹阳试验基地(32°00′N, 119°32′E)进行。淹水池长6 m, 宽3 m, 高1 m。淹水时注水至池高的3/4, 淹水期间保持水位一致。淹水时采用便携式多参数水质测定仪(荷兰EIJKELKAMP)测定水体特性, 测定结果见表 1。
| 观察时间 Observation time |
温度/℃ Temperature |
溶解氧含量/ (mg·L-1) Dissolved oxygen content |
pH | 电导率/ (μm·cm-1) Electrical conductivity |
总溶解性固体含量/(g·L-1) Total dissolved solids content |
浊度/(NTU) Turbidity |
氧化还原电位/mV Oxidation-reduction potential |
| 05:00AM | 25.8±0.6 | 7.8±0.4 | 7.6±0.3 | 376.3±54.5 | 0.244±0.04 | 22.3 | 221.9±54.7 |
| 14:00PM | 27.4±1.3 | 7.6±0.4 | 8.2±0.6 | 356.1±46.1 | 0.230±0.04 | 23.4 | 180.0±47.9 |
| 平均值Mean | 26.6 | 7.7 | 7.9 | 366.2 | 0.237 | 22.8 | 200.9 |
| 注:数据为5 d的平均值±标准差。 Note:Values are means±standard deviation of measurements made every day during 5 days complete submergence. |
|||||||
试验采用盆栽, 盆高35 cm, 内径28 cm。每盆装风干土15 kg, 供试土壤为当地水稻土, 含总氮1.12 g·kg-1、总磷0.47 g·kg-1、总钾1.95 g·kg-1。每盆栽3穴, 每穴3株苗。每盆施肥量为N 2.0 g、K2O 1.8 g、P2O5 1.2 g。其中, 基蘖肥与穗肥质量比为5 : 5。移栽前1周在盆中加水, 将土壤充分拌匀。水稻幼苗长至3叶1心时移栽, 保证秧苗素质中等以上。移栽10 d后, 对水稻进行为期5 d的没顶淹水处理。在解除淹水24 h后当天06:00和18:00叶面喷施ASTA, 设置3个浓度(0.4、0.8、1.6 mmol·L-1 ASTA)。喷施清水作为对照, 另设置不淹水处理作为整个淹水处理的对照。喷施效果以叶片正、反面均沾满药剂而不下滴为准。
试验共5个处理, 正常水分管理, 即不淹水处理(用CT表示); 淹水胁迫+解除淹水后喷施清水(CK); 淹水胁迫+解除淹水后喷施0.4 mmol·L-1 ASTA(ASTA-0.4);淹水胁迫+解除淹水后喷施0.8 mmol·L-1 ASTA(ASTA-0.8);淹水胁迫+解除淹水后喷施1.6 mmol·L-1 ASTA(ASTA-1.6)。采用随机区组设计, 每个处理30盆。淹水处理结束后排出多余水分转至正常水分管理。其他管理措施与常规栽培措施一致。
1.2 测定项目及数据收集 1.2.1 形态指标的测定在叶面喷施后0(当天)、3、6、9、12 d, 每处理选取10盆水稻考察茎蘖数。在叶面喷施0、3、6、9 d, 每处理选取10盆水稻考察绿叶数; 每处理选取30株测量株高(根系着生点到最高叶尖的距离); 每处理选取30株大小一致的植株, 按地上部及地下部分样, 105 ℃杀青30 min后, 80 ℃烘干至质量恒定后测量其干物质量; 采用蒽酮比色法测定植株可溶性总糖含量。
1.2.2 生理指标的测定在叶面喷施0、1、2、3、5、7 d取样测定生理指标, 将心叶下2片完全叶摘下, 液氮速冻30 min后, 保存于-80 ℃冰箱。采用李合生[20]的方法测定叶片中光合色素含量; 采用考马斯亮蓝G-250染色法测定叶片中可溶性蛋白含量; 采用南京建成生物公司提供的试剂盒及其方法测定H2O2的含量。依据Jiang等[21]的方法提取粗酶液, 采用硫代巴比妥酸法[22]测定丙二醛(MDA)含量, 采用李合生[20]和王学奎[23]的方法测定超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、谷胱甘肽还原酶(GR)活性和抗坏血酸过氧化物酶(APX)活性。
1.2.3 产量及其构成成熟期各处理按平均穗数取3盆植株样品, 按照常规考种方法考察穗部性状。
1.3 数据处理与分析采用Microsoft Excel 2010软件整理数据和绘图, 试验结果以3次重复的平均值表示, 数据分析采用t测验。
2 结果与分析 2.1 叶面喷施虾青素对分蘖期受淹水稻茎蘖数和绿叶数的影响图 1表明:水稻遭遇淹水胁迫后其茎蘖数和绿叶数明显低于不淹水处理(CT)。在淹没解除0~3 d各处理茎蘖数没有发生变化, 3 d以后分蘖恢复生长。喷施后12 d, ASTA-0.8处理茎蘖数较CK提高14.6%;喷施后3、6、9 d, ASTA-0.8处理的绿叶数显著增加, 增幅分别为16.2%、16.5%和22.8%。解除淹水后叶面喷施0.8 mmol·L-1虾青素可以同时增加受淹水稻的茎蘖数和绿叶数。

|
图 1 叶面喷施虾青素对分蘖期受淹水稻茎蘖数和绿叶数的影响 Fig. 1 Effects of foliar spraying astaxanthin(ASTA)on the number of tillers and green leaves of submerged rice at tillering stage CT:不淹水处理; CK:清水对照; ASTA-0.4:0.4 mmol·L-1虾青素叶面喷施处理; ASTA-0.8:0.8 mmol·L-1虾青素叶面喷施处理; ASTA-1.6:1.6 mmol·L-1虾青素叶面喷施处理。*P < 0.05。下同。 CT:Non-flooding treatment; CK:Clear water control; ASTA-0.4:0.4 mmol·L-1 ASTA foliar spraying treatment; ASTA-0.8:0.8 mmol·L-1 ASTA foliar spraying treatment; ASTA-1.6:1.6 mmol·L-1 ASTA foliar spraying treatment.*P < 0.05. The same as below. |
从图 2可见:淹水胁迫显著增加水稻株高, 降低水稻的地上部和地下部干物质量及根冠比。与CK相比, 叶面喷施虾青素3 d后受淹水稻株高明显降低, 地上部和地下部干物质积累加快。喷施后9 d, ASTA-0.8处理地上部干物质量显著高于CK, 增幅为27.9%, 地下部干物质量较CK显著增加32.1%。ASTA-1.6处理在喷施后6、9 d地下部干物质量和根冠比显著增加。
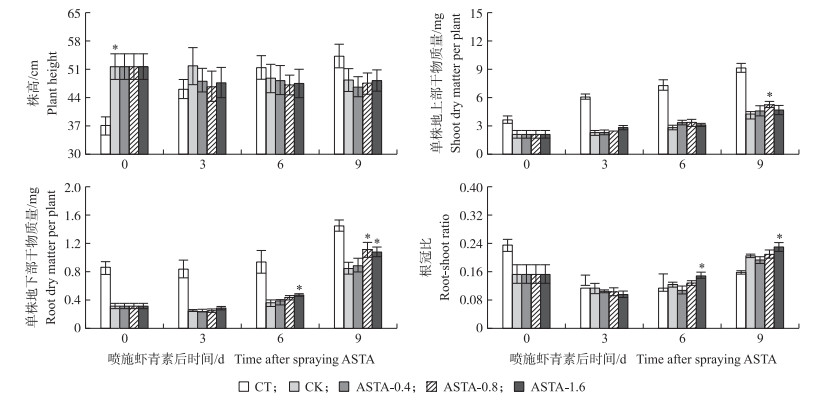
|
图 2 叶面喷施虾青素对分蘖期受淹水稻株高和干物质积累的影响 Fig. 2 Effects of foliar spraying ASTA on the height and dry matter accumulation of submerged rice at tillering stage |
从图 3可见:淹水胁迫后水稻叶片光合色素含量显著低于CT。叶面喷施后1、3、5、7 d, ASTA-0.8处理叶片中叶绿素a含量显著高于CK, 增幅分别为19.1%、12.5%、7.1%、12.2%;叶绿素b含量仅在喷施后1、3 d显著高于CK, 分别提高24.5%和22.0%;叶绿素a/b值在喷施后1、3 d显著低于CK。ASTA-0.8处理类胡萝卜素含量在喷施后1、3、5、7 d显著增加。ASTA-0.4处理中, 在喷施后1、3 d叶片中叶绿素a和叶绿素b含量显著增加, 喷施后3 d叶绿素a/b值显著降低, 降幅为5.8%;喷施后3、5 d类胡萝卜素含量显著增加, 较CK分别提高20.8%和8.0%。ASTA-1.6处理中, 叶绿素a和叶绿素b的含量在喷施后2 d均显著高于CK, 增幅分别为15.4%和22.4%;而叶绿素a/b值则显著降低, 降幅为5.1%;喷施后1~7 d类胡萝卜素含量均显著增加。

|
图 3 叶面喷施虾青素对分蘖期受淹水稻光合色素含量的影响 Fig. 3 Effects of foliar spraying ASTA on photosynthetic pigments of submerged rice at tillering stage |
从图 4可见:淹水胁迫显著降低水稻植株可溶性总糖以及叶片可溶性蛋白的含量。叶面喷施虾青素后3、9 d植株中可溶性总糖含量和喷施后5、7 d叶片中可溶性蛋白含量均显著增加。ASTA-0.8处理显著增加叶片中可溶性蛋白含量; 喷施后6 d, ASTA-0.4和ASTA-0.8处理中植株可溶性总糖含量显著低于CK, 分别降低12.8%和20.6%。

|
图 4 叶面喷施虾青素对分蘖期受淹水稻渗透调节物质的影响 Fig. 4 Effects of foliar spraying ASTA on osmotic adjustment of submerged rice at tillering stage |
从图 5可见:淹水胁迫显著增加水稻叶片中MDA和H2O2的含量。叶面喷施虾青素可以降低叶片中MDA和H2O2的含量。ASTA-0.8处理中, 喷施后3和7 d叶片MDA含量显著降低, 较CK分别降低20.7%和20.7%。ASTA-0.8处理中, 喷施后1、3、5 d水稻叶片中H2O2含量显著降低; ASTA-0.4和ASTA-1.6处理中, 喷施后1、2 d叶片H2O2含量显著降低; 喷施后7 d, ASTA-0.4、ASTA-0.8和ASTA-1.6处理H2O2含量较CK分别降低12.5%、6.3%和9.4%。
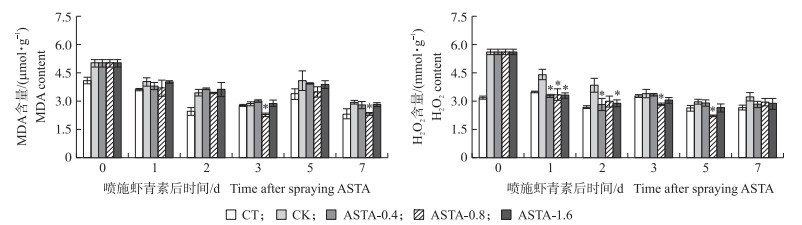
|
图 5 叶面喷施虾青素对分蘖期受淹水稻叶片MDA和H2O2含量的影响 Fig. 5 Effects of foliar spraying ASTA on MDA and H2O2 content of submerged rice leaf at tillering stage |
从图 6可见:淹水胁迫后水稻叶片中的SOD、CAT、APX和GR活性显著降低, POD活性升高。ASTA-0.8处理中, 喷施后1、3、5 d SOD活性显著增加, 较CK分别增加21.6%、29.8%和33.0%;喷施后1、2、3 d CAT活性显著高于CK, 增幅为64.1%、62.4%和36.1%;喷施后1 d APX活性和喷施后2 d GR活性显著高于CK, 分别提高53.6%和14.5%。ASTA-0.4和ASTA-1.6处理中, 喷施后2、3 d, CAT活性显著增加。ASTA-0.8处理中, 喷施后7 d, SOD、POD和CAT活性显著低于CK, 降幅分别为19.5%、52.4%和7.1%。
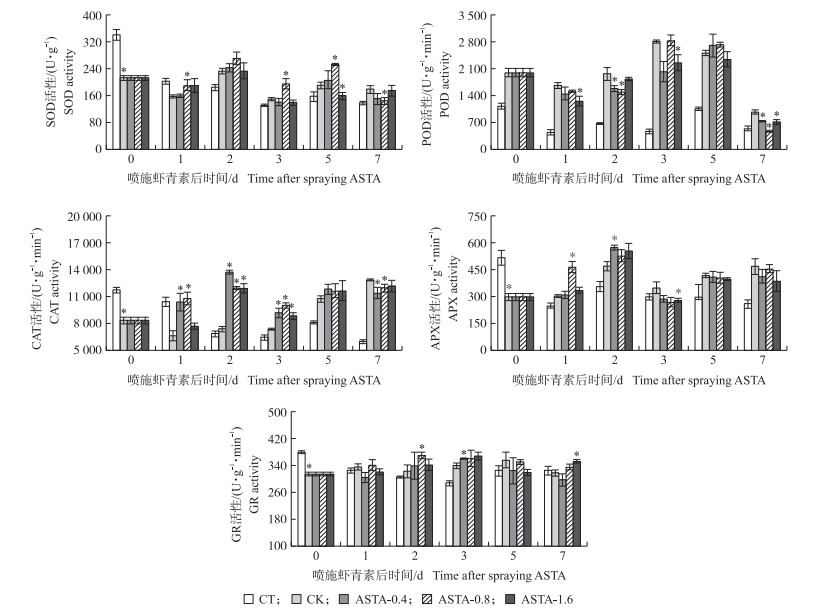
|
图 6 叶面喷施虾青素对分蘖期受淹水稻抗氧化酶活性的影响 Fig. 6 Effects of foliar spraying ASTA on antioxidant enzyme of submerged rice at tillering stage |
淹水胁迫后水稻产量显著低于无淹水处理CT。ASTA-0.8处理有效穗数、每穗粒数和结实率均增加, 缓解淹水胁迫带来的产量损失, 最终产量恢复到CT的98.7%。ASTA-0.4和ASTA-1.6处理产量比CK分别增产9.8%和2.2%(表 2)。
| 处理 Treatments |
每盆有效穗数 Panicle number per pot |
每穗粒数 Spikelet number per panicle |
结实率/% Seed-setting rate |
千粒质量/g 1 000-grain weight |
每盆产量/g Yield per pot |
| CT | 34a | 153a | 87.4b | 25.8a | 115.6a |
| CK | 28b | 161a | 85.7b | 25.1c | 96.8c |
| ASTA-0.4 | 29b | 166a | 86.1b | 25.7a | 106.3ab |
| ASTA-0.8 | 30b | 167a | 86.3a | 25.4b | 114.1a |
| ASTA-1.6 | 29b | 162a | 84.1b | 24.6d | 98.9bc |
| 注:不同字母表示处理间差异显著(P < 0.05)。The different letters mean signifficent difference at 0.05 level between treatments. | |||||
淹水胁迫严重降低光照强度, 阻碍气体交换, 影响植物的呼吸作用和光合作用, 导致严重的能量和碳失衡[24-25]。本研究结果显示:淹水处理显著增加水稻株高, 降低水稻植株地上部和地下部干物质量; 抑制分蘖发生和叶片生长, 降低叶片中叶绿素a、叶绿素b和植株中可溶性总糖含量; 降低抗氧化酶活性(SOD、CAT、APX、GR), 显著增加MDA和H2O2的含量, 最终加剧膜脂过氧化。这与前人研究结果一致[9, 11, 24]。
淹水解除后, 由于植物重新接触空气, 空气中的O2浓度比水中高, 造成植物组织中活性氧大量爆发, 淹水后引起的氧化损伤普遍比淹水期间诱导的氧化损伤更严重[25]。因此, 胁迫解除后清除活性氧, 将决定植物生长的恢复和存活。茎蘖数、绿叶数、生物量等是反映非生物胁迫最直观的指标, 本研究发现解除淹水胁迫后叶面喷施虾青素水稻株高不受影响, 其茎蘖数和绿叶数明显增加, 干物质积累加快, 表明叶面喷施虾青素促进受淹水稻恢复生长。根据本研究结果, 叶面喷施虾青素促进受淹水稻恢复生长可能有以下2个原因:1)外源虾青素提高水稻叶片中叶绿素含量。叶绿素是植物进行光合作用的重要色素, 也是评价光合活性的重要指标[26]。喷施虾青素后受淹水稻叶片中叶绿素含量显著高于CK, 3个虾青素处理的叶绿素含量在喷施后5 d分别恢复至CT处理的97.5%、97.5%、87.4%, 促进光合作用, 有助于植株中非结构性碳水化合物积累; 2)外源虾青素快速缓解氧化损伤, 提高细胞稳定性。逆境条件下植物能够正常生长发育的机制之一就是诱导抗氧化防御系统起作用, 其中抗氧化酶是抗氧化系统的主要表现形式之一。超氧化物歧化酶(SOD)作为一种重要的抗氧化剂, 可以保护细胞免受氧自由基的毒害[27]。过氧化物酶(POD)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)能清除植株体内的过氧化氢[28], 抗坏血酸过氧化物酶(APX)能清除生物体内超氧阴离子自由基。可溶性总糖和可溶性蛋白作为渗透调节物质, 在植物遭遇逆境时起到调节渗透势、维持细胞稳定的作用[29-30]。本研究发现叶面喷施虾青素后植株可溶性总糖含量、叶片可溶性蛋白含量显著增加, 3个虾青素处理在喷施后9 d植株中可溶性总糖含量就已达到CT的86.4%、93.1%、84.6%;此外, 抗氧化酶(SOD、CAT、APX、GR)活性快速上升, H2O2和MDA含量降低, 进而缓解氧化损伤, 减轻膜脂过氧化程度, 维持细胞稳定性; 从喷施后7 d开始水稻叶片中活性氧含量恢复至正常水平, 相应的抗氧化酶活性也降低, 将更多的能量用于生长, 有利于受淹水稻的恢复, 最终减少产量的损失。这与通过转基因技术积累虾青素的苹果植株能够提高苹果的抗氧化能力, 防止光合作用中的光氧化损伤的结果[31]一致。
选择最适宜浓度的外源虾青素施用可最大程度缓解水稻氧化损伤。叶面喷施0.8 mmol·L-1虾青素后12 d茎蘖数显著增加, 与CK相比提高14.6%, 最终产量恢复到CT的98.7%, 有效缓解淹水胁迫带来的产量损失; 但叶面喷施浓度为0.4和1.6 mmol·L-1虾青素时未能促进分蘖的发生, 在喷施后12 d茎蘖数较CK分别降低19.5%和14.6%, 且对产量的补救效果也不如ASTA-0.8处理。原因可能在于ASTA-0.8处理较ASTA-0.4和ASTA-1.6处理抗氧化酶SOD活性更高且持续的时间更长, 进而加快叶片中活性氧的清除, MDA含量显著低于其他处理, 至喷施后7 d就已恢复至与CT相似的水平, 加快了氧化损伤的缓解, 有利于受淹水稻的及时恢复; 且在ASTA-0.8处理中叶绿素a含量始终显著高于CK, 保证了较高的光合强度, 进而加快干物质积累。ASTA-0.4和ASTA-1.6处理在一定程度上提高抗氧化酶活性, 降低MDA含量, 但与CK相比未达到显著水平; 而干物质量的增加, 可能是因为其光合产物主要用于绿叶数的增加, 而非用于分蘖的发生。综上所述, 缓解淹水胁迫对水稻植株伤害的虾青素的最适宜浓度为0.8 mmol·L-1。
| [1] |
尹朝静.气候变化对中国水稻生产的影响研究[D].武汉: 华中农业大学, 2017. Yin C J. Study on the climate change impact on Chinese rice production[D]. Wuhan: Huazhong Agricultural University, 2017(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10504-1017171646.htm |
| [2] |
Hirabayashi Y, Mahendran R, Koirala S, et al. Global flood risk under climate change[J]. Nature Climate Change, 2013, 3(9): 816-821. DOI:10.1038/nclimate1911 |
| [3] |
Jackson B M. Ethylene and responses of plants to soil waterlogging and submergence[J]. Annual Review of Plant Physiology, 1985, 36(1): 145-174. |
| [4] |
Armstrong W. Aeration in higher plants[J]. Advances in Botanical Research, 1980, 7: 225-332. DOI:10.1016/S0065-2296(08)60089-0 |
| [5] |
Maurel C, Simonneau T, Sutka M. The significance of roots as hydraulic rheostats[J]. Journal of Experimental Botany, 2010, 61(12): 3191-3198. DOI:10.1093/jxb/erq150 |
| [6] |
Bailey-Serres J, Lee S C, Brinton E. Waterproofing crops:effective flooding survival strategies[J]. Plant Physiology, 2012, 160(4): 1698-1709. DOI:10.1104/pp.112.208173 |
| [7] |
Voesenek L A, Bailey-Serres J. Flood adaptive traits and processes:an overview[J]. The New Phytologist, 2015, 206(1): 57-73. DOI:10.1111/nph.13209 |
| [8] |
田志环. 淹涝胁迫对水稻影响的研究进展[J]. 安徽农业科学, 2008, 36(1): 143-145. Tian Z H. Research advance of the influence of submergence stress on rice[J]. Journal of Anhui Agricultural Sciences, 2008, 36(1): 143-145 (in Chinese with English abstract). DOI:10.3969/j.issn.0517-6611.2008.01.043 |
| [9] |
Liu M, Chu M J, Ding Y F, et al. Exogenous spermidine alleviates oxidative damage and reduce yield loss in rice submerged at tillering stage[J]. Frontiers in Plant Science, 2015, 6: 919. |
| [10] |
Gautam P, Lal B, Raja R, et al. Post-flood nitrogen and basal phosphorus management affects survival, metabolic changes and anti-oxidant enzyme activities of submerged rice (Oryza sativa L.)[J]. Functional Plant Biology, 2014, 41(12): 1284-1294. DOI:10.1071/FP14093 |
| [11] |
Gautam P, Lal B, Tripathi R, et al. Beneficial effects of potassium application in improving submergence tolerance of rice (Oryza sativa L.)[J]. Environmental & Experimental Botany, 2016, 128: 18-30. |
| [12] |
Chu M J, Liu M, Ding Y F, et al. Effect of nitrogen and silicon on rice submerged at tillering stage[J]. Agronomy Journal, 2017, 110(1): 183-192. |
| [13] |
姜颖, 赵越, 孙全军, 等. 植物生长调节剂在植物生长发育中的应用[J]. 黑龙江科学, 2018, 9(24): 4-7, 11. Jiang Y, Zhao Y, Sun Q J, et al. Application of plant growth regulators on plant growth and development[J]. Heilongjiang Science, 2018, 9(24): 4-7, 11 (in Chinese with English abstract). DOI:10.3969/j.issn.1674-8646.2018.24.002 |
| [14] |
Zhou W, Leul M. Uniconazole-induced alleviation of freezing injury in relation to changes in hormonal balance, enzyme activities and lipid peroxidation in winter rape[J]. Plant Growth Regulation, 1998, 26(1): 41-47. DOI:10.1023/A:1006004921265 |
| [15] |
Hoque M A, Banu M N A, Okuma E, et al. Exogenous proline and glycinebetaine increase NaCl-induced ascorbate-glutathione cycle enzyme activities, and proline improves salt tolerance more than glycinebetaine in tobacco Bright Yellow-2 suspension-cultured cells[J]. Journal of Plant Physiology, 2007, 164(11): 1457-1468. DOI:10.1016/j.jplph.2006.10.004 |
| [16] |
张健, 刘美艳. 一氧化氮提高黄瓜幼苗耐涝性的探究[J]. 中国瓜菜, 2017, 30(1): 18-21. Zhang J, Liu M Y. Enhancement of waterlogging tolerance of cucumber seedlings by nitric oxide[J]. China Cucurbits and Vegetables, 2017, 30(1): 18-21 (in Chinese with English abstract). DOI:10.3969/j.issn.1673-2871.2017.01.005 |
| [17] |
姚康飞, 张瑞莲, 刘晓娟, 等. 不同立体构型的虾青素抗脂质过氧化活性研究[J]. 中国食品学报, 2018, 18(10): 86-94. Yao K F, Zhang R L, Liu X J, et al. Studies on anti-lipid peroxidation activity of different stereoisomeric astaxanthin[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(10): 86-94 (in Chinese with English abstract). |
| [18] |
Dose J, Matsugo S, Yokokawa H, et al. Free radical scavenging and cellular antioxidant properties of astaxanthin[J]. International Journal of Molecular Sciences, 2016, 17(1): 103. DOI:10.3390/ijms17010103 |
| [19] |
朱丽, 钱前. 虾青素功能米:生物强化新思路, 优质米培育新资源[J]. 植物学报, 2019, 54(1): 4-8. Zhu L, Qian Q. Astaxanthin functional rice:new idea of biofortification, new perspectives for high-quality rice breeding[J]. Chinese Bulletin of Botany, 2019, 54(1): 4-8 (in Chinese with English abstract). |
| [20] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. Li H S. Principles and Techniques of Plant Physiological Biochemical Experiment[M]. Beijing: Higher Education Press, 2000 (in Chinese). |
| [21] |
Jiang M, Zhang J. Water stress-induced abscisic acid accumulation triggers the increased generation of reactive oxygen species and up-regulates the activities of antioxidant enzymes in maize leaves[J]. Journal of Experimental Botany, 2002, 53(379): 2401-2410. DOI:10.1093/jxb/erf090 |
| [22] |
王爱国, 罗广华. 植物的超氧物自由基与羟胺反应的定量关系[J]. 植物生理学通讯, 1990, 26(6): 55-57. Wang A G, Luo G H. Quantitative relation between the reaction of hydroxylamine and superoxide anion radicals in plants[J]. Plant Physiology Communications, 1990, 26(6): 55-57 (in Chinese). |
| [23] |
王学奎. 植物生理生化实验原理和技术[M]. 2版. 北京: 高等教育出版社, 2006. Wang X K. Principles and Techniques of Plant Physiological Biochemical Experiment[M]. 2nd ed. Beijing: Higher Education Press, 2006 (in Chinese). |
| [24] |
Yeung E, van Veen H, Vashisht D, et al. A stress recovery signaling network for enhanced flooding tolerance in Arabidopsis thaliana[J]. Proc Natl Acad Sci USA, 2018, 115(26): E6085-E6094. DOI:10.1073/pnas.1803841115 |
| [25] |
潘澜, 薛立. 植物淹水胁迫的生理学机制研究进展[J]. 生态学杂志, 2012, 31(10): 2662-2672. Pan L, Xue L. Plant physiological mechanisms in adapting to waterlogging stress:a review[J]. Chinese Journal of Ecology, 2012, 31(10): 2662-2672 (in Chinese with English abstract). |
| [26] |
Mishra A, Mishra K B, Höermiller I I, et al. Chlorophyll fluorescence emission as a reporter on cold tolerance in Arabidopsis thaliana accessions[J]. Plant Signaling & Behavior, 2011, 6(2): 301-310. |
| [27] |
贾漫丽, 李娜, 李季生, 等. 盐胁迫对4个桑树品种生理生化特性的影响[J]. 西北林学院学报, 2016, 31(5): 96-101. Jia M L, Li N, Li J S, et al. Effects of salt stress on physiological and biochemical characteristics of four mulberry varieties[J]. Journal of Northwest Forestry University, 2016, 31(5): 96-101 (in Chinese with English abstract). DOI:10.3969/j.issn.1001-7461.2016.05.16 |
| [28] |
Kennedy R A, Rumpho M E, Fox T C. An aerobic metabolism in plants[J]. Plant Physiology, 1992, 100: 16-21. DOI:10.1104/pp.100.1.16 |
| [29] |
Singh N K, Bracker C A, Hasegawa P M, et al. Characterization of osmotin:a thaumatin-like protein associated with osmotic adaptation in plant cells[J]. Plant Physiology, 1987, 85(2): 529-536. DOI:10.1104/pp.85.2.529 |
| [30] |
吴潇, 陈杨杨, 石新杰, 等. 喷施外源激素对'玉露香'梨叶片表皮蜡质组分、结构及渗透性的影响[J]. 南京农业大学学报, 2018, 41(4): 647-654. Wu X, Chen Y Y, Shi X J, et al. Effects of spraying exogenous hormones on cuticular wax composition, structure and permeability of the leaves in 'Yuluxiang' pear[J]. Journal of Nanjing Agricultural University, 2018, 41(4): 647-654 (in Chinese with English abstract). DOI:10.7685/jnau.201710007 |
| [31] |
Jia D J, Fan L M, Shen J L, et al. Genetic transformation of the astaxanthin biosynthetic genes bkt and crtR-B into apple tree to increase photooxidation resistance[J]. Scientia Horticulturae, 2019, 243: 428-433. DOI:10.1016/j.scienta.2018.08.058 |




