文章信息
- 蔡沛蓉, 冯楠楠, 郑豪, 邹辉, 顾建红, 刘学忠, 袁燕, 刘宗平, 卞建春
- CAI Peirong, FENG Nannan, ZHENG Hao, ZOU Hui, GU Jianhong, LIU Xuezhong, YUAN Yan, LIU Zongping, BIAN Jianchun
- 玉米赤霉烯酮对大鼠睾丸支持细胞乳酸产生及相关蛋白表达的影响
- Effect of zearalenone on lactic acid production and expression of related proteins in Sertoli cells
- 南京农业大学学报, 2019, 42(5): 911-916
- Journal of Nanjing Agricultural University, 2019, 42(5): 911-916.
- http://dx.doi.org/10.7685/jnau.201812027
-
文章历史
- 收稿日期: 2018-12-18
2. 江苏省动物重要疫病与人兽共患病防控协同创新中心, 江苏 扬州 225009
2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China
玉米赤霉烯酮(zearalenone, ZEA)是谷物和农作物中常见的一种具有类雌激素样作用的非甾体类霉菌毒素, 又被称为F-2毒素, 在生产实践中对畜牧业造成严重的危害[1]。近年来, 玉米赤霉烯酮造成雄性动物的生殖系统损害逐渐被重视, 但其毒性机制研究尚不清楚。有研究表明, ZEA可抑制睾丸间质细胞分泌睾酮[2], 影响精子的发生[3]。睾丸支持细胞(Sertoli cell, SC)是生殖系统的重要组成部分, 在精子形成过程中起着重要作用[4]。在精子发生过程中, 分化的精子细胞自身代谢不足以满足其能量需求, 为维持生精小管的能量稳态, SC可通过产生更多的能源物质以满足生殖细胞的能量需求[5]。SC与癌细胞具有相似的糖代谢方式, 称为类瓦尔堡效应(Warburg-like effect), 即通过自身的糖酵解产生乳酸作为生殖细胞的能源物质[6]。有研究表明, 乳酸是体外培养精子及精母细胞的首选能源物质, 粗线期精母细胞和圆形精子需要外源性的乳酸以获得能量[7]。同时, SC代谢产生的乳酸还可抑制生殖细胞发生凋亡[8]。我们推测, 玉米赤霉烯酮对雄性动物生殖机能产生影响可能与其通过干扰SC的乳酸代谢进而干扰生殖细胞的乳酸代谢有关。目前, 关于ZEA对SC乳酸产生的影响国内外无相关报道, 因此, 本试验以不同浓度ZEA处理SC, 研究ZEA对SC的乳酸产生及相关蛋白表达的影响, 旨在揭示ZEA致雄性生殖系统的毒性机制, 为动物ZEA中毒的防控提供理论依据。
1 材料与方法 1.1 试验动物试验用清洁级18~21日龄的幼年雄性Wistar大鼠, 由扬州大学比较医学中心提供。
1.2 主要试剂及仪器玉米赤霉烯酮(Sigma公司); RIPA裂解液、蛋白酶抑制剂复合物(北京普利莱基因技术有限公司); DMEM/F-12培养基、胎牛血清(Gibco公司); GAPDH抗体(CST公司); GLUT1、LDH、MCT4抗体(Abcam公司); 乳酸脱氢酶释放检测试剂盒(碧云天生物技术研究所); 乳酸、丙酮酸测试盒(南京建成生物研究所)。
Sunrise-basic 5810R(Ecan公司); 二氧化碳培养箱(Thermo公司); DMI3 000B荧光显微镜(LYCRA公司); UV-2450/2550紫外-可见分光光度计(岛津公司)。LSM-710激光共聚焦显微镜(Zeiss公司);
1.3 大鼠睾丸支持细胞(SC)分离与培养大鼠SC的分离与培养参照本实验室前期建立的试验方法进行[9]。大鼠断颈处死固定于解剖板上, 对腹部进行无菌处理, 分离睾丸, 在无菌PBS中洗涤3次后置于玻璃平皿中, 剥离睾丸白膜、周围脂肪组织及内部较大的血管, 将曲细精管撕扯拉散并转移至盛放2.5 g·L-1的胰蛋白酶中消化15 min, 随后加入50 g·L-1胶原酶消化15 min, 4 ℃、800 g离心10 min。加入2倍的DMEM/F-12培养基终止消化, 75 μm孔径滤网对组织黏液进行过滤, 滤液4 ℃、800 g离心10 min, 弃上清液, DMEM/F-12培养基重复洗2次, 最后转移至细胞瓶中, 在5% CO2、37 ℃培养箱中培养。待细胞贴壁后用Tris-HCl(pH7.4)的低渗溶液对SC进行纯化处理, 5% CO2、37 ℃培养箱中继续培养。
1.4 利用乳酸脱氢酶(LDH)释放检测细胞毒性将细胞按每孔5 000的数量接种到96孔板中, 待进入对数生长期后进行试验。设置不同浓度ZEA(0、0.1、1、10、20、30 μmol·L-1)处理组及对照孔组, 继续培养23 h。在对照孔组中加入LDH释放试剂, 混匀后继续在细胞培养箱中培养1 h。各孔分别吸取上清液120 μL, 加入到另1个96孔板中, 并在各孔中加入60 μL LDH检测工作液。混匀, 室温避光孵育30 min。测定液体吸光值(A490), 计算细胞死亡率(细胞毒性)。细胞死亡率=(处理样品孔A490-样品对照孔A490)/(细胞最大活性孔A490-样品对照孔A490)×100%。
1.5 细胞内、外乳酸含量检测将处于对数生长期的SC培养在60 mm培养皿中, 用不同浓度ZEA(0、0.1、1、10、20、30 μmol·L-1)处理24 h, 收集细胞培养液, 置于冰上或冷冻于-80 ℃待测; 用PBS洗涤, 加入100 μL细胞裂解液。刮取细胞至1.5 mL EP管中, 4 ℃裂解30 min, 超声波破碎20 s, 4 ℃、12 000 r·min-1离心10 min, 收集上清液置于冰上待测, 蛋白定量(BCA)法检测总蛋白浓度。
设置标准管、测定管, 分别加入3 mol·L-1标准品、待测的上清液各20 μL, 再加入酶工作液各1 mL、显示剂200 μL, 混匀后在37 ℃水浴反应10 min, 再加入终止液2 mL, 涡旋混匀。测定各管的吸光值(A530), 计算细胞中乳酸含量(mmol·g-1)。
细胞中乳酸含量=(测定管A530×标准品浓度)/(标准管A530×待测样本蛋白浓度)。
培养液中的乳酸含量=(测定管A530×标准品浓度×样品测试前稀释倍数)/标准管A530。
1.6 细胞内丙酮酸含量检测参照1.5节步骤裂解制备细胞。设置标准管、测定管, 分别加入3 mol·L-1标准品、待测上清液各100 μL, 再加入澄清剂各100 μL、显示剂各500 μL, 混匀后在37 ℃水浴反应10 min, 再加入终止液2.5 mL, 涡旋混匀。室温放置5 min, 测定各管的吸光值(A505), 计算细胞中的丙酮酸含量(μmol·mg-1)。
细胞中丙酮酸含量=(测定管A505×标准品浓度)/(标准管A505×待测样本蛋白浓度)。
1.7 免疫荧光检测乳酸脱氢酶(LDH)荧光强度将细胞接种于24孔板中, 以不同浓度ZEA(0、1、10、20、30 μmol·L-1)作用SC 24 h。弃去培养液, 以PBS洗涤2次后, 用4%多聚甲醛在4 ℃条件下固定30 min, PBS洗涤2次, 0.5%(体积分数)Triton X-100室温下固定20 min, PBS洗涤2次, 用50 g·L-1 BSA在室温下封闭30 min后, 加入LDH一抗, 在4 ℃条件下孵育12 h; PBS洗3次后, 加入FITC标记的二抗作用1 h, PBS洗3次后, 加入DIPA作用15 min, PBS再次洗涤3次后加入防荧光淬灭剂进行封片, 使用激光共聚焦显微镜进行观察。
1.8 Western blot检测乳酸代谢通路相关蛋白表达以不同浓度ZEA(0、0.1、1、10、20、30 μmol·L-1)处理SC 24 h后, 置于冰上, PBS洗涤2次后, 加入200 μL的细胞裂解液。刮取细胞至1.5 mL EP管中, 裂解30 min后, 超声破碎20 s, 12 000 r·min-1、4 ℃离心10 min, 收集上清液, BCA法检测总蛋白浓度。加入5×SDS蛋白上样缓冲液, 100 ℃加热10 min, -80 ℃保存。将上述蛋白样品室温溶解, 取8 μL进行SDS电泳。电泳分离后将蛋白转膜至硝酸纤维素膜上, 用50 g·L-1的封闭液在室温条件下封闭2 h, 加入一抗, 4 ℃孵育过夜。次日TBST缓冲液洗涤5次, 加二抗孵育2 h, 用TBST再洗涤5次, 用发光液显影检测葡萄跨膜糖转运蛋白1(GLUT1)、乳酸脱氢酶(LDH)、单羧酸转运蛋白4(MCT4)的表达水平。
1.9 数据的统计与处理采用SPSS 22.0统计软件进行数据统计, 采用单因素方差分析(one-way ANOVA)进行相关性检验, 图像分析采用CASP系统。数据结果均以平均数±标准差(x±SD)表示。
2 结果与分析 2.1 不同浓度ZEA对SC毒性的影响用0、0.1、1、10、20、30 μmol·L-1 ZEA作用于SC 24 h后, 细胞毒性(细胞死亡率)如图 1所示。随着ZEA浓度的增大, 细胞死亡率呈现剂量依赖性的上升趋势。与对照组相比, 10、20、30 μmol·L-1 ZEA染毒组细胞死亡率均极显著性升高(P < 0.01)。说明ZEA对SC具有毒性作用。

|
图 1 玉米赤霉烯酮(ZEA)对睾丸支持细胞(SC)的细胞毒性 Fig. 1 The cytotoxicity of zearalenone(ZEA) against Sertoli cells(SC) *、**分别表示与对照组相比差异显著(P < 0.05)和差异极显著(P < 0.01)。下同。 *, ** show significant difference compared with control group at 0.05(P < 0.05)and 0.01(P < 0.01)levels. The same as follows. |
以不同浓度ZEA(0、0.1、1、10、20、30 μmol·L-1)处理SC 24 h后, 通过乳酸试剂盒检测细胞内乳酸含量。如图 2-A所示:细胞内乳酸含量随着染毒浓度的增加呈下降趋势。与对照组相比, 10、20、30 μmol·L-1 ZEA染毒组细胞内的乳酸含量均极显著下降(P < 0.01)。如图 2-B所示:与对照组相比, 20 μmol·L-1 ZEA染毒组细胞培养液的乳酸含量显著性下降(P < 0.05), 30 μmol·L-1ZEA染毒组细胞培养液的乳酸含量极显著下降(P < 0.01)。上述结果表明ZEA能对SC的乳酸产生过程具有抑制作用。

|
图 2 ZEA对SC内(A)和外(培养液)(B)乳酸含量的影响 Fig. 2 The effects of ZEA on lactic acid content in SC(A)and in culture solution of SC(B) |
如图 3所示:随着ZEA处理浓度增加细胞内的丙酮酸含量下降。与对照组相比, 20和30 μmol·L-1 ZEA处理组可显著(P < 0.05)或极显著(P < 0.01)抑制SC内丙酮酸的产生, 并呈现较好的剂量依赖性。

|
图 3 ZEA对SC内丙酮酸含量的影响 Fig. 3 The effects of ZEA on pyruvate content in Sertoli cells |
Western blot检测不同浓度ZEA对SC乳酸产生相关蛋白GLUT1、LDH、MCT4表达的影响。如图 4所示:1、10、20、30 μmol·L-1 ZEA处理SC后, 可极显著降低(P < 0.01)细胞GLUT1和LDH的蛋白表达量; 而ZEA浓度达30 μmol·L-1时, MCT4的蛋白表达量极显著降低(P < 0.01)。说明ZEA可致SC乳酸产生相关蛋白的表达量下降。

|
图 4 ZEA对SC中GLUT1、LDH、MCT4蛋白表达的影响 Fig. 4 The effect of ZEA on the expression of GLUT1, LDH and MCT4 in SC |
以不同浓度ZEA(0、1、10、20、30 μmol·L-1)处理SC 24 h后, 利用激光共聚焦显微镜观察LDH荧光强度。如图 5所示:随着染毒剂量的增加, LDH荧光强度逐渐减弱。与对照组相比, 10、20、30 μmol·L-1 ZEA染毒组细胞内的蛋白表达量均极显著下降(P < 0.01)。这与Western blot结果相一致, 更进一步验证了ZEA对SC产生乳酸起抑制作用。
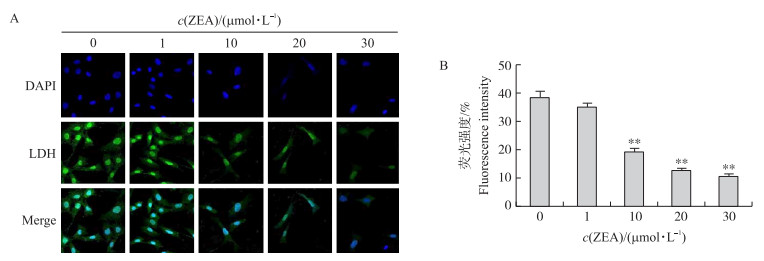
|
图 5 ZEA对SC中LDH表达的影响 Fig. 5 The effects of ZEA on the expression of LDH in SC A.激光共聚焦检测ZEA对LDH荧光强度的表达Laser confocal detecti on of expression of LDH fluorescence intensity; B. LDH荧光强度统计LDH fluorescence intensity percentage. |
玉米赤霉烯酮是一种具有类雌激素样作用的霉菌毒素, 也是环境中常见的内分泌干扰物质之一, 其广泛存在于多种农作物中, 严重危害动物生长发育[1, 10-11]。睾丸支持细胞(SC)是雄性生殖系统中雄性激素的受体细胞, 其代谢过程受相关激素的调控[12]。激素或类激素物质的异常干扰都可能对SC的代谢产生影响。有研究表明, 内分泌代谢疾病可通过影响SC乳酸生成进而导致雄性动物的生精功能受损[13]; 而雷公藤甲素、双酚A等环境毒素也可通过降低SC的乳酸生成而对精子发生产生影响[14-16]。SC能量代谢的稳定是生精功能维持正常的前提。研究表明, ZEA可对雄性生殖系统造成严重损伤[3, 17]。本试验通过ZEA对SC乳酸生成过程影响的研究, 证实了ZEA可致SC乳酸生成下降, 且呈现出明显的剂量依赖效应, 表明ZEA可通过抑制SC对生殖细胞的能量供应进而对雄性生殖系统造成损伤。
乳酸生成是能量代谢中一个复杂的过程, 受到多个关键蛋白的调控。GLUT是哺乳动物中参与葡萄糖转运的主要载体[18], 在乳酸生成过程中, SC首先通过GLUT1将葡萄糖转运进SC内, 之后通过糖酵解反应将葡萄糖氧化为丙酮酸。由于SC特殊的能量代谢作用, 其中大部分丙酮酸由LDH转化为乳酸。SC主要是通过脂质的β氧化产生能量[19]。MCT4是SC内乳酸转运出细胞的关键蛋白, 乳酸可通过MCT4将乳酸转运至生精小管中供生精细胞利用[20]。细胞培养液中的葡萄糖经GLUT1转运至细胞内后, 葡萄糖经糖酵解过程转化成丙酮酸。在本试验的结果中, 丙酮酸含量下降, 可能与葡萄转运蛋白GLUT1表达降低, 葡萄糖摄取减少有关, 最后导致丙酮酸含量下降; 而在乳酸产生通路中, 上游丙酮酸的减少也可能是导致下游乳酸产生下降的原因。乳酸生成关键蛋白GLUT1、LDH、MCT4的表达随ZEA浓度增加均表现剂量依赖下降, 与细胞内、外乳酸含量下降的趋势相符, 证实ZEA可通过干扰GLUT1、LDH及MCT4的表达而影响糖酵解及乳酸生成, 进而影响生殖细胞的能量代谢。乳酸生成是SC能量代谢中的一小部分, 目前, ZEA致SC能量代谢的相关研究报道较少, 还需再深入探讨。另外, 是否能通过改善ZEA对SC能量代谢的影响进而降低ZEA对SC的损伤也值得我们进一步研究。
综上, ZEA可通过干扰SC乳酸生成中的关键蛋白GLUT1、LDH、MCT4的表达而促使乳酸生成降低, 进而干扰睾丸中生精细胞的能量代谢, 并对雄性生殖机能产生不利影响。
| [1] |
Hesseltine C W. Mycotoxins[J]. Mycopathologia et Mycologia Applicata, 1969, 39(3/4): 371-383. |
| [2] |
郑王龙, 刘青, 王亚军, 等. 玉米赤霉烯酮对小鼠睾丸间质细胞内StAR蛋白及类固醇合成关键酶表达的影响[J]. 畜牧兽医学报, 2014, 45(7): 1091-1096. Zheng W L, Liu Q, Wang Y J, et al. Effects of zearalenone on the expression of steroidogenic acute regulatory protein and key enzymes in primary Ledying cells[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(7): 1091-1096 (in Chinese with English abstract). |
| [3] |
逄健, 曹全富, 孙中义. 玉米赤霉烯酮对雄性生殖能力影响的研究进展[J]. 中华男科学杂志, 2016, 22(11): 1034-1037. Pang J, Cao Q F, Sun Z Y. Impact of zearalenone on male fertility:an update[J]. National Journal of Andrology, 2016, 22(11): 1034-1037 (in Chinese with English abstract). |
| [4] |
Alves M G, Martins A D, Rato L, et al. Molecular mechanisms and signaling pathways involved in the nutritional support of spermatogenesis by Sertoli cells[M]//Methods in Molecular Biology. New York: Springer, 2018: 129-155.
|
| [5] |
Mateus I, Feijó M, Espínola L M, et al. Glucose and glutamine handling in the Sertoli cells of transgenic rats overexpressing regucalcin:plasticity towards lactate production[J]. Scientific Reports, 2018, 8: 10321. DOI:10.1038/s41598-018-28668-4 |
| [6] |
Oliveira P F, Martins A D, Moreira A C, et al. The Warburg effect revisited-lesson from the Sertoli cell[J]. Medicinal Research Reviews, 2015, 35(1): 126-151. |
| [7] |
Mita M, Hall P F. Metabolism of round spermatids from rats:lactate as the preferred substrate[J]. Biology of Reproduction, 1982, 26(3): 445-448. DOI:10.1095/biolreprod26.3.445 |
| [8] |
Erkkll K, Aito H, Aato K, et al. Lactate inhibits germ cell apoptosis in the human testis[J]. Molecular Human Reproduction, 2002, 8(2): 109-117. DOI:10.1093/molehr/8.2.109 |
| [9] |
冯楠楠, 王冰洁, 朱启航, 等. 玉米赤霉烯酮通过PI3K/Akt/mTOR通路诱导大鼠睾丸支持细胞自噬及对细胞周期分布的影响[J]. 南京农业大学学报, 2018, 41(4): 708-714. Feng N N, Wang B J, Zhu Q H, et al. Effects of zearalenone on the autophagy and cell cycle of Sertoli cells by PI3K/Akt/mTOR pathway[J]. Journal of Nanjing Agricultural University, 2018, 41(4): 708-714 (in Chinese with English abstract). DOI:10.7685/jnau.201712033 |
| [10] |
Xiong W P, Wang H K, Wu H, et al. Apoptotic spermatogenic cells can be energy Sources for Sertoli cells[J]. Reproduction, 2009, 137(3): 469-479. DOI:10.1530/REP-08-0343 |
| [11] |
蔡雨函, 胡延春, 赵黑成, 等. 玉米赤霉烯酮的毒性及生物降解研究进展[J]. 动物医学进展, 2012, 33(5): 102-105. Cai Y H, Hu Y C, Zhao H C, et al. Advance in toxicity and biodegradation of zearalenone[J]. Progress in Veterinary Medicine, 2012, 33(5): 102-105 (in Chinese with English abstract). DOI:10.3969/j.issn.1007-5038.2012.05.024 |
| [12] |
Alves M G, Rato L, Carvalho R A, et al. Hormonal control of Sertoli cell metabolism regulates spermatogenesis[J]. Cellular and Molecular Life Sciences, 2013, 70(5): 777-793. DOI:10.1007/s00018-012-1079-1 |
| [13] |
Alves M G, Martins A D, Rato L, et al. Molecular mechanisms beyond glucose transport in Diabetes-related male infertility[J]. Biochimica et Biophysica Acta(BBA):Molecular Basis of Disease, 2013, 1832(5): 626-635. DOI:10.1016/j.bbadis.2013.01.011 |
| [14] |
Cheng Y S, Chen G J, Wang L, et al. Triptolide-induced mitochondrial damage dysregulates fatty acid metabolism in mouse Sertoli cells[J]. Toxicology Letters, 2018, 292: 136-150. DOI:10.1016/j.toxlet.2018.04.035 |
| [15] |
Dias T R, Alves M G, Bernardino R L, et al. Dose-dependent effects of caffeine in human Sertoli cells metabolism and oxidative profile:relevance for male fertility[J]. Toxicology, 2015, 328: 12-20. DOI:10.1016/j.tox.2014.12.003 |
| [16] |
黄巍, 黄红梅, 王红, 等. 双酚A对大鼠睾丸支持细胞糖代谢的影响[J]. 中华男科学杂志, 2015, 21(2): 119-123. Huang W, Huang H M, Wang H, et al. Bisphenol A alters glucose metabolism in rat Sertoli cells in vitro[J]. National Journal of Andrology, 2015, 21(2): 119-123 (in Chinese with English abstract). |
| [17] |
张振玲, 薄存香, 郭启明, 等. 玉米赤霉醇染毒对雄性小鼠睾丸及生精功能的影响[J]. 卫生研究, 2010, 39(6): 755-758. Zhang Z L, Bo C X, Guo Q M, et al. Effect of zeranol on spermary and spermigenesis function of male mice[J]. Journal of Hygiene Research, 2010, 39(6): 755-758 (in Chinese with English abstract). |
| [18] |
Galardo M N, Gorga A, Merlo J P, et al. Participation of HIFs in the regulation of Sertoli cell lactate production[J]. Biochimie, 2017, 132: 9-18. DOI:10.1016/j.biochi.2016.10.006 |
| [19] |
Regueira M, Riera M F, Galardo M N, et al. FSH and bFGF regulate the expression of genes involved in Sertoli cell energetic metabolism[J]. General and Comparative Endocrinology, 2015, 222: 124-133. DOI:10.1016/j.ygcen.2015.08.011 |
| [20] |
Rato L, Alves M G, Socorro S, et al. Metabolic modulation induced by oestradiol and DHT in immature rat Sertoli cells cultured in vitro[J]. Bioscience Reports, 2012, 32(1): 61-69. DOI:10.1042/BSR20110030 |




