文章信息
- 曾涵芳, 张林, 陈孟姣, 李烨青, 王泽栋, 奚雨萌, 李莲, 韩兆玉
- ZENG Hanfang, ZHANG Lin, CHEN Mengjiao, LI Yeqing, WANG Zedong, XI Yumeng, LI Lian, HAN Zhaoyu
- 黄芪多糖对H2O2诱导的奶牛乳腺上皮细胞氧化损伤及凋亡的影响
- Effects of astragalus polysaccharides on H2O2induced oxidative damage and apoptosis in bovine mammary epithelial cells
- 南京农业大学学报, 2019, 42(5): 903-910
- Journal of Nanjing Agricultural University, 2019, 42(5): 903-910.
- http://dx.doi.org/10.7685/jnau.201809040
-
文章历史
- 收稿日期: 2018-09-27
2. 江苏省农业科学院畜牧研究所, 江苏 南京 210014
2. Animal Husbandry Institute, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
泌乳奶牛乳腺代谢旺盛所引起活性氧(reactive oxygen species, ROS)的生成和乳腺抗氧化机能间的平衡失调是导致乳房炎发生率升高, 乳产量和乳品质降低的主要诱导因素[1]。在正常状态下, 机体自动清除氧自由基而处于动态平衡。过量的氧自由基可触发细胞膜脂肪酸链式反应, 其脂质过氧化物的产生和蓄积导致细胞膜结构破坏, 并促使细胞的老化、凋亡[2], 从而降低乳腺组织的抗氧化机能[3], 影响奶牛的乳产量和乳品质[4]。抗氧化剂的使用可有效抑制细胞的凋亡, 缓解细胞的氧化损伤[5-6]。
黄芪多糖(astragalus polysaccharide, APS)是中药黄芪中主要的活性成分, 具有抗氧化、抗凋亡、抗肿瘤等药理作用[7-9]。研究表明, 在断奶仔猪日粮中添加APS可显著提高仔猪生长能力, 并影响仔猪肠道菌群丰富度[10]。在泌乳期荷斯坦奶牛精料中添加APS(5~100 g·kg-1)能显著提高血清的抗氧化能力[11]。在H2O2所致乳鼠心肌细胞氧化应激损伤后, 发现经APS处理后其细胞存活率及细胞中SOD、GSH-Px、过氧化氢酶(catalase, CAT)活性显著升高, ROS含量显著降低, 且细胞凋亡率均显著降低[12]。也有研究表明, APS的预处理对LPS诱导的奶牛乳腺上皮细胞凋亡起到拮抗保护作用, 且其作用机制与抑制各种细胞因子的分泌, 降低各种相关酶的活性, 减少嗜中性粒细胞浸润有关[13]。此外, APS还可以通过降低氧化应激并激活相关的信号通路来抑制病毒的复制, 从而预防病毒的感染[14]。然而, 关于APS对氧化应激状态下奶牛乳腺上皮细胞的作用及其分子机制尚不明确。因此, 本试验通过H2O2诱导建立奶牛乳腺上皮细胞氧化应激模型, 探讨APS对H2O2处理下奶牛乳腺上皮细胞增殖、凋亡、氧化损伤及相关基因、蛋白表达的影响, 为奶牛抗氧化剂的研制提供理论依据。
1 材料与方法 1.1 试验材料本试验MAC-T奶牛乳腺上皮细胞系为扬州大学杨章平教授所赠。黄芪多糖(纯度不少于90%)购自南京鼎国生物有限公司; DMEM/F12培养基、10 g·L-1 PBS购自Hyclone公司; 胎牛血清(FBS)、胰蛋白酶购自Gibco公司; ROS、细胞活力(CCK-8)、丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)等检测试剂盒购于南京建成生物研究所; Trizol试剂购自Invitrogen公司; PrimeScriptTM RT Master Mix、Premix Ex Taq Ⅱ购于TaKaRa公司。
1.2 方法 1.2.1 奶牛乳腺上皮细胞系的冻存、培养将对数生长期融合度大于70%的MAC-T细胞用胰蛋白酶消化, 置于二甲亚砜(DMSO)中, 4 ℃ 30 min, -20 ℃ 2 h, 最后液氮长期保存。将装有MAC-T细胞的冻存管从液氮罐中取出后, 置于37 ℃水浴中, 轻轻摇晃使其快速溶解, 用DMEM/F12离心洗涤(1 000 r·min-1, 5 min)2次, 接种T25培养瓶, 置于37 ℃、5% CO2、饱和湿度的培养箱内培养。12 h待细胞贴壁后, 更换培养基除去死细胞。每24 h换培养液1次, 待细胞长至80%~90%汇合时, 进行细胞消化传代培养。
1.2.2 免疫荧光鉴定奶牛乳腺上皮细胞制作细胞爬片, 按照免疫荧光步骤进行如下操作:待细胞长到1×106 mL-1后, 吸出培养基, PBS洗2次, 每次5 min, 每孔加1 mL 40 g·L-1多聚甲醛溶液固定细胞1 h, PBS洗3次, 每次5 min, 然后用0.5% Triton X-100穿孔20 min, PBS洗2次后, 20 g·L-1 BSA封闭1 h, 最后加入稀释好的角蛋白18(Abcam公司)兔多克隆抗体(1:500)孵育, 4 ℃过夜。PBS洗3次后加二抗(羊抗兔IgG 1:500)室温孵育1 h, PBS洗3次, 每次3 min, 再加入Hoechst 33342染核10 min, PBS洗涤后用4′, 6-二脒基-2-苯基吲哚(DAPI)染液的封片剂封片, 最后置于激光共聚焦显微镜下观察染色情况。
1.2.3 H2O2诱导氧化应激损伤模型的建立将对数期生长的MAC-T细胞接种于96孔细胞培养板中, 待细胞铺满90%时, 用含有不同浓度H2O2(0、200、400、600、800、1 000 μmol·L-1)的培养基作用2 h, 并用H2O2 600 μmol·L-1的培养基处理MAC-T细胞2、4、6、8 h。按照CCK-8试剂盒说明书操作, 检测各组细胞的存活率, 每组6个重复, 结果取平均值。选取可导致60%左右细胞凋亡的H2O2浓度建立氧化应激损伤模型。
1.2.4 黄芪多糖作用浓度的筛选APS由DMEM/F12培养基溶解, 用70 μm的无菌滤器过滤后分装于15 mL无菌离心管。临用前用DMEM/F12完全培养基稀释成工作浓度。
将对数期生长的奶牛乳腺上皮细胞接种于96孔细胞培养板中, 待细胞铺满为90%时, 加入含有不同质量浓度(0、2、4、6、8、10、20、40、80 mg·mL-1)APS的DMEM/E12培养液处理24 h。按照CCK-8试剂盒说明书, 检测各组细胞的存活率。每组6个重复, 结果取平均值。
1.2.5 试验分组及处理细胞随机分为3组, 每组3个重复。空白对照(CK)组:DMEM/F12培养基培养细胞; H2O2组:DMEM/F12培养基培养细胞24 h, 再用600 μmol·L-1 H2O2处理细胞2 h; H2O2+APS(8 mg·mL-1)组:DMEM/F12培养基培养细胞24 h, 用600 μmol·L-1 H2O2处理细胞2 h后, 再用8 mg·mL-1 APS处理细胞24 h。
1.2.6 细胞中ROS含量的测定将各组细胞制成细胞爬片, H2O2组用含有600 μmol·L-1 H2O2培养细胞24 h后, 用PBS洗1次, 再根据活性氧检测试剂盒说明书进行操作, 最后倒置激光共聚焦显微镜下观察染色结果。
1.2.7 SOD、GSH-Px活性和MDA含量的测定按照SOD、GSH-Px和MDA试剂盒说明书测定SOD、GSH-Px活性和MDA含量。每个样品重复6次, 取平均值。
1.2.8 流式细胞术检测细胞凋亡收集细胞, 按照Annexin V-FITC凋亡双染测定试剂盒(美国BD公司, 货号:559763)说明书用流式细胞仪检测细胞凋亡。
1.2.9 RNA提取与RT-qPCR测定凋亡相关基因的表达收集细胞, 按Trizol试剂盒说明书提取细胞总RNA。取1 000 ng总RNA用TaKaRa试剂盒反转录成cDNA, -80 ℃保存备用。按照SYBR Green试剂盒检测凋亡相关基因mRNA的表达水平。反应产物经熔解曲线检测特异性。用2-ΔΔCT计算各基因mRNA相对表达量。引物序列见表 1。
| 基因 Gene |
基因登录号 GenBank ID |
引物对序列 Primer pairs sequences(5′→3′) |
| Bax | XM_010814989.2 | TGGACATTGGACTTCCTTCG/CCAGCCACAAAGATGGTCAC |
| Bcl-2 | XM_005224105.3 | ATGTGTGTGGAGAGCGTCAA/CCTTCAGAGACAGCCAGGAG |
| Caspase-3 | AB090246.2 | CTGAGGGTCAGCTCCTAGCG/GCTGCAGCTCTGCTGGACT |
| β-actin | X00182.1 | ACCACACCTTCTACAACGAG/GAACATGATCTGGGTCATCTTC |
收集细胞, 加入含苯甲基磺酰氟(PMSF)的裂解液提取细胞总蛋白, BCA试剂盒(碧云天生物技术公司)测定细胞蛋白浓度。加入上样缓冲液, 100 ℃变性10 min, 用预制胶进行电泳分离, 电泳完毕后用电转仪转移到硝酸纤维素膜上, 用50 g·L-1脱脂牛奶室温封闭1 h, 加一抗室温孵育2 h或者4 ℃过夜, 加HRP标记的羊抗兔IgG二抗孵育1 h, 最后用化学发光法显示结果, 用Image J进行条带的灰度分析。试验所用抗体为:Bcl-2(WL01556)和Bax(WL03315)多抗购于万类生物科技有限公司; Cleaved-Caspase-3(bs-0081R)多抗购于北京博奥森公司; GAPDH多抗购于Proteintech公司。
1.3 统计分析采用SPSS 20.0软件进行方差分析和差异显著性检验。所有试验均重复3次, 数据均用平均值±标准误(x±SE)表示。
2 结果与分析 2.1 奶牛乳腺上皮细胞的鉴定利用上皮细胞的特异性表达蛋白——角蛋白18(CK-18)的敏感性, 采用免疫荧光染色方法对奶牛乳腺上皮细胞进行鉴定。如图 1所示:DAPI染色后, 细胞核为蓝光(图 1-A); 利用角蛋白18的免疫荧光表达定位, 视野内大于90%的细胞均表达特异性的绿色荧光, 细胞角蛋白18染色呈阳性(图 1-B)。由此证明所培养的细胞为奶牛乳腺上皮细胞。
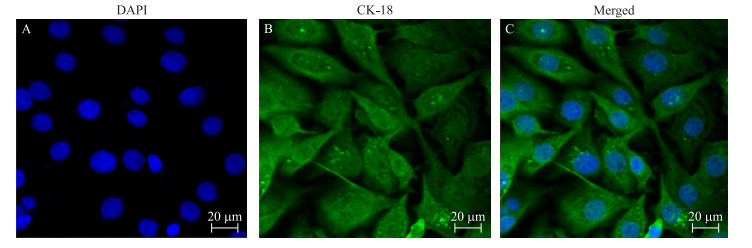
|
图 1 角蛋白18免疫荧光鉴定奶牛乳腺上皮细胞 Fig. 1 Identification of bovine mammary epithelial cells by cytokeratin-18(CK-18)immunofluorescence A.细胞核DAPI染色DAPI staining of nucleus; B.角蛋白18免疫荧光表达定位Immunofluorescence localization of CK-18;C.细胞核和细胞质合成图Nuclear and cytoplasmic synthesis chart. |
如图 2所示:用含有不同浓度H2O2处理奶牛乳腺上皮细胞2 h后, 当H2O2浓度为400 μmol·L-1时, 细胞活力(存活率)显著低于对照组(P < 0.05);当H2O2浓度为600、800、1 000 μmol·L-1时, 细胞活力极显著低于对照组(P < 0.01)。当H2O2浓度为600 μmol·L-1时, 细胞活力为67%, 而H2O2浓度为800和1 000 μmol·L-1时, 乳腺上皮细胞死亡较多。因此, 本试验采用600 μmol·L-1H2O2来建立奶牛乳腺上皮细胞系氧化应激模型。
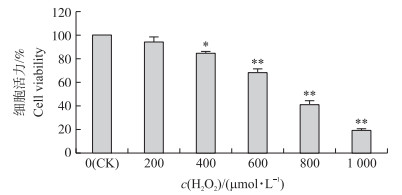
|
图 2 H2O2对奶牛乳腺上皮细胞活力的影响 Fig. 2 Effect of H2O2 on the viability of bovine mammary epithelial cells 与对照组相比Compared with control group, *P < 0.05, **P < 0.01.下同The same as follows. |
如图 3所示:当APS浓度大于10 mg·mL-1时, 细胞活力极显著下降(P < 0.01)。说明, 当APS单独作用于奶牛乳腺上皮细胞, 且浓度小于10 mg·mL-1时, 对细胞活力没有影响。因此, 选取8 mg·mL-1的APS进行后续试验。
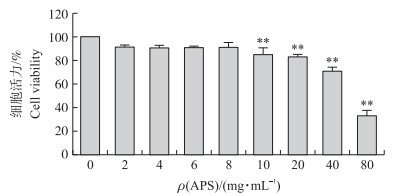
|
图 3 黄芪多糖(APS)对奶牛乳腺上皮细胞活力的影响 Fig. 3 Effect of APS on the viability of bovine mammary epithelial cells |
如图 4所示:与对照组(CK)相比, H2O2组ROS水平极显著升高(P < 0.01);然而, 与H2O2组相比, H2O2+APS组ROS水平极显著下降(P < 0.01)。由此可知, 黄芪多糖对H2O2诱导的奶牛乳腺上皮细胞中的ROS产生有缓解作用。
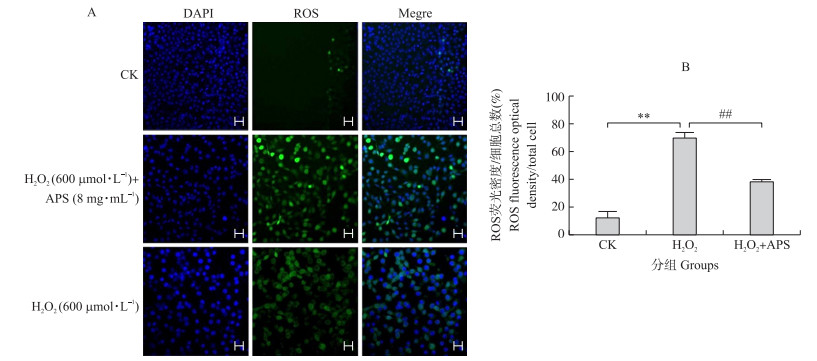
|
图 4 黄芪多糖对H2O2诱导的奶牛乳腺上皮细胞内ROS含量影响的荧光观察(A)与统计(B) Fig. 4 Fluorescence observation of the effect of APS on H2O2 induced ROS content in bovine mammary epithelial cells(A)and statistics(B) ##P < 0.01. Bar=50 μm.下同The same as below. |
如图 5所示:与对照组相比, H2O2组SOD、GSH-Px活性极显著下降(P < 0.01), 而与H2O2组相比, H2O2+APS组的SOD、GSH-Px活性显著增加(P < 0.05)。然而, 与对照组相比, H2O2组MDA含量极显著增加(P < 0.01);H2O2+APS组的GSH-Px活性较H2O2组显著降低(P < 0.05)。因此, APS能够提高H2O2诱导奶牛乳腺上皮细胞抗氧化酶活性, 减少脂质过氧化物MDA的生成。
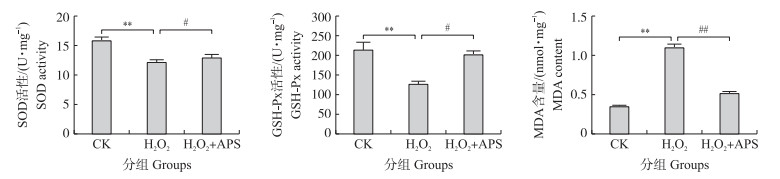
|
图 5 黄芪多糖对H2O2诱导的奶牛乳腺上皮细胞SOD、GSH-Px活性和MDA含量的影响 Fig. 5 Effects of APS on activities of SOD, GSH-Px and MDA content in H2O2 induced bovine mammary epithelial cells #P < 0.05. |
如图 6所示:与对照组相比, H2O2组的细胞凋亡率极显著上升(P < 0.01);与H2O2组相比, H2O2+APS组的细胞凋亡率极显著下降(P < 0.01)。说明APS能够缓解H2O2诱导的奶牛乳腺上皮细胞的凋亡。
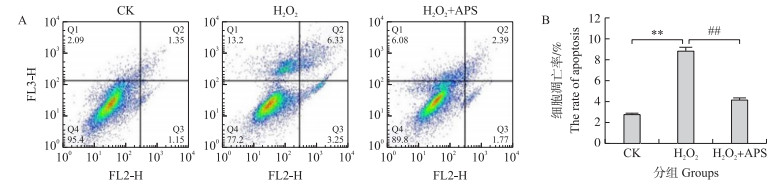
|
图 6 黄芪多糖对H2O2诱导的奶牛乳腺上皮细胞凋亡率的影响 Fig. 6 Effect of APS on H2O2 induced apoptosis in bovine mammary epithelial cells |
通过RT-qPCR和Western blot检测细胞凋亡关键基因Bax和Bcl-2 mRNA及蛋白的表达, 进一步测定黄芪多糖对H2O2诱导的奶牛乳腺上皮细胞的作用。如图 7所示:与对照组相比, H2O2组Bax/Bcl-2 mRNA比值和Caspase-3 mRNA的表达水平均极显著升高(P < 0.01), 而与H2O2组相比, H2O2+APS组的Bax/Bcl-2 mRNA比值和Caspase-3 mRNA的表达水平均极显著降低(P < 0.01)。
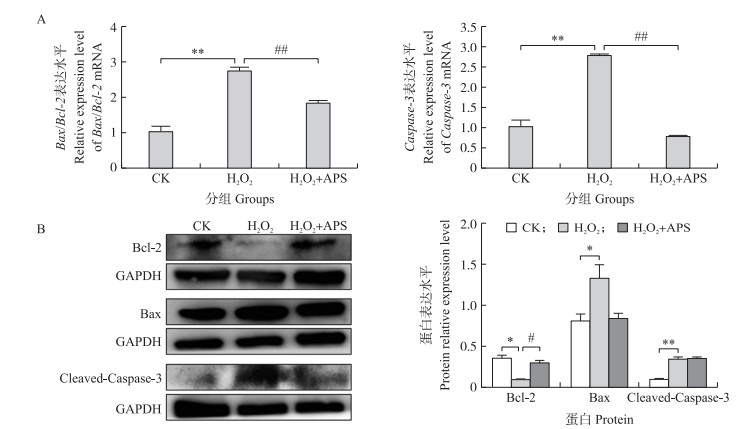
|
图 7 黄芪多糖对H2O2诱导奶牛乳腺上皮细胞凋亡相关基因Bax、Bcl-2与Caspase-3 mRNA(A)及蛋白(B)表达的影响 Fig. 7 Effects of APS on H2O2 induced apoptosis related genes Bax, Bcl-2 and Caspase-3 mRNA(A) and protein(B)expression in bovine mammary epithelial cells |
与对照组相比, H2O2组Bcl-2蛋白表达水平显著下降(P < 0.05), Bax蛋白表达水平显著升高(P < 0.05), Cleaved-Caspase-3蛋白表达水平极显著升高(P < 0.01);而与H2O2组相比, H2O2+APS组的Bcl-2蛋白表达水平显著上升(P < 0.05), 而Bax、Cleaved-Caspase-3的蛋白表达水平差异不显著(P>0.05)。说明, 黄芪多糖能够缓解H2O2引起的奶牛乳腺上皮细胞的凋亡。
3 讨论在泌乳早期, 尤其是高产奶牛, 大量乳的合成和分泌致使乳腺组织对能量的需求量急剧增加, 其需氧代谢活动明显提高, 导致大量ROS产生, 引起氧化应激。奶牛乳腺上皮细胞(bovine mammary epithelial cells, BMEC)是奶牛乳腺组织的主要构成细胞, 是乳脂和乳蛋白合成与分泌的重要场所, 其细胞的生物合成能力决定了奶牛乳腺的产奶能力[15]。因此, 建立BMEC氧化应激模型, 对于揭示奶牛氧化应激机制、提高奶牛抗氧化能力和产奶性能具有重要的意义。ROS主要有O2·-、OH-、H2O2、NO等。目前, 由于H2O2比较容易获得, 且其性质相对稳定, 操作方便, 越来越多的研究者们都通过H2O2来诱导细胞建立氧化应激模型[16-17]。有报道将细胞存活率为70%~80%作为H2O2诱导奶牛乳腺上皮细胞氧化损伤的模型依据[18]。Ma等[19]通过600 μmol·L-1 H2O2作用于奶牛乳腺上皮细胞6 h来诱导其发生氧化损伤。本试验发现, 当600 μmol·L-1 H2O2作用于奶牛乳腺上皮细胞系2 h时, 细胞存活率降低至67%左右, 细胞出现氧化损伤。为了防止细胞发生不可逆的氧化损伤, 本试验以此来建立乳腺细胞系的氧化应激模型。
当细胞内ROS产生和清除的动态平衡被打破时, 就会启动有效的抗ROS防御体系, 如SOD、GSH-Px、CAT。SOD能够催化ROS生成H2O2和O2, 其活性在一定程度上体现了机体对活性氧自由基的清除能力[20]。CAT和GSH-Px进一步代谢H2O2, 加速H2O2的分解形成O2和H2O, 避免H2O2对细胞的影响[21]。此外, 血清中脂质过氧化终产物MDA的含量也能够间接反映细胞损伤程度。研究者发现, APS对自由基(·OH、DPPH、ABTS+、O2·-)均有一定的清除作用, 在质量浓度为1 g·L-1时, APS对DPPH(1, 1-二苯基-2-三硝基苯肼)的清除率为72.30%, 对·OH的清除率达到60.20%, 并且呈剂量效应[22]。有研究证实, APS不仅能够降低H2O2诱导的人脐静脉内皮细胞ROS水平, 而且增加了内皮型一氧化氮合酶和超氧化物歧化酶蛋白表达, 提高细胞内的环磷酸鸟苷(一氧化氮的活性标记物)的表达, 恢复线粒体膜电位, 从而改善人脐静脉内皮细胞ROS水平失衡, 增加细胞的抗氧化功能[23]。此外, Li等[24]研究显示, APS可通过清除ROS并增加抗氧化酶的活性来抗衰老。本研究用H2O2处理奶牛乳腺上皮细胞后发现, 其细胞中的ROS、MDA含量均极显著升高, 而SOD、GSH-Px活性均极显著下降。而用APS联合H2O2乳腺上皮细胞后, MDA含量显著低于H2O2组, 而SOD、GSH-Px活性则均显著高于H2O2组。由此判断, APS对H2O2诱导的乳腺上皮细胞产生的ROS具有一定的清除能力, 且能够降低脂质过氧化反应, 并通过提高抗氧化酶的活性来提高乳腺上皮细胞的抗氧化能力, 从而缓解H2O2诱导乳腺上皮细胞的氧化损伤。
ROS是细胞出现凋亡的前体产物, 且ROS引起或调节细胞凋亡的机制通常包括受体激活、Caspase激活、Bcl-2蛋白家族和线粒体功能紊乱[25]。线粒体通路上的Bcl-2家族在细胞凋亡中发挥着“主开关”的作用, Bax是重要的细胞凋亡基因[26], Bcl-2/Bax值决定细胞受到凋亡刺激时的生存状态, Bcl-2蛋白的比例大时细胞趋于存活, Bax蛋白的比例大时细胞趋于凋亡。半胱氨酸蛋白酶(Caspase)家族是介导细胞凋亡过程中的重要组成部分, 其中Caspase-3在细胞凋亡途径中起着关键性作用[27]。有研究证实, APS能够通过恢复线粒体融合-裂变过程的失衡, 线粒体吞噬激活及SIRT1途径来改善因过度运动产生氧化应激而引起的线粒体功能障碍[28]。另一方面, APS不仅能够抑制高糖诱导的H9C2细胞凋亡, 还可以调节Bcl-2与Bax在线粒体中的比例[7]。本研究显示, APS能够极显著降低H2O2诱导的奶牛乳腺上皮细胞凋亡率, 降低Bax/Bcl-2值及Caspase-3 mRNA的表达水平, 从而缓解细胞凋亡。而Yin等[29]在H2O2诱导的C2C12细胞凋亡中发现, APS能够促进H2O2处理下C2C12细胞中Bcl-2蛋白的表达, 但不改变Bax, 从而降低Bax/Bcl-2值, 而且APS还能够抑制Caspase-3的活化。由此显示, APS能够降低H2O2诱导的乳腺上皮细胞的Bax/Bcl-2值, 且通过抑制H2O2诱导的乳腺上皮细胞Caspase3的激活来减缓氧化损伤引起的细胞凋亡。
综上所述, APS能够提高H2O2诱导的奶牛乳腺上皮细胞抗氧化酶SOD、GSH-Px活性, 并且减少脂质过氧化产物MDA的生成。此外, APS能够降低H2O2诱导的奶乳腺上皮细胞中ROS的产生, 降低Bax/Bcl-2值, 抑制凋亡因子Caspase-3的活性, 从而减缓氧化损伤引起的奶牛乳腺上皮细胞凋亡。
| [1] |
Schweizer M. Oxidative stress in cells infected with bovine viral diarrhoea virus:a crucial step in the induction of apoptosis[J]. Journal of General Virology, 1999, 80(3): 1147-1155. |
| [2] |
Takahashi M, Keicho K, Takahashi H, et al. Effect of oxidative stress on development and DNA damage in in vitro cultured bovine embryos by comet assay[J]. Theriogenology, 2000, 54(1): 137-145. DOI:10.1016/S0093-691X(00)00332-0 |
| [3] |
Shi H Y, Yan S M, Guo Y M, et al. Vitamin A pretreatment protects NO-induced bovine mammary epithelial cells from oxidative stress by modulating Nrf2 and NF-κB signaling pathways[J]. Journal of Animal Science, 2018, 96(4): 1305-1316. DOI:10.1093/jas/sky037 |
| [4] |
Addis M F, Tedde V, Puggioni G M, et al. Evaluation of milk cathelicidin for detection of bovine mastitis[J]. Journal of Dairy Science, 2016, 99(8): 6446-6456. DOI:10.3168/jds.2015-10293 |
| [5] |
Han Z Y, Mu T, Yang Z. Methionine protects against hyperthermia-induced cell injury in cultured bovine mammary epithelial cells[J]. Cell Stress & Chaperones, 2015, 20(1): 109-120. |
| [6] |
Wei N, Wei Y, Li B, et al. Baicalein promotes neuronal and behavioral recovery after intracerebral hemorrhage via suppressing apoptosis, oxidative stress and neuroinflammation[J]. Neurochemical Research, 2017, 42(5): 1-9. |
| [7] |
Sun S, Yang S, Min D, et al. The effect of astragalus polysaccharides on attenuation of diabetic cardiomyopathy through inhibiting the extrinsic and intrinsic apoptotic pathways in high glucose-stimulated H9C2 cells[J]. BMC Complementary & Alternative Medicine, 2017, 17(1): 310. |
| [8] |
Zhen Z, Meng M, Ni H. Chemosensitizing effect of astragalus polysaccharides on nasopharyngeal carcinoma cells by inducing apoptosis and modulating expression of Bax/Bcl-2 ratio and Caspases[J]. Medical Science Monitor International Medical Journal of Experimental & Clinical Research, 2017, 23: 462-469. |
| [9] |
Liu D, Xu J, Qian G, et al. Selenizing astragalus polysaccharide attenuates PCV2 replication promotion caused by oxidative stress through autophagy inhibition via PI3K/AKT activation[J]. International Journal of Biological Macromolecules, 2018, 108: 350-359. DOI:10.1016/j.ijbiomac.2017.12.010 |
| [10] |
甄玉国, 陈雪, 王晓磊, 等. 黄芪多糖(APS)对断奶仔猪生长性能、血液生理生化指标及菌群多样性的影响[J]. 中国兽医学报, 2016, 36(11): 1954-1968. Zhen Y G, Chen X, Wang X L, et al. Effects of dietary astragalus polysacharides on grouth performance, blood index and microflora diversity of weand pigs[J]. Chinese Journal of Veterinary Science, 2016, 36(11): 1954-1968 (in Chinese with English abstract). |
| [11] |
申义君.奶牛口服黄芪多糖对奶牛血液生理生化、口蹄疫抗体水平及抗氧化能力的影响研究[D].雅安: 四川农业大学, 2014. Shen Y J. Studies on the activity of blood physiologic and serum biochemical and antioxidant enzyme and the immunomodulation effect of the astragalus polysaccharides in lactating holstein cows[D]. Ya'an: Sichuan Agricultural University, 2014(in Chinese with English abstract). |
| [12] |
沈玉珏. 黄芪多糖对H2O2所致乳鼠心肌细胞氧化应激损伤的影响[J]. 现代中西医结合杂志, 2016, 25(19): 2083-2087. Shen Y J. Effects of astraglus polysaccharides on oxidative stress injury in neonatal rat cadiocytes induced by H2O2[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2016, 25(19): 2083-2087 (in Chinese with English abstract). DOI:10.3969/j.issn.1008-8849.2016.19.010 |
| [13] |
孟云.黄芪多糖对LPS诱导奶牛乳腺上皮细胞凋亡的体外保护作用研究[D].合肥: 安徽农业大学, 2014. Meng Y. The protective effects of astragalus polysaccharides on bovine mammary epithelial cells apoptosis induced by LPS in vitro[D]. Hefei: Anhui Agricultural University, 2014(in Chinese with English abstract). |
| [14] |
Xue H, Gan F, Zhang Z, et al. Astragalus polysaccharides inhibits PCV2 replication by inhibiting oxidative stress and blocking NF-κB pathway[J]. International Journal of Biological Macromolecules, 2015, 81(7): 22-30. |
| [15] |
Zhao K, Liu H Y, Zhou M M, et al. Establishment and characterization of a lactating bovine mammary epithelial cell model for the study of milk synthesis[J]. Cell Biology International, 2010, 34(7): 717-721. DOI:10.1042/CBI20100023 |
| [16] |
Huang W Y, Wu H, Li D J, et al. Protective effects of blueberry anthocyanins against H2O2-induced oxidative injuries in human retinal pigment epithelial cells[J]. Journal of Agriculture & Food Chemistry, 2018, 66(7): 1638-1648. |
| [17] |
Fatma G, Houda B, Ahmed L. H2O2-induced oxidative stress, AChE inhibition and mediated brain injury attenuated by thymus algeriensis[J]. Applied Physioloy Nutrition Metabolism, 2018, 43(12): 1275-1281. DOI:10.1139/apnm-2018-0107 |
| [18] |
金鹿, 闫素梅, 史彬林, 等. 过氧化氢诱导的奶牛乳腺上皮细胞氧化损伤模型的建立[J]. 动物营养学报, 2014, 26(12): 3651-3658. Jin L, Yan S M, Shi B L, et al. Establishment of oxidative damage model of bovine mammary epithelial cells induced by hydrogen peroxide[J]. Chinese Journal of Animal Nutrition, 2014, 26(12): 3651-3658 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-267x.2014.12.014 |
| [19] |
Ma Y F, Wu Z H, Gao M, et al. Nuclear factor erythroid 2-related factor 2 antioxidant response element pathways protect bovine mammary epithelial cells against H2O2-induced oxidative damage in vitro[J]. Journal of Dairy Science, 2018, 101(6): 5329-5344. DOI:10.3168/jds.2017-14128 |
| [20] |
Fattman C L, Schaefer L M, Oury T D. Extracellular superoxide dismutase in biology and medicine[J]. Free Radical Biology & Medicine, 2003, 35(3): 236-256. |
| [21] |
Yang L L, Huang M S, Huang C C, et al. The association between adult asthma and superoxide dismutase and catalase gene activity[J]. International Archives of Allergy & Immunology, 2011, 156(4): 373-380. |
| [22] |
倪慧艳, 陈伟, 宋文静. 黄芪多糖抗氧化作用研究[J]. 中医学报, 2017, 32(9): 1705-1707. Ni H Y, Chen W, Song W J. Study of antioxidant properties of astragalus polysaccharide[J]. Acta Chinese Medicine, 2017, 32(9): 1705-1707 (in Chinese with English abstract). |
| [23] |
Han R, Tang F, Lu M, et al. Astragalus polysaccharide ameliorates H2O2-induced human umbilical vein endothelial cell injury[J]. Molecular Medicine Reports, 2017, 15(6): 4027-4034. DOI:10.3892/mmr.2017.6515 |
| [24] |
Li X T, Zhang Y K, Kuang H X, et al. Mitochondrial protection and anti-aging activity of astragalus polysaccharides and their potential mechanism[J]. International Journal of Molecular Sciences, 2012, 13(2): 1747-1761. DOI:10.3390/ijms13021747 |
| [25] |
Ryter S W, Kim H P, Hoetzel A, et al. Mechanisms of cell death in oxidative stress[J]. Antioxid Redox Signal, 2007, 9(1): 49-89. DOI:10.1089/ars.2007.9.49 |
| [26] |
Ashkenazi A, Fairbrother W J, Leverson J D, et al. From basic apoptosis discoveries to advanced selective BCL-2 family inhibitors[J]. Nature Reviews Drug Discovery, 2017, 16(4): 273-284. DOI:10.1038/nrd.2016.253 |
| [27] |
Pu X, Storr S J, Zhang Y, et al. Caspase-3 and Caspase-8 expression in breast cancer:Caspase-3 is associated with survival[J]. Apoptosis, 2017, 22(3): 1-12. |
| [28] |
Huang Y F, Lu L, Zhu D J, et al. Effects of astragalus polysaccharides on dysfunction of mitochondrial dynamics induced by oxidative stress[J]. Oxidative Medicine & Cellular Longevity, 2016, 2016(10): 1-13. |
| [29] |
Yin Y, Lu L, Wang D, et al. Astragalus polysaccharide inhibits autophagy and apoptosis from peroxide-induced injury in C2C12 myoblasts[J]. Cell Biochemistry & Biophysics, 2015, 73(2): 433-439. |




