文章信息
- 娄志英, 王云鹏, 袁启明, 张露露, 顾沁, 王暄, 伍辉军, 高学文
- LOU Zhiying, WANG Yunpeng, YUAN Qiming, ZHANG Lulu, GU Qin, WANG Xuan, WU Huijun, GAO Xuewen
- 生防假单胞菌Pf-5对秀丽隐杆线虫的毒性及其作用机制
- Toxicity and nematicidal mechanism of Pseudomonas protegens Pf-5 against Caenorhabditis elegans
- 南京农业大学学报, 2019, 42(5): 827-834
- Journal of Nanjing Agricultural University, 2019, 42(5): 827-834.
- http://dx.doi.org/10.7685/jnau.201902005
-
文章历史
- 收稿日期: 2019-02-18
2. 江苏省益生制剂重点建设实验室/淮阴工学院, 江苏 淮安 223003
2. Jiangsu Provincial Key Construction Laboratory of Probiotics Preparation/Huaiyin Institute of Technology, Huai'an 223003, China
植物寄生线虫是一类世界性分布的重要植物病原物, 造成的经济损失每年高达1 570亿美元[1]。其中, 根结线虫(Meloidogyne spp.)侵染植物后, 会造成植物根部形成由巨细胞组成的根结, 严重时导致植物生长受到抑制, 萎蔫, 甚至枯萎死亡[2]。根结线虫病目前已经成为设施蔬菜连作最主要的障碍因素之一。大豆孢囊线虫(Heterodera glycines)侵染大豆后, 在须根上形成大量的孢囊, 严重时导致地上部位明显矮化、不能结荚或结荚少, 该病害已成为危害大豆生产最严重的病害之一[3]。目前, 植物线虫病害的主要防治方法有化学防治、物理防治以及生物防治。化学杀线虫剂主要有熏蒸剂和非熏蒸剂2大类。熏蒸剂杀虫效果彻底, 防病增产效果显著, 但会经食物链在动物体内富集, 不利于环境的可持续发展[4]。非熏蒸剂一般是内吸性的, 会危害植物自身, 因此只能在播种前使用, 只起到预防作用[5]。物理防治主要采用暴晒、水淹、灌注热水和微波辐射等方法, 可在一定程度上抑制田间线虫病的发生率, 但是以上有些方法不仅难以彻底有效杀灭土壤深层线虫, 而且不便于中国传统田间操作[6]。植物线虫病害的生物防治主要是利用线虫天敌、微生物和植物产生的拮抗性代谢物等。线虫病害的生物防治, 具有对环境友好和可持续性等优点, 已成为杀线虫剂的重要研究方向之一。
已有报道表明, 许多生防细菌具有杀线虫活性。其中, 报道较多的是芽胞杆菌(Bacillus spp.)和假单胞菌属(Pseudomonas spp.)的生防菌。在生防芽胞杆菌方面, 解淀粉芽胞杆菌(Bacillus amyloliquefaciens)B1619对设施蔬菜根结线虫病具有较高防效[7]。解淀粉芽胞杆菌XZ-173对根结线虫有致死活性, 并且能抑制卵孵化, 还能够显著降低番茄根上的根结数和卵囊数, 促进番茄地下部根系和地上部植株的生长[8]。枯草芽胞杆菌(B.subtilis)OKB105菌株对爪哇根结线虫(M. javanica)具有较高的致死活性, 并且该活性物质来自嘌呤生物合成中的代谢产物[9]。在生防假单胞菌方面, 铜绿假单胞菌(P.aeruginosa)能够显著抑制爪哇根结线虫的生长与繁殖, 减少根结线虫数量, 从而很大程度上降低根结指数[10-11]。该类菌产生的弹性蛋白酶和绿脓菌素在杀秀丽隐杆线虫(Caenorhabditis elegans)中起着重要作用[12]。假单胞菌MB03对秀丽隐杆线虫和南方根结线虫都具有很强的致死活性[13]。恶臭假单胞菌(P.putida)1A00316具有诱导番茄抗南方根结线虫的活性[14]。
假单胞菌(P.protegens)Pf-5菌株, 先前命名为荧光假单胞菌(P.fluorescens)Pf-5。该菌株分离自棉花根际土壤, 对卵菌、真菌和细菌等引起的植物病害具有较好的防治效果, 是研究生防假单胞菌的模式菌株[15]。Pf-5菌株能产生2, 4-二乙酰基间苯三酚(2, 4-diacetylphloroglucinol, DAPG)、硝吡咯菌素、藤黄绿脓菌素(pyoluteorin, Plt)、根菌素(rhizoxin)和脂肽类物质(orfamide A)等抑菌活性物质, 这些物质在其防治植物病害中起着重要作用[15]。其中, DAPG还能诱导植物产生系统抗性(induced systemic resistance, ISR)[16]。前期我们发现Pf-5对南方根结线虫具有一定的致死活性。为了进一步对其抑制线虫的机制进行研究, 我们利用模式生物秀丽隐杆线虫开展后续研究工作。秀丽隐杆线虫具有遗传背景清楚, 结构简单, 繁殖效率高, 培养条件简单, 身体透明、便于观察等优点, 现已经广泛应用于药剂的高通量筛选。该模式线虫在研究生防菌的杀线虫机制中也有相应的研究报道, 如通过生防菌苏云金芽胞杆菌与秀丽隐杆线虫的互作体系, 发现该生防菌Cry6Aa毒素诱导的线虫细胞坏死需要天冬氨酸蛋白酶的参与[17]; 还鉴定到该生防菌金属蛋白酶Bmp1具有杀线虫活性[18]。本研究通过建立生防假单胞菌Pf-5菌株与秀丽隐杆线虫互作体系, 鉴定该菌株产生的杀线虫活性物质, 研究其作用机制, 旨在为开发新型环保线虫生防制剂提供理论支撑。
1 材料与方法 1.1 试验材料及供试菌株P.protegens Pf-5由俄勒冈州立大学的Joyce E. Loper教授馈赠。秀丽隐杆线虫野生型N2由华中农业大学的鞠守勇博士提供。试验中所涉及的质粒保存在大肠杆菌Top10中。本研究所用的菌株和质粒见表 1。引物序列见表 2, 由南京金斯瑞生物技术有限公司合成。试验中抗生素的使用浓度为:氨苄青霉素(Ap)100 μg · mL-1, 卡那霉素(Km)50 μg · mL-1。试验所用的酶购于TaKaRa公司; 细菌基因组DNA提取试剂盒购于天根生化科技有限公司; 质粒提取试剂盒、切胶回收试剂盒均购于捷倍思生物公司。
| 菌株/质粒Strains/Plasmids | 相关特性Characteristics | 来源Source |
| Pseudomonas protegens | ||
| Pf-5 | Wild type | Joyce E. Loper |
| Pf-5ΔfitD | ΔfitD mutant of Pf-5 | This study |
| Pf-5(gfp) | This study | |
| Pf-5ΔfitD(gfp) | This study | |
| Pf-5 fitDΔD | Mutation the Delivery region of fitD gene in Pf-5 strain | This study |
| Pf-5 fitDΔDC | Mutation the Delivery and CROPS region of fitD in Pf-5 strain | This study |
| Escherichia coli | ||
| Top10 | For cloning the genes and constructing vectors | Laboratory stock |
| OP50 | For culture the C.elegans | Laboratory stock |
| Plasmids | ||
| pK18mobsacB | Vector, Apr | This study |
| pRK-2013 | Vector, Km | This study |
| 引物Primer | 引物序列Primer sequence(5′→3′) |
| fitD F1 | GAGCTCGGTACCCGGGGATCCTTCCGGTTCCGGCAAATC(BamHⅠ) |
| fitD F2 | TGCCTGCAGGTCGACTCTAGATCAGTCCTTCATCTGCAGCGC(XbaⅠ) |
| fitD F3 | AAGGACTGATCTAGAGTCGACATGAGCAAACCCATGAATTCG(XbaⅠ) |
| fitD F4 | ACGACGGCCAGTGCCAAGCTTTGAGACCGCGATGCAGGT(HindⅢ) |
| fitD outF | TGCGCCAGCTGGATCTGG |
| fitD outR | TGGTTGGAGATGATCGAC |
| fitDΔD F1 | CGCGGATCCAGAAGCTGTTCCTGGCCT(BamHⅠ) |
| fitDΔD F2 | TGTTGCTTGCCGACAGTTTGCTCCACCTGGCGGCGTT |
| fitDΔD F3 | AACGCCGCCAGGTGGAGCAAACTGTCGGCAAGCAACA |
| fitDΔD F4 | CCCAAGCTTACACCGGCAGCGCACTCTT(HindⅢ) |
| fitDΔD outF | CCTCAGTGAAGACTTCCG |
| fitDΔD outR | CTTGCAGCGCGGACGAT |
| fitDΔDC F1 | CGCGGATCCAGAAGCTGTTCCTGGCCT(BamHⅠ) |
| fitDΔDC F2 | GGTCATCCTGAGGAGCATTGTGCTCCACCTGGCGGCGTT |
| fitDΔDC F3 | AACGCCGCCAGGTGGAGCACAATGCTCCTCAGGATGACC |
| fitDΔDC F4 | CCCAAGCTTTTGGATCTAACACCGGGAAA(HindⅢ) |
| fitDΔDC outF | CCTCAGTGAAGACTTCCG |
| fitDΔDC outR | CAGCAGTGGGACGACAA |
| 注:酶切位点用下划线表示。 Note:Restriction sites in primers are underlined. | |
用大肠杆菌(E.coli)OP50培养秀丽隐杆线虫[19]。具体步骤如下。
1.2.1 含E.coli OP50平板的制作从E.coli OP50的活化平板中, 挑取单菌落接种到20 mL LB液体中, 37 ℃、140 r · min-1培养10 h左右。取100 μL培养液涂布于线虫生长培养基(nematode growth medium, NGM)(1.7 g · L-1琼脂粉, 2.5 g · L-1蛋白胨, 25 mmol · L-1 NaCl, 50 mmol · L-1 KH2PO4(pH6.0), 5 μg · mL-1胆固醇, 1 mmol · L-1 CaC12, 1 mmol · L-1 MgSO4)[20]上, 平板倒置于37 ℃恒温箱中培养10 h, 制成含菌平板。该含菌平板放在4 ℃可以保存7 d。
1.2.2 秀丽隐杆线虫的喂养及传代从线虫培养平板中挑取1 cm×1 cm大小的培养块, 接种到含E.coli OP50的NGM固体培养基上, 20 ℃恒温培养箱中培养传代。
1.2.3 秀丽隐杆线虫同期化秀丽隐杆线虫转接培养4 d后, 选取虫卵和孕期成虫分布密集, 但没有幼虫孵化或者孵化率极低的线虫培养板, 加入2 mL无菌水, 将平板倾斜放置, 收集板上的虫卵和孕期成虫至15 mL离心管中, 若残留在平板上卵和线虫比较多, 则用水再次冲洗并收集, 2 000 r · min-1离心1 min; 保留沉淀虫卵和成虫, 加入3 mL线虫裂解缓冲液(0.5 mol · L-1 NaOH, 50 mL · L-1 NaOCl), 放置8 min左右, 期间可以放到涡旋混匀器上加速线虫裂解, 直到线虫虫体破裂时, 向离心管中添加5 mL灭菌水, 2 000 r · min-1离心1 min, 离心管垂直放置10 min, 使虫卵完全沉降, 用移液枪轻轻吸除上清液, 再用5 mL灭菌水洗涤2次; 在沉淀中添加5 mL M9缓冲液(4.2 mmol · L-1 Na2HPO4, 2.2 mmol · L-1 KH2PO4, 8.55 mmol · L-1 NaCl, 0.9 mmol · L-1 MgSO4), 用移液枪轻柔吹打均匀, 3 000 r · min-1离心1 min; 用移液枪轻柔吸去上清液, 再次加入2 mL M9缓冲液继续洗涤2次, 最后加入1 mL M9缓冲液后, 将离心管放到20 ℃恒温培养箱中旋转培养16 h, 即可得到L1(1龄)幼虫。在无菌条件下将L1幼虫均匀接种到含E.coli OP50的NGM培养板中, 吹干多余水分, 20 ℃恒温培养箱放置44 h, L1幼虫成长为L4(4龄)线虫。
1.3 Pf-5菌株突变体的构建和验证采用三亲交配的方法[21]构建Pf-5菌株突变体, 使用自杀载体pK18mobsacB。首先以Pf-5基因组为模板, 以引物fitD F1和fitD F2扩增得到大小为616 bp的交换左臂, 克隆到pK18mobsacB的BamHⅠ和XbaⅠ位点, 测序确定左边正确后, 得到载体pK18fitDL; 然后再用fitD F3和fitD F4引物扩增得到大小为1 184 bp的右臂, 克隆到pK18fitDL的XbaⅠ和HindⅢ位点, 测序确定右臂正确后, 获得载体pK18fitDLR。通过三亲交配的方法将重组质粒, 以单交换的方式插入到基因组中, 得到单交换子, 再利用蔗糖筛选得到无抗性的二次交换子。对这些转化子利用外围引物fitD outF和fitD outR进行验证, 通过电泳条带的变迁以及测序验证, 最终获得正确的Pf-5ΔfitD突变体。
Pf-5 fitDΔD和Pf-5 fitDΔDC突变体的构建和验证也采用类似的方法进行。不同的是突变载体中的交换左、右臂的融合采用重叠PCR进行, 获得的片段克隆到pK18mobsacB的BamHⅠ和HindⅢ位点。Pf-5菌株及其突变体的绿色荧光蛋白基因标记, 采用电转化进行遗传操作, 载体为pBBR-GFP。
1.4 Pf-5菌株及其突变体对秀丽隐杆线虫的毒力测定使用96孔微量培养板, 每个生测孔中包括:170 μL M9缓冲液, 5 μL 8 mmol · L-1 5-氟-2′-脱氧尿苷(5-fluoro-2′-deoxyuridine, FUdR), 对照组加入D600为0.6的E.coli OP50 20 μL; 试验组中, 分别加入D600为0.6的Pf-5菌株或其突变体各20 μL。混合均匀后每个孔中有195 μL混合物, 最后加入5 μL L4幼虫(每孔约40头)。将生测板放入铺有湿润滤纸的培养皿中, 20 ℃培养, 分别在处理6、12、24、48和96 h, 在解剖显微镜下观察, 并统计死亡虫数; 采用铂金丝触碰线虫, 排除假死的线虫, 记录死亡数量, 以校正死亡率。死亡率=(死亡虫数/供试虫数)×100%;校正死亡率=(处理死亡率-对照死亡率)/(1-对照死亡率)×100%。最后用SPSS Statistics 22软件进行回归分析, 计算致死中浓度(LC50)。
2 结果与分析 2.1 Pf-5菌株菌悬液对秀丽隐杆线虫的杀虫活性用Pf-5菌株菌悬液喂食模式线虫秀丽隐杆线虫, 死亡的虫体身体僵直, 体内出现空泡, 延长处理时间, 虫体由内到外会慢慢消解; 而用大肠杆菌喂养的秀丽隐杆线虫, 虫体自然卷曲, 游动自如, 能在培养基中自由活动(图 1)。
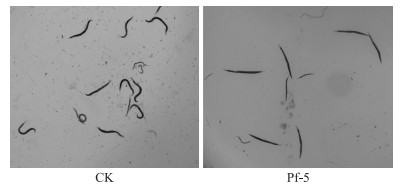
|
图 1 Pf-5菌株菌悬液对秀丽隐杆线虫活力的影响(在体式镜下观察) Fig. 1 The effect of Pf-5 suspension on the activity of Caenorhabditis elegans(observed under stereomicroscopy) |
用不同浓度的Pf-5菌株菌悬液喂食秀丽隐杆线虫, 在不同时间段观察线虫的死亡情况。结果表明:在同一浓度下, 随着时间的增加, 线虫死亡率逐渐升高; 在同一时间段, 菌悬液浓度越高线虫死亡率越高。48 h时, 浓度为105和106 CFU · mL-1菌液处理线虫的死亡率超过45%, 而高剂量菌液(107~108 CFU · mL-1)的死亡率则高达80%(图 2)。经统计分析表明:48 h时, Pf-5菌株对秀丽隐杆线虫的LC50为4.92×107 CFU · mL-1, 96 h的LC50为3.58×106 CFU · mL-1, 死亡率与浓度以及时间呈正相关性。
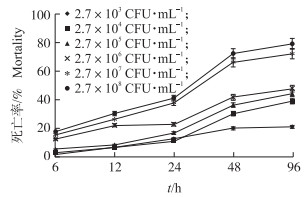
|
图 2 不同浓度的Pf-5菌株菌悬液对秀丽隐杆线虫的致死活性 Fig. 2 The lethal activity of different concentrations of Pf-5 suspension against to the C.elegans |
据文献报道, 荧光假单胞菌(P.protegens)CHA0菌株fit基因簇中产生的FitD蛋白具有杀螟虫的活性[22], 而Pf-5菌株与该菌株背景相似。为了确定Pf-5菌株中的FitD在线虫活性中的作用, 我们构建了Pf-5ΔfitD突变体。活性检测表明:用同一浓度的菌悬液处理线虫, 24 h时, 野生型Pf-5菌株对秀丽隐杆线虫致死率达到51.26%, 而突变体Pf-5ΔfitD只有20.60%, 与野生型相比差异显著; 当处理时间为48 h时, 野生型Pf-5菌株对线虫的致死活性达到73.57%, 而突变体Pf-5ΔfitD的活性也只有25.04%, 与野生型相比差异显著(图 3)。这表明, FitD蛋白在Pf-5菌株的杀线虫活性中起着主要作用。
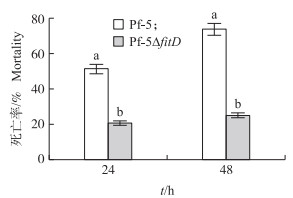
|
图 3 Pf-5菌株及其突变体对秀丽隐杆线虫的致死活性 Fig. 3 The lethal activity of Pf-5 strain and its mutant against to C.elegans 不同小写字母表示同一时间不同处理差异显著(P < 0.05)。下同。 Different lowercase letters indicate significant difference in treatment at the same time(P < 0.05).The same as follows. |
为了研究fitD基因是否影响Pf-5菌株进入线虫体内以及定殖能力, 我们利用绿色荧光蛋白编码基因对相关菌株进行了标记。荧光观察结果表明, 野生型Pf-5和突变体Pf-5ΔfitD都能成功进入线虫体内和肠道部位(图 4-A)。我们对每头线虫体内的含菌量进行检测。结果表明:每头线虫含野生型Pf-5和突变体Pf-5ΔfitD的量在数量级上没有明显差异(图 4-B), 说明fitD基因不影响Pf-5在线虫体内定殖。
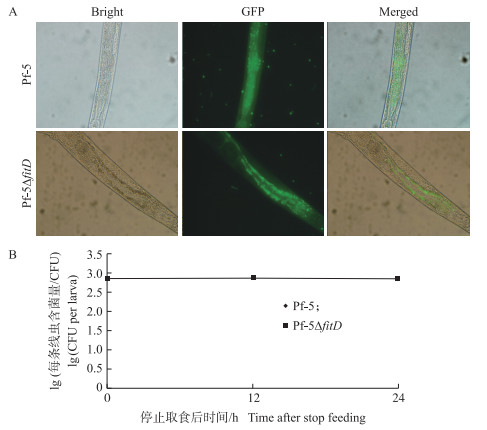
|
图 4 Pf-5菌株及其突变体在秀丽隐杆线虫的定殖 Fig. 4 Colonization of Pf-5 strain and its mutants in C.elegans A.普通显微镜和荧光显微镜观察结果; B.虫体内细菌数量。 A. Observations by ordinary microscope and fluorescence microscope; B. The number of bacteria in the C.elegans. |
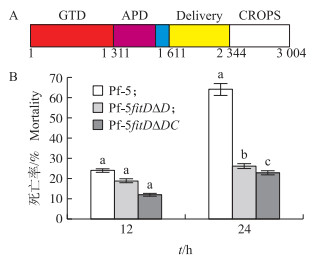
结构预测(图 5-A)表明, FitD蛋白含有4个典型的功能结构域。其中, 糖基转移酶结构域(glucosyltransferase domain, GTD)可能起到抑制宿主GTPase的活性; 自激活结构域(autoprotease domain, APD)在结合肌醇-6磷酸之后诱导蛋白发生自我剪切, 释放活性区域; Delivery结构域与ToxA具有相似性, 可能具有细胞膜的打孔功能, 从而杀死寄主, 是该蛋白杀线虫的核心区域; CROPS结构域可能负责与细胞膜上的受体结合, 但受体种类未知。为进一步研究FitD蛋白中关键结构域对其杀线虫活性的影响, 我们突变了Pf-5菌株fitD基因中编码的Delivery和CROPS结构域。活性测定表明:突变体Pf-5fitDΔD和Pf-5fitDΔDC与野生型Pf-5相比, 在12 h的杀线虫活性并没有显著差异; 但在24 h时, 2个结构域突变体杀线虫活性下降明显, 与野生型差异显著, 尤其是Delivery和CROPS双缺失突变体, 但Pf-5fitDΔD和Pf-5fitDΔDC之间差异不显著(图 5-B)。这说明Delivery和CROPS结构域对FitD蛋白的活性起着关键作用。
|
图 5 FitD结构预测(A)及Pf-5菌株及其FitD结构域缺失突变体对秀丽隐杆线虫的致死活性(B) Fig. 5 FitD structure predicts (A)and the lethal activity of Pf-5 strains and their FitD domain mutants against C.elegans(B) GTD:糖基转移酶结构域; APD:自激活结构域; Delivery:可能具有细胞膜的打孔功能; CROPS:结构域可能负责与细胞膜上的受体结合。 GTD is glucosyltransferase domain; APD is autoprotease domain; Delivery may have cell membrane perforation function; CROPS domain may be responsible for binding to receptors on the cell membrane. |
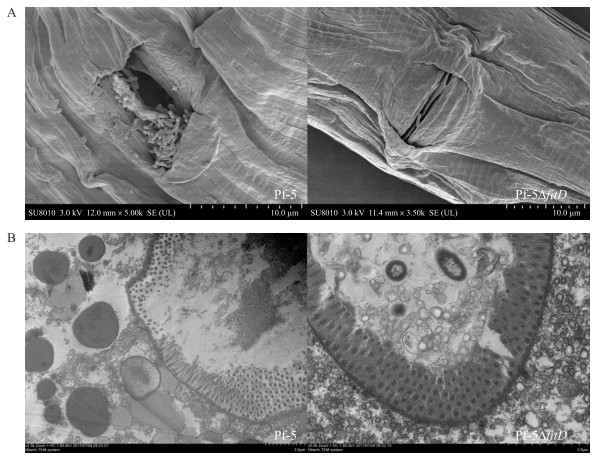
为了研究Pf-5菌株中FitD蛋白的作用机制, 本研究分别利用扫描电镜和投射电镜对处理之后的线虫进行观察。扫描电镜观察结果(图 6-A)显示:在处理时间内, 野生型Pf-5菌株和突变体Pf-5ΔfitD在线虫外壁上均无破损或孔洞, 整个线虫的外表完整。这表明该菌株的作用位点不是线虫的外壁。透射电镜分析结果(图 6-B)显示:Pf-5菌株处理之后, 会导致线虫肠道绒毛变薄、甚至脱落; 而突变体Pf-5ΔfitD处理之后, 则没有出现这种现象。这表明Pf-5菌株产生的杀线虫FitD蛋白作用位点是肠道。
|
图 6 扫描电镜(A)和透射电镜(B)观察Pf-5菌株及其突变体Pf-5ΔfitD对秀丽隐杆线虫的影响 Fig. 6 Effects of strain Pf-5 and its mutant Pf-5ΔfitD on C.elegans observed by scanning electron microscopy(A)and transmission electron microscopy(B) |
生防假单胞菌是一种重要的根际促生菌(plant growth promoting rhizobacteria, PGPR), 这类菌能利用植物根系分泌物生长繁殖, 产生一系列有益的生物活性物质。抑菌活性物质如硝吡咯菌素和脂肽类物质等, 在其防治植物病害中起着重要作用; 营养利用物质如嗜铁素能帮助其竞争铁元素, 从而具有抑制病原物的活性, 在防治烟草青枯病、甜瓜果斑病、甜瓜蔓枯病和小麦全蚀病等中起着重要作用。此外, 生防假单胞菌还具有诱导植物抗病性的活性。基于这些有益的生物学效应, 这类菌具有潜在的应用价值[23]。很多假单胞菌被开发成商品化的生防制剂, 如Pf-5、CHA0、M18等。本研究发现假单胞菌Pf-5菌株对秀丽隐杆线虫具有致死活性, 这不仅扩大假单胞菌Pf-5菌株的生防范围, 而且为作物线虫病害的绿色防治提供理论支持。
已有研究表明, 铜绿假单胞菌的一些菌株对根结线虫病具有较好的防治效果[10, 24], 但具体活性物质有待进一步研究。为了鉴定Pf-5菌株中杀线虫活性物质, 通过查阅相关文献发现与Pf-5菌株背景相似的CHA0菌株, 对重要鳞翅目昆虫害虫的幼虫, 如烟草夜蛾(Manduca sexta)和大蜡螟(Candida mellonella)的幼虫具有致死活性, 并且这种活性与其产生的FitD蛋白密切相关[22]。FitD蛋白是一种大小为3.27×105的大蛋白, 与发光杆菌产生的Mcf1毒素具有结构相似性。Mcf1毒素具有促进血细胞和中肠上皮细胞凋亡的活性。为了证明FitD蛋白在Pf-5菌株杀线虫活性中的作用, 我们构建了相应的突变体, 结果发现突变fitD基因后, 突变菌株的杀线虫活性显著下降, 这表明FitD蛋白是Pf-5菌株产生的主要杀线虫活性物质。
生物信息学分析和活性预测表明, FitD含有GTD、APD、Delivery和CROPS这4个结构域。其中, Delivery结构域可能具有细胞膜的打孔功能, 从而杀死寄主, 是该蛋白活性中心; CROPS结构域可能负责与细胞膜上的受体结合。当突变FitD的Delivery和CROPS结构域之后, 突变体对秀丽隐杆线虫的致死活性也显著下降。说明这2个区域对于其杀线虫活性起着至关重要的作用。FitD的Delivery区域与艰难梭菌(Clostridium difficile)毒素TcdA和TcdB的穿孔区域具有结构相似性。当烟草天蛾(Manduca sexta)幼虫被喂食Tcd毒素之后, 前中肠上皮组织会出现空洞, 在肠腔中出现细胞碎片, 导致停止发育直至死亡[25]。这说明, 这类毒素的作用位点在肠道。本研究利用扫描和透射电镜观察的结果表明, 野生型Pf-5菌株会造成线虫肠道绒毛变薄、甚至脱落; 而fitD突变体则没有观察到这种现象, 这说明FitD蛋白的作用位点应该也位于肠道。然而, FitD蛋白与线虫体内的哪类蛋白互作尚待进一步研究。
| [1] |
Mazzola M, Cook R J, Thomashow L S, et al. Contribution of phenazine antibiotic biosynthesis to the ecological competence of fluorescent pseudomonads in soil habitats[J]. Applied & Environmental Microbiology, 1992, 58(8): 2616-2624. |
| [2] |
Bird A F. Orientation of the larvae of Meloidogyne javanica relative to roots[J]. Nematologica, 1962, 8(4): 275-287. DOI:10.1163/187529262X00062 |
| [3] |
冯志新. 植物线虫学[M]. 北京: 科学出版社, 2011: 135. Feng Z X. Plant Nematode Science[M]. Beijing: Science Press, 2011: 135 (in Chinese). |
| [4] |
Noling J W. Nematode management in carrots[J]. Entomology & Nematology, 2010, ENY-021. |
| [5] |
Noling J W. Nematode management in tomatoes, peppers, and eggplant[J]. Entomology & Nematology, 2016, ENY-032. |
| [6] |
许灵杰, 杜相革, 翟欣, 等. 烟草根结线虫病研究概况及其防治措施[J]. 黑龙江农业科学, 2013(12): 153-157,164. Xu L J, Du X G, Zhai X, et al. Research situation and control measures of tobacco root knot nematode[J]. Heilongjiang Agricultural Sciences, 2013(12): 153-157,164 (in Chinese with English abstract). DOI:10.3969/j.issn.1002-2767.2013.12.046 |
| [7] |
蒋盼盼, 陈志谊, 甘颖, 等. 解淀粉芽孢杆菌B1619对设施蔬菜根结线虫病的防治效果[J]. 江苏农业科学, 2017, 45(12): 81-84. Jiang P P, Chen Z Y, Gan Y, et al. Control effect of Bacillus amyloliquefaciens B1619 on root-knot nematode disease in facility vegetables[J]. Jiangsu Agricultural Sciences, 2017, 45(12): 81-84 (in Chinese). |
| [8] |
朱震, 陈芳, 肖同建, 等. 拮抗菌生物有机肥对番茄根结线虫的防治作用[J]. 应用生态学报, 2011, 22(4): 1033-1038. Zhu Z, Chen F, Xiao T J, et al. Controlling effect of antagonist bioorganic fertilizer on tomato root-knot nematode[J]. Chinese Journal of Applied Ecology, 2011, 22(4): 1033-1038 (in Chinese with English abstract). |
| [9] |
Xia Y F, Xie S S, Ma X, et al. The purL gene of Bacillus subtilis is associated with nematicidal activity[J]. FEMS Microbiology Letters, 2011, 322(2): 99-107. DOI:10.1111/j.1574-6968.2011.02336.x |
| [10] |
Siddiqui I A, Qureshi S A, Sultana V, et al. Biological control of root rot-root knot disease complex of tomato[J]. Plant & Soil, 2000, 227(1/2): 163-169. |
| [11] |
Siddiqui I A, Shaukat S S. Rhizobacteria-mediated induction of systemic resistance(ISR)in tomato against Meloidogyne javanica[J]. Journal of Phytopathology, 2002, 150(8/9): 469-473. DOI:10.1046/j.1439-0434.2002.00784.x |
| [12] |
范津.丁香假单胞菌MB03及铜绿假单胞菌中对线虫毒性蛋白筛选与鉴定[D].武汉: 华中农业大学, 2017. Fan J. Screening and characterization of nematode-pathogenic from Pseudomonas syringae MB03 and Pseudomonas aeruginosa[D]. Wuhan: Huazhong Agricultural University, 2017(in Chinese with English abstract). |
| [13] |
梁红梅.铜绿假单胞菌ATCC27853对秀丽隐杆线虫的毒性研究[D].兰州: 兰州大学, 2015. Liang H M. Study on Pseudomonas aeruginosa ATCC27853 strain toxicity in Caenorhabditis elegans[D]. Lanzhou: Lanzhou University, 2015(in Chinese with English abstract). |
| [14] |
唐佳频, 邵宗泽, 张智涛, 等. 南极土壤来源的恶臭假单胞菌1A00316抗南方根结线虫的机制[J]. 应用与环境生物学报, 2014, 20(6): 1046-1051. Tang J P, Shao Z Z, Zhang Z T, et al. Mechanism of antagonistic bacteria Pseudomonas putida 1A00316 from the South Pole soil against Meloidogyne incognita[J]. Chinese Journal of Applied and Environmental Biology, 2014, 20(6): 1046-1051 (in Chinese with English abstract). |
| [15] |
Paulsen I T, Press C M, Ravel J, et al. Complete genome sequence of the plant commensal Pseudomonas fluorescens Pf-5[J]. Nature Biotechnology, 2005, 23(7): 873-878. DOI:10.1038/nbt1110 |
| [16] |
Weller D M, Mavrodi D V, van Pelt J A, et al. Induced systemic resistance in Arabidopsis thaliana against Pseudomonas syringae pv. tomato by 2, 4-diacetylphloroglucinol-producing Pseudomonas fluorescens[J]. Phytopathology, 2012, 102(4): 403-412. DOI:10.1094/PHYTO-08-11-0222 |
| [17] |
Peng D H, Lin J, Huang Q, et al. A novel metalloproteinase virulence factor is involved in Bacillus thuringiensis, pathogenesis in nematodes and insects[J]. Environmental Microbiology, 2016, 18(3): 846-862. DOI:10.1111/1462-2920.13069 |
| [18] |
Zhang F J, Peng D H, Cheng C S, et al. Bacillus thuringiensis crystal protein Cry6Aa triggers Caenorhabditis elegans necrosis pathway mediated by aspartic protease(ASP-1)[J]. PLoS Pathogens, 2016, 12(1): e1005389. DOI:10.1371/journal.ppat.1005389 |
| [19] |
李有全, 关贵全, 彭欲率, 等. 秀丽隐杆线虫的培养与保存研究[J]. 中国兽医科学, 2011, 41(10): 1001-1004. Li Y Q, Guan G Q, Peng Y L, et al. Study on the culture and preservation of Caenorhabditis elegans[J]. Chinese Veterinary Science, 2011, 41(10): 1001-1004 (in Chinese with English abstract). |
| [20] |
Williams P L, Dusenbery D B. Using the nematode Caenorhabditis elegans to predict mammalian acute lethality to metallic salts[J]. Toxicology & Industrial Health, 1988, 4(4): 469-478. |
| [21] |
王铁霖, 杨玉文, 关巍, 等. 西瓜嗜酸菌LuxR家族基因luxR4229的功能研究[J]. 植物病理学报, 2016, 46(2): 198-206. Wang T L, Yang Y W, Guan W, et al. Functional analysis of luxR4229, a LuxR family gene, in Acidovorax citrulli[J]. Acta Phytopathologica Sinica, 2016, 46(2): 198-206 (in Chinese with English abstract). |
| [22] |
Péchy-Tarr M, Bruck D J, Maurhofer M, et al. Molecular analysis of a novel gene cluster encoding an insect toxin in plantassociated strains of Pseudomonas fluorescens[J]. Environ Microbiol, 2008, 10(9): 2368-2386. DOI:10.1111/j.1462-2920.2008.01662.x |
| [23] |
李 䶮, 刘娜, 郑丽博. 荧光假单胞菌植物病害防治及研究进展[J]. 分子植物育种, 2018, 16(11): 3693-3697. Li Y, Liu N, Zheng L B. Prevention and treatment of plant diseases of Pseudomonas fluorescens and research progress[J]. Molecular Plant Breeding, 2018, 16(11): 3693-3697 (in Chinese with English abstract). |
| [24] |
Ali N I, Siddiqui I A, Shahid Shaukat S, et al. Nematicidal activity of some strains of Pseudomonas spp.[J]. Soil Biology & Biochemistry, 2002, 34(8): 1051-1058. DOI:10.1016/s0038-0717(02)00029-9 |
| [25] |
Blackburn M, Golubeva E, Bowen D, et al. A novel insecticidal toxin from Photorhabdus luminescens, toxin complex a(Tca), and its histopathological effects on the midgut of Manduca sexta[J]. Applied and Environmental Microbiology, 1998, 64(8): 3036-3041. |




