文章信息
- 任海波, 刘同坤, 袁敬平, 吴小婷, 王惠玉, 侯喜林
- REN Haibo, LIU Tongkun, YUAN Jingping, WU Xiaoting, WANG Huiyu, HOU Xilin
- 不结球白菜BcICE1基因的克隆与功能分析
- Cloning and functional analysis of BcICE1 gene in non-heading Chinese cabbage
- 南京农业大学学报, 2019, 42(5): 802-810
- Journal of Nanjing Agricultural University, 2019, 42(5): 802-810.
- http://dx.doi.org/10.7685/jnau.201901007
-
文章历史
- 收稿日期: 2019-01-03
不结球白菜(Brassica campestris ssp. chinensis)是我国长江中、下游地区人们最喜爱的蔬菜之一[1], 但其生长过程中会受到多种非生物胁迫的影响, 导致作物的产量和品质下降[2]。在农业生产中, 冷害是最严重的自然灾害之一, 导致每年的蔬菜经济损失巨大[3]。因此提高不结球白菜的抗寒性, 延长生长期, 将有利于提高不结球白菜的产量与品质[4]。
当植物遭遇冷胁迫时, 体内与冷相关的基因会迅速表达, 从而提高植物的抗寒性, 这种现象称为冷驯化, 其中由冷胁迫诱导而表达的基因称为冷诱导基因(cold regulated gene, COR)[5]。COR的核心序列为A/GCCGAC, 启动子上含有C重复元件(C-repeat, CRT)或脱水反应元件(dehydration-responsive-element, DRE)。在冷胁迫下, C重复结合因子(CRT-binding factor, CBF)/脱水响应元件结合蛋白1(dehydration-responsive element binding protein 1, DREB1)转录因子与COR启动子上的顺式作用元件相互作用诱导COR表达, 提高植物的抗寒性[6]。诱导C重复结合因子表达基因ICE1 编码的蛋白具有MYC转录因子家族特有的bHLH(碱性-螺旋-环-螺旋)DNA结合域, 过表达ICE1基因能促进CBF3及其下游COR的表达, 相反ice1 突变体抑制其表达[7]。进一步研究发现, 在冷胁迫下ICE1蛋白被泛素化、磷酸化、脱磷酸化等作用修饰后, 能够特异与CBF3启动子上的MYC顺式作用元件结合, 激活CBF3-COR冷响应通路, 从而增强植物抗寒性[8]。在拟南芥中ICE1的同源基因ICE2通过调控CBF1基因的表达, 具有相似的提高抗寒性的作用, 说明ICE基因在植物抵御冷胁迫过程中扮演重要的角色[9]。目前已从多种植物中发现ICE1 基因, 包括油菜[10]、苹果[11]、菊花[12]、番茄[13]、柑橘[14], 并且转ICE基因的番茄[15]、黄瓜[16]和柠檬[17]均能显著增强抗寒性。
目前, 关于不结球白菜ICE1 基因在抗寒中的作用尚未见报道。因此, 本研究采用同源克隆的方法, 从不结球白菜品种‘NHCC001’中克隆BcICE1基因, 并对BcICE1蛋白进行亚细胞定位与转录激活活性分析, 同时获得BcICE1转基因株系进行功能验证, 旨在明确BcICE1基因在不结球白菜抗寒途径中的作用, 为阐明不结球白菜耐寒机制提供理论基础。
1 材料与方法 1.1 试验材料不结球白菜品种‘NHCC001’由南京农业大学白菜生物系统学实验室提供。将种子播种于灭菌基质中, 置于人工气候室培养, 光/暗时间为16 h/8 h, 昼/夜温度为24 ℃/16 ℃, 相对湿度为(80±5)%。待幼苗长至5叶期时, 转移至光照培养箱进行4 ℃处理3 h, 取植株叶片, 用液氮速冻并保存于-80 ℃冰箱。
1.2 试验方法 1.2.1 RNA的提取和cDNA合成取0.1 g叶片在液氮中研磨, 用植物总RNA提取试剂盒[天根生化科技(北京)有限公司]提取总RNA。按照PrimeScriptTM RT reagent Kit with cDNA反转录试剂盒(TaKaRa公司)说明书将提取的RNA反转录为cDNA。
1.2.2 BcICE1全长基因的克隆在GenBank上查找获得拟南芥AtICE1基因序列, 用Primer Premier 5.0软件设计特异引物BcICE1-F1和BcICE1-R1(表 1), 以‘NHCC001’的cDNA为模板, 采用同源克隆的方法进行PCR扩增, 将扩增产物连接到pEASY载体(北京全式金生物技术有限公司), 热激法转化大肠杆菌感受态细胞Trans5α, 挑取阳性克隆, 测序验证。
| 引物名称Primer name | 引物序列Primer sequence(5′→3′) |
| BcICE1-F1/R1 | ATGGTTCTCGACGGAAACGG/TCAGATCATACCAGCGTAGCCC |
| BcICE1-F2/R2 | CACCATGGTTCTCGACGGAAACGG/GATCATACCAGCGTAGCCC |
| BcICE1-F3/R3 | CATGGAGGCCGAATTCATGGTTCTCGACGGAAACGGCGGT/GCAGGTCGACGGATCCTCAGATCATACCAGCGTATCCCG |
| BcICE1-F4/R4 | CGGACATATCCAAGCTCCTATG/CCTTCTGATTCCAACGGAGTAA |
| AtCBF3-F/R | GATGACGACGTATCGTTATGGA/TACACTCGTTTCTCAGTTTTACAAAC |
| AtCOR15-F/R | GCAGATGGTGAGAAAGCGAA/GGCATCCTTAGCCTCTCCTG |
| AtCOR47-F/R | GGACACCACGACAAGACAGC/CGTGACAGCTGGTGAATCCT |
| AtELF4-F/R | TGACCACACAGTCTCTGCAA/ACCAGGGAGACTTGTTGGAC |
| IPP2A-F/R | AGGCTACACGTTCGGACAAG/TGGGGCACTAAACACAGTCA |
参考D-TOPO试剂盒(Invitrogen公司)中Gateway的技术说明, 利用同源重组的原理, 进行BP和LR两步反应构建植物过表达载体。将BcICE1基因CDS区域的上游引物加上attB接头CACC, 下游引物去掉终止密码子, 所得引物为BcICE1-F2、BcICE1-R2(表 1)。使用PrimerSTAR Max高保真酶进行PCR扩增, 反应程序:96 ℃ 5 min; 96 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 90 s, 共32个循环, 4 ℃保存。用12 g · L-1琼脂糖凝胶电泳检测, 胶回收目的片段。将目的片段导入到TOPO载体, 反应体系为:目的片段2 μL、盐离子缓冲液1 μL、ddH2O 2 μL、TOPO载体1 μL, 混匀后, 室温20~23 ℃反应15 min; 转化大肠杆菌Trans5α, 挑取单克隆, 摇菌测序, 测序正确的质粒即TOPO-BcICE1。
由于载体TOPO与过表达载体pEarlyGate101筛选抗性一致, 因此用限制性内切酶MluⅠ对载体TOPO进行单酶切线性化, 将酶切后含有目的基因的载体片段进行胶回收, 然后与过表达载体进行LR反应。反应体系为:载体TOPO-BcICE1 2 μL、过表达载体pEarleyGate101 2 μL、LR酶1 μL, 混匀后, 室温25 ℃反应5 h。将反应产物转化Trans5α, 挑取单克隆, 摇菌测序, 测序正确的质粒即为表达载体pEarlyGate101-BcICE1-YFP。
1.2.4 酵母pGBKT7-BcICE1载体的构建按照Infusion试剂盒说明书要求, 以BcICE1基因和pGBKT7载体序列信息, 设计含有EcoRⅠ与BamHⅠ酶切位点的特异引物BcICE1-F3和BcICE1-R3(表 1)。PCR扩增目的片段, 插入到pGBKT7质粒中的EcoRⅠ和BamHⅠ酶切位点处, 构成重组质粒pGBKT7-BcICE1, 转化大肠杆菌感受态细胞Trans5α, 挑单克隆进行菌液检测和测序。测序正确的质粒作为诱饵质粒备用。
1.2.5 BcICE1蛋白生物信息学分析在NCBI数据库下载不同物种ICE1蛋白的氨基酸序列, 采用MEGA 5软件对氨基酸序列进行系统进化树分析, 运用DNAMAN 6.0软件对氨基酸序列进行比对, 并计算相对分子质量和等电点。
1.2.6 不结球白菜幼苗的低温和干旱处理将生长30 d的幼苗, 分别进行4 ℃低温和10%聚乙二醇6000(PEG-6000)干旱处理。分别在处理0、1、3、5、8、12和24 h与0、3、6、12和24 h时取样, 所取样品放入液氮速冻, -80 ℃冰箱保存。
1.2.7 BcICE1蛋白的亚细胞定位分析利用液氮冻融法将构建好的表达载体pEarlyGate101-BcICE1-YFP转入农杆菌GV3101, 涂布于含50 μg · mL-1卡那霉素的LB固体培养基上, 28 ℃黑暗培养48 h后, 挑取阳性克隆, 菌液PCR检测。将检测正确的农杆菌在含50 μg · mL-1卡那霉素的LB液体培养基中28 ℃振荡培养20 h, 然后取1%(体积分数)菌液接种于含50 μg · mL-1的LB液体培养基中28 ℃、200 r · min-1培养至D600为1.0。4 000 r · min-1离心10 min, 用10 mmol · L-1MgCl2、10 mmol · L-1MES(pH5.7)、150 μmol · L-1乙酰丁香酮缓冲液重悬至D600为0.8, 室温放置4 h后, 用1 mL注射器将含有pEarlyGate101-BcICE1-YFP的农杆菌注射30 d苗龄烟草叶片, 用H2B-RFP进行细胞核标记。将注射后的烟草置于人工气候室培养3 d后, 在激光共聚焦显微镜下观察H2B-RFP红色细胞核荧光信号与YFP黄色荧光信号, 分析BcICE1的亚细胞定位。
1.2.8 诱饵载体转化及酵母菌株转录激活活性检测利用PEG介导的醋酸锂感受态细胞转化法, 将空载质粒pGADT7、pGBKT7和pGBKT7-BcICE1分别共转化到AH109酵母感受态细胞, 并分别涂布于SD/-Trp/-Leu固体培养基上, 在30 ℃暗培养2~3 d后, 挑取单菌落接种到5 mL SD/-Trp/-Leu液体培养基中, 过夜振荡孵育至D600值达到1.0。将酵母菌液分别按100、10-1、10-2和10-3稀释, 吸取8 μL至SD/-Trp/- Leu/-His/-Ade固体培养基上, 30 ℃培养2~3 d后, 观察菌落数量及形态, 以此判断是否具有转录激活活性。
1.2.9 BcICE1基因导入拟南芥植株将含有pEarlyGate101-BcICE1-YFP的农杆菌接种于含5 mL质量浓度均为50 μg · mL-1的利福平和卡那霉素的LB液体培养基中, 28 ℃、200 r · min-1振荡培养18 h, 取5 mL菌液转到100 mL含相同抗生素的LB液体培养基中, 28 ℃、200 r · min-1振荡培养12 h, 至D600为1.5。4 000 r · min-1离心10 min, 弃上清液, 用渗透缓冲液重悬至D600为0.8。将拟南芥花蕾浸入重悬菌液中, 30 s后用吸水纸吸干植株。将侵染后的拟南芥植株置于人工气候室培养, 收取拟南芥种子。将收获的拟南芥种子低温春化3 d, 用70%(体积分数)的无水乙醇消毒2 min, 无菌水冲洗2次, 加入10%(体积分数)次氯酸钠溶液消毒10 min, 期间不断振荡, 无菌水冲洗3次, 拟南芥种子播种于含10 μg · mL-1草甘膦的MS固体培养基中, 人工气候室培养15 d, 观察筛选, 2周后对筛选的拟南芥进行PCR检测, 选出阳性植株即为T1代, 收种后继续筛选。
1.2.10 Western blot验证选取T2代生长旺盛的拟南芥植株叶片, 提取叶片总蛋白。经SDS-PAGE电泳后, 用湿转法转至NC膜中, 再用丽春红对NC膜进行染色, 观察条带。根据蛋白标准品剪取对应的NC膜, 并将NC膜放入到50 g · L-1脱脂奶粉中, 在室温下封闭1 h; 加入YFP抗体稀释液(1 : 2 000), 室温孵育1 h; 用TBST洗涤3次, 每次10 min, 再加入带有HRP标记的兔抗鼠免疫蛋白G稀释液(1 : 5 000), 温室孵育1 h; 用TBST洗涤3次, 每次10 min, 进行ECL化学发光反应。用底物Pico与膜反应5 min, 去除残液, 用VersaDocMP400凝胶成像仪拍照, 检测BcICE1-YFP蛋白在拟南芥植株中的表达。
1.2.11 转BcICE1拟南芥植株抗寒性分析选取BcICE1基因表达量高的植株采收种子, 对拟南芥种子进行消毒处理, 方法同1.2.9节种子消毒方法, 以野生型拟南芥为对照, 播种于含10 μg · mL-1草甘膦的MS固体培养基中, 人工气候室培养12 d, 然后, 放入-5 ℃人工光培箱中处理5 h, 再放回人工气候室恢复培养2 d, 统计成活数, 计算成活率。
1.2.12 转BcICE1拟南芥植株离子渗透率测定选取BcICE1基因表达量高的植株进行培养, 并以野生型拟南芥植株为对照。培养20 d后, 放入0 ℃人工光培箱中处理24 h。每个株系选取5株, 分别取0.3 g样品, 将转基因与野生型拟南芥样品置于50 mL离心管中, 用20 mL ddH2O浸泡3 h, 雷磁DDS-307电导率仪(上海仪电科学)测量离子渗透值, 即C1。将样品煮沸20 min后冷却至室温, 再次测量离子渗透值, 即C2。离子渗透率=C1/C2×100%。3次重复, 取均值。
1.2.13 抗寒相关基因的RT-qPCR分析根据植物总RNA提取试剂盒的方法提取总RNA。按照PrimeScriptTM RT reagent Kit with gDNA(Perfect Real Time)反转录试剂盒的方法将提取的RNA反转录为单链cDNA。使用Primer Premier 5.0设计荧光定量特异性引物, 其中拟南芥以AtELF4作为内参基因, 不结球白菜采用IPP2作为内参基因。反应体系参照SYBR Premix Ex Taq试剂盒(TaKaRa公司)说明书。相对表达量采用2-ΔΔCT法分析[18]。
1.3 数据统计方法试验数据采用SPSS 23.0软件进行统计分析与差异显著性检验。
2 结果与分析 2.1 BcICE1的同源克隆和序列分析以不结球白菜品种‘NHCC001’cDNA为模板, 采用同源克隆的方法, 获得目的基因片段(图 1), BcICE1基因含1 338 bp的开放阅读框, 编码466个氨基酸, 其蛋白相对分子质量为47.40×103, 理论等电点为5.42。
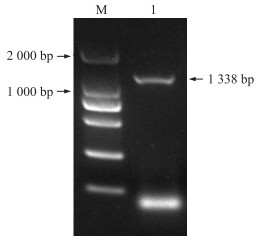
|
图 1 BcICE1基因的克隆 Fig. 1 Cloning of the BcICE 1 gene M. DL2000 marker; 1. BcICE1扩增产物BcICE1 amplification product. |
利用BLAST对BcICE1基因编码的氨基酸同源性进行检索, 共获得10个ICE1氨基酸序列。序列比对显示, BcICE1与其他植物ICE1蛋白序列相同, 具有典型的bHLH结构域和高度保守的C端(图 2-A)。系统进化树分析表明, BcICE1蛋白与欧洲油菜、荠菜和拟南芥ICE1蛋白同源关系最近(图 2-B)。
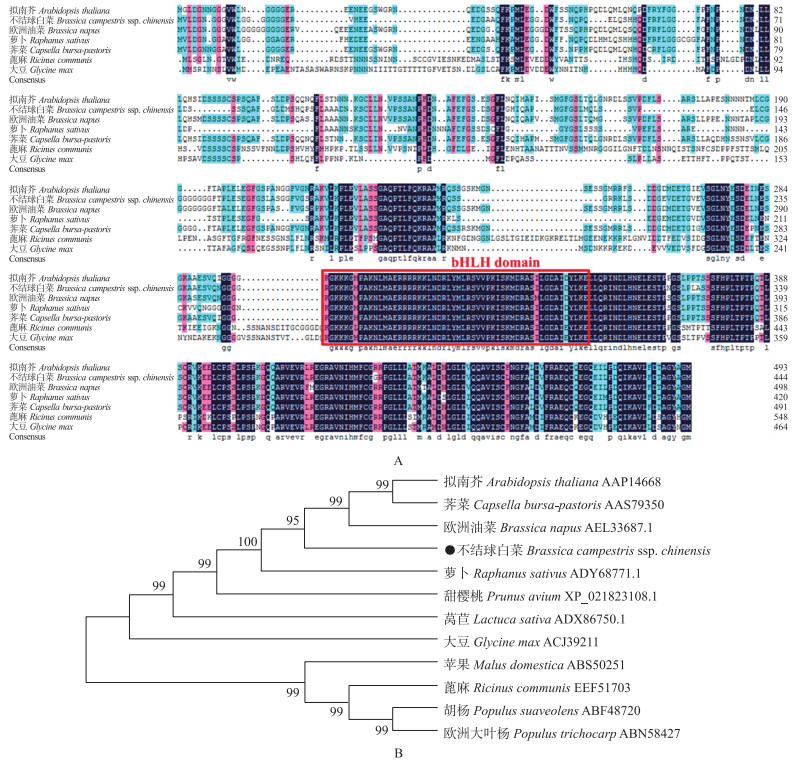
|
图 2 BcICE1与其他物种ICE1蛋白的多序列比对(A)及进化树分析(B) Fig. 2 Multiple sequence alignment(A)and phylogenetic tree analysis(B)of BcICE1 with other species' ICE1 protein 红色方框为位于第260~309个氨基酸的bHLH保守结构域。 Red box is located in the bHLH conserved domain of 260-309 amino acids. |
由图 3可见:BcICE1基因在冷处理后相对表达量迅速上调, 在3 h时达到最高, 随后缓慢下降, 24 h后恢复到未处理时水平。在干旱处理后, BcICE1基因相对表达量随处理时间的延长而持续上调, 在12 h时达到最高水平, 为未处理时的5倍, 24 h后恢复到正常水平。

|
图 3 BcICE1基因在冷胁迫(A)以及干旱胁迫(B)下的表达量 Fig. 3 Expression level of BcICE1 gene under cold stress(A)and drought stress(B) |
BcICE1蛋白在烟草上瞬时表达的检测表明:与BcICE1形成融合蛋白的YFP在细胞核上发光, 且黄色荧光与核标签的红色荧光重合(图 4)。因此说明BcICE1定位在细胞核上。

|
图 4 BcICE1在本氏烟草叶片中的亚细胞定位 Fig. 4 Subcelluer localization of BcICE1 in leaves of Nicotiana benthamiana |
由图 5可见:试验组与阴性对照组均能在SD/-Trp/-Leu中生长, 且生长状况一致, 表明试验组没有自毒性。试验组能在SD/-Trp/-Leu/-His/-Ade固体培养基中生长, 而阴性对照则不能, 表明BcICE1蛋白有转录激活性。

|
图 5 BcICE1蛋白转录激活活性验证 Fig. 5 The verification of transactivation activity of BcICE1 protein |
通过PCR扩增BcICE1基因鉴定出10株转基因拟南芥植株, 经4 ℃低温处理12 h后从T2代选取3株转基因拟南芥植株(3#、10#和12#)进行相对表达量分析, 并以野生型作为对照。结果(图 6-A)表明:3#、10#和12#植株的BcICE1基因表达量均显著高于野生型植株。进一步Western blot验证结果(图 6-B)显示:在3个转基因植株中均观察到BcICE1蛋白印迹, 表明BcICE1基因在转基因拟南芥株系中成功表达。

|
图 6 过表达BcICE1拟南芥的相对表达分析(A)以及Western blot鉴定(B) Fig. 6 Relative expression analysis(A)and Western blot identification(B)ofBcICE1-overexpressed Arabidopsis thaliana WT:野生型植株Wild-type plant; 3#, 10#, 12#:转基因植株Transgenic plants. * * * P < 0.001.下同。 The same as follows. |
将转基因拟南芥与野生型播种在MS培养基中培养, 生长12 d后无明显差异(图 7-A)。-5 ℃低温处理5 h, 正常条件下恢复2 d, 野生型拟南芥大部分枯死, 而过表达拟南芥只有少部分枯死(图 7-B)。对过表达BcICE1拟南芥与野生型进行成活率统计, 结果表明, 3#、10#和12#植株的成活率分别为83%、70%和45%, 而野生型拟南芥为19%(图 7-C)。离子渗透率测定结果(图 7-D)显示:3#、10#和12#植株的离子渗透率分别为42.88%、41.54%和51.00%, 而野生型为59.58%。

|
图 7 转基因型与野生型拟南芥幼苗抗寒性鉴定(A、B)及成活率(C)与离子渗透率(D)分析 Fig. 7 Identification of cold resistance(A, B)and the analysis of survival rate(C)and ion permeability(D) in transgenic and wild-type A.thaliana seedlings |
由图 8可见:在低温处理前, 过表达拟南芥与野生型植株中AtCBF3和AtCOR15A基因的相对表达量无显著差异, 低温处理12 h后, 2个基因的相对表达量都显著上升, 且过表达拟南芥植株显著高于野生型植株。
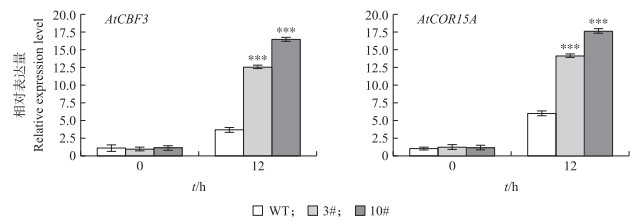
|
图 8 冷胁迫处理后转基因型与野生型拟南芥AtCBF3和AtCOR15A基因表达分析 Fig. 8 Expression analysis of AtCBF3 and AtCOR15A gene in transgenic and wild-type A.thaliana after cold stress treatment |
植株的抗寒性是一个复杂的生物适应现象, 涉及转录调控、生理生化以及分子结构等方面的一系列变化过程。通过调控大量冷响应基因的表达是植物适应低温环境的主要途径[18]。研究显示转录因子在植株抗寒过程中扮演着重要作用[19]。因此, 研究和分析这些基因在不结球白菜中的功能, 对于加速不结球白菜抗寒育种具有重要意义。
本研究首先在不结球白菜‘NHCC001’中克隆出BcICE1基因, 其次, BcICE1瞬时表达测定发现BcICE1在细胞核中表达, 且酵母双杂交技术表明BcICE1有较强的转录激活性, 这与Chinnusamy等[5]关于拟南芥AtICE1蛋白研究结果一致。多序列比对及保守结构域预测分析发现BcICE1蛋白属于bHLH转录因子家族。系统进化树分析表明不结球白菜BcICE1蛋白与拟南芥ICE1蛋白同源关系较近。综上可知BcICE1基因可能与AtICE1基因具有相同的功能。
本试验中, 低温处理不结球白菜能迅速诱导BcICE1基因的表达, 在3 h时达到最大值, 随后下调, 推测该基因的上调表达可以启动下游与冷胁迫相关基因的表达, 而下游基因的上调表达又对BcICE1基因反馈调节, 使BcICE1 基因的表达量在上升后又降低并接近于对照水平。Yuan等[20]研究发现在橡胶树中HbICE1 基因能够响应冷胁迫, 并表现随处理时间延长先增高再降低的趋势, 这与本研究结果一致。聚乙二醇(PEG)常作为一种模拟干旱试剂, 前人研究证实PEG-6000处理引起植物水分关系的变化与土壤干旱非常相似[21]。杨春杰等[22]研究报道10%PEG-6000模拟干旱能有效引起甘蓝型油菜生理指标的变化。因此本研究采用10%PEG-6000模拟干旱处理不结球白菜, 发现BcICE1基因相对表达量变化同冷胁迫下的趋势相近, 12 h达到最大值然后降低, 但在拟南芥中未发现AtICE1基因响应干旱胁迫, 而在柑橘中PtrICE1 基因响应干旱胁迫, 短时间内随处理时间的延长而增加[23]。本研究结果与之相似, 推测ICE 1基因响应干旱胁迫的差异可能与物种的特异性有关。
本研究转基因试验证明过表达BcICE1基因的拟南芥植株抗寒性显著高于野生型, 这与转水稻OsICE1 基因的拟南芥能显著增加其寒冷抗性相似[24]。电解质渗透率是一种测定植物细胞损伤程度的重要指标, 电解质渗透率越低细胞损伤程度越小[25]。本研究结果表明, 经低温处理后, 过表达BcICE1基因的拟南芥电解质渗透率显著低于野生型。在常温条件下, 过表达BcICE1基因拟南芥植株未能上调AtCBF3及其下游AtCOR15A基因的表达量, 而经低温处理后, 表达量则显著上调, 推测可能低温诱导其他辅酶因子调节BcICE1蛋白促进下游基因表达。先前的研究已经证明了这个假设, 拟南芥中开放气孔1(open stomata 1, OST1)是一种脱落酸信号途径中的蛋白激酶, 磷酸化ICE1蛋白阻止高表达渗透响应基因(high expression of osmotically responsivegene 1, HOS1)泛素E3连接酶降解ICE1蛋白, 对ICE1蛋白活性起到正调控作用[26]。SIZ1 SUMO E3连接酶对ICE1蛋白进行类泛素化, 抑制ICE1蛋白降解, 对ICE1蛋白活性起到正调控作用[27]。综上推测, 不结球白菜BcICE1与拟南芥AtICE1基因的作用模式和生物学功能可能相同, 均是通过ICE1-CBF-COR信号转导途径调控不结球白菜对低温处理的响应。但关于BcICE1基因的调控机制及是否存在其他未知BcICE1互作基因, 共同参与调控不结球白菜的抗寒路径, 还有待进一步研究。
| [1] |
侯喜林. 不结球白菜育种研究新进展[J]. 南京农业大学学报, 2003, 26(4): 111-115. Hou X L. Advances in breeding of non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 2003, 26(4): 111-115 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2003.04.026 |
| [2] |
张蜀宁, 张振超, 张红亮, 等. 低温胁迫对不同倍性不结球白菜生长及生理生化特征的影响[J]. 西北植物学报, 2008, 15(1): 109-112. Zhang S N, Zhang Z C, Zhang H L, et al. Effects of low temperature stress on growth, physiological and biochemical characteristics of different ploidy non-heading Chinese cabbage[J]. Acta Botaica Boreali-Occidentalia Sinica, 2008, 15(1): 109-112 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-4025.2008.01.020 |
| [3] |
Kim S H, Chung W S, Bahk S, et al. Phosphorylation of the transcriptional repressor MYB15 by mitogen-activated protein kinase 6 is required for freezing tolerance in Arabidopsis[J]. Nucleic Acids Research, 2017, 45(11): 6613-6627. DOI:10.1093/nar/gkx417 |
| [4] |
王镇.不结球白菜冷相关CBF基因的鉴定及调控路径[D].南京: 南京农业大学, 2015. Wang Z. Identification and regulation of cold-related CBF genes in non-heading Chinese cabbage[D]. Nanjing: Nanjing Agricultural University, 2015(in Chinese with English abstract). |
| [5] |
Chinnusamy V, Zhu J, Zhu J K. Cold stress regulation of gene expression in plants[J]. Trends in Plant Science, 2007, 12(10): 445-451. |
| [6] |
Jaglo-Ottosen K R, Gilmour S J, Zarka D G, et al. Arabidopsis CBF1 overexpression induces COR genes and enhances freezing tolerance[J]. Science, 1998, 280(5360): 104-106. DOI:10.1126/science.280.5360.104 |
| [7] |
Chinnusamy V, Ohta M, Kanrar S, et al. ICE1, a regulator of cold-induced transcriptome and freezing tolerance in Arabidopsis[J]. Genes and Development, 2003, 17(8): 1043-1054. DOI:10.1101/gad.1077503 |
| [8] |
Shi Y, Ding Y, Yang S. Molecular regulation of CBF signaling in cold acclimation[J]. Trends in Plant Science, 2018, 23(7): 623-627. DOI:10.1016/j.tplants.2018.04.002 |
| [9] |
Fursova O V, Pogorelko G V, Tarasov V A. Identification of ICE2, a gene involved in cold acclimation which determines freezing tolerance in Arabidopsis thaliana[J]. Gene, 2009, 429(1/2): 98-103. |
| [10] |
张腾国, 常燕, 王娟, 等. 油菜BnICE1的克隆及表达分析[J]. 中国农业科学, 2013, 46(1): 205-214. Zhang T G, Chang Y, Wang J, et al. Cloning and expression analysis of a BnICE1 from Brassica napus[J]. Scientia Agricultura Sinica, 2013, 46(1): 205-214 (in Chinese with English abstract). DOI:10.3864/j.issn.0578-1752.2013.01.024 |
| [11] |
Feng X M, Zhao Q, Zhao L L, et al. The cold-induced basic helix-loop-helix transcription factor gene MdCIbHLH1 encodes an ICE-like protein in apple[J]. BMC Plant Biology, 2012, 12(1): 22. DOI:10.1186/1471-2229-12-22 |
| [12] |
Chen Y, Jiang J, Song A, et al. Ambient temperature enhanced freezing tolerance of Chrysanthemum dichrum CdICE1 Arabidopsis via miR398[J]. BMC Biology, 2013, 11(1): 121. DOI:10.1186/1741-7007-11-121 |
| [13] |
Feng H L, Ma N N, Meng X, et al. A novel tomato MYC-type ICE1-like transcription factor, SlICE1a, confers cold, osmotic and salt tolerance in transgenic tobacco[J]. Plant Physiology and Biochemistry, 2013, 73: 309-320. DOI:10.1016/j.plaphy.2013.09.014 |
| [14] |
Huang X S, Wang W, Zhang Q, et al. A basic helix-loop-helix transcription factor, PtrbHLH, of Poncirus trifoliata confers cold tolerance and modulates peroxidase-mediated scavenging of hydrogen peroxide[J]. Plant Physiology, 2013, 162(2): 1178-1194. DOI:10.1104/pp.112.210740 |
| [15] |
Yu X H, Juan J X, Gao Z L, et al. Cloning and transformation of INDUCER of CBF EXPRESSION1(ICE1)in tomato[J]. Genetics and Molecular Research, 2015, 14(4): 13131-13143. DOI:10.4238/2015.October.26.9 |
| [16] |
Liu L, Duan L, Zhang J, et al. Cucumber(Cucumis sativus L.)over-expressing cold-induced transcriptome regulator ICE1 exhibits changed morphological characters and enhances chilling tolerance[J]. Scientia Horticulturae, 2010, 124(1): 29-33. DOI:10.1016/j.scienta.2009.11.018 |
| [17] |
Huang J Q, Sun Z H. Agrobacterium-mediated transfer of Arabidopsis ICE1 gene into lemon(Citrus limon(L.)Burm. F. cv. Eureka)[J]. Agricultural Science in China, 2005, 4(9): 714-720. |
| [18] |
Wu P, Wang W L, Li Y. Divergent evolutionary patterns of the MAPK cascade genes in Brassica rapa and plant phylogenetics[J]. Horticulture Research, 2017, 4: 17079. DOI:10.1038/hortres.2017.79 |
| [19] |
Doherty C J, van Buskirk H A, Myers S J, et al. Roles for Arabidopsis CAMTA transcription factors in cold-regulated gene expression and freezing tolerance[J]. The Plant Cell, 2009, 21(3): 972-984. DOI:10.1105/tpc.108.063958 |
| [20] |
Yuan H M, Sheng Y, Chen W J, et al. Overexpression of Hevea brasiliensis HbICE1 enhances cold tolerance in Arabidopsis[J]. Frontiers in Plant Science, 2017, 8: 1462. DOI:10.3389/fpls.2017.01462 |
| [21] |
Kaufmann M R, Eckard A N. Evaluation of water stress control with polyethylene glycols by analysis of guttation[J]. Plant Physiology, 1971, 47(4): 453-456. DOI:10.1104/pp.47.4.453 |
| [22] |
杨春杰, 张学昆, 邹崇顺, 等. PEG-6000模拟干旱胁迫对不同甘蓝型油菜品种萌发和幼苗生长的影响[J]. 中国油料作物学报, 2007, 29(4): 425-430. Yang C J, Zhang X K, Zou C S, et al. Effects of drought simulated by PEG-6000 on germination and seedling growth of rapeseed(Brassica napus L.)[J]. Chinese Journal of Oil Crop Sciences, 2007, 29(4): 425-430 (in Chinese with English abstract). DOI:10.3321/j.issn:1007-9084.2007.04.013 |
| [23] |
Huang X S, Zhang Q, Zhu D, et al. ICE1 of Poncirus trifoliata functions in cold tolerance by modulating polyamine levels through interacting with arginine decarboxylase[J]. Journal of Experimental Botany, 2015, 66(11): 3259-3274. DOI:10.1093/jxb/erv138 |
| [24] |
Deng C, Ye H, Fan M, et al. The rice transcription factors OsICE confer enhanced cold tolerance in transgenic Arabidopsis[J]. Plant Signaling and Behavior, 2017, 12(5): e1316442. DOI:10.1080/15592324.2017.1316442 |
| [25] |
Xu W, Jiao Y, Li R, et al. Chinese wild-growing Vitis amurensis ICE1 and ICE2 encode MYC-type bHLH transcription activators that regulate cold tolerance in Arabidopsis[J]. PLoS One, 2014, 9(7): e102303. DOI:10.1371/journal.pone.0102303 |
| [26] |
Ding Y, Li H, Zhang X, et al. OST1 kinase modulates freezing tolerance by enhancing ICE1 stability in Arabidopsis[J]. Developmental Cell, 2015, 32(3): 278-289. DOI:10.1016/j.devcel.2014.12.023 |
| [27] |
Miura K, Jin J B, Lee J, et al. SIZ1-mediated sumoylation of ICE1 controls CBF3/DREB1A expression and freezing tolerance in Arabidopsis[J]. The Plant Cell, 2007, 19(4): 1403-1414. DOI:10.1105/tpc.106.048397 |




