文章信息
- 李双飞, 黄颜众, 轩慧冬, 黄鹭, 赵晋铭, 王海棠, 郭娜, 邢邯
- LI Shuangfei, HUANG Yanzhong, XUAN Huidong, HUANG Lu, ZHAO Jinming, WANG Haitang, GUO Na, XING Han
- 大豆GmTIP1-1基因克隆及功能研究
- Cloning and functional analysis of GmTIP1-1 in soybean
- 南京农业大学学报, 2019, 42(5): 793-801
- Journal of Nanjing Agricultural University, 2019, 42(5): 793-801.
- http://dx.doi.org/10.7685/jnau.201901024
-
文章历史
- 收稿日期: 2019-01-10
非生物胁迫是全球作物生产的主要环境限制因素。干旱胁迫作为非生物胁迫之一, 使植物水分失衡而导致逆境伤害, 对于植物的生长代谢过程、经济作物的产量及再生产等均有影响[1]。因此, 逆境胁迫下植物维持水分平衡的机制一直是耐逆研究的热点。水分吸收和跨膜及组织间转运对于植物的生长发育至关重要。
作物可以通过一系列不同途径共同实现对于水分的转运, 其中非原生质体途径通过细胞壁实现, 共质体途径则经由胞间连丝借助水通道或扩散通过细胞膜实现。其中水分子的跨膜转运主要受水通道蛋白(aquaporin, AQP)的调节[2]。AQP作为细胞内和细胞间水分运输的主要通道蛋白, 能够依赖渗透势高效介导水分的跨膜转运, 在维持细胞渗透平衡和调节植物生理过程中发挥重要作用。根据其定位和序列的相似性将AQP分为5个亚家族:质膜内在蛋白(PIP)、液泡膜内在蛋白(TIP)、类Nod26膜内在蛋白(NIP)、小分子碱性膜内在蛋白(SIP)和X内在蛋白(XIP)[3]。AQP通过水、小分子溶质、气体和重金属的有效转运提高植物的抗逆性, 在植物水平衡和水利用效率中起关键作用[4-5]。
相关研究表明, 干旱胁迫能够显著影响苹果AQP的相对表达水平[6]。在烟草中, NtAQP1的过量表达增加了叶净光合速率、叶肉CO2电导率和气孔导度, 而其沉默则降低根系水传导率。在番茄(Solanum lycopersicum)中表达NtAQP1可导致植物具有更高的气孔导度[7], 而植物的气孔导度和根系水力传导能力都间接影响植物对于干旱胁迫的抵抗能力。AQP中的亚家族蛋白TIP在很多种植物的非生物胁迫耐受性的提高方面起到关键作用。Pou等[8]研究发现, 水分胁迫和重新浇水使葡萄叶片的VvTIP2-1和VvPIP2-1表达差异显著。在拟南芥中异位表达TsTIP1-2时, 拟南芥对抗干旱、盐和氧化胁迫的能力增强[9]。葛晓兰等[10]发现, ThTIP在柽柳和酵母中对盐害、干旱和重金属胁迫有应答效应。过表达ThTIP的转基因拟南芥株系, 在NaCl和甘露醇胁迫处理下种子萌发率、根长、鲜质量及生长势都要优于野生型植株[11]。类似研究表明, 番茄SITIP 2-2在拟南芥中异源表达可提高其对土壤盐度的适应能力[12]。Punzo等[13]发现, 在拟南芥中ThTIP41可以和PP2A发生互作, 通过调节ABA通路来提高植物对非生物胁迫的抵抗能力。因此, 通过对植物进行外源激素处理来研究基因对于非生物胁迫的响应是非常直观且有效的方法。
大豆作为食用油和富含蛋白质膳食的重要来源, 是非常有前景的作物。因此, 研究大豆中的水通道蛋白在干旱胁迫下的水分平衡机制, 可作为大豆抗旱分子机制研究的新参考, 为大豆抗逆分子育种开拓新思路。Zhang等[14]观察到在大豆中GmTIP 2-3的表达模式受PEG和ABA的影响, 并且在酵母细胞中过表达GmTIP 2-3其渗透胁迫耐受性均提高。目前关于大豆TIP基因的研究较少, 本研究拟从大豆中克隆出GmTIP1-1的CDS全长序列, 对其进行组织表达分析以及干旱、激素处理诱导表达分析, 利用酵母双杂技术筛选出在非生物胁迫中与GmTIP1-1有效互作的蛋白, 明确该蛋白在大豆响应非生物胁迫过程中的作用机制, 为进一步探究大豆抗逆分子机制提供参考。
1 材料与方法 1.1 试验材料大豆(Glycine max)品种‘天隆1号’由中国油料作物研究所周新安研究员提供。
1.2 生物信息学分析利用BioXM 2.6对GmTIP1-1进行ORF查找、翻译及蛋白质理化性质的分析; 用GmTIP1-1氨基酸序列在NCBI进行BLAST比对, 获得同源性高的蛋白质序列, 使用DNAMAN 8.0程序进行多重序列比对, 利用MEGA 7.0软件构建进化树。利用在线的SMART(http://smart.embl-heidelberg.de)进行结构域及跨膜区域分析。
1.3 基因克隆及表达载体构建提取大豆‘天隆1号’幼苗根部组织的RNA, 反转录得到cDNA。设计特异性引物, 以此为模板进行PCR扩增, 获得目的基因, 与pEASY-Blunt载体连接、鉴定, 构建pAN580过表达载体用于亚细胞定位试验, 构建pBT3-N载体用于酵母双杂试验。
1.4 实时荧光定量PCR分析利用植物总RNA提取试剂盒(DP419, TIANGEN)提取大豆根、茎、叶等组织的总RNA, 并反转录获得cDNA。根据基因序列设计特异性定量引物(表 1), 每个试验组设置3次生物学重复, GmActin作为内参基因。使用SYBR Green Master Mix(Q111-02, Vazyme)试剂进行实时荧光定量PCR, 目的基因相对表达量利用2-ΔΔCT方法计算, 利用SPSS v17.0软件进行统计分析, 采用t测验对GmTIP1-1基因的表达水平进行显著性差异分析。并用GraphPad prism 5软件作图。
| 引物名称Primer name | 序列Sequence(5′→3′) | 用途Usage |
| GmTIP1-1-F | CATCATCATCATCATCACCGTTGA | GmTIP1-1克隆Cloning of GmTIP1-1 |
| GmTIP1-1-R | AACCATACACAGAAGAAGATTCCG | |
| GmTIP1-1-L-F | TTACTCCGCGGCATCGTCTA | GmTIP1-1实时荧光定量qRT-PCR of GmTIP1-1 |
| GmTIP1-1-L-R | GGAAAGCCCGAATGCTGGAA | |
| GmF-box-L-F | ACAAGGAGCAGAGCACAGAT | GmF-box实时荧光定量qRT-PCR of GmF-box |
| GmF-box-L-R | GGACGGATCAAGCACTTCAC | |
| GmSNARE-L-F | GGAGGAGCTCGAAAGGATCA | GmSNARE实时荧光定量qRT-PCR of GmSNARE |
| GmSNARE-L-R | GCCTTCTGCTTCTGCAAACT | |
| GmActin-F | GGTGGTTCTATCTTGGCATC | 实时荧光定量内参Reference gene in qRT-PCR |
| GmActin-R | CTTTCGCTTCAATAACCCTA | |
| GmTIP1-1-Y-F | CGGTCCCGGGGGATCCATGGATGCCGATCAGAAACATCGCC | GmTIP1-1亚克隆Sub-cloning of GmTIP1-1 |
| GmTIP1-1-Y-R | TGCTCACCATGGATCCGCTAGTAGTCAGTGCTG | |
| GmTIP1-1-YA1-F | CGGTCCCGGGGGATCCATGTTGAAGGCGGGGTTGG | GmTIP1-1A1亚克隆Sub-cloning of GmTIP1-1A1 |
| GmTIP1-1-YA1-R | TGCTCACCATGGATCCGATGCCGGAACCTGAACC | |
| GmTIP1-1-YA2-F | CGGTCCCGGGGGATCCATGTCCATCGCCCATGCTTTC | GmTIP1-1A2亚克隆Sub-cloning of GmTIP1-1A2 |
| GmTIP1-1-YA2-R | TGCTCACCATGGATCCGACGTGGCCGCCGGAGAT | |
| GmTIP1-1-YA3-F | CGGTCCCGGGGGATCCATGATCGTCTACGTCATCGCCC | GmTIP1-1A3亚克隆Sub-cloning of GmTIP1-1A3 |
| GmTIP1-1-YA3-R | TGCTCACCATGGATCCGGCAGTGACGAAGGCGAG | |
| GmTIP1-1-YA4-F | CGGTCCCGGGGGATCCATGGCTGGAGTCGGAGTTGG | GmTIP1-1A4亚克隆Sub-cloning of GmTIP1-1A4 |
| GmTIP1-1-YA4-R | TGCTCACCATGGATCCGACTGTGTACACCAAACCGAAG | |
| GmTIP1-1-YA5-F | CGGTCCCGGGGGATCCATGTTGGGAATTATTGCTCCCATCG | GmTIP1-1A5亚克隆Sub-cloning of GmTIP1-1A5 |
| GmTIP1-1-YA5-R | TGCTCACCATGGATCCGAAGGCCCCACCCAACAAAATG | |
| GmTIP1-1-YA6-F | CGGTCCCGGGGGATCCATGTGGATCTACTGGGCCGG | GmTIP1-1A6亚克隆Sub-cloning of GmTIP1-1A6 |
| GmTIP1-1-YA6-R | TGCTCACCATGGATCCGATGAAGACAACCTCGTAGATAAGC | |
| GmTIP1-1-Y2H-F | CGCCTCGGCCCCATGGATGCCGATCAGAAACATCGCC | GmTIP1-1亚克隆Sub-cloning of GmTIP1-1 |
| GmTIP1-1-Y2H-R | TAGCTACTTACCATGGCTAGTAGTCAGTGCTGGGAAGC |
提取含有GmTIP1-1及6个不同跨膜结构域的重组质粒, 浓缩使其质量浓度≥1 000 ng·μL-1。烟草叶片倒置摆放于MS培养基上。通过基因枪轰击法将包裹了重组质粒的球状金粉转入烟草叶片细胞, 将其暗培养16~20 h, 制片, 用激光共聚焦显微镜观察。
1.6 GmTIP1-1基因在不同胁迫处理下的表达分析选取籽粒饱满、无破皮的‘天隆1号’种子播种于以蛭石为基质的花盆中, 置于温室中培养。温室温度25 ℃, 光照条件为16 h光照和8 h黑暗, 正常浇水。待大豆第1片三出复叶刚刚展开时, 将每盆的大豆土壤1次性浇透水后停止浇水。一部分在停止浇水的0、1、2、3、5、7 d取样, 另一部分转移至200 μmol·L-1脱落酸(ABA)培养0、6、12、24、36、48 h后取样。大豆根、茎、叶分别取样。采用天根公司RNA提取试剂盒提取大豆各部位总RNA, 使用TaKaRa公司的荧光定量反转录试剂盒获得各组织的cDNA, 使用Vazyme公司的SYBR Green Master Mix试剂盒进行荧光定量PCR, 检测GmTIP1-1基因在干旱胁迫下的表达水平。
1.7 GmTIP1-1的互作蛋白确定将表达GmTIP1-1蛋白的NMY551酵母菌在SD/-Leu平板上划线, 30 ℃培养3 d后接种于SD/-Leu液体培养基中, 培养至细胞经历2次分裂, 转化效率达到最优。将文库质粒转化到制备的高质量酵母细胞中, 复苏培养90 min。菌液涂布于SD/-Leu/-Trp/-His/-Ade/10 mmol·L-1 3-AT固体培养基上, 30 ℃恒温培养3~5 d。
挑取生长在SD/-Leu/-Trp/-His/-Ade/10 mmol·L-1 3-AT固体培养基上的阳性克隆, 接种于2 mL液体培养基SD/-Leu/-Trp中, 30 ℃、220 r·min-1培养2 d。质粒提取测序后通过Soybase数据库进行BLAST比对分析, 确定互作蛋白再进行一对一验证。将NMY51酵母菌涂布于YPDA培养基平板上, 30 ℃倒置培养3 d左右, 直至菌落大小为2~3 mm。挑取酵母菌落培养于50 mL YPDA液体培养基中, 30 ℃、220 r·min-1振荡过夜培养。以质粒pTSU2-APP和pPR3-N为阴性对照, 质粒pTSU2-APP和pNubG-Fe65为阳性对照进行试验。用AD质粒和BD质粒pBT 3-N-GmTIP1-1转化到制备好的高质量酵母细胞中, 将菌液涂布于直径为100 mm的SD/-Leu/-Trp/10 mmol·L-13-AT固体培养基平板和SD/-Leu/-Trp/-His/-Ade/10 mmol·L-1 3-AT固体培养基平板上, 30 ℃恒温培养3~5 d, 观察结果。
2 结果与分析 2.1 GmTIP1-1基因克隆利用特异性引物, PCR扩增获得的GmTIP1-1基因(ID为Glyma.03G185900.1)ORF片段与参考基因组一致, CDS序列全长为753 bp, 编码250个氨基酸(图 1), 等电点为6.51。

|
图 1 GmTIP1-1的ORF和氨基酸序列 Fig. 1 The ORF and amino acid sequence of GmTIP1-1 |
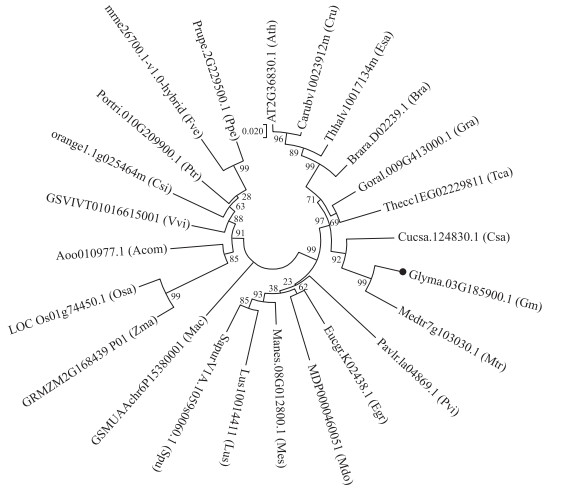
用GmTIP1-1的氨基酸序列在NCBI进行BLAST比对, 下载同源性高的蛋白序列, 先用ClustalX软件进行初步序列比对, 再利用MEGA 7.0软件构建进化树。结果(图 2)表明, 大豆GmTIP1-1蛋白与苜蓿(Medicago truncatula)和黄瓜(Cucumis sativus)的TIP1-1蛋白亲缘关系相近。与苜蓿相似性达99%, 与黄瓜有92%的相似度。
|
图 2 GmTIP1-1进化树分析 Fig. 2 Phylogenetic tree analysis of GmTIP1-1 Gm:大豆Glycine max; Csa:黄瓜Cucumis sativus; Vvi:葡萄Vitis vinifera; Mdo:苹果Malus domestica; Mtr:苜蓿Medicago truncatula; Pvi:稷Panicum virgatum; Cru:芥菜Capsella rubella; Csi:柑橘Citrus sinensis; Lus:亚麻Linum usitatissimum; Ptr:胡杨Populus trichocarpa; Ppe:樱桃Prunus persica; Fve:草莓Fragaria vesca; Tca:可可Theobroma cacao; Gra:棉花Gossypium raimondii; Esa:山嵛菜Eutrema salsugineum; Osa:水稻Oryza sativa; Ath:拟南芥Arabidopsis thaliana columbia; Bra:芸苔Brassica rapa FPsc; Spu:沙柳Salix purpurea; Zma:玉米Zea mays; Egr:桉树Eucalyptus grandis; Mac:芭蕉Musa acuminata; Mes:蜀葵Manihot esculenta; Acom:凤梨Ananas comosus. |
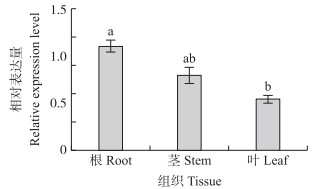
利用荧光定量PCR方法, 分析GmTIP1-1在大豆根、茎、叶中的表达量(图 3)。结果表明, GmTIP1-1基因在大豆中表达广泛, 但GmTIP1-1在大豆根中的表达量最高, 在茎中次之, 在叶中的表达量最低, 各组织间差异显著。
|
图 3 GmTIP1-1在大豆组织中的表达分析 Fig. 3 Expression analysis of GmTIP1-1 in soybean tissues 不同小写字母表示在0.05水平差异显著。 The different small letters indicate significant difference at 0.05 level. |
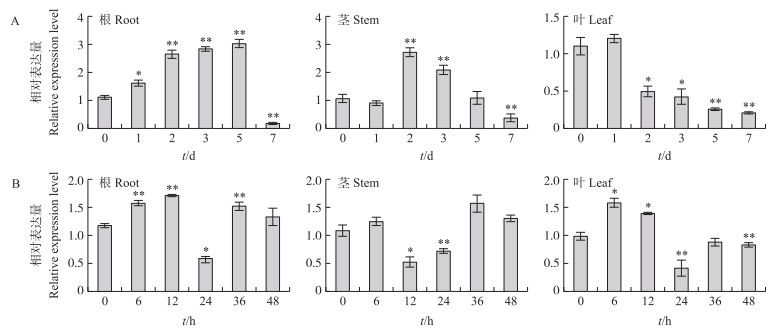
为研究GmTIP1-1基因对非生物胁迫的响应, 利用实时荧光定量PCR分析大豆在干旱和激素处理后GmTIP1-1的转录水平。结果(图 4)表明, 在干旱胁迫条件下, GmTIP1-1在大豆根、茎中均受诱导, 在干旱5 d的根和2 d的茎中, GmTIP1-1表达量分别为对照的3.0和2.6倍。但是在叶中GmTIP1-1表达受抑制, 在干旱5 d时表达量为对照的1/5(图 4-A)。可见, GmTIP1-1通过在各组织中的差异表达来提高根获取水分的能力, 茎运输水分的能力以及叶部减少水分蒸腾从而抵抗干旱胁迫的作用。
|
图 4 干旱(A)和200 μmol·L-1 ABA(B)不同处理时间下GmTIP1-1基因在大豆组织中的表达情况 Fig. 4 Expression of GmTIP1-1 gene in soybean tissue under different treatment time of drought(A)and 200 μmol·L-1 ABA(B) * P < 0.05, * * P < 0.01. The same as follows. |
在200 μmol·L-1脱落酸(ABA)处理下, GmTIP1-1在根、茎、叶中的表达量都出现了先上调后下降再上调表达的趋势, 在ABA处理6 h的根、36 h的茎和6 h的叶中表达量均约为对照的1.5倍(图 4-B)。外施ABA迅速诱导GmTIP1-1表达, 随后达到蛋白饱和状态, 但随着处理时间延长继续诱导表达。
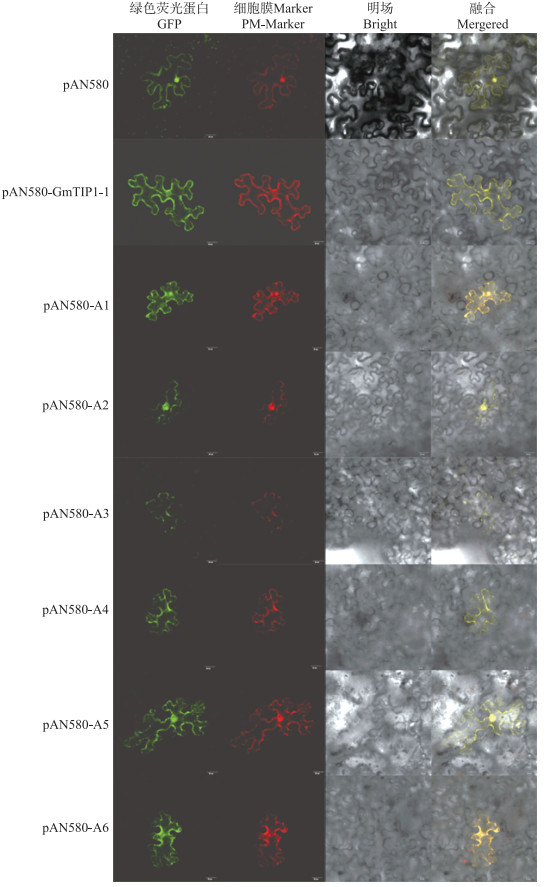
2.4 GmTIP1-1蛋白的亚细胞定位利用基因枪法将pAN580-GmTIP1-1重组质粒转化到烟草叶片表皮细胞中, 暗培养16~20 h, 用激光共聚焦荧光显微镜观察绿色荧光蛋白的分布。结果(图 5)显示:在转化空载体质粒pAN 580的烟草叶片表皮细胞中, 细胞膜、细胞质以及细胞核中均有绿色荧光分布, 而在转化重组质粒的烟草叶片表皮细胞中, 绿色荧光主要分布于细胞膜部位, 与细胞膜Marker红色荧光重合, 最后融合结果为黄色。表明:GmTIP1-1蛋白定位于细胞膜上。
|
图 5 GmTIP1-1蛋白及不同结构域在烟草叶片表皮细胞的定位 Fig. 5 Localization of GmTIP1-1 protein and different domains in epidermal cells of tobacco leaves |
通过SMART数据库进行蛋白结构预测, 发现GmTIP1-1蛋白含有1个MIP结构域, 并且包括6个跨膜区域(图 6)。将含有GmTIP1-1的6个跨膜结构域A1(aa22~42)、A2(aa62~84)、A3(aa104~126)、A4(aa136~158)、A5(aa170~192)和A6(aa216~238)的重组质粒, 利用基因枪法转入烟草叶片细胞, 暗培养后用激光共聚焦显微镜观测结果。亚细胞定位结果表明, GmTIP1-1蛋白的6个跨膜区域均定位于细胞膜上(图 5)。说明GmTIP1-1蛋白的每个结构域的定位效应相同。
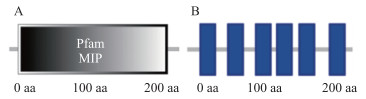
|
图 6 GmTIP1-1蛋白的结构域(A)和跨膜区域(B) Fig. 6 The domain(A)and transmembrane region(B)of the GmTIP1-1 protein |
通过酵母双杂筛库试验, 对所有阳性克隆进行一对一验证。30 ℃恒温培养5 d后发现, 阳性对照、阴性对照、pPR 3-N-GmF-box+pBT3-N-GmTIP1-1、pPR3-N-GmSNARE+pBT3-N-GmTIP1-1在SD/-Leu/-Trp/10 mmol·L-1 3-AT的固体培养基上均生长正常。在SD/-Leu/-Trp/-His/-Ade/10 mmol·L-1 3-AT固体培养基上阴性对照不能生长, 阳性对照、pPR3-N-GmF-box+pBT3-N-GmTIP1-1、pPR3-N-GmSNARE+pBT3-N-GmTIP1-1生长正常(图 7)。表明GmF-box和GmSNARE与GmTIP1-1在酵母体内存在相互作用。
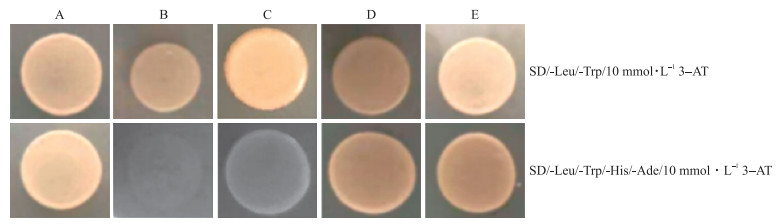
|
图 7 GmTIP1-1蛋白与GmF-box蛋白和GmSNARE蛋白互作鉴定 Fig. 7 Interaction between GmTIP1-1 protein and GmF-box protein and GmSNARE protein A.阳性对照Positive control:pTSU2-APP+pNubG-Fe65; B.阴性对照Negative control:pTSU2-APP+pPR3-N; C.阴性对照Negative control:pBT3-N-GmTIP1-1+pPR3-N; D. pPR3-N-GmF-box+pBT3-N-GmTIP1-1; E. pPR3-N-GmSNARE+pBT3-N-GmTIP1-1. |
利用实时荧光定量PCR分析在非生物胁迫下与GmTIP1-1蛋白存在互作效应的蛋白GmSNARE和GmF-box的相对表达水平。结果(图 8)显示, 在干旱胁迫下, GmSNARE在根和茎中均受到诱导表达。但在叶中, 表达量无显著差异。在干旱处理7 d时, 根和茎的GmSNARE基因表达量分别是对照的10倍和13倍左右(图 8-A)。GmF-box基因在大豆的根、茎、叶中均有诱导表达, 并且诱导上调表达水平非常显著。在根中, 干旱处理1 d时, 开始出现显著诱导表达; 在茎中, 干旱处理2 d时, 开始出现显著诱导表达; 在叶中, 干旱处理3 d时开始出现显著诱导表达。GmF-box基因在干旱处理5 d的根、7 d的茎和7 d的叶中表达量最高, 分别约为对照的65倍、27倍和29倍(图 8-B)。这些结果表明:GmSNARE和GmF-box基因都受到非生物胁迫的诱导表达, 可能通过与GmTIP1-1蛋白互作共同调节植物体水分平衡。
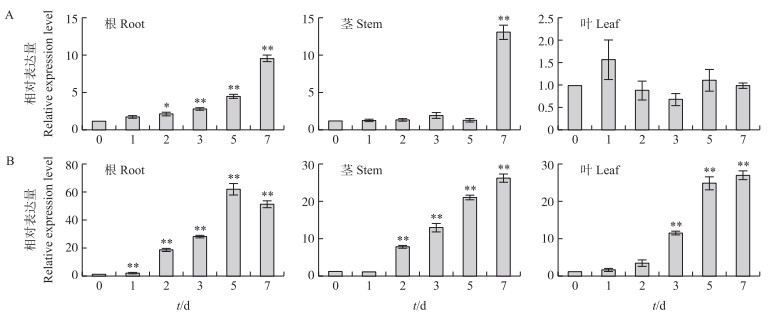
|
图 8 不同干旱处理时间下GmSNARE(A)和GmF-box(B)基因的表达情况 Fig. 8 Expression of GmSNARE(A)and GmF-box(B)genes under drought treatmen time |
大豆在应对恶劣的外界环境如非生物胁迫时, 可以通过迅速激活相关信号转导途径以及诱导合成大量抗逆基因产物来发挥作用[15]。
当植物在非生物胁迫因素存在的环境下生长时, 为了降低伤害, 植物会通过水和多种溶质的转运和区室化等一系列方式来维持体内渗透平衡和离子平衡[16]。TIP作为水通道蛋白, 植物中分布最为广泛, 在水分运输过程中发挥重要作用。一般来说, 根的抗胁迫能力决定了地上部水分的可利用程度, 并且对植物CO2的积累和作物产量也有很大影响。本研究对大豆‘天隆1号’不同组织中GmTIP1-1基因相对表达量分析显示, GmTIP1-1基因在根中表达量最高。在干旱胁迫处理时, GmTIP1-1基因在根和茎中的相对表达量都出现先上调表达后下调表达趋势。而在叶中表现出随着干旱处理时间出现持续下调的表达趋势。这可能是因为当植物处于干旱胁迫初期时, 根系的导水率会显著下降, 植物通过加强根系对水分的获取能力以及提高茎部水通道的运输能力来抵抗胁迫, 达到植物维持水分平衡的目的。叶片为了减少蒸腾作用造成的水分流失, 使叶片水通道活性降低, 保持气孔关闭。因此在叶中表现出随着干旱处理时间出现持续下调的趋势。对水稻和拟南芥的干旱胁迫处理研究结果也表明, 叶片中大部分AQP在长期的干旱胁迫下的表达都有下降的趋势[17]。
与GmTIP1-1基因在植物响应水分胁迫中的作用相一致, 脱落酸(ABA)也可以在某种程度上调节水通道蛋白基因的表达。在水稻受到水分胁迫的时候, 尤其是在植株体内能够生成大量ABA的旱地水稻品种的根中大多数水通道蛋白的表达都会增强[18]。植物对非生物胁迫的适应受到信号通路和生化过程的复杂网络的调节。这些适应性机制中有些是由内源性脱落酸(ABA)水平的增加引发的。所以外源ABA处理可以更直观有效地了解GmTIP1-1基因对于非生物胁迫的响应。这些都表明, GmTIP1-1基因可以响应非生物胁迫信号, 不仅仅是干旱胁迫, 也包括ABA激素信号, 通过调节表达水平, 保持植物水分平衡, 提高对非生物胁迫的耐受性。
GmTIP1-1蛋白作为定位于细胞膜的水通道蛋白, 可以直接通过表达水平的高低来调节植物水分平衡。植物对于非生物胁迫的调节网络是非常复杂的, 该蛋白可能存在其他抵抗非生物胁迫的机制。因此, 本研究利用酵母双杂筛选互作蛋白, 且发现了GmTIP1-1蛋白与响应逆境胁迫蛋白GmSNARE和蛋白GmF-box存在互作。由此, 我们可以进一步分析该蛋白在大豆抵抗非生物胁迫中的作用机制。
植物SNARE蛋白主要通过介导囊泡融合调节植物正常的生长发育并参与植物对外界环境的响应[19]。有研究表明, 烟草中SNARE蛋白和NtSyr1蛋白主要是通过调节囊泡的运输控制K+通道蛋白在质膜上的正确定位及植物对ABA激素的响应[20]。当拟南芥缺失了SNARE基因AtVAMP71时, 会产生抑制含H2O2的运输囊泡与膜的融合效应, 从而减少H2O2对植物细胞的毒害, 提高植物对非生物胁迫的耐受性[21-22]。本研究中发现GmSNARE蛋白与GmTIP1-1蛋白存在互作效应。那么, 我们可以推测GmSNARE通过与GmTIP1-1互作进而控制囊泡的运输与融合, 影响TIP蛋白的活性和状态。并且, AtVAMP71缺失植株的气孔关闭程度减小, 干旱胁迫下叶片失水速率提高, 使植物对干旱胁迫的耐受性降低。在干旱处理下GmSNARE在叶中表达量下降, 与GmTIP1-1在干旱处理下叶中的表达趋势相似, 所以GmSNARE对GmTIP1-1存在正向调控效应。
越来越多的研究发现, F-box基因在植物生长发育和响应非生物逆境胁迫过程中发挥重要作用[23]。相关研究表明, 过表达小麦TaFBA1基因的转基因烟草综合生长指标都高于野生型, 说明小麦TaFBA1基因能响应多种非生物胁迫[24-25]。拟南芥F-box基因MAX2能正调控植物的抗旱反应, 参与了植物对干旱及对ABA的反应[26]。研究发现, 与野生型相比, DOR拟南芥突变体中含有更高浓度的ABA, 并且拟南芥F-box基因DOR1在叶片保卫细胞中特异性表达。推测DOR1与拟南芥气孔关闭, 从而增加植株的抗旱性密切相关[27]。进一步分析发现, DOR1在依赖ABA和不依赖ABA两条通路上都起作用。这与本研究中在干旱处理下GmF-box基因上调诱导表达结果一致。因为GmF-box与GmTIP1-1存在互作关系, 所以我们可以推测GmF-box基因通过响应植物内部ABA信号来调节GmTIP1-1基因的表达水平进而保持植物自身的水分平衡, 提高对非生物胁迫的耐受性。
| [1] |
沈少杰, 吴玉香, 郑郁善. 植物干旱胁迫响应机制研究进展——从表型到分子[J]. 生物技术进展, 2017, 7(3): 169-176. Shen S J, Wu Y X, Zheng Y S. Review on drought response in plants from phenotype to molecular[J]. Current Biotechnology, 2017, 7(3): 169-176 (in Chinese with English abstract). |
| [2] |
Obroucheva N V, Sin'Kevich I A. Aquaporins and cell growth[J]. Russian Journal of Plant Physiology, 2010, 57(2): 153-165. DOI:10.1134/S1021443710020019 |
| [3] |
Johanson U, Karlsson M, Johansson I, et al. The complete set of genes encoding major intrinsic proteins in Arabidopsis provides a framework for a new nomenclature for major intrinsic proteins in plants[J]. Plant Physiology, 2001, 126(4): 1358-1369. DOI:10.1104/pp.126.4.1358 |
| [4] |
Aharon R, Shahak Y, Wininger S, et al. Overexpression of a plasma membrane aquaporin in transgenic tobacco improves plant vigor under favorable growth conditions but not under drought or salt stress[J]. The Plant Cell, 2003, 15(2): 439-447. DOI:10.1105/tpc.009225 |
| [5] |
Terashima I, Ono K. Effects of HgCl2 on CO2 dependence of leaf photosynthesis:evidence indicating involvement of aquaporins in CO2 diffusion across the plasma membrane[J]. Plant Cell Physiology, 2002, 43(1): 70-78. DOI:10.1093/pcp/pcf001 |
| [6] |
冉应龙.干旱胁迫对2个苹果砧木水分生理及AQPs表达水平的影响[D].兰州: 甘肃农业大学, 2017. Ran Y L. Effects of drought stress on water physiology and AQPs expression in two apple rootstocks[D]. Lanzhou: Gansu Agricultural University, 2017(in Chinese with English abstract). |
| [7] |
Sade N, Gebretsadik M, Seligmann R, et al. The role of tobacco aquaporin1 in improving water use efficiency, hydraulic conductivity, and yield production under salt stress[J]. Plant Physiology, 2010, 152(1): 245-254. DOI:10.1104/pp.109.145854 |
| [8] |
Pou A, Medrano H, Flexas J, et al. A putative role for TIP and PIP aquaporins in dynamics of leaf hydraulic and stomatal conductances in grapevine under water stress and re-watering[J]. Plant, Cell & Environment, 2013, 36(4): 828-843. |
| [9] |
Wang L L, Chen A P, Zhong N Q, et al. The thellungiella salsuginea tonoplast aquaporin TsTIP1;2 functions in protection against multiple abiotic stresses[J]. Plant Cell Physiology, 2014, 55(1): 148-161. DOI:10.1093/pcp/pct166 |
| [10] |
葛晓兰, 刘彩霞, 张鑫鑫, 等. 柽柳ThDUF106基因的植物表达载体构建及其功能验证[J]. 植物研究, 2018, 38(2): 260-267. Ge X L, Liu C X, Zhang X X, et al. Construction and functional verification of plant expression vector of Tamarix ThDUF106 gene[J]. Bulletin of Botanical Research, 2018, 38(2): 260-267 (in Chinese with English abstract). |
| [11] |
张春蕊.柽柳ThTIP基因抗逆功能研究及上游调控因子的鉴定[D].哈尔滨: 东北林业大学, 2017. Zhang C R. Functional charcaterization of the aabiotic stress and identification of up-stream regulation of ThTIP from Tamarix hispida[D]. Harbin: Northeast Forestry University, 2017(in Chinese with English abstract). |
| [12] |
Regon P, Panda P, Kshetrimayum E, et al. Genome-wide comparative analysis of tonoplast intrinsic protein(TIP)genes in plants[J]. Functional & Integrative Genomics, 2014, 14(4): 617-629. |
| [13] |
Punzo P, Ruggiero A, Possenti M, et al. The PP2A-interactor TIP41 modulates ABA responses in Arabidopsis thaliana[J]. The Plant Journal, 2018, 94(6): 991-1009. DOI:10.1111/tpj.13913 |
| [14] |
Zhang D Y, Tong J F, He X L, et al. A novel soybean intrinsic protein gene, GmTIP2;3, involved in responding to osmotic stress[J]. Frontiers in Plant Science, 2016, 6: 1237. |
| [15] |
Kizis D, Pages M. Maize DRE-binding proteins DBF1 and DBF2 are involved in rab17 regulation through the drought-responsive element in an ABA-dependent pathway[J]. The Plant Journal, 2002, 30(6): 679-689. DOI:10.1046/j.1365-313X.2002.01325.x |
| [16] |
Ruiz-Lozano J M, Porcel R, Azcon C, et al. Regulation by arbuscular mycorrhizae of the integrated physiological response to salinity in plants:new challenges in physiological and molecular studies[J]. Journal of Experimental Botany, 2012, 63(11): 4033-4044. DOI:10.1093/jxb/ers126 |
| [17] |
Maathuis F J M, Filatov V, Herzyk P, et al. Transcriptome analysis of root transporters reveals participation of multiple gene families in the response to cation stress[J]. The Plant Journal, 2003, 35(6): 675-692. DOI:10.1046/j.1365-313X.2003.01839.x |
| [18] |
Hose E, Steudle E, Hartung W. Abscisic acid and hydraulic conductivity of maize roots:a study using cell-and root-pressure probes[J]. Planta, 2000, 211(6): 874-882. DOI:10.1007/s004250000412 |
| [19] |
Sokolovski S, Hills A, Gay R A, et al. Functional interaction of the SNARE protein NtSyp121 in Ca2+ channel gating, Ca2+ transients and ABA signalling of stomatal guard cells[J]. Molecular Plant, 2008, 1(2): 347-358. DOI:10.1093/mp/ssm029 |
| [20] |
金红敏, 李立新. 拟南芥SNARE因子在膜泡运输中的功能[J]. 植物学报, 2010, 45(4): 479-491. Jin H M, Li L X. Role of Arabidopsis SNARE proteins in vesicle trafficking[J]. Chinese Bulletin of Botany, 2010, 45(4): 479-491 (in Chinese with English abstract). DOI:10.3969/j.issn.1674-3466.2010.04.012 |
| [21] |
Zhu J H, Gong Z Z, Zhang C Q, et al. OSM1/SYP61:a syntaxin protein in Arabidopsis controls abscisic acid-mediated and non-abscisic acid-mediated responses to abiotic stress[J]. The Plant Cell, 2002, 14(12): 3009-3028. DOI:10.1105/tpc.006981 |
| [22] |
Leshem Y, Melamed-Book N, Cagnac O, et al. Suppression of Arabidopsis vesicle-SNARE expression inhibited fusion of H2O2 containing vesicles with tonoplast and increased salt tolerance[J]. Proc Natl Acad Sci USA, 2006, 103(47): 18008-18013. DOI:10.1073/pnas.0604421103 |
| [23] |
Leshem Y, Golani Y, Kaye Y, et al. Reduced expression of the v-SNAREs AtVAMP71/AtVAMP7C gene family in Arabidopsis reduces drought tolerance by suppression of abscisic acid-dependent stomatal closure[J]. Journal of Experimental Botany, 2010, 61(10): 2615-2622. DOI:10.1093/jxb/erq099 |
| [24] |
Kong X Z, Zhou S M, Yin S H, et al. Stress-inducible expression of an F-box gene TaFBA1 from wheat enhanced the drought tolerance in transgenic tobacco plants without impacting growth and development[J]. Frontiers in Plant Science, 2016, 7: 1295. DOI:10.3389/fpls.2016.01295 |
| [25] |
Zhao Z X, Zhang G Q, Zhou S M, et al. The improvement of salt tolerance in transgenic tobacco by overexpression of wheat F-box gene TaFBA1[J]. Plant Science, 2017, 259: 71-85. DOI:10.1016/j.plantsci.2017.03.010 |
| [26] |
Zhou S M, Kong X Z, Kang H H, et al. The involvement of wheat F-box protein gene TaFBA1 in the oxidative stress tolerance of plants[J]. PLoS One, 2015, 10(4): e0122117. DOI:10.1371/journal.pone.0122117 |
| [27] |
Bu Q, Lv T, Shen H, et al. Regulation of drought tolerance by the F-box protein MAX2 in Arabidopsis[J]. Plant Physiology, 2014, 164(1): 424-439. DOI:10.1104/pp.113.226837 |




