文章信息
- 杨治河, 邹彦, 曹言, 陈芳慧, 李友余, 陈婧, 王校怡
- YANG Zhihe, ZOU Yan, CAO Yan, CHEN Fanghui, LI Youyu, CHEN Jing, WANG Xiaoyi
- 铅胁迫对小鼠精子发生和精子活力的影响及机制
- Lead stress on spermatogenesis and sperm motility in mice impact and mechanism
- 南京农业大学学报, 2019, 42(4): 752-758
- Journal of Nanjing Agricultural University, 2019, 42(4): 752-758.
- http://dx.doi.org/10.7685/jnau.201903070
-
文章历史
- 收稿日期: 2019-03-29
2. 南京农业大学动物科技学院, 江苏 南京 210095
2. College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China
铅污染是发达国家和发展中国家的重大公共卫生问题, 并以各种形式影响着动物及人类的健康, 无论是急性还是慢性铅胁迫都可引起人体多系统损害, 尤其是生殖毒性[1-2]。不育是威胁人类生殖健康的全球性难题, 男性不育患者呈逐年上升趋势。其中, 精子质量下降是男性不育的最主要原因之一。流行病学调查研究和试验研究都表明, 铅胁迫会影响精子质量[3-4], 但其影响精子质量的机制尚不明确。近年来, 随着计算机辅助精子分析系统的应用, 发现精子形态与精子的运动学和活力有关[5]。本研究选择9个与精原细胞增殖、精母细胞减数分裂和精子形成3个阶段有关的基因, 检测其表达, 测定精子运动学参数和精子活力参数, 试图从分子水平探讨铅影响精子发生及精子活力的分子机制。
1 材料与方法 1.1 试验动物分组选用12周龄、成年雄性昆明小鼠12只(由南京农业大学实验动物中心提供), 体质量为(22±3)g, 随机分为1个处理组和1个对照组, 每组6个重复。正常饲养, 适应1周后开始试验。
1.2 主要仪器及试剂荧光定量PCR仪(Real-Time PCR System)由新加坡生产; 穗加精液分析(SSA)自动检测系统(北京穗加软件公司); Macro红宝石精子计数板(南京宇宬光学有限公司生产); RNA提取试剂Trizol Reagent(15596-026)购自Invitrogen公司; 反转录试剂M-MLV反转录酶(M1705)和Ribonuclease Inhibitor(N2112S)购自Promega公司; DEPC(D5758)、Oligo dT(O4387)购自Sigma公司; qPCR相关试剂miRNA 1st Strand cDNA Synthesis Kit(by stem-loop)(MR101-01)购自宝生物工程(大连)有限公司; M199培养液购于HyClone公司; 醋酸铅(Pb(CH3 COO)2·3H2O)溶液, 天津市凯通化学试剂有限公司生产。
1.3 铅胁迫试验小鼠模型建立处理组每48 h按体质量腹腔注射60 mg·kg-1醋酸铅溶液, 对照组小鼠每48 h注射等体积的灭菌生理盐水。重复注射5次。试验期间, 认真观察小鼠的饮欲、食欲及精神状态。
1.4 涂片观察铅胁迫对精液品质的影响于第5次注射后48 h, 以颈部脱臼法处死小鼠。剪开腹壁, 暴露生殖系统, 摘取左侧睾丸和附睾, 备用。摘取右侧附睾, 制备精液涂片, 每个样本制备2张精液涂片。1张用负相差显微镜观察精子运动并拍照, 另1张用姬姆萨染色后在光镜下观察精子形态并拍照。
1.5 铅胁迫下精子运动学参数和活力参数的测定小鼠处理如1.4节, 摘取左侧睾丸和附睾, 在含有37 ℃预热的生理盐水表面皿中清洗, 迅速放入1 mL 37 ℃温育的M199培养液中, 剪开附睾尾, 置入37 ℃培养箱, 孵育3 min, 使精子游出, 得精子悬液。取出睾丸及附睾, 备用。按照文献[6]的方法测定, 取10 μL精子悬液滴于Macro红宝石精子计数板的计数池后, 盖上圆盖板, 依靠盖板的重力使精子悬液分散成一层10 μm的液柱。将计数板放在负相差显微镜载物台上, 结合SSA自动检测系统[7]镜下观察, 对照组和处理组每份样品扫描10个视野, SSA自动统计精子曲线运动速度、直线运动速度、平均路径速度、精子头侧摆幅度、鞭打频率、平均角位移、直线性、前向性、摆动性等精子运动学的各项参数; 此外, SSA还可以自动统计精子活力参数, 包括前向运动、非前向运动和不活动精子的浓度和比例。
1.6 睾丸和生精相关基因的RT-qPCR检测取睾丸组织, 提取RNA, 检验RNA纯度, 纯度达标后进行反转录生成cDNA, 使用荧光定量PCR仪检测Oct4、DAZ1、SCP3、Tsc21、ACR、Acrv1、cyclinA1、SPATA46和LDH-C4等与睾丸组织代谢和生精过程密切相关的基因表达水平。以上操作均按试剂盒说明书进行。
1.7 睾丸组织的切片观察睾丸常规石蜡包埋切片(3~4 μm), HE染色, 光镜观察对照组和处理组睾丸组织形态并拍照, 分别计数睾丸横切面上的生精小管数; 分别随机观察对照组和处理组8个生精小管, 计数生精细胞数。
1.8 数据处理与统计分析用Excel 2010进行数据的整理和统计, 数据用平均数±标准差(x±SD)表示, 采用Graphpad生物统计软件对试验数据进行方差分析和差异显著性检验。
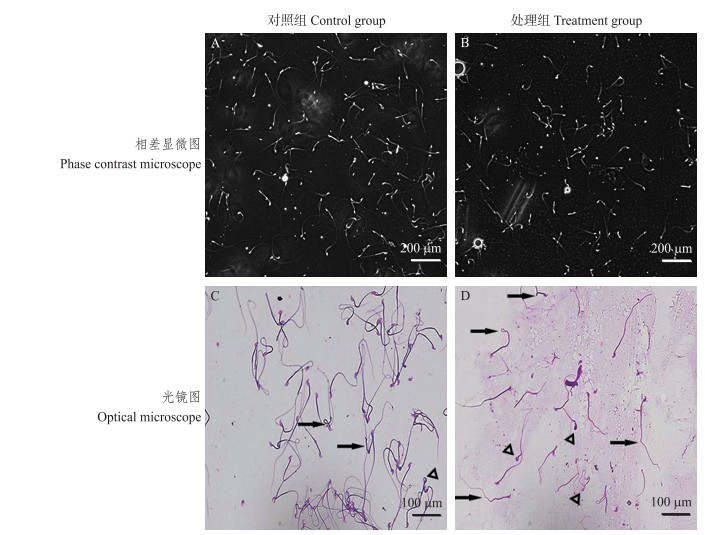
2 结果与分析 2.1 涂片观察铅胁迫对小鼠精液品质的影响 2.1.1 相差显微镜观察精液涂片后用相差显微镜观察, 发现与对照组相比, 铅胁迫处理组小鼠活动精子的比例低于50%, 说明精子活力明显下降(图 1-A、-B)。
|
图 1 涂片观察铅(60 mg·kg-1)胁迫对小鼠精液品质的影响 Fig. 1 Effect of lead (60 mg·kg-1) stress on semen quality in mice by smear ↑表示颈部、尾部弯曲↑indicate curved neck and tail; △表示头部异常△indicate abnormal head. |
精液经涂片、姬姆萨染色后, 用普通光镜观察。与对照组相比, 铅胁迫处理组小鼠精子发生不同程度的头部、颈部、尾部等畸形, 出现梨形头、头部空泡化等现象; 精子尾部发生弯曲甚至卷曲。精子形态普遍异常, 提示精子质量明显下降(图 1-C、-D)。
2.2 铅胁迫对小鼠精子运动学参数和精子活力参数的影响 2.2.1 对小鼠精子活力参数的影响由表 1可见:处理组小鼠前向运动和非前向运动的精子浓度和比例极显著低于对照组(P < 0.001), 而不活动的精子浓度和比例极显著高于对照组(P < 0.001)。精子活动率为前向运动和非前向运动的精子之和, 其比例极显著低于对照组(P < 0.001), 说明精子活力极度低下。
| 分组 Group |
前向运动(a+b级)精子 Forward movement sperm |
非前向运动(c级)精子 Non-forward movement sperm |
不活动(d级)精子 Inactive sperm |
精子活动率 (a+b+c级)/% Sperm activity rate |
|||||
| 浓度/(106 mL-1) Concentration |
比例/% Percentage |
浓度/(106 mL-1) Concentration |
比例/% Percentage |
浓度/(106 mL-1) Concentration |
比例/% Percentage |
||||
| 对照组 Control group |
7.48±1.36 | 54.47±5.85 | 0.62±0.19 | 4.45±0.80 | 5.72±1.55 | 41.07±6.05 | 58.92±6.07 | ||
| 处理组 Treatment group |
1.61±0.29*** | 27.24±2.93*** | 0.13±0.04*** | 2.13±0.40*** | 4.09±1.16*** | 70.89±3.00*** | 29.36±3.04*** | ||
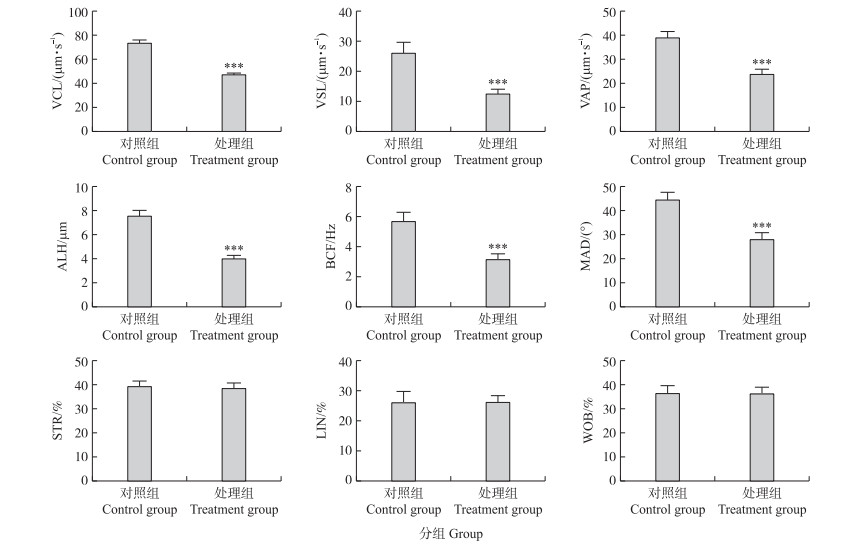
由图 2可见:与对照组相比, 铅胁迫处理组小鼠精子运动速度参数(VCL、VSL、VAP)和精子空间位移程度参数(ALH、BCF、MAD)均极显著降低(P < 0.001), 而精子运动方式参数(LIN、STR、WOB)变化不大(P > 0.05)。
|
图 2 铅胁迫对小鼠精子运动学参数的影响
Fig. 2 Effects of lead stress on sperm kinesiology parameters in mice
*, **, ** *表示与对照组比较差异显著(P < 0.05)、差异极显著(P < 0.01, P < 0.001)。下同。 VCL:曲线速度Curvilinear velocity; VSL:直线速度Straight-line velocity; VAP:平均路径速度Average path velocity; ALH:精子头侧摆幅度Amplitude of lateral head displacement; BCF:鞭打频率Beat-cross frequency; MAD:平均角位移Mean angular displacement; STR:前向性Straightness; LIN:直线性Linearity; WOB:摆动性Wobble. *, **, ** *mean significant difference at 0.05, 0.01, 0.001 levels compared with normal control group. The same as follows. |
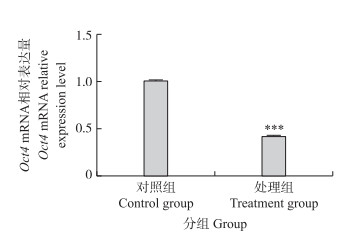
RT-qPCR检测结果表明, 铅胁迫处理组小鼠的精原细胞增殖相关基因Oct4 mRNA表达水平极显著低于对照组(P < 0.001)(图 3)。
|
图 3 铅胁迫对精原细胞增殖相关基因Oct4 mRNA表达的影响 Fig. 3 Effects of lead stress on the expression of proliferation-related gene Oct4 mRNA in spermatogonia |
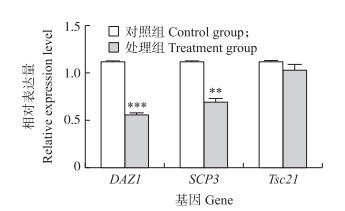
由图 4可知:与对照组相比, 铅胁迫处理组小鼠DAZ1 mRNA表达水平极显著下降(P < 0.001), SCP3 mRNA表达水平极显著下降(P < 0.01), 而Tsc21 mRNA表达水平无显著差异(P > 0.05)。
|
图 4 铅胁迫对精母细胞减数分裂相关基因mRNA表达的影响 Fig. 4 Effects of lead stress on the expression of meiotic related genes mRNA in spermatocytes |
由图 5可知:与对照组相比, 铅胁迫处理组小鼠精子形成相关基因ACR、Acrv1 mRNA表达水平极显著下降(P < 0.01), cyclinA1、SPATA46 mRNA表达水平显著下降(P < 0.05), 而LDH-C4 mRNA表达水平无显著差异(P > 0.05)。
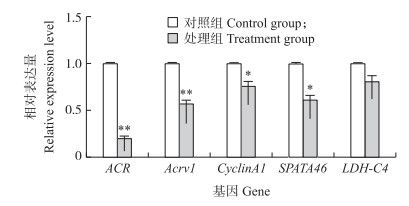
|
图 5 铅胁迫对精子形成相关基因mRNA表达的影响 Fig. 5 Effects of lead stress on the expression of genes mRNA involved in spermatogenesis |
从图 6可见:与对照组相比, 处理组小鼠生精小管数和生精细胞数均明显减少, 部分生精细胞坏死, 并在生精细胞坏死集中区域支持细胞(sertoli cell)增多, 未见成熟精子。睾丸间质明显疏松水肿, 间质内以中性粒细胞为主的炎性浸润, 睾丸间质细胞数明显减少。

|
图 6 铅对小鼠睾丸组织形态的影响(HE染色) Fig. 6 Effects of lead on testicular histomorphology of mice by HE staining A、B、C为对照组低、中、高倍; D、E、F为处理组低、中、高倍。△示生精小管; ↑示睾丸间质。 A, B, C as the control group low, medium and high times; D, E, F as the treatment group low, medium and high times. △indicating seminal tubule; ↑indicating testicular stroma. |
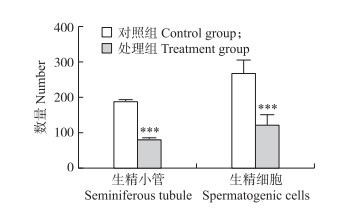
|
图 7 铅对小鼠睾丸生精小管数和生精细胞数量的影响 Fig. 7 Effect of lead on the number of seminiferous tubules and spermatogenic cells in mouse testis |
计数睾丸横切面上生精小管数后, 再分别随机观察对照组和处理组8个生精小管, 计数生精细胞数, 发现处理组生精小管数和生精细胞数均极显著减少(P < 0.001)。
3 讨论 3.1 铅胁迫对睾丸间质细胞的损伤精子发生是在下丘脑、垂体、睾丸所分泌激素的精密调节下进行的。睾丸间质细胞在黄体生成素作用下分泌雄激素, 雄激素可启动和维持精子发生。血睾屏障(blood-testis barrier, BTB)结构与功能对维持精子发生具有至关重要的作用, 为生殖细胞分裂增殖及精子生成创造特殊稳定的微环境。支持细胞合成和分泌的雄激素结合蛋白(androgen-binding-protein, ABP)与雄激素结合, 以保持生精小管内有较高的雄激素水平, 促进精子发生。支持细胞具有强大的吞噬功能, 可以吞噬变性坏死的生精细胞和精子细胞脱落的残余胞质以及细小的异物颗粒。本试验结果表明:处理组小鼠睾丸间质明显疏松水肿, 间质内以中性粒细胞为主的炎性浸润, 睾丸间质细胞数量明显减少。而在生精小管内, 生精细胞变性坏死集中的区域支持细胞增多。马文领等[8]也发现铅可以使小鼠睾丸间质细胞减少, 雄激素分泌减少, 导致精子产生减少。由此可见, 铅引起的睾丸损伤, 可致睾丸间质细胞损伤和生精障碍。
3.2 铅胁迫对生精作用的影响精子发生经历精原细胞增殖、精母细胞减数分裂和精子形成3个阶段, 本试验结果表明铅胁迫影响精子发生的上述3个阶段。
在鼠和人体内, Oct4基因主要表达于胚胎干细胞及生殖干细胞中。哺乳动物在胚胎发育过程中受多种基因的严密调控, 以保证其有序进行组织分化和个体发育, Oct4基因就是其中一个关键基因。Oct4基因是形成多能干细胞唯一不可缺的基因[9]。本试验表明, 铅极显著降低小鼠Oct4 mRNA的表达水平, 影响小鼠精原干细胞的增殖, 致精子发生障碍, 精子数显著减少, 这是铅影响精子数量的主要原因之一。
控制精子生成的基因或基因簇被称为无精子因子(azoospermia factors, AZF), DAZ基因是主要的AZF基因。人的DAZ1基因定位于Y染色体长臂(Yq11)上, 是Y染色体无精子因子基因, 它主要表达在精母细胞阶段, 其突变或缺失可造成男性精子发生异常, 出现男性不育[10]。Vogt等[11]将Y染色体长臂上主导精子形成的区域分为AZFa、AZFb和AZFc区。其中, AZFa主导精母细胞的增殖; AZFb(DAZsY134)缺失, 导致生殖细胞成熟停滞; AZFc区(DAZsY254)基因缺陷可造成无精子症, 也可造成极度少精症。本试验表明, 铅胁迫极显著降低DAZ1 mRNA表达水平, 影响精母细胞的增殖和生殖细胞的成熟, 致精子数显著减少, 生殖细胞成熟停滞, 精子发生障碍。这是铅影响精子数量的另一原因, 也是铅影响生殖细胞成熟的原因。
联会复合体蛋白3(synaptonemal complex protein 3, SCP3)是减数分裂的特征性结构蛋白。Yuan等[12]发现, 缺乏SCP3的雄性小鼠精母细胞的染色体不发生联会。本试验表明, 铅胁迫致小鼠SCP3 mRNA表达水平显著降低。表明铅胁迫可干扰减数分裂期间同源染色体配对和重组, 影响精母细胞的减数分裂, 致精子数显著减少, 精子发生障碍。这是铅影响精子数量的另一原因。周永翠等[13]研究证实, 睾丸特异性蛋白(Tsc21)主要分布于人睾丸组织的精母细胞和圆形精子细胞中, 其在生精阻滞的无精症患者中表达减少, 表明Tsc21蛋白的表达减少与无精子症患者的生精障碍有一定的关系。本试验表明, 铅胁迫对小鼠Tsc21 mRNA表达水平没有显著影响, 说明铅胁迫损伤睾丸与抑制Tsc21蛋白的表达无直接关联。
Acrv1是一种精子顶体蛋白, 主要定位于成熟小鼠睾丸组织的圆形精子和长形精子细胞[14]。本试验表明, 铅胁迫致小鼠Acrv1 mRNA的表达水平显著降低。说明铅胁迫可能干扰了精子顶体蛋白的形成。
细胞周期蛋白A(cyclin A)有两种, 即A1和A2。Sweeney等[15]发现, cyclin A1在精子细胞晚期的mRNA表达水平显著升高, 减数分裂完成后不久就消失, 说明其表达受细胞周期调控。本试验表明, 铅胁迫影响小鼠cyclinA1 mRNA的表达。说明铅胁迫影响小鼠精子的细胞周期调控, 致精子发生障碍。SPATA46缺失导致精子头部形状异常和精子与卵子融合失败, 是导致雄性不育的原因。Chen等[16]发现, SPATA46高度特异性表达定位于顶体下区域核膜中的跨膜区, 蛋白质位于核膜上蛋白质的N端。在亚细胞水平, SPATA46缺陷, 显示精子结构缺陷, 包括核膜不连续和核内空腔, 核形状异常。SPATA46是一种新蛋白, 参与精子头部重塑和精子与卵子融合。本试验表明, 铅胁迫致小鼠SPATA46 mRNA表达显著下降, 这是铅引起畸形精子数增加的主要原因之一。
3.3 铅胁迫对精子运动参数及精子活力的影响SSA分析结果表明:铅胁迫使小鼠精子的运动速度和空间位移程度极显著下降, 而对精子的运动方式影响不大。前向运动和非前向运动精子的浓度、比例和精子活动率极显著下降, 而不活动的精子浓度和比例极高, 表明精子活力极度低下。从精液涂片可见, 铅胁迫下小鼠精子发生不同程度的头部、颈部、尾部等畸形。而这种混合型畸形可能是影响精子运动能力的主要原因之一[5]。
综上所述, 铅胁迫可引起睾丸间质细胞损伤和生精障碍。铅可能通过下调Oct4、DAZ1、SCP3和SPATA46基因的表达, 使精子数量减少, 精子成熟停滞, 畸形精子增加和精子活力下降。
| [1] |
赵剑, 童希琼, 蔡亚非. 铅对小鼠血液和肝肾影响的实验性初步观察[J]. 生物学杂志, 2010, 27(1): 17-19, 38. Zhao J, Tong X Q, Cai Y F. The preliminary researches on the toxic effects of Pb on mouse blood liver and kidney[J]. Journal of Biology, 2010, 27(1): 17-19, 38 (in Chinese with English abstract). DOI:10.3969/j.issn.1008-9632.2010.01.017 |
| [2] |
Mitra P, Sharma S, Purohit P, et al. Clinical and molecular aspects of lead toxicity:an update[J]. Crit Rev Clin Lab Sci, 2017, 54(7/8): 506-528. |
| [3] |
高亚萍, 陈拽生, 邵岚, 等. 男性不育患者血清和精浆中铅、超氧化物歧化酶和丙二醛含量的研究[J]. 中国医药导报, 2011, 8(35): 95-97. Gao Y P, Chen Z S, Shao L, et al. Study on lead, superoxide dismutase and malondialdehyde contents in serum and seminal plasma of patients with male infertility[J]. Medical Examination, 2011, 8(35): 95-97 (in Chinese with English abstract). DOI:10.3969/j.issn.1673-7210.2011.35.041 |
| [4] |
Wijesekara G U S, Fernando D M S, Wijerathna S, et al. Environmental and occupational exposures as a cause of male infertility[J]. Ceylon Medical Journal, 2015, 60(2): 52. DOI:10.4038/cmj.v60i2.7090 |
| [5] |
毛献宝, 薛林涛, 何冰, 等. 精子形态与精子动力学参数的相关性分析[J]. 中国临床新医学, 2016, 9(5): 379-383. Mao X B, Xue L T, He B, et al. Relationship between sperm motility parameters and sperm morphology[J]. Chinese Journal of New Clinical Medicine, 2016, 9(5): 379-383 (in Chinese with English abstract). DOI:10.3969/j.issn.1674-3806.2016.05.04 |
| [6] |
WHO.人类精液检查及处理实验室手册[M]. 5版.谷翊群, 陈振文, 卢文红, 等, 译.北京: 人民卫生出版社, 2011: 117-118. WHO. Laboratory Manual for the Examination and Processing of Human Semen[M]. 5th ed. Gu Y Q, Chen Z W, Lu W H, et al, Translations. Beijing: People's Medical Publishing House, 2011: 117-118(in Chinese). |
| [7] |
苏晓慧, 孙明琪, 张梅洁, 等. 穗加精液分析自动检测系统与血细胞计数板人工计数法在小鼠精液分析中的应用[J]. 山东大学学报(医学版), 2018, 56(6): 1-5. Su X H, Sun M Q, Zhang M J, et al. Application of Suiplus semen analysis automatic detection system and manual counting using hemocytometer in mouse semen analysis[J]. Journal of Shandong University(Medical Edition), 2018, 56(6): 1-5 (in Chinese with English abstract). |
| [8] |
马文领, 张峰, 刘卫, 等. 雷公滕及铅、镉对小鼠睾丸间质细胞一氧化氮合酶活性的影响[J]. 解剖学报, 2000(2): 183-185, 212. Ma W L, Zhang F, Liu W, et al. Effects of tripterygium wilfordiif, lead and cadmium on NOS activity of mice testis in terstitial cells[J]. Acta Anatomica Sinica, 2000(2): 183-185, 212 (in Chinese with English abstract). DOI:10.3321/j.issn:0529-1356.2000.02.023 |
| [9] |
郑鹏生, 曹浩哲. Oct4基因的研究进展[J]. 西安交通大学学报(医学版), 2010, 31(5): 521-526. Zheng P S, Cao H Z. Advances of Oct4 gene research[J]. Journal of Xi'an Jiaotong University(Medical Sciences), 2010, 31(5): 521-526 (in Chinese with English abstract). |
| [10] |
王卫国. DAZ1、DAZ2基因原位表达研究[C]//中华医学会男科学分会.中华医学会第八次全国男科学学术会议论文集.广州, 2007. Wang W G. In situ expression of DAZ1 and DAZ2 genes[C]//Chinese Medical Association Men's Science Branch. Proceedings of the 8th National Conference of Men's Sciences of China Medical Association. Guangzhou, 2007(in Chinese). |
| [11] |
Vogt P H, Edelmann A, Kirsch S, et al. Human Y chromosome azoospermia factors (AZF) mapped to different subregions in Yq11[J]. Human Molecular Genetics, 1996, 5(7): 933-943. DOI:10.1093/hmg/5.7.933 |
| [12] |
Yuan L, Liu J G, Zhao J, et al. The murine SCP3 gene is required for synaptonemal complex assembly, chromosome synapsis, and male fertility[J]. Molecular Cell, 2000, 5(1): 73-83. DOI:10.1016/S1097-2765(00)80404-9 |
| [13] |
周永翠, 刁瑞英, 颜秋霞, 等. 人睾丸特异性基因蛋白抗体制备及其在无精症睾丸组织中的表达[J]. 检验医学与临床, 2012, 9(13): 1537-1538, 1540. Zhou Y C, Diao R Y, Yan Q X, et al. Preparation of the antibody against human TSC21 protein and its expression characteristics in testis form patients with azoospermia[J]. Laboratory Medicine and Clinic, 2012, 9(13): 1537-1538, 1540 (in Chinese with English abstract). DOI:10.3969/j.issn.1672-9455.2012.13.001 |
| [14] |
颜秋霞, 唐爱发, 葛颂, 等. 精子顶体小泡蛋白-1(ACRV1)在小鼠睾丸组织中的表达与定位[J]. 生殖与避孕, 2011, 31(9): 582-586. Yan Q X, Tang A F, Ge S, et al. Expression and localization of acrosomal vesicle protein-1(ACRV1)in mouse testis[J]. Reproduction and Contraception, 2011, 31(9): 582-586 (in Chinese with English abstract). |
| [15] |
Sweeney C, Murphy M, Kubelka M, et al. A distinct cyclin A is expressed in germ cells in the mouse[J]. Development, 1996, 122(1): 53-64. |
| [16] |
Chen J, Gu Y, Zhang Z, et al. Deficiency of SPATA46, a novel nuclear membrane protein, causes subfertility in male mice[J]. Biol Reprod, 2016, 95(3): 58-78. DOI:10.1095/biolreprod.116.140996 |



