文章信息
- 萧晟, 刘丹丹, 甘芳, 黄克和
- XIAO Sheng, LIU Dandan, GAN Fang, HUANG Kehe
- 脱氧雪腐镰刀菌烯醇对IPEC-J2细胞增殖、凋亡和屏障功能的影响及其自噬机制
- Effects of deoxynivalenol on the proliferation, apoptosis and barrier function of IPEC-J2 cells and its autophagy mechanisms
- 南京农业大学学报, 2019, 42(4): 746-751
- Journal of Nanjing Agricultural University, 2019, 42(4): 746-751.
- http://dx.doi.org/10.7685/jnau.201901044
-
文章历史
- 收稿日期: 2019-01-26
2. 南京农业大学动物医学院, 江苏 南京 210095
2. College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China
脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON), 又名呕吐毒素, 是一种主要由禾谷镰刀菌和大镰刀菌产生的单端孢属真菌毒素, 对动物和人具有神经毒性、肠毒性及免疫毒性等多种毒性作用[1-2]。已有研究报道, DON可以破坏肠道黏膜结构和影响消化吸收功能, 导致畜禽生长受阻, 给养殖行业带来巨大的经济损失[3-4]。肠道黏膜上皮屏障在调节侵入物的免疫应答中起重要作用[5-6]。细胞自噬(autophagy)是一种维持细胞内环境稳态的自我保护机制[7-8], 在维持内环境稳态以及调节机体衰老、自身免疫系统清除病原菌等生理过程中发挥重要作用[9-10]。已有研究表明, 细胞自噬在肠道黏膜屏障中发挥一定的作用[11], 自噬基因的上调可以缓解肠上皮坏死[12], 但未见DON与细胞自噬、细胞跨膜电阻以及紧密连接蛋白Occludin表达相关的报道。
猪对DON较敏感[13], 因其消化和免疫系统与人类相似而成为DON的经典研究模型[14-15]。因此, 本试验选用猪空肠上皮细胞(piglet jejunal epithelial cells, IPEC-J2)作为对象, 研究DON对肠道细胞增殖、凋亡和屏障功能的影响及其相关机制, 为动物霉菌毒素中毒的防控提供新思路。
1 材料与方法 1.1 试验材料 1.1.1 主要试剂仔猪空肠上皮细胞(IPEC-J2)购自舜冉(上海)生物试剂有限公司; DON标准品(纯度大于99.0%)、噻唑蓝(MTT)、二甲亚枫(DMSO)、雷帕霉素(Rapa)和LC3抗体购自Sigma公司; DMEM/F12培养基、胎牛血清(FBS)和胰蛋白酶购自Gibco公司; Hoechst 33258染色液购自碧云天生物技术公司; Occludin抗体、Cleaved-Caspase3抗体、β-actin抗体和免疫球蛋白IgG二抗购自CST公司。
1.1.2 主要仪器CO2恒温培养箱、酶标仪和台式高速离心机购自Thermo公司; 共聚焦显微镜购自Zeiss公司; PowerPac Basic型蛋白电泳仪、转膜仪和ChemiDoc XRS+型蛋白免疫印迹化学发光成像系统购自Bio-Rad公司。
1.2 试验方法 1.2.1 MTT法检测DON对IPEC-J2细胞增殖的影响用DMEM/F12培养基(含体积分数为10%的FBS和1%的青链霉素)在37 ℃和5% CO2的条件下常规培养IPEC-J2细胞。将生长状态良好的IPEC-J2细胞接种于96孔板内, 每孔2×104个, 培养24 h后换成不同浓度(0、0.5、1、2、4、8和16 μmol·L-1)的DON工作液。继续培养24 h后于各孔分别加入15 μL MTT(5 g·L-1), 37 ℃作用4 h; 弃上清液后各孔分别加入150 μL DMSO, 于酶标仪读取细胞吸光值(A490), 以不添加DON的细胞作为空白对照, 比较不同浓度DON对IPEC-J2细胞增殖的影响。试验重复3次。
1.2.2 Hoechst 33258染色法检测DON对IPEC-J2细胞凋亡的影响将生长状态良好的IPEC-J2细胞接种于6孔板内, 每孔3×105个, 培养24 h后换成不同浓度(0、2、4和8 μmol·L-1)的DON工作液。继续培养24 h后, PBS洗3次, 4%(体积分数)多聚甲醛4 ℃固定20 min; PBS洗3次, 加200 μL Hoechst 33258(5 g·L-1)于25 ℃孵育5 min; PBS洗3次后于荧光显微镜下观察细胞凋亡情况。
1.2.3 细胞电阻仪检测DON对IPEC-J2细胞跨膜电阻(TEER)的影响将生长状态良好的IPEC-J2细胞接种于transwell 12孔板中, 每孔6×104个, 培养6 d后换成0, 2, 4和8 μmol·L-1的DON工作液。继续培养24 h后由Millipore-ERS上皮细胞电阻仪检测TEER值。
1.2.4 IFA检测DON对IPEC-J2细胞内紧密连接蛋白的分布和表达的影响将生长状态良好的IPEC-J2细胞接种于加有0.2 nm玻片的12孔板内, 每孔6×104个, 培养24 h后换成不同浓度的DON工作液。继续培养24 h后PBS洗3次, 4%(体积分数)多聚甲醛4 ℃固定20 min; PBS洗3次后加0.2%(体积分数)Triton X-100 25 ℃孵育15 min; PBS洗3次, 室温下加50 g ·L-1 BSA封闭2 h; 加入相应一抗于4 ℃孵育过夜; PBS洗3次, 室温下加荧光二抗孵育1 h; PBS洗3次后, 于荧光显微镜下观察紧密连接蛋白的分布和表达情况。
1.2.5 Western blot检测DON对IPEC-J2细胞紧密连接蛋白和自噬相关蛋白表达的影响将生长状态良好的IPEC-J2细胞接种于6孔细胞培养板内, 每孔3×105个, 培养24 h; 换成不同浓度的DON工作液, 继续培养24 h; 收集细胞, 提取细胞总蛋白并用BCA试剂盒测定蛋白浓度; 蛋白变性后进行SDS-PAGE电泳; 采用半干转膜仪转膜; 室温下加50 g ·L-1 BSA或50 g ·L-1脱脂奶粉封闭2 h, 加入一抗4 ℃孵育过夜; TBST洗3次, 加二抗室温下孵育1 h; TBST洗3次, ECL显影成像。
1.2.6 自噬激活剂Rapa对DON引起的肠毒性的影响用4 μmol·L-1 DON处理IPEC-J2细胞12 h后, 加自噬激活剂Rapa(5 μmol·L-1)继续培养12 h, 收样。用Western blot、MTT和细胞电阻仪分别检测LC3-Ⅱ、Atg5、Cleaved-Caspase3和Occludin蛋白表达、细胞增殖和TEER值。
1.3 数据处理与分析试验数据均以平均值±标准差(x±SD)表示, 采用SPSS 17.0统计软件进行单因素方差分析(one-way ANOVA)。运用GraphPad Prism 7.0数据软件绘制柱状图。
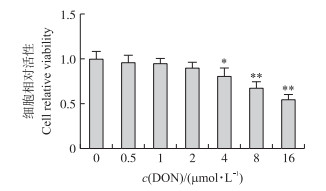
2 结果与分析 2.1 不同浓度DON对IPEC-J2细胞增殖的影响由图 1可见:与对照组比较, 0.5、1和2 μmol·L-1 DON对IPEC-J2细胞的相对活性无显著影响(P > 0.05), 4、8和16 μmol·L-1 DON可显著抑制IPEC-J2细胞的相对活性(P < 0.05或P < 0.01)。表明DON可抑制IPEC-J2细胞的增殖。
|
图 1 不同浓度DON对IPEC-J2细胞活性的影响 Fig. 1 Effects of various concentrations of DON on the viability of IPEC-J2 cells 与不添加DON的细胞对照组相比, *P < 0.05, **P < 0.01。下同。 Compared with control(cells without DON treatment), *P < 0.05, **P < 0.01. The same as follows. |
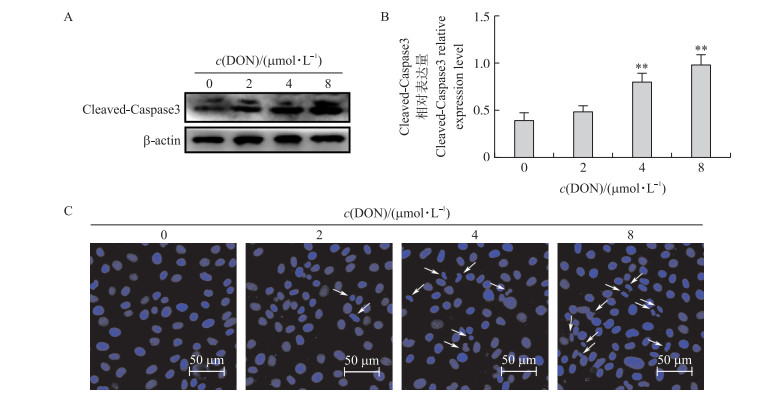
由图 2可见:与对照组比较, 4和8 μmol·L-1DON可诱发细胞凋亡, 表现在细胞中凋亡标志性蛋白Cleaved-Caspase3表达极显著增加(P < 0.01), 细胞核发生固缩或断裂及核内凋亡小体数量增多, 表明DON可引起IPEC-J2细胞发生凋亡。
|
图 2 不同浓度DON对IPEC-J2细胞凋亡的影响 Fig. 2 Effects of various concentrations of DON on apoptosis of IPEC-J2 cells A、B.凋亡相关蛋白表达的Western blot分析; C.细胞凋亡形态的Hoechst 33258染色法测定。白色箭头表示凋亡的细胞核, 表现为细胞核内出现凋亡小体、细胞核发生固缩或断裂。 A, B. Western blot analysis of apoptosis-related protein expressions; C. The assays of Hoechst 33258 for cells apoptosis morphology. The white arrows indicate the apoptotic nucleus with apoptotic corpuscles, pyknosis, or nuclear frag mentation. |
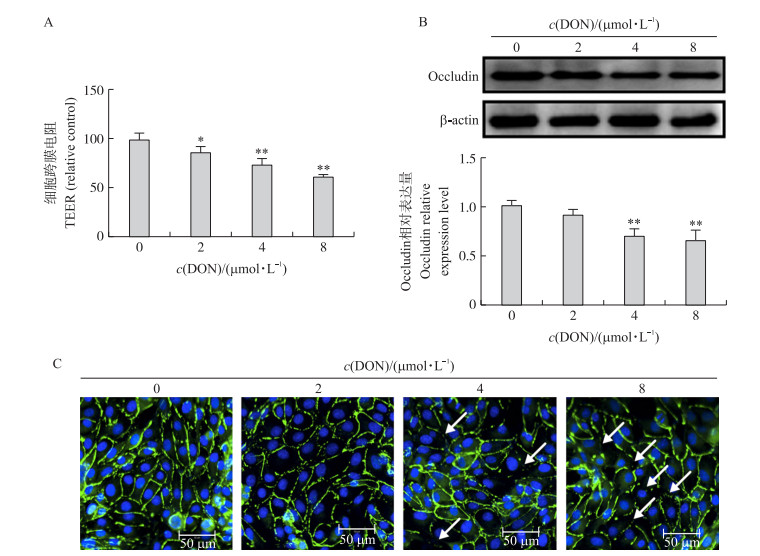
由图 3可见:与对照组比较, 2、4和8 μmol·L-1 DON显著降低IPEC-J2细胞跨膜电阻(TEER)值(P < 0.05或P < 0.01);4和8 μmol·L-1 DON极显著降低IPEC-J2细胞中紧密连接蛋白Occludin的表达(P < 0.01)。表明DON可导致IPEC-J2细胞屏障障碍。
|
图 3 不同浓度DON对IPEC-J2细胞屏障功能的影响 Fig. 3 Effects of various concentrations of DON on barrier function of IPEC-J2 cells A.细胞跨膜电阻值; B.紧密连接蛋白Occludin相对表达量的Western blot分析; C. Occludin在IPEC-J2细胞分布定位的IFA检测。蓝色荧光表示细胞核; 绿色荧光表示Occludin; 白色箭头表示屏障障碍, 表现为紧密连接蛋白的断裂。 A. Cell transmembrance resistance(TEER); B. The Western blot analysis of tight junction protein Occludin expressions; C. IFA detection of Occludin localization in IPEC-J2 cells. The nucleuses were indicated by the blue fluorescence, the expression and distribution of Occludin were indicated by the green fluorescence. The barrier dysfunction was identified by the break of the tight junction protein Occludin(white arrows). |
由图 4可见:与对照组比较, 4和8 μmol·L-1 DON极显著降低IPEC-J2细胞中自噬相关蛋白LC3-Ⅱ和Atg5的表达(P < 0.01)。表明DON抑制了IPEC-J2细胞自噬。

|
图 4 不同浓度DON对IPEC-J2细胞自噬相关蛋白表达影响的Western blot检测 Fig. 4 Western blot analysis of the effects of different concentrations of DON on the expression of autophagy related proteins in IPEC-J2 cells |
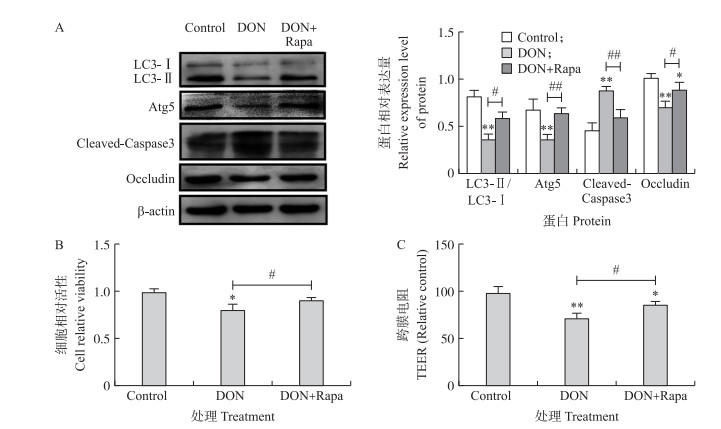
由图 5可见:与4 μmol·L-1 DON处理组比较, 自噬激活剂雷帕霉素(Rapa)可显著增加IPEC-J2细胞中的自噬相关蛋白LC3-Ⅱ和Atg5的表达(P < 0.05)。Rapa的添加缓解了由DON引起的IPEC-J2细胞毒性、凋亡和屏障功能障碍, 表现在DON引起的IPEC-J2细胞增殖抑制、凋亡相关蛋白Clealved-Caspase3表达增加、紧密连接蛋白Occludin表达增加以及细胞跨膜电阻的增加被显著逆转(P < 0.05), 表明DON可以通过下调细胞自噬水平引发肠毒性。
|
图 5 自噬激活剂Rapa对4 μmol·L-1 DON引起的细胞毒性、凋亡和屏障功能障碍的影响 Fig. 5 Effects of autophagy activator Rapa on cell toxicity, apoptosis and barrier disorder induced by 4 μmol·L-1 DON A.自噬相关蛋白表达的Western blot检测; B.细胞增殖的MTT法检测; C. TEER检测。#、##分别表示DON+Rapa处理组与4 μmol·L-1 DON处理组相比差异显著(P < 0.05)和差异极显著(P < 0.01)。 A. Western blot analysis of autophagy-related proteins expression; B. MTT assay of cell proliferation; C. TEER assay. DON+Rapa treatment group compared with 4 μmol·L-1 DON treated cells, #P < 0.05, ##P < 0.01. |
DON作为谷物中检出率和检出量最高的霉菌毒素, 对人类和动物的健康均构成了严重威胁。研究表明, DON对动物的毒性作用主要体现在损害胃肠道的健康[16-18]。高剂量的DON会导致动物腹泻、呕吐、白细胞增多、胃肠道出血并最终导致死亡; 而低剂量的DON会诱发动物厌食、体质量增加缓慢和营养效率改变[5, 19]。国内外对DON影响胃肠道的研究有很多, 但对其影响肠道屏障功能及相关机制的研究仍不深入。本试验选用IPEC-J2细胞作为研究对象, 进一步探讨DON对肠道细胞增殖、凋亡和屏障功能的影响及其潜在机制。
紧密连接是依靠一系列跨膜、搭桥及有信号功能的蛋白质相互作用构成的动态复合体, 主要包括闭合蛋白(Occludin)等多种家族蛋白, 与肠道上皮细胞共同组成肠道黏膜上皮屏障, 对维持肠道上皮细胞的完整性非常重要[4, 20]。已有研究表明, 低剂量DON可以诱发肠上皮细胞的形态和组织损伤, 如绒毛的萎缩和融合[21], 还可以减少杯状细胞的数量, 并改变肠渗透性[22]。本试验结果表明, 2、4和8 μmol·L-1 DON处理IPEC-J2细胞24 h, 可显著抑制细胞增殖, 促进细胞凋亡, 降低跨膜电阻和紧密连接蛋白Occludin的表达。说明一定浓度的DON可引起肠细胞毒性和屏障功能障碍。
有研究表明自噬与肠道损伤有关, 那么DON是否通过自噬引起肠细胞毒性呢?细胞自噬是真核生物中进化保守的对细胞内物质进行周转的重要过程, 该过程中一些损坏的蛋白或细胞器被自噬小泡包裹后, 转送入溶酶体中进行降解并得以循环利用[23]。研究表明, 这种非凋亡程序性的细胞死亡机制对细胞具有保护作用[23-24]。对细胞自噬与肠道损伤的相关研究结果表明, 自噬与肠道损伤后的功能恢复有关[12]。本试验证明, DON处理降低细胞自噬水平; 相对于DON处理组, 自噬激活剂雷帕霉素不仅可以显著增加细胞自噬水平, 并且显著缓解DON导致的增殖毒性、凋亡和肠屏障障碍, 首次证实DON是通过抑制细胞自噬诱发肠毒性。
综上所述, 体外试验表明, DON处理可导致IPEC-J2细胞增殖能力和屏障功能下降, 凋亡增加, 还导致细胞自噬水平下降; 而添加自噬激活剂显著缓解DON导致的细胞增殖毒性、凋亡和肠屏障障碍。说明DON通过抑制自噬对IPEC-J2细胞产生一定的肠毒性。
| [1] |
Ebrahem M, Kersten S, Valenta H, et al. Effects of feeding deoxynivalenol(DON)-contaminated wheat to laying hens and roosters of different genetic background on the reproductive performance and health of the newly hatched chicks[J]. Mycotoxin Res, 2014, 30(3): 131-140. DOI:10.1007/s12550-014-0197-z |
| [2] |
Wang S, Yang J, Zhang B, et al. Deoxynivalenol impairs porcine intestinal host defense peptide expression in weaned piglets and IPEC-J2 cells[J]. Toxins(Basel), 2018, 10(12): 541-556. |
| [3] |
Pierron A, Alassane-Kpembi I, Oswald I P. Impact of two mycotoxins deoxynivalenol and fumonisin on pig intestinal health[J]. Porcine Health Manag, 2016, 2: 21-28. DOI:10.1186/s40813-016-0041-2 |
| [4] |
Lucke A, Bohm J, Zebeli Q, et al. Dietary deoxynivalenol and oral lipopolysaccharide challenge differently affect intestinal innate immune response and barrier function in broiler chickens[J]. J Anim Sci, 2018, 96(12): 5134-5143. |
| [5] |
Vancamelbeke M, Vermeire S. The intestinal barrier:a fundamental role in health and disease[J]. Expert Rev Gastroenterol Hepatol, 2017, 11(9): 821-834. DOI:10.1080/17474124.2017.1343143 |
| [6] |
Luissint A C, Parkos C A, Nusrat A. Inflammation and the intestinal barrier:leukocyte-epithelial cell interactions, cell junction remodeling, and mucosal repair[J]. Gastroenterology, 2016, 151(4): 616-632. DOI:10.1053/j.gastro.2016.07.008 |
| [7] |
Kim H J, Lee S, Jung J U. When autophagy meets viruses:a double-edged sword with functions in defense and offense[J]. Semin Immunopathol, 2010, 32(4): 323-341. DOI:10.1007/s00281-010-0226-8 |
| [8] |
Sun Y, Yu S, Ding N, et al. Autophagy benefits the replication of Newcastle disease virus in chicken cells and tissues[J]. J Virol, 2014, 88(1): 525-537. DOI:10.1128/JVI.01849-13 |
| [9] |
Levine B, Kroemer G. Biological functions of autophagy genes:a disease perspective[J]. Cell, 2019, 176(1/2): 11-42. |
| [10] |
Chen X, Xu J, Liu D, et al. The aggravating effect of selenium deficiency on T-2 toxin-induced damage on primary cardiomyocyte results from a reduction of protective autophagy[J]. Chem Biol Interact, 2019, 300: 27-34. DOI:10.1016/j.cbi.2019.01.009 |
| [11] |
Cadwell K. Crosstalk between autophagy and inflammatory signalling pathways:balancing defence and homeostasis[J]. Nat Rev Immunol, 2016, 16(11): 661-675. DOI:10.1038/nri.2016.100 |
| [12] |
Matsuzawa-Ishimoto Y, Shono Y, Gomez L E, et al. Autophagy protein ATG16L1 prevents necroptosis in the intestinal epithelium[J]. J Exp Med, 2017, 214(12): 3687-3705. DOI:10.1084/jem.20170558 |
| [13] |
Ghareeb K, Awad W A, Bohm J, et al. Impacts of the feed contaminant deoxynivalenol on the intestine of monogastric animals:poultry and swine[J]. J Appl Toxicol, 2015, 35(4): 327-337. DOI:10.1002/jat.v35.4 |
| [14] |
Meurens F, Summerfield A, Nauwynck H, et al. The pig:a model for human infectious diseases[J]. Trends Microbiol, 2012, 20(1): 50-57. |
| [15] |
Patterson J K, Lei X G, Miller D D. The pig as an experimental model for elucidating the mechanisms governing dietary influence on mineral absorption[J]. Exp Biol Med, 2008, 233(6): 651-664. DOI:10.3181/0709-MR-262 |
| [16] |
Adesso S, Autore G, Quaroni A, et al. The food contaminants nivalenol and deoxynivalenol induce inflammation in intestinal epithelial cells by regulating reactive oxygen species release[J]. Nutrients, 2017, 9(12): 1343-1359. DOI:10.3390/nu9121343 |
| [17] |
Pierron A, Mimoun S, Murate L S, et al. Intestinal toxicity of the masked mycotoxin deoxynivalenol-3-beta-D-glucoside[J]. Arch Toxicol, 2016, 90(8): 2037-2046. DOI:10.1007/s00204-015-1592-8 |
| [18] |
Awad W A, Aschenbach J R, Zentek J. Cytotoxicity and metabolic stress induced by deoxynivalenol in the porcine intestinal IPEC-J2 cell line[J]. J Anim Physiol Anim Nutr, 2012, 96(4): 709-716. DOI:10.1111/j.1439-0396.2011.01199.x |
| [19] |
Hamilton R M, Thompson B K, Trenholm H L, et al. Effects of feeding white Leghorn hens diets that contain deoxynivalenol(vomitoxin)-contaminated wheat[J]. Poult Sci, 1985, 64(10): 1840-1852. DOI:10.3382/ps.0641840 |
| [20] |
Capaldo C T, Powell D N, Kalman D. Layered defense:how mucus and tight junctions seal the intestinal barrier[J]. J Mol Med, 2017, 95(9): 927-934. DOI:10.1007/s00109-017-1557-x |
| [21] |
Suzuki T. Regulation of intestinal epithelial permeability by tight junctions[J]. Cell Mol Life Sci, 2013, 70(4): 631-659. DOI:10.1007/s00018-012-1070-x |
| [22] |
Liao P, Liao M, Li L, et al. Effect of deoxynivalenol on apoptosis, barrier function, and expression levels of genes involved in nutrient transport, mitochondrial biogenesis and function in IPEC-J2 cells[J]. Toxicol Res, 2017, 6(6): 866-877. DOI:10.1039/C7TX00202E |
| [23] |
Wirawan E, Berghe V T, Lippens S, et al. Autophagy:for better or for worse[J]. Cell Res, 2012, 22(1): 43-61. |
| [24] |
Ge D, Gao J, Han L, et al. Novel effects of sphingosylphosphorylcholine on the apoptosis of breast cancer via autophagy/AKT/p38 and JNK signaling[J]. J Cell Physiol, 2019, 234(7): 11451-11462. DOI:10.1002/jcp.v234.7 |




