文章信息
- 卢劲晔, 顾蓓蓓, 卢炜, 刘静
- LU Jinye, GU Beibei, LU Wei, LIU Jing
- 雷帕霉素对大肠杆菌诱发的大鼠乳腺上皮细胞炎症反应的影响
- Rapamycin attenuates Escherichia coli induced inflammatory response in rat mammary epithelial cells
- 南京农业大学学报, 2019, 42(4): 740-745
- Journal of Nanjing Agricultural University, 2019, 42(4): 740-745.
- http://dx.doi.org/10.7685/jnau.201806033
-
文章历史
- 收稿日期: 2018-06-25
先天性免疫系统是机体识别和清除入侵病原体的第一道防线, 依赖模式识别受体(PRR)识别病原体的病原相关分子模式, 进而招募相应的接头蛋白, 激活信号级联反应, 促进炎症细胞因子、趋化因子的分泌和表达, 从而杀伤和清除病原微生物。哺乳动物雷帕霉素靶蛋白(mTOR)是一种进化上保守的丝氨酸/苏氨酸蛋白激酶。研究表明与mTOR相关的信号通路复杂且涉及面广泛, 其直接或间接调节至少800余种蛋白质的磷酸化表达[1], 在先天性免疫应答、识别病原微生物及诱导细胞因子释放等方面发挥重要作用。作为mTOR特异性的抑制剂, 雷帕霉素(Rapa)已被证实在多种疾病的治疗过程中发挥了积极的作用[2-3]。病原微生物入侵乳腺组织, 表达在宿主细胞表面的PRR通过识别病原微生物特定的病原相关分子模式(PAMP)启动炎症反应[4]。Toll样受体(TLR)是发现最早且研究最透彻的一组PRR, 定位于细胞的膜结构上广泛识别多种PAMP, 通过招募接头蛋白MyD88和β干扰素TIR结构域衔接蛋白(TRIF), 激活核转录因子κB(NF-κB)信号通路[5]。乳腺上皮细胞是构成乳腺组织的主要功能细胞, Strandberg等[6]研究发现乳腺上皮细胞除发挥主要的泌乳功能外, 其表面表达的TLR2、TLR4等PRR, 受到致病因子刺激后表达显著增强, 这一发现开启了乳腺上皮细胞先天免疫应答的新纪元。TLR在乳腺炎发病机制中的作用也引起人们的广泛关注, TLR介导的信号转导途径中各个节点蛋白在乳腺炎的发生及转归过程中发挥重要作用, 成为乳腺炎防治的靶标分子[4, 7-9]。介于mTOR在信号通路各关键节点中的重要调节作用, 本研究选用mTOR特异性抑制剂雷帕霉素, 通过建立大鼠原代培养乳腺上皮细胞炎症反应模型, 探讨雷帕霉素对TLR信号通路的影响及其对炎性细胞因子释放及氧化应激反应的调控作用, 为临床上寻找早期乳腺炎诊断和治疗的潜在靶点提供试验依据。
1 材料与方法 1.1 试验材料 1.1.1 主要试剂和仪器雷帕霉素(Rapa)购自Select chemicals公司; 抑肽酶、苯甲基磺酰氟(PMSF)、二硫苏糖醇(DTT)、Ⅰ型胶原酶、透明质酸酶、双氢罗丹明(DHE)购自Sigma公司; PVDF膜购自Millipore公司; 兔抗鼠TLR-4、MyD88多克隆抗体购自Santa cruz公司; 小鼠抗甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体购自Bioworld公司; 辣根过氧化物酶(HRP)标记的羊抗兔、兔抗小鼠IgG购自武汉博士德公司; 细胞核蛋白与总蛋白提取试剂盒、BCA蛋白定量试剂盒购自北京博迈德科技发展有限公司; ECL化学发光检测试剂盒购自Pierce公司; 炎性因子芯片检测试剂盒(RayBiotech); 丙二醛(MDA)、超氧化物歧化酶(SOD)和总抗氧化能力(T-AOC)检测试剂盒购自南京建成生物工程研究所。
MIKRO-22R型高速冷冻离心机(德国Andreas Hettich GmbH8 CO.KG), FMJ-182放射免疫γ计数器(中国科学院上海原子核研究所日环仪器厂), 核酸浓度测定仪(德国Eppendorf Biophotometer), 荧光定量PCR仪(ABI Prism 7300), 垂直板电泳槽及半干转印仪(美国Bio-Rad公司)。
1.1.2 细菌大肠杆菌(E.coli)分离自南京某奶牛场, 由南京农业大学动物医学院泌乳生物学实验室馈赠。经肉汤培养基复壮分离, 调整浓度至2×1012 CFU·mL-1备用。
1.1.3 细胞培养及处理取妊娠中后期大鼠第4、5对乳腺组织, 剪碎, 尽量剔除脂肪和结缔组织, 置于2 mg·mL-1 Ⅰ型胶原酶和100 U·mL-1透明质酸酶消化液中37 ℃消化3 h, 过滤, 多次瞬时离心以去除未消化完全的组织团块和成纤维细胞等, 以每孔5×106 mL-1(每孔2 mL)接种于6孔板, 37 ℃、5% CO2条件下培养。细胞贴壁后换液以去除未贴壁的细胞和碎片等, 待细胞铺满培养板底90%以上时, 更换培养液为无血清培养液, 同时试验组采用100 nmol·L-1的Rapa预处理4 h, 经感染复数(MOI)为10的大肠杆菌处理2 h后收集细胞及细胞上清液, 4 ℃保存。
1.2 试验方法 1.2.1 乳腺上皮细胞TLR-4、MyD88蛋白表达水平的Western blot检测提取细胞的总蛋白, 经SDS-PAGE分离后转印到PVDF膜上, 5%脱脂奶粉室温封闭2 h, 分别于TLR-4、MyD88一抗中4 ℃孵育过夜; TBST充分洗涤, 经HRP标记的羊抗兔IgG孵育并充分洗涤后用ECL化学发光检测试剂盒显色。以GAPDH为内参, 经凝胶图像分析系统对条带进行光密度测定并分析, 以目的蛋白和内参条带的光密度比值代表相应蛋白的相对表达水平。
1.2.2 乳腺上皮细胞炎性细胞因子表达的蛋白芯片检测用炎性因子白细胞介素(IL)-1α、IL-1β、IL-2、IL-4、IL-6、IL-10、IL-13, 肿瘤坏死因子α(TNF-α), 干扰素γ(IFN-γ), 微生物蛋白1(MCP-1)芯片检测试剂盒检测细胞上清液中的炎性细胞因子相对表达量。每个样本重复3次。
1.2.3 乳腺上皮细胞ROS释放量的流式细胞检测细胞经Rapa和大肠杆菌处理后更换无血清培养液, 用100 μmol·L-1 DHE(一种可自由穿透细胞膜而被用于检测氧自由基的荧光染料)37 ℃孵育10 min, 0.01 mol·L-1、pH7.2 PBS洗涤3次后, 重悬于PBS中混匀后流式细胞仪检测。以上试验重复3次, 荧光强度取3次平均值。
1.2.4 乳腺上皮细胞MDA含量、SOD活性和T-AOC水平的检测试剂盒提取细胞总蛋白, MDA含量测定采用TBA比色法; SOD活性采用黄嘌呤氧化酶(羟胺法)检测; T-AOC水平采用化学比色法检测。具体操作步骤按照试剂盒说明书进行。
1.3 数据处理数据均以平均值±标准误(x±SE)表示, 采用SPSS 19.0统计学软件进行方差分析, 组间差异采用t测验或单因素方差分析。
2 结果与分析 2.1 Rapa对乳腺上皮细胞TLR-4、MyD88蛋白表达水平的影响如图 1所示:大肠杆菌刺激后, 乳腺上皮细胞TLR-4和MyD88蛋白表达水平均显著升高(P < 0.05), Rapa处理对大肠杆菌诱发的TLR-4表达无显著影响, 而能下调MyD88的表达。

|
图 1 雷帕霉素(Rapa)对乳腺上皮细胞TLR-4和MyD88蛋白表达水平的影响 Fig. 1 Effects of rapamycin (Rapa) on the expression of TLR-4 and MyD88 in mammary epithelial cells Control:对照组Untreated; Rapa:Rapa处理组Treated by Rapa; E.coil:Escherichia coil处理组Treated by E.coil; E.coil+Rapa:E.coil、Rapa共处理组Treated by both E.coil and Rapa. *P < 0.05. |
采用大鼠炎性因子芯片检测试剂盒对大鼠乳腺上皮细胞培养上清液的炎性因子相对表达量进行检测。结果(图 2)显示:大肠杆菌刺激乳腺上皮细胞后IL-1β和TNF-α水平显著上升(P < 0.05), 较对照分别提高3.9倍和3.4倍; 而Rapa预处理后TNF-α和IL-1β水平显著降低(P < 0.05)。
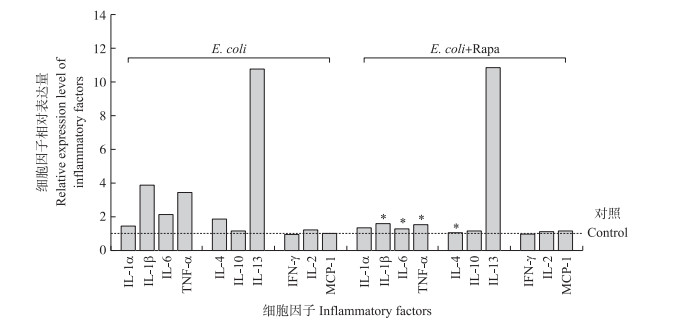
|
图 2 Rapa对大鼠乳腺上皮细胞炎性因子相对表达量的影响 Fig. 2 Effects of Rapa on the relative expression level of inflammatory factors in rat mammary epithelial cells |
从图 3可知:与对照组相比, 大肠杆菌刺激乳腺上皮细胞后ROS释放量显著上升(P < 0.05), 但Rapa处理ROS释放量有降低趋势, Rapa预处理显著下调大肠杆菌刺激引起的ROS释放量。

|
图 3 Rapa对乳腺上皮细胞(MEC)ROS释放量的影响 Fig. 3 Effects of Rapa on ROS release from mammary epithelial cells |
从图 4可知:Rapa预处理削弱大肠杆菌诱发引起的大鼠乳腺上皮细胞SOD活性和T-AOC水平的下降。大肠杆菌诱导能显著增加MDA含量, Rapa预处理显著降低大肠杆菌引起的MDA含量。
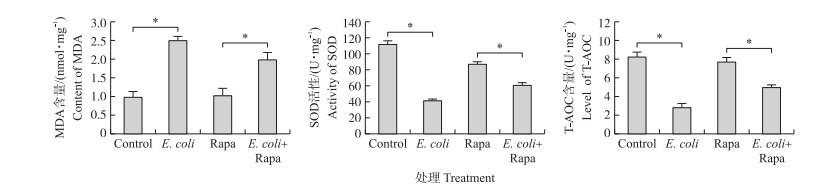
|
图 4 Rapa对乳腺上皮细胞MDA含量、SOD活性和T-AOC水平的影响 Fig. 4 Effects of Rapa on MDA content, SOD activity and T-AOC level in mammary epithelial cells |
天然免疫系统存在于所有多细胞动物中, 是机体最古老的抗感染机制之一。病原微生物入侵乳腺组织后, 乳腺上皮细胞表面的PRR能第一时间识别PAMP, 构筑乳腺防御病原体入侵的第一道防线[4]。TLR是参与非特异性免疫的一类重要蛋白质分子, 也是连接非特异性免疫和特异性免疫的桥梁。TLR定位于细胞的膜结构上, 广泛识别多种PAMP, 通过招募接头蛋白MyD88和TRIF, 激活NF-κB信号通路, 启动固有免疫[4-5]。已有报道证实乳腺上皮细胞表面能表达TLR-2和TLR-4, 分别识别革兰氏阳性菌的磷脂酸(LTA)和革兰氏阴性菌的脂多糖(LPS), TLR及其信号途径成为乳腺炎发展转归的调控靶点[6]。以大肠杆菌诱导的试验性乳腺炎为例, 大肠杆菌入侵乳腺组织, 激活乳腺上皮细胞表面的TLR-4, 通过MyD88依赖性途径和MyD88非依赖性途径(TRIF依赖性)激活下游信号, 引起炎性因子的上调表达。MyD88依赖性途径是由TLR-4激活, 形成LPS/TLR4/MD2复合物, 通过招募接头蛋白MyD88激活NF-κB, 导致一系列的炎症因子的上调表达。MyD88非依赖性途径是LPS与TLR-4结合后, 不通过MyD88, 而是通过TRIF引起信号转导, 激活NF-κB信号通路[4, 10-12]。本研究结果与前人研究结果一致, 未刺激的大鼠乳腺上皮细胞有TLR-4的微弱表达, E.coli处理后TLR-4及其通路关键蛋白MyD88的表达水平显著提高。
mTOR作为Toll样受体的下游蛋白, 其表达与激活与上皮细胞炎症及炎症过程中细胞的功能紊乱相关[13]。Zhao等[14]研究表明, TLR3激活后通过mTOR途径激活核糖体蛋白S6激酶(p70S6K)、磷酸化起始因子4E结合蛋白1(p4EBP1)、应激活化激酶(JNK)、NF-κB和干扰素调节因子3(IRF3), 参与调节炎症反应; Lorne等[15]研究发现, 急性肺损伤时mTOR伴随着TLR-4的激活而活化, mTOR的激活在调节中性粒细胞的功能和与中性粒细胞相关的炎症反应中发挥重要作用。Rapa是属于三烯大环内酯类化合物, 主要是通过抑制mTOR信号通路及其下游的蛋白激酶活性而发挥免疫抑制作用。有研究报道证实, Rapa能抑制TLR-2诱发引起炎症反应, 其机制是Rapa能调节MAPK和NF-κB信号通路, 通过抑制p38、胞外信号调节激酶(ERK1/2)和NF-κB, 从而降低炎症细胞因子的过度分泌[16]。本试验结果表明, Rapa处理对大鼠乳腺上皮细胞TLR-4的表达无显著影响, 而能显著下调MyD88的表达, 推测Rapa可能通过干预MyD88调节乳腺上皮细胞的炎症反应。Schmitz等[17]研究也证实, TLR通过磷脂酰肌醇3(PI3K)/丝氨酸苏氨酸蛋白激酶(Akt)激活mTOR, mTOR与MyD88支架蛋白物理性结合, 从而调节其下游因子的表达。
TLR/MyD88信号通路的活化最终导致一系列细胞因子的过度表达, 这也是乳腺炎发病机制的主要原因。细胞因子可以分为前炎性细胞因子、抗炎性细胞因子等[18], 前炎性细胞因子和抗炎性细胞因子的动态平衡在炎症的进展中发挥了至关重要的作用[19]。前炎性细胞因子如TNF-α和IL-1β的过度释放是乳腺炎引起组织损伤的重要因素, 本研究结果显示雷帕霉素处理能显著降低上述前炎性细胞因子的过度释放。TNF-α和IL-1β能进一步刺激许多二级细胞因子的释放而加剧炎症反应, IL-8就是IL-1β进一步刺激产生的一种重要的趋化因子, 对嗜中性粒细胞(PMN)有激活作用。PMN是机体抵抗感染的主要非特异性防御细胞, IL-8可以诱导其变形、趋化、脱颗粒、活性氧自由基ROS释放等[20-22]。PMN吞噬病原微生物主要是通过释放ROS实现的, 但持续激活的PMN释放过量高毒性的ROS是乳腺炎引起组织损伤的主要因素之一。体外研究已经证实ROS对乳腺上皮细胞有一定的细胞毒性作用[4], 过量释放的ROS与机体的抗氧化能力失衡, 会导致机体的氧化应激, 从而引起乳腺上皮细胞的坏死和凋亡。本研究发现, 雷帕霉素预处理显著降低致病因子刺激引起的ROS的过度释放, 显著提高乳腺上皮细胞的抗氧化水平, 这可能是其保护乳腺组织抵御损伤的机制之一。
乳腺炎可发生于各种乳用家畜甚至人类, 在奶牛产业乳腺炎更是频繁发生, 成为制约奶牛业发展的主要疾病之一。本研究结果证实雷帕霉素能通过抑制炎性细胞因子和活性氧自由基的过度释放, 改善机体的抗氧化水平, 从而促进乳腺炎的转归, 结果可为临床上寻找新的乳腺炎防治方法提供试验依据。
| [1] |
Katarzyna S, Katarzyna K, Aleksandra J K, et al. Neuroscience forefront review molecular neurobiology of mTOR[J]. Neuroscience, 2017, 341: 112-153. DOI:10.1016/j.neuroscience.2016.11.017 |
| [2] |
Li J, Kim S G, Blenis J. Rapamycin:one drug, many effects[J]. Cell Metabolism, 2014, 19: 373-379. DOI:10.1016/j.cmet.2014.01.001 |
| [3] |
Wang Y, Chen J, Tang W Q, et al. Rapamycin inhibits the proliferation of endothelial cells in hemangioma by blocking the mTOR-FABP4 pathway[J]. Biomedicine & Pharmacotherapy, 2017, 85: 272-279. |
| [4] |
Zheng L H, Xu Y Y, Lu J Y, et al. Variant innate immune responses of mammary epithelial cells to challenge by Staphylococcus aureus, Escherichia coli and the regulating effect of taurine on these bioprocesses[J]. Free Radical Biology & Medicine, 2016, 96: 166-180. |
| [5] |
Liu S, Shi X, Bauer I, et al. Lingual antimicrobial peptide and IL-8 expression are oppositely regulated by the antagonistic effects of NF-κB p65 and C/EBPβ in mammary epithelial cells[J]. Microbiology and Immunology, 2011, 48: 895-908. |
| [6] |
Strandberg Y, Gary C, Vuocolo T, et al. Lipopolysaccharide and lipoteichoic acid induce different innate immune responses in bovine mammary epithelial cells[J]. Cytokine, 2005, 31: 72-86. DOI:10.1016/j.cyto.2005.02.010 |
| [7] |
Gu B B, Miao J F, Fa Y M, et al. Retinoid attenuates lipopolysaccharide-induced inflammatory responses by suppressing TLR4/NF-κB expression in rat mammary tissue[J]. Int Immunopharmacol, 2010, 10(7): 799-805. DOI:10.1016/j.intimp.2010.04.022 |
| [8] |
Miao J, Zheng L, Zhang J, et al. The effect of taurine on the toll-like receptors/nuclear factor kappa B (TLRs/NF-κB) signaling pathway in Streptococcus uberis-induced mastitis in rats[J]. Int Immunopharmacol, 2011, 11: 1740-1746. DOI:10.1016/j.intimp.2011.06.008 |
| [9] |
Fu H, Gao R, Gao Y, et al. Curcumin attenuates inflammatory responses by suppressing TLR4-mediated NF-κB signaling pathway in lipopolysaccharide-induced mastitis in mice[J]. Int Immunopharmacol, 2014, 20: 54-58. DOI:10.1016/j.intimp.2014.01.024 |
| [10] |
Lorraine M S, Katie L S. Mamammary gland immunity and mastitis susceptibility[J]. J Mammary Gland Biol, 2002, 7(2): 135-146. DOI:10.1023/A:1020347818725 |
| [11] |
Bradley A J. Bovine mastitis:an evolving disease[J]. Vet J, 2002, 164: 116-128. DOI:10.1053/tvjl.2002.0724 |
| [12] |
Rinaldi M, Li R W, Capuco A V. Mastitis associated transcriptomic disruptions in cattle[J]. Vet Immunol Immunopathol, 2010, 138: 267-279. DOI:10.1016/j.vetimm.2010.10.005 |
| [13] |
贺鹏. PM2.5对大鼠变应性鼻炎鼻黏膜上皮中TLR2/4及mTOR信号通路表达的影响[D].长春: 吉林大学, 2017. He P. Effect of PM2.5 on TLR2/4 and mTOR signaling pathway expression in nasal epithelium of rats with allergic rhinitis[D]. Changchun: Jilin University, 2017(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10183-1017156378.htm |
| [14] |
Zhao J, Benakanakere M R, Hosur K B, et al. Mammalian target of rapamycin (mTOR) regulates TLR3 induced cytokines in human oral keratinocytes[J]. Molecular Immunology, 2010, 48(1/2/3): 294-304. |
| [15] |
Lorne E, Zhao X, Zmijewski J W, et al. Participation of mammalian target of rapamycin complex 1 in Toll-like receptor 2- and 4-induced neutrophil activation and acute lung injury[J]. American Journal of Respiratory Cell & Molecular Biology, 2009, 41(2): 237-245. |
| [16] |
Sun R, Zhang Y, Ma S, et al. Down-regulation of mitogen-activated protein jinases and nuclear-κB signaling is involved in rapamycin suppression of TLR2-induced inflammatory response in monocytic THP-1 cells[J]. Microbiol Immunol, 2015, 59(10): 614-622. DOI:10.1111/1348-0421.12321 |
| [17] |
Schmitz F, Heit A, Dreher S, et al. Mammalian target of rapamycin (mTOR) orchestrates the defense program of innate immune cells[J]. European Journal of Immunology, 2008, 38(1): 2981-2992. |
| [18] |
Wakkad A E I, Nel-M H, Sibaii H, et al. Proinflammatory, anti-inflammatory cytokines and adiponkines in students with central obesity[J]. Cytokine, 2013, 61(2): 682-687. DOI:10.1016/j.cyto.2012.11.010 |
| [19] |
Atwell D M, Grichnik K P, Newman M F, et al. Balance of proinflammatory and antiinflammatory cytokines at thoracic cancer operation:an important conceot in modern anesthesia[J]. The Annals of Thoracic Surgery, 1998, 68(4): 1134-1150. |
| [20] |
Oguma K. In vitro effect of recombinat human tumor necrosis factor on canine neutrophil apoptosis[J]. Research in Veterinary Science, 2006, 80(2): 162-166. DOI:10.1016/j.rvsc.2005.05.012 |
| [21] |
Ho W Y, Wong C K, Lam C W K. Tumor necrosis factor-α up-regulates the expression of CCL2 and adhesion molecules of human proximal tubular epithelial cells through MAPK signaling pathways[J]. Immunobiology, 2008, 213: 533-544. DOI:10.1016/j.imbio.2008.01.003 |
| [22] |
Higashimoto T, Panopoulos A, Hsieh CL, et al. TNF-α induces chromosomal abnormalities independent of ROS through IKK, JNK, p38 and caspase pathways[J]. Cytokine, 2006, 34: 39-50. DOI:10.1016/j.cyto.2006.03.015 |



