文章信息
- 吕存, 孙玉亭, 胡传炯, 纪宇, 成艳芬, 朱伟云
- LÜ Cun, SUN Yuting, HU Chuanjiong, JI Yu, CHENG Yanfen, ZHU Weiyun
- 合生元对保育猪生长性能、粪样菌群结构和短链脂肪酸含量的影响
- Effects of synbiotics on the growth performance, microbial community and concentrations of short chain fatty acids in feces of nursery pigs
- 南京农业大学学报, 2019, 42(4): 721-728
- Journal of Nanjing Agricultural University, 2019, 42(4): 721-728.
- http://dx.doi.org/10.7685/jnau.201809007
-
文章历史
- 收稿日期: 2018-09-05
2. 天邦食品股份有限公司天邦研究院, 上海 200233
2. TECH-BANK Food Co., Ltd., Shanghai 200233, China
早期断奶是养猪生产的重要环节, 在断奶过程中由于日粮由母乳转变为富含谷物原料的颗粒饲料, 再加上外界环境的变化, 以母乳为底物建立的肠道菌群结构发生剧烈变化, 引起仔猪肠道菌群紊乱, 破坏了肠道微生物屏障, 增加了病原菌定殖的风险, 造成仔猪腹泻, 严重影响仔猪的生长性能[1-2]。合生元是将益生菌和益生素联合使用, 共同发挥二者益生作用的复合微生态制剂[3]。已有研究表明, 合生元具有提高仔猪生长性能[4]、促进肠道发育[5]、调节肠道菌群结构[6]等功能, 但其具体机制尚不清楚。乳酸杆菌和丁酸梭菌是被广泛报道的具有益生作用的菌株[7-8]。它们可以产生有益于宿主的微生物代谢产物, 改善肠腔环境, 减少病原菌定殖。菊粉和果寡糖属于益生素, 可以被肠道中的乳酸杆菌、双歧杆菌等益生菌利用, 促进益生菌在肠道中的增殖[9-10]。本试验研究了上述两种益生菌和益生素的组合对断奶仔猪肠道菌群及其代谢的调节作用, 探讨其缓解断奶应激、提高生长性能的作用机制。同时, 确定其最佳使用时间段, 为该合生元在养猪生产上的应用提供依据。
1 材料方法 1.1 试验动物与试验设计选取体质量相近(6.35±0.20)kg、21日龄断奶的同批次健康仔猪240头, 分为对照组和试验组, 每组3个重复, 每个重复40头仔猪。试验组通过饮水饲喂合生元(每栏每天添加芽胞乳酸杆菌1×1010 CFU、丁酸梭菌3×1010 CFU、菊粉30 g、果寡糖20 g), 其添加量主要依据前期动物试验结果[11], 结合商业公司的丁酸梭菌产品的建议添加量确定, 然后与益生素菊粉和果寡糖按一定比例配合而成。21~42日龄每天饲喂, 43~70日龄隔天饲喂, 剂量加倍。对照组正常饮水。丁酸梭菌由某商业公司提供, 芽胞乳酸杆菌由南京农业大学消化道微生物实验室保存; 菊粉和果寡糖购自北京厚嘉生物技术有限公司, 纯度大于90%。
1.2 饲养管理试验在安徽蚌埠某猪场进行, 保育猪饲料也由该猪场提供, 日粮组成和营养水平如表 1所示。保育猪自由饮水, 采食。其免疫和消毒程序按照商业猪场的常规流程进行。
| 原料组成 Ingredients |
第1阶段 (21~42日龄) Phase 1(21 to 42 days of age) |
第2阶段 (43~70日龄) Phase 2(43 to 70 days of age) |
营养水平2) Nutrient levels |
第1阶段 (21~42日龄) Phase 1(21 to 42 days of age) |
第2阶段 (43~70日龄) Phase 2(43 to 70 days of age) |
|
| 豆粕Soybean meal | 25 | 23 | 消化能3) Digestible energy | 13.85 | 13.85 | |
| 乳清粉Whey powder | 9.5 | 7.3 | 粗蛋白质Crude protein | 20.3 | 18.5 | |
| 鱼粉Fish meal | 4.5 | 2.5 | 钙Calcium | 0.75 | 0.74 | |
| 豆油Soybean oil | 2 | 2 | 总磷Total phosphorus | 0.55 | 0.54 | |
| 石粉Limestone | 1.1 | 1.2 | 赖氨酸Lysine | 1.30 | 1.15 | |
| 预混料Premix1) | 1 | 1.3 | ||||
| CaHPO4 | 0.35 | 0.20 | ||||
| NaCl | 0.3 | 0.3 | ||||
| 赖氨酸Lysine | 0.15 | 0.1 | ||||
| 丙酸钙Calcium propionate | 0.1 | 0.1 | ||||
| 注: 1)预混料为每千克饲料提供Premix provided the following per kg of diets:维生素(V)B2 5.5 mg, VB6 27.6 μg, VD 4 500 IU, VE 60 IU, VA 13 000 IU, VK3 2.5 IU, VB1 3.5 mg, D-泛酸D-pantothenic acid 14.6 mg, 生物素Biotin 25 μg, 烟酸Nicotinic acid 30 mg, 胆碱Choline 500 mg, Fe 110 mg, Mn 30 mg, Cu 30 mg, Zn 110 mg, I 0.65 mg, Se 0.3 mg. 2)营养水平为计算值Nutrient levels were calculated values. 3)消化能单位是MJ·kg-1 Digestible energy unit is MJ·kg-1. | ||||||
分别于保育猪21、28、42和70日龄时, 每个重复选取2头(每组6头), 于直肠采集新鲜粪样, 放于50 mL无菌离心管中, 迅速置于-20 ℃保存, 用于测定微生物菌群结构与短链脂肪酸(SCFA)含量。
1.4 测定指标和方法 1.4.1 生长性能分别于21(试验前)、42和70日龄称取保育猪空腹体质量, 计算平均日增重(average daily gain, ADG)。每天记录采食量, 计算平均日采食量(average daily feed intake, ADFI)和料重比(feed/gain, F/G)。准确记录每天腹泻保育猪头数, 计算腹泻率。腹泻率=腹泻头数/(供试猪总头数×饲养天数)×100%。其中每头保育猪腹泻1 d记为1个腹泻头次。
1.4.2 粪样菌群结构分析取0.3 g粪样于2 mL无菌离心管中, 加入1 mL PBS缓冲液, 涡旋振荡后, 3 000 g离心5 min, 吸取上层菌液转移到2 mL新离心管中, 12 000 g离心5 min后, 弃上清液, 加入1 mL CTAB(hexadecyl trimethyl ammonium bromide)溶液, 混匀后转移到含有0.3 g锆珠的无菌锆珠管中充分振荡混匀后, 使用珠磨式组织研磨器(Bead-beater, Biospec, USA)破坏细胞壁, 再参照Dai等[12]的方法提取粪样中微生物的总DNA。
使用细菌通用引物515F和806R对细菌16S rRNA基因V4区进行扩增, 扩增产物在Hiseq 2500平台进行PE250双端测序(华大基因有限公司)。测序完成后根据Li等[13]的方法, 首先去除长度小于400 bp、大于500 bp的序列以及含N碱基的序列, 然后对数据进行拼接并去除平均长度低于30 bp的序列。过滤后的序列在QIIME软件中进行OTU聚类。在菌群OTU水平上计算Chao1指数, 用以评估菌群的丰度; 计算Shannon和Simpson指数, 用以评估粪样菌群的多样性。利用Greengenes数据库对OTU进行分类注释。使用GraphPad Prism 5(GRAPHPAD Software, San Diego, CA, USA)软件绘图。
1.4.3 粪样中短链脂肪酸含量的测定取0.3 g粪样加入2 mL离心管中, 加入1.5 mL超纯水, 充分振荡混匀, 12 000 g离心5 min, 取上清液300 μL, 按照5 : 1的比例加入250 g·L-1偏磷酸巴豆酸溶液, -20 ℃过夜, 再以12 000 g离心10 min后, 吸取上清液, 并使用0.22 μm滤膜过滤上清液, 乙醚萃取过滤后的上清液, 使用Agilent7890A气相色谱仪检测萃取液中SCFA的含量[14]。
1.5 数据处理与统计分析数据表示为平均数±标准误, 采用SPSS 20.0软件中的独立样本t测验对数据进行显著性检验, P < 0.05表示数据之间差异显著。使用Pearson相关系数法(GRAPHPAD Software, San Diego, CA, USA)分析粪样菌群、代谢产物和生长性能间的相关性。
2 结果与分析 2.1 合生元对保育猪生长性能的影响由表 2可知:与对照组相比, 合生元显著增加21~42日龄保育猪的ADFI和ADG(P < 0.05);显著降低保育猪腹泻率(P < 0.05)。合生元显著增加了43~70日龄保育猪的ADG(P < 0.05), 对ADFI、F/G值和腹泻率无显著影响。合生元的使用对21~70日龄保育猪的上述生长性能指标无显著影响。
| 项目Items | 对照组Control group | 处理组Treatment group |
| 初始体质量/kg Initial weight | 6.40±0.03 | 6.38±0.04 |
| 终末体质量/kg Final weight | 24.89±0.54 | 28.13±0.91* |
| 21~42日龄21-42 days of age | ||
| 平均日采食量/(g·d-1) ADFI | 358.96±13.72 | 402.74±4.20* |
| 平均日增重/(g·d-1) ADG | 264.02±6.97 | 296.53±7.78* |
| 料重比F/G | 1.37±0.01 | 1.36±0.03 |
| 腹泻率/% Diarrhea incidence | 3.28±0.07 | 2.64±0.04* |
| 43~70日龄43-70 days of age | ||
| 平均日采食量/(g·d-1) ADFI | 698.68±9.56 | 786.44±64.40 |
| 平均日增重/(g·d-1) ADG | 457.30±19.58 | 550.40±32.15* |
| 料重比F/G | 1.53±0.11 | 1.43±0.08 |
| 腹泻率/% Diarrhea incidence | 1.88±0.86 | 1.54±0.49 |
| 21~70日龄21-70 days of age | ||
| 平均日采食量/(g·d-1) ADFI | 541.50±8.71 | 594.66±30.86 |
| 平均日增重/(g·d-1) ADG | 362.53±13.47 | 426.88±27.46 |
| 料重比F/G | 1.47±0.06 | 1.40±0.05 |
| 腹泻率/% Diarrhea incidence | 2.52±0.30 | 2.06±0.20 |
| Note:ADFI:Average daily feed intake; ADG:Average daily gain; F/G:Feed/gain. *P < 0.05. The same as follows. | ||
21日龄断奶保育猪粪样中乙酸、丙酸、丁酸和总SCFA的含量分别为(8.57±0.27)、(2.73±0.55)、(2.12±0.14)和(13.55±0.59)μmol·g-1。由表 3可知, 使用合生元可显著增加保育期猪粪样中总SCFA和丁酸的含量(P < 0.05);显著增加28与42日龄猪粪样中乙酸含量(P < 0.05);对保育期猪粪样中丙酸含量无显著影响(P > 0.05)。
| μmol·g-1 | |||
| 日龄Days of age | 项目Items | 对照组Control group | 处理组Treatment group |
| 乙酸Acetic acid | 17.35±0.79 | 25.60±1.28* | |
| 28 | 丙酸Propionic acid | 9.61±0.17 | 10.67±0.53 |
| 丁酸Butyric acid | 3.27±0.89 | 5.13±0.29* | |
| 总短链脂肪酸Total SCFA | 30.46±0.34 | 40.83±0.29* | |
| 乙酸Acetic acid | 25.40±1.30 | 29.25±0.59* | |
| 42 | 丙酸Propionic acid | 12.81±0.68 | 14.88±1.05 |
| 丁酸Butyric acid | 9.79±0.41 | 11.35±0.29* | |
| 总短链脂肪酸Total SCFA | 48.35±1.28 | 56.18±0.17* | |
| 乙酸Acetic acid | 43.25±1.44 | 45.75±1.69 | |
| 70 | 丙酸Propionic acid | 21.67±0.61 | 22.22±0.61 |
| 丁酸Butyric acid | 14.59±0.82 | 17.50±0.63* | |
| 总短链脂肪酸Total SCFA | 80.75±0.76 | 83.09±0.57* | |
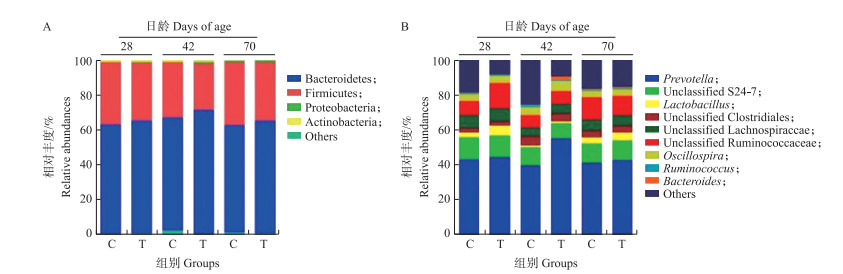
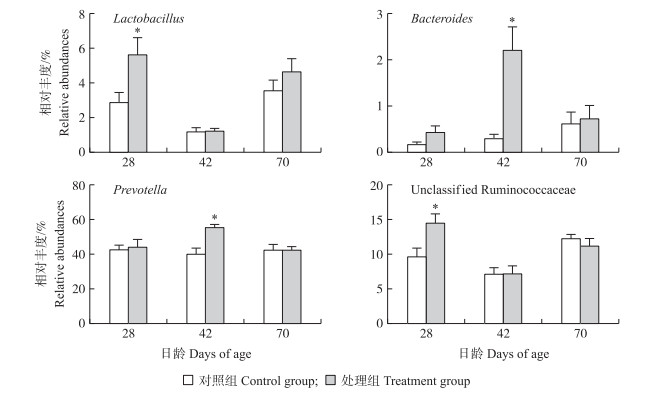
21日龄保育猪粪样菌群Chao1、Shannon和Simpson指数分别为798.63±16.7、6.34±0.15和0.96±0.01;OTU数为690.89±14.20。合生元对28、42和70日龄保育猪粪样菌群多样性与丰度无显著影响(表 4)。由图 1-A可知, 粪样中厚壁菌门(Firmicutes)、拟杆菌门(Bacteroides)为主要的优势菌门, 合生元对保育猪粪样菌群门水平的相对丰度无显著影响。而在属水平上, 对相对丰度大于1%的菌属(图 1-B)进一步分析发现(图 2), 合生元显著增加了28日龄保育猪粪样中Lactobacillus和unclassified Ruminococcaceae的相对丰度(P < 0.05);显著增加了42日龄猪粪样中Bacteroides和Prevolla的相对丰度(P < 0.05);对70日龄粪样上述菌属相对丰度无显著影响(P > 0.05)。
| 日龄Days of age | 项目Items | 对照组Control group | 处理组Treatment group |
| OTU数OTU | 833.33±46.30 | 741.50±59.50 | |
| 28 | Chao1指数Chao1 index | 963.98±52.08 | 928.12±39.15 |
| 香农指数Shannon index | 6.11±0.12 | 5.69±0.29 | |
| 辛普森指数Simpson index | 0.94±0.01 | 0.89±0.03 | |
| OTU数OTU | 849.00±37.49 | 796.17±56.46 | |
| 42 | Chao1指数Chao1 index | 935.33±36.82 | 878.57±56.74 |
| 香农指数Shannon index | 6.30±0.24 | 6.25±0.22 | |
| 辛普森指数Simpson index | 0.95±0.01 | 0.96±0.01 | |
| OTU数OTU | 968.67±16.09 | 969.17±26.76 | |
| 72 | Chao1指数Chao1 index | 1 044.76±18.79 | 1 077.44±31.14 |
| 香农指数Shannon index | 6.88±0.16 | 6.70±0.22 | |
| 辛普森指数Simpson index | 0.96±0.01 | 0.96±0.01 |
|
图 1 合生元处理组(T)和对照组(C)保育猪粪样菌群门(A)和属水平(B)的相对丰度 Fig. 1 Relative abundance of microbial phyla (A) and genus (B) in feces of nursery pigs in feces treatment (T) and control (C) groups |
|
图 2 合生元对保育猪粪样菌群属水平相对丰度的影响 Fig. 2 Effects of synbiotics on the relative abundances of bacterial genus in the feces of nursery pigs |
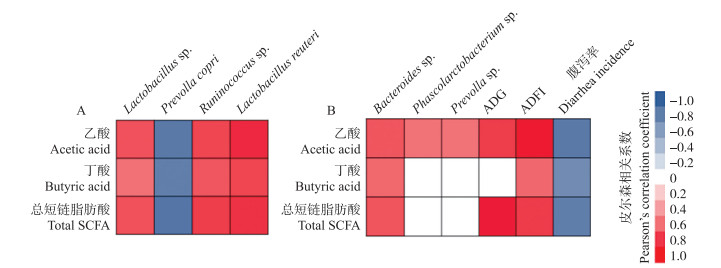
从图 3可见:28日龄时, Lactobacillus sp.、Lactobacillus reuteri和Ruminococcus sp.与粪样中乙酸、丁酸和总SCFA含量显著正相关(P < 0.05);而Prevolla copri与粪样中乙酸、丁酸和总SCFA含量显著负相关(P < 0.05)。42日龄时, 保育猪粪样中Prevolla sp.和Phascolarctobacterium sp.与乙酸含量显著正相关(P < 0.05);Bacteriodes sp.与乙酸、丁酸和总SCFA含量及ADG显著正相关(P < 0.05);乙酸、丁酸、总SCFA与猪腹泻率显著负相关(P < 0.05), 与ADFI显著正相关(P < 0.05)。
|
图 3 保育猪粪样菌群与SCFA、生长性能指标的相关性分析(A, 28日龄; B, 42日龄) Fig. 3 Correlation analysis of microbial community and the growth performance and SCFA concentrations in the feces of nursery pigs at 28(A)and 42(B)days of age 红色、蓝色和白色分别代表显著正相关(P < 0.05)、显著负相关(P < 0.05)和不相关(P > 0.05)。 The red, blue and white color represent significant positive correlation(P < 0.05), significant negative correlation(P < 0.05), and no correlation(P > 0.05), respectively. |
仔猪在断奶过程中由于应激造成了肠道菌群结构紊乱, 继而损害仔猪肠道健康, 影响仔猪生长性能[15]。已有研究显示, 合生元由于同时含有益生菌和益生素, 可显著提高断奶仔猪的ADFI和ADG, 降低F/G, 缓解由致病性大肠杆菌造成的仔猪腹泻[16]。我们还发现, 保育猪断奶到42日龄使用合生元, 对保育猪生长性能的改善效果明显优于42日龄后使用, 即在21~42日龄使用合生元不仅增加保育猪的ADG和ADFI, 同时减少腹泻; 43~70日龄使用合生元仅增加ADG。由此可见, 在21~42日龄使用合生元更有利于调节保育猪肠道健康, 提高其生长性能。朱伟云等[17]研究发现, 仔猪肠道内菌群结构在断奶后发生明显演替, 但在断奶13 d后仔猪体内已经形成了各自特征的菌群, 菌群结构趋于稳定。边高瑞等[18]通过对断奶仔猪肠道菌群结构进行追踪, 也发现了类似的规律。21~42日龄与43~70日龄合生元的饲喂方式不同也可能导致后期合生元使用效果不理想。金三俊等[19]研究发现, 合生元的饲喂方式和剂量水平是影响其效果的重要因素。考虑到42日龄后保育猪肠道菌群逐渐趋于稳定, 我们在试验后期改变了合生元的饲喂方式。42日龄后采用隔天饲喂剂量翻倍的方式, 加大了保育猪一次性摄入合生元的剂量, 但这种单次高剂量的摄入可能超出了其合适的剂量水平。
本研究结果显示, 合生元可以通过调节猪肠道菌群结构、改变其代谢产物组成, 从而显著提高21~42日龄保育猪的生长性能。合生元对保育猪肠道菌群结构的调节表现为:增加粪样中乳酸杆菌等有益菌的相对丰度和一些具有降解日粮中纤维能力的菌属的相对丰度, 帮助保育猪更好地适应日粮状态和成分的改变。前期研究显示, 在断奶过程中仔猪的肠道菌群结构发生剧烈的变化, 表现为断奶前肠道中的优势菌乳酸杆菌的数量降低, 同时潜在致病菌如Streptococcus suis和Moraxella cuniculi等数量快速上升, 从而增加了仔猪患病的风险[11, 20]。在本试验中, 合生元显著增加了28日龄保育猪粪样中乳酸杆菌的相对丰度。乳酸杆菌是肠道中重要的益生菌, 在保证保育猪肠道健康方面起重要作用, 且仔猪断奶过程中乳酸杆菌数量下降是引起仔猪肠道菌群紊乱的重要因素[11], 本研究中, 添加合生元导致的乳酸杆菌相对丰度增加能帮助仔猪调节肠道环境, 从而抵抗病原菌的定殖。Chae等[16]使用乳果糖复合益生菌肠球菌饲喂仔猪后发现, 仔猪粪样中Lactobacillus的相对丰度增加。本研究还发现, 42日龄时合生元处理组猪粪样中Prevolla和Bacteroides的相对丰度显著高于对照组。这些微生物具有产生纤维降解酶的能力, 如甘露聚糖酶、木聚糖酶和β葡聚糖酶, 有利于仔猪消化分解断奶后日粮中富含的谷物纤维[21], 从而帮助仔猪适应日粮成分的改变。同时, 拟杆菌、瘤胃球菌等是肠道中重要的厌氧菌属, 对维持肠道厌氧环境有重要作用, 其相对丰度降低与肠道菌群紊乱有密切关系[22]。
肠道菌群结构的改变, 势必会导致其代谢产物发生改变。乙酸、丙酸和丁酸等SCFA是微生物利用营养素的重要代谢产物, 可以调节肠腔pH值, 减少病原菌的定殖, 缓解由病原菌引起的肠道感染和炎症, 对维持肠道健康有重要作用[23]。本研究中, 使用合生元可显著增加保育猪肠道内SCFA含量。金三俊等[19]研究也发现, 在仔猪日粮中添加由乳酸菌和酵母菌组成的复合微生态制剂, 可以显著提高仔猪粪样中乙酸、丙酸和丁酸的含量。赵秀英等[24]给仔猪灌喂植物乳杆菌和干酪乳杆菌复合菌液, 显著增加了保育猪回肠和结肠中乙酸和总SCFA的含量。Guerra-Ordaz等[25]在保育猪日粮中添加由低聚乳果糖和植物乳酸杆菌配合成的合生元, 饲喂14 d后发现保育猪结肠中乙酸和丁酸的含量显著上升。本研究中, 使用合生元后乙酸和丁酸含量显著提高, 可能与肠道中乳酸杆菌和未分类瘤胃球菌相对丰度增加有关。Gao等[26]报道, 回肠和粪样中乙酸、丁酸和总SCFA的含量与乳酸杆菌属正相关, 粪样中瘤胃球菌属的相对丰度与丁酸的含量正相关。Zhang等[27]研究也表明, 拟杆菌属的相对丰度与猪盲肠中丙酸与丁酸含量正相关。SCFA中的丁酸是结肠上皮细胞重要的能量物质, 可以促进肠上皮细胞的增殖。同时, SCFA本身也是一种能量物质, 可以被宿主利用, 参与宿主的能量代谢[28]。在人体上的研究结果表明, 肥胖个体肠道中SCFA的含量要显著高于消瘦个体[29]。也有研究表明, 短链脂肪酸可以增强肠道的屏障功能, 有利于保证肠道健康[30]。这与本试验中保育猪生长性能的改善可能有一定的关系。由此可见, 本试验中保育猪日增重的显著增加与SCFA浓度上升有密切关系。
综上, 合生元可通过增加肠道内有益菌相对丰度, 提高微生物代谢产物SCFA含量发挥益生作用, 从而提高保育猪ADFI和ADG。断奶后3周内使用效果更佳。关于断奶后使用合生元对育肥期肠道菌群结构的长期影响及对屠宰胴体品质的影响有待进一步研究。
| [1] |
Frese S A, Parker K, Calvert C C, et al. Diet shapes the gut microbiome of pigs during nursing and weaning[J]. Microbiome, 2015, 3(1): 28. DOI:10.1186/s40168-015-0091-8 |
| [2] |
Gresse R, Chaucheyrasdurand F, Fleury M A, et al. Gut microbiota dysbiosis in postweaning piglets:understanding the keys to health[J]. Trends in Microbiology, 2017, 25(10): 851-873. DOI:10.1016/j.tim.2017.05.004 |
| [3] |
Fooks L J, Fuller R, Gibson G R. Prebiotic, probiotic and human gut microbiology[J]. International Dairy Journal, 1999, 9(1): 53-61. DOI:10.1016/S0958-6946(99)00044-8 |
| [4] |
刘虎传, 张敏红, 冯京海, 等. 益生菌制剂对早期断奶仔猪生长性能和免疫指标的影响[J]. 动物营养学报, 2012, 24(6): 1124-1131. Liu H C, Zhang M H, Feng J H, et al. Effects of probiotic preparation on intestinal pH, mucosal morphology and volatile fatty acids content in early weaner piglets[J]. Animal Husbandry and Veterinary Medicine, 2012, 24(6): 1124-1131 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-267x.2012.06.019 |
| [5] |
Mair C, Plitzner C, Pfaffl M W, et al. Inulin and probiotics in newly weaned piglets:effects on intestinal morphology, mRNA expression levels of inflammatory marker genes and haematology[J]. Archives of Animal Nutrition, 2010, 64(4): 304-321. DOI:10.1080/1745039X.2010.492137 |
| [6] |
Shim S B, Verstegen M W, Kim I H, et al. Effects of feeding antibiotic-free creep feed supplemented with oligofructose, probiotics or synbiotics to suckling piglets increases the preweaning weight gain and composition of intestinal microbiota[J]. Archives of Animal Nutrition, 2005, 59(6): 419-427. DOI:10.1080/17450390500353234 |
| [7] |
Huang C H, Qiao S Y, Li D F, et al. Effects of Lactobacilli on the performance, diarrhea incidence, VFA concentration and gastrointestinal microbial flora of weaning pigs[J]. Asian-Australasian Journal of Animal Sciences, 2004, 17(3): 401-409. DOI:10.5713/ajas.2004.401 |
| [8] |
Kong Q, HeG Q, Jia J L, et al. Oral administration of Clostridium butyricum for modulating gastrointestinal microflora in mice[J]. Current Microbiology, 2011, 62(2): 512-517. |
| [9] |
Tsukahara T, Iwasaki Y K, Ushida K. Stimulation of butyrate production in the large intestine of weaning piglets by dietary fructooligosaccharides and its influence on the histological variables of the large intestinal mucosa[J]. Journal of Nutritional Science & Vitaminology, 2003, 49(6): 414-421. |
| [10] |
Carlett R F, Kathleen S, Zoё F, et al. Effect of inulin on the human gut microbiota:stimulation of Bifidobacterium adolescentis and Faecalibacterium prausnitzii[J]. British Journal of Nutrition, 2009, 101(4): 541-550. |
| [11] |
Su Y, Yao W, Perez-Gutierrez O N, et al. 16S ribosomal RNA-based methods to monitor changes in the hindgut bacterial community of piglets after oral administration of Lactobacillus sobrius S1[J]. Anaerobe, 2008, 14(2): 78-86. DOI:10.1016/j.anaerobe.2007.12.004 |
| [12] |
Dai Z L, Zhang J, Wu G, et al. Utilization of amino acids by bacteria from the pig small intestine[J]. Amino Acids, 2010, 39(5): 1201-1215. DOI:10.1007/s00726-010-0556-9 |
| [13] |
Li M, Jin W, Li Y, et al. Spatial dynamics of the bacterial community structure in the gastrointestinal tract of red kangaroo(Macropus rufus)[J]. World Journal of Microbiology and Biotechnology, 2016, 32(6): 1-9. |
| [14] |
Wang X F, Mao S Y, Liu J H, et al. Effect of gynosaponins on methane production and microbe numbers in a fungus-methanogen co-culture[J]. Journal of Animal & Feed Sciences, 2011, 20(2): 272-284. |
| [15] |
Konstantinov S R, Favier C F, Zhu W Y, et al. Microbial diversity studies of the porcine gastrointestinal ecosystem during weaning transition[J]. Animal Research, 2004, 53(4): 317-324. DOI:10.1051/animres:2004019 |
| [16] |
Chae J P, Pajarillo E A, Kyoung O J, et al. Revealing the combined effects of lactulose and probiotic enterococci on the swine faecal microbiota using 454 pyrosequencing[J]. Microbial Biotechnology, 2016, 9(4): 486-495. DOI:10.1111/1751-7915.12370 |
| [17] |
朱伟云, 姚文, 毛胜勇. 变性梯度凝胶电泳法研究断奶仔猪粪样细菌区系变化[J]. 微生物学报, 2003, 43(4): 503-508. Zhu W Y, Yao W, Mao S Y. Development of bacterial community in faeces of weaning piglets asrevealed by denaturing gradient gel electrophoresis[J]. Acta Microbiologica Sinica, 2003, 43(4): 503-508 (in Chinese with English abstract). DOI:10.3321/j.issn:0001-6209.2003.04.017 |
| [18] |
边高瑞, 谢飞, 苏勇, 等. 应用16S rRNA基因技术研究仔猪结肠梭菌Ⅳ群变化[J]. 微生物学报, 2010, 50(10): 1373-1379. Bian G R, Xie F, Su Y, et al. 16S rRNA gene-based molecular methods to monitor Clostridium cluster Ⅳ community in the colon of piglets[J]. Acta Microbiologica Sinica, 2010, 50(10): 1373-1379 (in Chinese with English abstract). |
| [19] |
金三俊, 董佳琦, 任红立, 等. 复合微生态制剂对断奶仔猪生长性能、血清生化和免疫指标及粪样中挥发性脂肪酸含量的影响[J]. 动物营养学报, 2017, 29(12): 4477-4484. Jin S J, Dong J Q, Ren H L, et al. Effects of compound probiotics on growth performance, serum biochemical and immune indices and volatile fatty acid contents in feces of weaned piglets[J]. Chinese Journal of Animal Nutrition, 2017, 29(12): 4477-4484 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-267x.2017.12.028 |
| [20] |
Su Y, Yao W, Perez-Gutierrez O N, et al. Changes in abundance of Lactobacillus spp. and Streptococcus suis in the stomach, jejunum and ileum of piglets after weaning[J]. FEMS Microbiology Ecology, 2010, 66(3): 546-555. |
| [21] |
Flint H J, Bayer E A. Plant cell wall breakdown by anaerobic microorganisms from the mammalian digestive tract[J]. Annals of the New York Academy of Sciences, 2010, 1125(1): 280-288. |
| [22] |
Shin N R, Whon T W, Bae J W. Proteobacteria:microbial signature of dysbiosis in gut microbiota[J]. Trends in Biotechnology, 2015, 33(9): 496-503. DOI:10.1016/j.tibtech.2015.06.011 |
| [23] |
Tan J, Mckenzie C, Vuillermin P J, et al. Dietary fiber and bacterial SCFA enhance oral tolerance and protect against food allergy through diverse cellular pathways[J]. Cell Reports, 2016, 15(12): 2809-2824. DOI:10.1016/j.celrep.2016.05.047 |
| [24] |
赵秀英, 县怡涵, 李晨博, 等. 灌喂植物乳杆菌和干酪乳杆菌增加仔猪肠道菌群多样性及短链脂肪酸生成[J]. 微生物学报, 2016, 56(8): 1291-1300. Zhao X Y, Xian Y H, Li C B, et al. Feeding Lactobacillus plantarum and Lactobacillus casei increased microbial diversity and short chain fatty acids production in the gut-intestinal tract of weaning piglets[J]. Acta Microbiologica Sinica, 2016, 56(8): 1291-1300 (in Chinese with English abstract). |
| [25] |
Guerra-Ordaz A A, Molist F, Hermes R G, et al. Effect of inclusion of lactulose and Lactobacillus plantarum on the intestinal environment and performance of piglets at weaning[J]. Animal Feed Science and Technology, 2013, 185(3/4): 160-168. |
| [26] |
Gao K, Pi Y, Peng Y, et al. Time-course responses of ileal and fecal microbiota and metabolite profiles to antibiotics in cannulated pigs[J]. Applied Microbiology and Biotechnology, 2018, 102(5): 2289-2299. DOI:10.1007/s00253-018-8774-2 |
| [27] |
Zhang C, Yu M, Yang Y, et al. Differential effect of early antibiotic intervention on bacterial fermentation patterns and mucosal gene expression in the colon of pigs under diets with different protein levels[J]. Applied Microbiology and Biotechnology, 2016, 101(6): 1-13. |
| [28] |
Koh A, De Vadder F, Kovatcheva-Datchary P, et al. From dietary fiber to host physiology:short-chain fatty acids as key bacterial metabolites[J]. Cell, 2016, 165(6): 1332-1345. DOI:10.1016/j.cell.2016.05.041 |
| [29] |
Schwiertz A, Taras D, Schafer K, et al. Microbiota and SCFA in lean and overweight healthy subjects[J]. Obesity(Silver Spring), 2010, 18(1): 190-195. |
| [30] |
张亚南, 李轩, 陈慧子, 等. 丙酸钠对IPEC-J2细胞紧密连接及炎症细胞因子的影响[J]. 南京农业大学学报, 2019, 42(1): 137-144. Zhao Y N, Li X, Chen H Z, et al. Effects of sodium propionate on the tight junction and inflammatory cytokines in IPEC-J2 cells[J]. Journal of Nanjing Agricultural University, 2019, 42(1): 137-144 (in Chinese with English abstract). DOI:10.7685/jnau.201801017 |




